一种单细胞全长转录组文库的构建方法及其应用与流程
1.本发明涉及基因工程技术领域,尤其涉及一种单细胞全长转录组文库的构建方法及其应用。
背景技术:
2.传统的转录组测序得到的是一群细胞基因表达的的平均水平,这种方式会导致细胞间的异质性被掩盖,难以区分不同细胞的基因组差异。而现有的单细胞转录组测序能够测定一群细胞中单个细胞基因表达水平,从大量细胞中筛选出异质细胞进行研究。但是基于流式细胞仪和激光捕获纤维切割等技术的单细胞筛选及测序技术具有成本高、通量低的缺点;而基于barcode标签的细胞转录组测序技术读长短。
技术实现要素:
3.为了解决现有技术存在的问题,本发明提供一种单细胞全长转录组文库的构建方法。通过给不同细胞带上不同baorcod序列便于测序后数据筛选;扩增后的全长基因不需打断,可直接用ont平台测序。
4.第一方面,本发明提供一种单细胞全长转录组文库的构建方法,包括:
5.在beads上连接barcode序列,将连接有barcode序列的beads、油相和细胞混合后包裹形成待测油包水;针对所述待测油包水提取dna之后进行ont检测。
6.进一步地,所述连接有barcode序列beads、油相和细胞的体积比为(5~10):(20~30):(40~50)。
7.进一步地,所述beads上还连接有反转录引物;所述反转录引物包括如下核苷酸序列:
[0008]5’‑
ctacacgacgctcttccgatctnnnnnnnnnnnnnntttttttttttttttttttttttttttvn-3’。
[0009]
进一步地,所述提取dna包括反转录、破油纯化和pcr扩增。
[0010]
进一步地,所述反转录中使用的rtmix包括:0.4~0.6% bsa和0.1~0.3%tween 20。
[0011]
进一步地,如上bsa和tween20均为配置好的,质量或体积百分含量为10%的bsa和tween20。
[0012]
本发明在反转录过程中,在rt mix中加入bsa,其一方面可以保护逆转录酶,增加酶的稳定性,又能够对细胞起到生理和机械保护的作用。在这种情况下对于细胞活性的要求降低,一般情况下,构建单细胞转录组文库对细胞活性要求80%以上,而在rt mix中加入bsa,使得本发明对于对细胞活性要求在60%以上即可。
[0013]
此外,本发明还在rtmix中加入tween 20,通常情况下,tween20通常被认为对细胞有破坏作用,但是本发明发现低浓度tween20对细胞活性影响较小(加上本发明加入bsa之后放宽了对细胞活性的要求),而且在加入tween20之后增加了细胞相流动性,缩短了油包
technologies 2100bioanalyzerd购自安捷伦;amp mix、末端修复试剂、接头连接试剂购自neb;无核酶水购自天根;80%乙醇溶液现用现配。
[0030]
实施例1
[0031]
1、将单细胞悬液与逆转录试剂混合,制备细胞相
[0032]
1.1按照下表配制rt mix:
[0033]
表1 rt mix配方
[0034]
试剂用量/ul5
×
rt buffer16dntp3rnaseout1tso110%bsa410%tween201.6superscript iii reverse transcriptase4
[0035]
tso引物序列:ggtatcaacgcagagtacatrgrgrg。
[0036]
1.2制备细胞mix
[0037]
根据要检测的细胞量(1-2万个细胞)及细胞浓度配制细胞mix体系(细胞采用活性在60%以上的细胞):
[0038]
表2细胞mix体系
[0039]
试剂用量/ul细胞x细胞培养液49.4-x
[0040]
其中细胞培养液指dmem/mem/1640等细胞培养液。
[0041]
2、制备油包水,进行反转录
[0042]
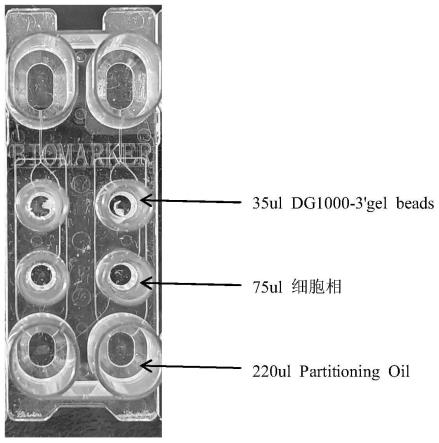
2.1加入细胞相、dg1000-3'gel beads及partitioning oil。加入量及位置,见图1(细胞相由如上rt mix和细胞mix组成,共80μl,上样75μl)。dg1000-3'gel beads中引物序列:
[0043]
ctacacgacgctcttccgatctnnnnnnnnnnnnnntttttttttttttttttttttttttttvn。
[0044]
2.2制备油包水
[0045]
将芯片放入百创dg1000仪器中,等待油包水生成。
[0046]
2.3进行反转录
[0047]
将生成的油包水全部转移到pcr管中,进行反转录。
[0048]
反转录体系如下:
[0049]
表3反转录体系
[0050]
温度时间50℃90min85℃5min4℃hold
[0051]
3、样品破油纯化,进行扩增
[0052]
3.1破油
[0053]
取出pcr管,贴壁缓慢加入100ul破油试剂,静置30s后油包水溶解,上层溶液透明。
[0054]
3.2纯化
[0055]
3.2.1弃去下层溶液,向管中加入194ul纯化试剂及6ul dynabeads磁珠。
[0056]
3.2.2移液枪混匀,静置5min。
[0057]
3.2.3移液枪再次混匀,静置5min。
[0058]
3.2.4将pcr管置于磁力架上,待液体澄清后洗去上清,加入300ul 80%乙醇溶液,30s洗去上清;再加入200ul 80%乙醇溶液,30s洗去上清。瞬时离心后加pcr管置于磁力架上,吸去残留的乙醇溶液。
[0059]
3.2.5静置1min后,加入23.5ul无核酸酶水,吹匀后室温静置5min。
[0060]
3.2.6将pcr管置于磁力架上静置2min。
[0061]
3.3扩增
[0062]
配制pcr mix:
[0063]
表4 pcr mix配方
[0064]
试剂用量/ulamp mix25cdna primers2
[0065]
cdna引物序列:
[0066]
f:aagcagtggtatcaacgcagagt
[0067]
r:ctacacgacgctcttccgat。
[0068]
从磁力架上的pcr管中取23ul rt产物加入pcr mix中混匀,瞬时离心后置于pcr仪中,pcr仪中的反应程序如下:
[0069]
表5 pcr反应程序
[0070][0071]
4、pcr产物纯化
[0072]
4.1spri磁珠涡旋混匀后取30ul加入pcr产物中,吹打混匀,静置5min。
[0073]
4.2将pcr管置于磁力架上,静置至溶液澄清,弃去上清。
[0074]
4.3加入100ul 80%乙醇溶液,静置30s后,弃去上清。
[0075]
4.4重复5.3步骤。
[0076]
4.5瞬时离心后将pcr管置于磁力架上,吸去残留的乙醇溶液。
[0077]
4.6静置至磁珠表明不再光滑时,立即加入25ul无核酸酶水,吹打混匀,室温静置2min。
[0078]
4.7将pcr管重新放置于磁力架上,溶液澄清后吸取上清至新的pcr管中。
[0079]
4.8使用high sensitivity agilent technologies 2100bioanalyzerd对纯化后pcr产物峰型进行测定。质检图如图2所示。
[0080]
5、末端修复及纯化
[0081]
5.1末端修复
[0082]
配制末端修复体系:
[0083]
表6末端修复体系
[0084]
试剂用量/ulffpe buffer3.5ffpe master mix1endprep buffer3.5endprep master mix2pcr纯化产物x无核酸酶水50-x
[0085]
混匀后瞬时离心,放入pcr仪进行末端修复,反应程序如下:
[0086]
表7 pcr反应程序
[0087]
温度时间20℃15min65℃5min
[0088]
5.2末端修复产物纯化
[0089]
5.2.1 agencourt ampure x磁珠涡旋混匀后取48ul加入末修产物中,吹打混匀,静置5min。
[0090]
5.2.2将样品管置于磁力架上,静置至溶液澄清,弃去上清。
[0091]
5.2.3加入200ul新鲜配置的70%乙醇静置30s后,弃去上清。
[0092]
5.2.4重复步骤5.2.3。
[0093]
5.2.5瞬时离心后将pcr管置于磁力架上,吸去残留的乙醇溶液。
[0094]
5.2.6静置至磁珠表明不再光滑时,加入61ul无核酸酶水,吹打混匀,室温静置5min。
[0095]
5.2.7将pcr管重新放置于磁力架上,溶液澄清后吸取上清61ul至新的pcr管中。
[0096]
6、连接测序接头及纯化
[0097]
6.1接头连接
[0098]
配制接头连接体系:
[0099]
表8配制接头连接体系
[0100]
试剂用量/ulnebnext quick t4 dna ligase10lnb(ont)25
amx(ont)5末修纯化产物x无核酸酶水60-x
[0101]
混匀后瞬时离心,放入pcr仪进行接头连接,反应程序:25℃反应45min。
[0102]
6.2接头连接产物纯化
[0103]
6.2.1 agencourt ampure x磁珠涡旋混匀后取40ul加入接头连接产物中,吹打混匀,静置5min。
[0104]
6.2.2将样品管置于磁力架上,静置至溶液澄清,弃去上清。
[0105]
6.2.3加入用250ul sfb(ont)静置3min后,弃去上清。
[0106]
6.2.4重复步骤5.2.3。
[0107]
6.2.5瞬时离心后将pcr管置于磁力架上,吸去残留的sfb溶液。
[0108]
6.2.6静置至磁珠表明不再光滑时,加入25ul elution buffer,吹打混匀,室温静置5min。
[0109]
6.2.7将pcr管重新放置于磁力架上,溶液澄清后吸取上清至新的pcr管中。
[0110]
7、测序分析
[0111]
对样品进行测序,分析下机数据进行全长转录组基因表达量分析。检测结果见下表。
[0112]
表9全长转录组基因表达量分析结果
[0113][0114]
对比例1
[0115]
本发明进一步采用常规的单细胞转录组测序方法进行如实施例1中相同的方法进行测序,以及分析得到如下表所示的结果:
[0116]
表10单细胞转录组测序法的测序结果
[0117][0118]
最后应说明的是:以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管
参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1