一种高产γ-氨基丁酸和红曲色素的发酵液的制备方法
一种高产
γ-氨基丁酸和红曲色素的发酵液的制备方法
技术领域
1.本发明涉及生物和食品技术领域,具体涉及一种高产γ-氨基丁酸和红曲色素的发酵液的制备方法。
背景技术:
2.红曲霉是一种在中国具有千年历史的发酵食品用真菌。它能合成很多有营养价值的次级代谢物,包括红曲色素,γ-氨基丁酸(gaba)等。其发酵产物能有效降低血压,降低血浆胆固醇水平,并具有抗菌活性。红曲色素是中国传统的食品着色剂,它们是由黄色、橙色和红色化合物混合组成,研究表明,红曲色素能降低总胆固醇和低密度脂蛋白胆固醇的水平,同时具有抗炎和增强免疫力等功效,已成为医药卫生、防腐保健、食品着色等领域研究开发的热点。gaba是一种功能性非蛋白质氨基酸,由谷氨酸脱羧酶使谷氨酸脱羧而产生。是中枢神经系统的主要抑制性神经递质,具有降压、镇静、利尿等生理功能,可以延缓大脑衰亡、抗焦虑和治疗神经疾病。在1979年日本的endo第一次发现红曲霉合成的一种特殊物质gaba具有降压活性。红曲霉也因而成为继乳酸菌、酵母菌之后,又一种被广泛研究和应用于gaba生产的微生物。
3.现有的红曲色素的生成工艺有液态发酵和液固发酵,其中,液态发酵的生产工艺流程如下:平板与斜面培养(7-8d)-》种子液培养(24-26h)
→‑‑
级种子罐培养(7-8h).
→
二级种子罐培养(7-8h)-+发酵罐培养(70-75h)-》板框压滤
‑→
浸泡滤渣(用70%-80%酒精浸泡搅拌约26-38h)-》再次压滤-+真空浓缩(回收酒精)-》喷雾干燥(粉状红曲红)
→
成品包装。液固发酵是先用种子罐液体培养种子,代替固体种曲接种,后用固体培养发酵,简称液一固法,适用于产量大的红曲厂。它与传统生产工艺不同的是:纯种培养制种;提高发酵厚度;采用通风措施和自控设备装置来控制培养品温;利用烘干设备进行成品干燥等。但是,红曲霉代谢物产量低是红曲霉发酵的关键性难题。目前,通过菌种改良、优化发酵参数是提高其代谢物产量的主要方式,例如,董用胜在“红曲霉固态发酵生产monacolin k工艺条件的研究”(《食品研究与开发》2007.vol28.no.06)摘要:通过对红曲霉tq-57固态发酵生产monacolin k的工艺条件的研究,确定了固态发酵的工艺条件为:培养基水分50%,相对湿度75%,起始ph值为6.0,发酵温度25c,发酵时间16d,蛋白胨用量为3.0%,甘油用量为0.2%,monacolin k量可达到2.243mg/go通风培养时monacolin k量为2.563mg/g干基质。王远卓在“红曲霉菌液态发酵生成红曲色素条件优化”一文中,用分别改变碳源(葡萄糖、蔗糖、可溶性淀粉)、氮源(硝酸钠、氯化铵、尿素)、ph(3.5、4.5、5.5、6.5、7.5、8.0)以及液体量(75、100、125、150、175、200ml)确定最佳发酵条件是:葡萄糖30g/l、硝酸钠15g/l,ph5.5。除此之外,越来越多的底物也被研究者所开发,如甘蔗渣、马铃薯渣、玉米芯、米汤等。多数研究者倾向于对已有的发酵方法进行优化或针对菌种进行改良,以提高营养物质含量,但效果甚微。因此,现在迫切地需要开发出能提高红曲霉发酵物中营养物含量的方法。
4.桑叶是桑科植物的叶子,具有丰富的营养价值和多种药用功能。桑叶中含有黄酮、氨基酸、生物碱、甾类等多种活性成分,因而具有降血压、降血脂、抗炎、抗衰老等多种疗效。
研究表明,桑叶中gaba的平均含量为2260mg/kg左右(龚铄等《厌氧处理对桑叶gaba含量的影响》《安徽农业科学》,2016,44(15:):p71-72,89),显著高于其他天然植物,因而以桑叶为原料研制富含gaba的产品具有广阔的前景。
5.由于桑叶优质的生物活性和高营养价值,本专利首次以其作为红曲霉发酵的底物,提出了一种高产gaba和红曲色素的红曲霉发酵液的制备方法,为红曲霉高效生产gaba和红曲色素提供了新的思路。本专利所述的方法尚未见报道。
技术实现要素:
6.发明目的:为了克服现有技术的不足,本发明的目的在于提出一种高产γ-氨基丁酸和红曲色素的发酵液,是以桑叶作为红曲霉发酵的底物,通过液态发酵的方式,综合提高红曲霉的gaba和红曲色素产量。
7.技术方案:为了实现上述发明目的,发明人采用了以下技术方案:
8.一种高产γ-氨基丁酸和红曲色素的发酵液的制备方法,是将红曲霉制备成种子液,然后接种在以桑叶为底物的液态培养基内,在一定条件下发酵,获得发酵液。
9.种子液制备方法为:(参考高佳佳报道的方法制备红曲种子液(灵芝菌和红曲霉及红茶菌混合发酵红茶的工艺研究[d].《浙江工业大学》,2013))
[0010]
1、配制培养基
[0011]
(1)红曲霉斜面种子培养基:
[0012]
12brix麦芽琼脂培养基:取麦芽:水(m:v)=1:4,搅拌均匀后在65℃水浴中糖化4小时,糖化程度用碘滴定,糖化完全后,将糖化液用4-6层纱布过滤,如果滤液混浊不清,将糖化液加鸡蛋清煮沸后再过滤,得到澄清液体测试其糖度,高则稀释,低则加葡萄糖,达到12brix后加入2%琼脂加热搅拌溶解,分装入试管中,121℃,20min灭菌,放置斜面(斜面高度大概为试管高度三分之一)冷却至凝固。
[0013]
(2)红曲霉种子液培养基:
[0014]
葡萄糖30g/l,蛋白胨20g/l,硝酸钠2g/l,七水硫酸镁1g/l,磷酸二氢钾1g/l,初始ph自然,加入适量蒸馏水后,加热搅拌溶解,分装于500ml三角瓶中,每瓶装液体100ml,121℃,20min灭菌,冷却备用。
[0015]
2、红曲霉菌种活化:将冰箱保藏的红曲霉(来源于中科院微生物研究所)斜面菌种在室温下放置5h后,接入新配制的红曲霉斜面种子培养基中,于恒温培养箱中30℃静置培养7天;将培养的红曲霉斜面菌种切成5mm
×
5mm大小块状,取5块菌种接入100ml新配制的红曲霉种子液培养基(装于500ml三角瓶)中,30℃,150rpm条件下培养2天待用。
[0016]
3、液态培养基制备及发酵条件为:液体发酵培养基为20~60g/l桑叶粉、15~75g/l葡萄糖、5~25g/l蛋白胨、1g/l七水硫酸镁和2g/l磷酸二氢钾,将种子液以接种量为8%(v/v)接入液态发酵培养基中,在26℃~36℃和180r/min转速下发酵192h,获取发酵液。
[0017]
红曲液态发酵桑叶的指标活性物为gaba和红曲色素,gaba和红曲色素的测定方法如下:
[0018]
1)gaba含量的测定(比色法与hplc法对比测定桑叶茶中γ-氨基丁酸的含量[j].食品科学,2018,39(24):256-260.)
[0019]
取发酵液10ml,超声萃取10min,10000rpm离心10min,上清通过0.45μm毫升孔过滤
器。最后,在60%乙醇溶液中稀释10倍。取样品提取液1.0ml,加入1ml 0.1mol/l四硼酸钠缓冲液,1.2ml 6%重蒸酚溶液,0.6ml7%次氯酸钠溶液,混合均匀,沸水浴10min后立即冰浴5min,室温放置呈蓝绿色,加入2ml 60%乙醇溶液。以不添加样品为空白对照,在640nm下测量吸光度,采用标准曲线法计算提取物中gaba的浓度。以吸光度值为纵坐标,gaba浓度(g/l)为水平坐标绘制标准曲线,标准曲线方程为:y=0.7332x+0.3933,r2=0.9909。
[0020]
2)红曲色素色阶测定(4株红曲霉发酵产生次级代谢产物的分析[j].食品安全质量检测学报,2014,5(1):148-153;production of citrinin-free monascus pigments by submerged culture at low ph[j].enzyme and microbial technology,2014,55)
[0021]
将5ml发酵液与45ml 70%乙醇混合进行超声处理(2h,60℃),4000r/min离心15min。用70%乙醇稀释20倍后,分别在410nm、470nm和510nm处分析黄色、橙色和红色的色阶。最后,三组色阶叠加,即红曲色素色阶。
[0022]
有益效果:
[0023]
1)本发明首次将桑叶作为红曲霉液态发酵的主要底物,显著地提高了gaba和红曲色素产量。
[0024]
2)本发明以桑叶为红曲霉液态发酵底物,为桑叶的药食产品开发、红曲霉发酵生产gaba和红曲色素提供参考。
[0025]
3)本发明发酵液中的gaba含量为11.239
±
0.103g/l,红曲色素色阶为311.083
±
0.231u/ml,相较于传统红曲霉发酵,gaba和红曲色素的含量均提高100%以上。
附图说明
[0026]
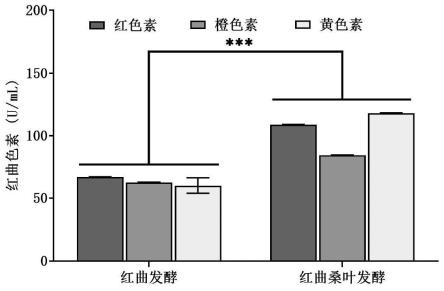
图1是红曲桑叶发酵液与红曲霉发酵液(对照)对比图。
[0027]
图2是红曲桑叶发酵、红曲发酵和桑叶提取的gaba含量对比图
[0028]
图3是红曲桑叶发酵和红曲发酵的红曲色素色阶对比图。
具体实施方式
[0029]
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
[0030]
实施例1
[0031]
本实施例说明桑叶粉添加量对发酵液中gaba和红曲色素含量的影响。
[0032]
固定培养基中葡萄糖(40g/l)、蛋白胨(15g/l)、七水硫酸镁(1g/l)和磷酸二氢钾(2g/l)含量不变,分别配制桑叶粉含量为20、30、40、50和60g/l的桑叶液体培养基。将活化的红曲霉种子液按照8%(v/v)接种量接入桑叶液体培养基中,在30℃和180r/min转速下发酵192h,获取发酵液。不同桑叶粉添加量的发酵液中gaba和红曲色素含量见表1。从表1可以看出,桑叶粉添加提高了发酵液中gaba和红曲色素含量,在添加桑叶粉40g/l时,发酵液中gaba和红曲色素含量最高,且明显高于对照组1和对照组2,对照组1是40g/l桑叶粉溶液;对照组2是不含桑叶粉的发酵液。
[0033]
表1桑叶粉添加量对发酵液中gaba和红曲色素含量的影响
[0034][0035][0036]
实施例2
[0037]
本实施例说明葡萄糖添加量对发酵液中gaba和红曲色素含量的影响。
[0038]
固定培养基中桑叶粉(40g/l)、蛋白胨(15g/l)、七水硫酸镁(1g/l)和磷酸二氢钾(2g/l)含量不变,分别配制葡萄糖含量为15、30、45、60和75g/l的桑叶液体培养基。将活化的红曲霉种子液按照8%(v/v)接种量接入桑叶液体培养基中,在30℃和180r/min转速下发酵192h,获取发酵液。不同葡萄糖添加量的发酵液中gaba和红曲色素含量见表2。从表2可以看出,葡萄糖含量变化对发酵液中gaba和红曲色素含量有影响,在葡萄糖含量45g/l时,发酵液中gaba和红曲色素含量最高,且明显高于对照组。
[0039]
表2葡萄糖添加量对发酵液中gaba和红曲色素含量的影响
[0040]
不同发酵液gaba(g/l)红曲色素(u/ml)含0g/l葡萄糖(对照)4.319
±
0.171144.567
±
0.611含15g/l葡萄糖9.207
±
0.159157.567
±
0.202含30g/l葡萄糖10.343
±
0.102149.167
±
0.454含45g/l葡萄糖10.707
±
0.055255.110
±
0.328含60g/l葡萄糖8.288
±
0.144250.050
±
0.614含75g/l葡萄糖3.001
±
0.450230.500
±
0.100
[0041]
实施例3
[0042]
本实施例说明蛋白胨添加量对发酵液中gaba和红曲色素含量的影响。
[0043]
固定培养基中桑叶粉(40g/l)、葡萄糖(45g/l)、七水硫酸镁(1g/l)和磷酸二氢钾(2g/l)含量不变,分别配制蛋白胨含量为5、10、15、20和25g/l的桑叶液体培养基。将活化的红曲霉种子液按照8%(v/v)接种量接入桑叶液体培养基中,在30℃和180r/min转速下发酵192h,获取发酵液。不同蛋白胨添加量的发酵液中gaba和红曲色素含量见表3。从表3可以看出,蛋白胨含量变化对发酵液中gaba和红曲色素含量有影响,在蛋白胨含量15g/l时,发酵液中gaba和红曲色素含量最高,且明显高于对照组。
[0044]
表3蛋白胨添加量对发酵液中gaba和红曲色素含量的影响
[0045]
不同发酵液gaba(g/l)红曲色素(u/ml)含0g/l蛋白胨4.701
±
0.250141.733
±
0.247含5g/l蛋白胨11.334
±
0.089234.100
±
0.150
含10g/l蛋白胨11.112
±
0.197270.750
±
0.050含15g/l蛋白胨11.643
±
0.089297.550
±
0.180含20g/l蛋白胨10.339
±
0.127292.433
±
0.355含25g/l蛋白胨7.484
±
0.085248.233
±
0.462
[0046]
实施例4
[0047]
本实施例说明发酵温度对发酵液中gaba和红曲色素含量的影响。
[0048]
配制桑叶液体培养基,其配方为:桑叶粉(40g/l)、葡萄糖(45g/l)、蛋白胨(15g/l)、七水硫酸镁(1g/l)、磷酸二氢钾(2g/l)。将活化的红曲霉种子液按照8%(v/v)接种量接入桑叶液体培养基中,分别在26℃、28℃、30℃、32℃、34℃、36℃下180r/min发酵192h,获取发酵液。不同发酵温度的发酵液中gaba和红曲色素含量见表4。从表4可以看出,发酵温度变化对发酵液中gaba和红曲色素含量有影响,在发酵温度32℃时,发酵液中gaba和红曲色素含量最高。
[0049]
综上,确定了桑叶液体培养基的最佳组成及最优发酵温度分别为:40g/l桑叶粉,45g/l葡萄糖、15g/l蛋白胨、1g/l七水硫酸镁、2g/l磷酸二氢钾、发酵温度32℃;在此条件下,桑叶发酵液中gaba含量为11.239
±
0.103g/l,红曲色素色阶为311.083
±
0.231u/ml;各性能指标见图1、图2和图3。
[0050]
表4发酵温度对发酵液中gaba和红曲色素含量的影响
[0051]
发酵温度gaba(g/l)红曲色素(u/ml)26℃6.674
±
0.512239.317
±
0.22528℃9.557
±
0.170251.001
±
1.27630℃10.371
±
0.088291.083
±
0.10432℃11.239
±
0.103311.083
±
0.23134℃10.516
±
0.232309.333
±
0.49136℃8.925
±
0.199298.533
±
0.247。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1