一种β-卡巴林-肉桂酸骨架衍生物及制备方法和用途
一种
β-卡巴林-肉桂酸骨架衍生物及制备方法和用途
技术领域
1.本发明属于药物化学合成技术领域,具体涉及一种β-卡巴林-肉桂酸骨架衍生物,还涉及该β-卡巴林-肉桂酸骨架衍生物的制备方法和用途。
背景技术:
2.糖尿病是一种由于遗传和环境因素长期共同作用下引起的胰岛素分泌相对不足或者绝对不足的代谢性疾病。糖尿病以高血糖为主要特征,并可引发渐进性糖、脂肪、蛋白质、水和电解质代谢紊乱。根据国际糖尿病联盟(idf)最新发布的《全球糖尿病地图(第10版)》显示,2型糖尿病是最常见的糖尿病类型,约占所有糖尿病病例的90%。2型糖尿病主要表现为胰岛素抵抗,即机体外周组织对胰岛素反应不敏感,使得血糖水平持续升高,刺激胰岛β细胞释放出更多的胰岛素。然而,持续的胰岛β细胞高负荷最终会耗尽胰腺,导致胰岛素分泌减少,血糖水平进一步升高(高血糖症)。
3.近年来,我国糖尿病的患病率逐年增加,在2015-2017年中国糖尿病患病率达到11.2%,糖尿病的知晓率(36.5%)、治疗率(32.2%)和控制率(49.2%),近几年有所改善,但仍处于低水平。目前,治疗2型糖尿病的常用药物包括二甲双胍(减少肝脏糖原的分解)、磺酰脲类(格列奈类,促进胰岛素分泌)等。然而,上市的药物只能暂时减缓血糖的升高,并不能促进胰岛细胞增殖或者使患者痊愈。
4.随着对糖尿病患病机理的深入研究,一种应用小分子刺激β细胞再生的方法已成为一种有前途的糖尿病治疗策略。研究人员发现双特异性酪氨酸磷酸化调节激酶1a(dyrk1a)能够调节β细胞增殖,抑制dyrk1a活性能够促进胰岛β细胞增殖。目前,针对这一靶点进行研究的化合物有cc-401、gnf2133,因此,dyrk1a抑制剂的研发可能成为最具有吸引力的抗糖尿病药物研究的方向。
5.在对β-卡巴林化合物的研究中,去氢骆驼蓬碱(harmine)是最早发现的dyrk1a小分子抑制剂,现在仍然是衡量β细胞增殖的标准。在去氢骆驼蓬碱之后,有大量的卡巴林类化合物被用于抑制dyrk1a靶点的研究中。因此,β-卡巴林的母核是一种良好的治疗糖尿病的先导化合物。
6.在对阿魏酸(肉桂酸的衍生物)进行研究时,发现阿魏酸具有调节糖代谢的功能,并能够保护机体组织器官免受因高血糖诱导的氧化应激、炎症等损伤。阿魏酸结构中的羧基形成酰胺时,研究人员体外研究发现此类肉桂酰胺类化学物能够刺激胰岛素的分泌。常见的噻唑烷二酮类降糖药(代表药物:罗格列酮)是胰岛素增敏剂的主要类型,该类药物结构上均具有噻唑烷二酮的部分,也可看作是苯丙酸的衍生物。该类药物可以增加靶组织对胰岛素的敏感性,促进外周组织对葡萄糖的吸收和利用。因此,肉桂酰胺类化学物可以作为一种抗2型糖尿病的药物进行研究。
7.基于β-卡巴林类化合物对dyrk1a有良好的抑制活性,促进患者体内β细胞的增殖,从而升高机体胰岛素水平,发挥降低血糖的作用。此外,肉桂酰胺类化合物与噻唑烷二酮降糖药在化学结构上有一定的相似性,在对这类化合物进行体外研究时,也发现其降血糖的
功效。
技术实现要素:
8.本发明的目的在于提供一种β-卡巴林-肉桂酸骨架衍生物,具有良好的抗糖尿病活性。
9.本发明的第二目的在于提供上述β-卡巴林-肉桂酸骨架衍生物的制备方法。
10.本发明的第三目的在于提供β-卡巴林-肉桂酸骨架衍生物在制备糖尿病药物的用途。
11.本发明的第四目的在于提供一种治疗糖尿病的药物,包括β-卡巴林-肉桂酸骨架衍生物或其与酸合成药学上可接受的盐、水合物。
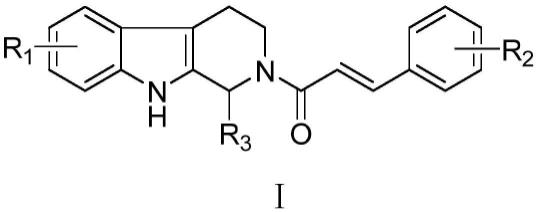
12.本发明所采用的技术方案是,一种β-卡巴林-肉桂酸骨架衍生物,其结构通式如式(i)所示:
[0013][0014]
其中:r1为甲基、甲氧基、三氟甲基、卤素中的任意一种;
[0015]
r2为苯环上取代的羟基、甲氧基或者卤素;
[0016]
r3为氢、甲基或者乙基;
[0017]
本发明的特点还在于,
[0018]
优选的,β-卡巴林-肉桂酸骨架衍生物为:(2e)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}-3-苯基丙基-2-烯-1-酮、(2e)-3-(2-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮、(2e)-3-(3-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮、(2e)-3-(4-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮、(2e)-3-(4-氟苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮、(2e)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基]-3-苯基丙-2-烯-1-酮、(2e)-3-(2-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮、(2e)-3-(3-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮、(2e)-3-(4-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮、(2e)-3-(4-氟苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮中的任意一种。
[0019]
本发明所采用的另一技术方案是,一种β-卡巴林-肉桂酸骨架衍生物的制备方法,具体按照以下步骤实施:
[0020]
步骤1,将色胺或5-甲氧基色胺溶解在二氯甲烷中,之后置于冰浴中冷却至0℃,加入催化剂三氟乙酸,并将混合物在0℃的条件下搅拌0.5h,再加入乙醛,并将所得混合物在室温下搅拌24h,得到四氢卡巴林衍生物;
[0021]
步骤2,将肉桂酸类化合物溶解在dmf中,缓慢滴加n,n-二异丙基乙胺,再加入2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯,将混合物在室温下搅拌0.5h后,再加入四氢卡巴林衍生物,室温搅拌12h,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,即为β-卡巴林-肉桂酸骨架衍生物。
[0022]
本发明的有益效果是,通过两步反应合成β-卡巴林-肉桂酸骨架衍生物,反应条件温和,容易重复,且产率高。首次研究了β-卡巴林-肉桂酸骨架衍生物的胰岛β细胞促增殖活性和细胞保护活性,是潜在治疗糖尿病的新化学实体。对于抗糖尿病药物的研究与开发具有重要意义。
具体实施方式
[0023]
下面结合具体实施方式对本发明进行详细说明。
[0024]
本发明一种β-卡巴林-肉桂酸骨架衍生物的制备方法,具体按照以下步骤实施:
[0025]
步骤1,将色胺或5-甲氧基色胺溶解在二氯甲烷中,之后置于冰浴中冷却至0℃,加入催化剂三氟乙酸,并将混合物在0℃的条件下搅拌0.5h,再加入乙醛,并将所得混合物在室温下搅拌24h,得到四氢卡巴林衍生物;
[0026]
步骤2,将肉桂酸类化合物溶解在dmf中,缓慢滴加n,n-二异丙基乙胺(dipea),再加入2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入四氢卡巴林衍生物,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,即为β-卡巴林-肉桂酸骨架衍生物;
[0027]
肉桂酸类化合物为肉桂酸、2-氯肉桂酸、3-氯肉桂酸、4-氯肉桂酸、4-氟肉桂酸、氟肉桂酸中的任意一种;
[0028]
本发明的β-卡巴林-肉桂酸骨架衍生物用于治疗糖尿病。由于β-卡巴林类化合物和肉桂酸都具有良好的抗糖尿病的活性,应用了“组合化学”和多靶点药物设计的设计理念,通过碳氮键将两个部分连接,形成一个具有双重疗效的化合物。具体为:首先将色胺或5-甲氧基色胺在二氯甲烷中以三氟乙酸为催化剂,与乙醛反应生成四氢卡巴林衍生物,四氢卡巴林再与不同取代的肉桂酸反应生成目标β-卡巴林-肉桂酸骨架衍生物。
[0029]
合成路线如下:
[0030][0031]
(a)ch3cho,tfa,dcm,rt,24h(b)dipdea,hatu,rt,12h
[0032]
通过对合成的β-卡巴林-肉桂酸骨架衍生物进行体外小鼠min6胰岛β细胞增殖活
性测试和保护作用研究,发现所有化合物均促进胰岛β细胞增殖,此外细胞保护实验表明大部分化合物的细胞存活率均优于或相当于棕榈酸损伤模型组,是一种理想的保护胰岛β细胞化学实体,对治疗糖尿病有重要意义。
[0033]
实施例1中间体的制备
[0034]
a、1-甲基-1h,2h,3h,4h,9h-吡啶并[3,4-b]吲哚(a),结构式如下:
[0035][0036]
取1g色胺(6.24mmol)加入100ml茄型瓶中,用50ml二氯甲烷(dcm)超声溶解,在冰浴中冷却至0℃,滴加0.7ml三氟乙酸(tfa,9.36mmol),并将混合物在0℃搅拌约0.5h,向反应液中加入1.4ml乙醛(25.0mmol),并将所得混合物在室温下搅拌24h,通过tlc薄层色谱监测反应完全,将反应物抽滤用2%的氨水洗三遍,得到淡黄色固体,产率为54.31%。经鉴定为1-甲基-1h,2h,3h,4h,9h-吡啶并[3,4-b]吲哚。
[0037]
其中,产物表征如下:
[0038]
mp 194-200℃;1h-nmr(400mhz,dmso-d6)δ11.17(1h,s,h-9),7.44(1h,d,j=7.8hz,h-5),7.36(1h,d,j=8.1hz,h-8),7.10(1h,dt,j=11.1,4.0hz,h-6),7.01(1h,t,j=7.4hz,h-7),4.61(1h,q,j=6.6hz,h-1),3.52(m,1h),3.26(m,1h),2.87(2h,m,h-4),1.59(3h,d,j=6.8hz,ch3);
13
c-nmr(100mhz,dmso-d6)δ136.5,132.7,126.5,122.0,119.4,118.4,111.8,105.9,48.8,41.1,19.3,18.1;esi-ms m/z:187.1[m+h]
+
。
[0039]
b、6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶并[3,4-b]吲哚(b),结构式如下:
[0040][0041]
方法同a,取1g 5-甲氧基色胺(5.3mmol)加入100ml茄型瓶中,用50mldcm超声溶解,在冰浴中冷却至0℃,滴加0.59mltfa(3.5mmol),并将混合物在0℃搅拌约0.5h,向反应液中加入1.18ml甲醛(21.0mmol),并将所得混合物在室温下搅拌24h,通过tlc薄层色谱监测反应完全,将反应物抽滤用2%氨水洗三遍,得到棕色固体,产率82.75%;经鉴定为6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶并[3,4-b]吲哚。
[0042]
其中,产物表征如下:
[0043]
mp 196-204℃;1h-nmr(400mhz,dmso-d6)δ10.85(1h,s,h-9),7.23(1h,d,j=8.7hz,h-5),6.92(1h,d,j=2.4hz,h-8),6.72(1h,dd,j=8.7,2.4hz,h-7),4.43(1h,q,j=6.5hz,h-1),3.75(3h,s,och3),3.41(1h,s,h-3),3.14(1h,s,h-3),2.75(2h,s,h-4),1.51(3h,d,j=6.7hz,ch3);
13
c-nmr(100mhz,dmso-d6)δ153.7,134.8,131.4,127.1,112.3,111.56,106.1,100.4,55.8,48.8,41.6,20.3,18.8;esi-ms m/z:217.1[m+h]
+
。
[0044]
实施例2(2e)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}-3-苯基丙基-2-烯-1-酮(a1)的制备
[0045][0046]
取30mg肉桂酸于50ml茄型瓶中,用3mldmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物a,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,棕色粉末;产率43.25%;经鉴定为(2e)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}-3-苯基丙基-2-烯-1-酮。
[0047]
其中,产物表征如下:
[0048]
mp 226-230℃;1h-nmr(400mhz,cdcl3)δ8.36(1h,s,nh),7.77(1h,d,j=15.4hz,ch=ch),7.60(2h,d,j=6.3hz,ph-h),7.50(1h,d,j=7.6hz,ph-h),7.42(2h,d,j=6.9hz,ph-h),7.37(1h,d,j=7.8hz,ph-h),7.19(1h,t,j=7.3hz,ph-h),7.13(1h,t,j=7.3hz,ph-h),7.03(1h,d,j=15.4hz,ch=ch),5.94(1h,q,j=6.1hz,h-1),4.34(1h,dd,j=12.6,1.7hz,h-3),3.59(1h,m,h-3),1.59(3h,d,j=6.4hz,ch3);
13
c-nmr(100mhz,cdcl3)δ165.8,143.1,136.2,135.3,129.7,128.9,127.8,126.7,121.8,119.5,117.9,117.6,111.1,107.3,46.1,40.4,22.5,19.3;esi-ms m/z:317.1[m+h]
+
。
[0049]
实施例3(2e)-3-(2-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(a2)的制备
[0050]
结构式如下:
[0051][0052]
方法同a1,取30mg 2-氯肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物a,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,黄白色粉末,产率70.05%;经鉴定为(2e)-3-(2-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0053]
其中,产物表征如下:
[0054]
mp 212-220℃;1h-nmr(400mhz,cdcl3)δ8.41(1h,s,nh),8.07(1h,d,j=15.5hz,ch=ch),8.02(1h,s,ph-h),7.66(1h,dd,j=5.3,3.8hz,ph-h),7.47(1h,d,j=7.7hz,ph-h),7.43(1h,dt,j=6.9,3.6hz,ph-h),7.37(1h,d,j=8.0hz,ph-h),7.30(2h,dd,j=5.6,3.6hz,ph-h),7.17(1h,t,j=7.3hz,ph-h),7.10(1h,t,j=7.3hz,ph-h),6.98(1h,d,j=15.5hz,ch=ch),5.92(1h,q,j=6.6hz,h-1),4.30(1h,dd,j=13.7,3.9hz,h-3),3.58(1h,m,h-3),2.96(2h,s,h-4),1.58(3h,d,j=6.7hz,ch3);
13
c-nmr(100mhz,cdcl3)δ165.4,
138.7,136.1,134.7,133.7,130.4,130.2,127.7,127.7,127.0,126.7,121.9,121.0(m),119.6,118.0,111.1,107.4,46.1,40.5,22.5,19.3;esi-ms m/z:351.1[m+h]
+
。
[0055]
实施例4(2e)-3-(3-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(a3)的制备
[0056]
结构式如下:
[0057][0058]
方法同a1,取30mg3-氯肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物a,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,黄白色粉末;产率70.50%;经鉴定为(2e)-3-(3-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0059]
其中,产物表征如下:
[0060]
mp 210-218℃;1h-nmr(400mhz,cdcl3)δ8.19(1h,s,nh),7.66(d,j=15.4hz,1h,ch=ch),7.56(1h,s,ph-h),7.48(1h,d,j=7.8hz,ph-h),7.41(1h,t,j=5.6hz,ph-h),7.18(1h,t,j=7.3hz,ph-h),7.11(1h,t,j=7.3hz,ph-h),7.00(d,j=15.4hz,1h,ch=ch),5.90(1h,q,j=6.6hz,h-1),4.30(1h,dd,j=14.1,3.4hz,h-3),3.58(1h,m,h-3),2.89(2h,m,h-4),1.56(3h,d,j=6.7hz,ch3);
13
c-nmr(100mhz,cdcl3)δ165.30,141.4,137.1,136.2,135.1,134.9,130.1,129.6,127.3,126.6,126.3,121.9,119.6,119.3,118.0,111.1,107.3,46.2,40.5,22.6,19.2;esi-ms m/z:351.1[m+h]
+
。
[0061]
实施例5(2e)-3-(4-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(a4)的制备
[0062]
结构式如下:
[0063][0064]
方法同a1,取30mg 4-氯肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物a,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,棕色粉末,产率51.04%;经鉴定为(2e)-3-(4-氯苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0065]
其中,产物表征如下:
[0066]
mp 220-225℃;1h-nmr(400mhz,cdcl3)δ8.06(1h,s,nh),7.68(1h,d,j=15.4hz,ch=ch),7.50(2h,d,j=8.0hz,ph-h),7.46(1h,dd,j=8.7,1.8hz,ph-h),7.37(2h,d,j=
8.4hz,ph-h),7.33(1h,dd,j=5.8,2.7hz,ph-h),7.18(1h,t,j=7.4hz,ph-h),7.11(1h,t,j=7.3hz,ph-h),6.97(1h,d,j=15.5hz,ch=ch),5.89(1h,q,j=6.6hz,h-1),4.30(1h,dd,j=13.9,3.6hz,h-3),3.57(1h,m,h-3),2.88(2h,m,h-4),1.56(3h,d,j=6.7hz,ch3);
13
c-nmr(100mhz,cdcl3)δ165.5,141.7,136.2,135.5,133.7,129.1,129.0,126.6,121.8,119.5,118.3,118.0,111.1,107.2,46.2,40.4,22.5,19.2;esi-ms m/z:351.1[m+h]
+
。
[0067]
实施例6(2e)-3-(4-氟苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(a5)的制备
[0068]
结构式如下:
[0069][0070]
方法同a1,取30mg 4-氟肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物a,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,棕色粉末,产率51.04%;经鉴定为(2e)-3-(4-氟苯基)-1-{1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0071]
其中,产物表征如下:
[0072]
mp 222-226℃;1h-nmr(400mhz,cdcl3)δ8.30(s,1h,nh),7.71(1h,d,j=15.4hz,ch=ch),7.54(2h,q,j=7.5hz,ph-h),7.48(1h,d,j=7.8hz,ph-h),7.35(1h,d,j=7.9hz,ph-h),7.17(1h,t,j=7.4hz,ph-h),7.09(2h,d,j=7.7hz,ph-h),6.93(d,j=15.4hz,1h,ch=ch),5.91(1h,dd,j=11.9,5.6hz,h-3),4.30(1h,dd,j=13.7,3.0hz,h-3),3.57(1h,m,h-1),2.88(2h,m,h-4),1.56(3h,d,j=6.6hz,ch3);
13
c-nmr(100mhz,dmso-d6)δ165.1,141.0,136.4,136.2,132.3,130.8,130.7,126.8,121.3,119.2,119.0,118.2,116.3,116.1,111.5,106.7,100.0,22.7,19.3;esi-ms m/z:335.1[m+h]
+
。
[0073]
实施例7(2e)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基]-3-苯基丙-2-烯-1-酮(b1)的制备
[0074]
结构式如下:
[0075][0076]
取30mg氟肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物b,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,黄绿粉末,产率48.99%;经鉴定为(2e)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基]-3-苯基丙-2-烯-1-酮。
[0077]
其中,产物表征如下:
[0078]
mp 96-105℃;1h-nmr(400mhz,cdcl3)δ8.20(1h,s,nh),7.74(1h,d,j=15.4hz,ch=ch),7.57(2h,d,j=6.7hz,ph-h),7.40(3h,d,j=7.4hz,ph-h),7.23(1h,d,j=8.7hz,ph-h),7.00(1h,d,j=15.4hz,ch=ch),6.93(1h,s,ph-h),6.82(1h,dd,j=8.7,2.3hz,ph-h),5.89(1h,q,j=6.5hz,h-1),4.31(dd,j=13.8,3.5hz,1h,h-3),3.86(s,3h,och3),2.52(1h,m,h-3),2.82(2h,m,h-4),1.55(3h,d,j=6.6hz,ch3);
13
c-nmr(100mhz,cdcl3)δ165.8,154.1,143.0,136.2,135.3,131.3,129.7,128.9,127.8,127.0,117.8,111.8,111.4,107.0,100.4,56.0,46.2,40.4,22.6,19.3;esi-ms m/z:347.2[m+h]
+
。
[0079]
实施例8(2e)-3-(2-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(b2)的制备
[0080]
结构式如下:
[0081][0082]
取30mg 2-氯肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物b,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,黄白色粉末,产率59.89%;经鉴定为(2e)-3-(2-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0083]
其中,产物表征如下:
[0084]
mp 208-212℃;1h-nmr(400mhz,cdcl3)δ8.46(1h,s,nh),8.08(1h,d,j=15.5hz,ch=ch),7.66(1h,dd,j=5.4,3.7hz,ph-h),7.43(1h,dd,j=5.6,3.5hz,ph-h),7.30(2h,dd,j=5.7,3.5hz,ph-h),7.24(1h,s,ph-h),6.98(1h,d,j=15.6hz,ch=ch),6.92(1h,d,j=1.4hz,ph-h),6.82(1h,dd,j=8.7,2.4hz,ph-h),5.90(1h,q,j=6.4hz,h-1),4.29(1h,dd,j=14.0,4.0hz,h-3),3.85(3h,s,och3),3.57(1h,m,h-3),2.82(2h,m,h-4),1.56(3h,d,j=6.7hz,ch3);
13
c-nmr(100mhz,cdcl3)δ165.5,154.1,138.7,136.1,134.7,133.7,131.4,130.5,130.2,127.7,127.0,127.0,120.9,111.9,111.4,106.9,100.4,56.0,46.3,40.6,22.6,19.3;esi-ms m/z:381.0[m+h]
+
。
[0085]
实施例9(2e)-3-(3-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(b3)的制备
[0086]
结构式如下:
[0087][0088]
取30mg 2-氯肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸
酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物b,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,深棕色粉末,产率51.59%;经鉴定为(2e)-3-(3-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0089]
其中,产物表征如下:
[0090]
mp 86-96℃;1h nmr(400mhz,cdcl3)δ8.26(1h,s,nh),7.65(1h,d,j=15.4hz,ch=ch),7.53(1h,m,ph-h),7.41(1h,dd,j=7.1,5.3hz,ph-h),7.33(2h,d,j=5.3hz,ph-h),7.23(1h,d,j=8.7hz,ph-h),7.00(1h,d,j=15.4hz,ch=ch),6.93(1h,s,ph-h),6.82(1h,dd,j=8.7,2.3hz,ph-h),5.87(1h,q,j=6.4hz,h-1),4.29(1h,dd,j=13.8,3.7hz,h-3),3.86(3h,s,och3),3.57(m,1h,h-3),2.82(2h,dt,j=7.0,5.4hz,h-4),1.54(3h,d,j=6.7hz,ch3);
13
c-nmr(100mhz,cdcl3)δ165.3,154.1,141.4,137.1,136.0,134.8,131.3,130.1,129.6,127.3,127.0,126.3,119.2,111.8,111.5,107.0,100.5,56.0,46.2,40.5,22.6,19.3;esi-ms m/z:381.1[m+h]
+
。
[0091]
实施例10(2e)-3-(4-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(b4)
[0092]
结构式如下:
[0093][0094]
取30mg 2-氯肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物b,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,黄白色粉末,产率55.50%;经鉴定为(2e)-3-(4-氯苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0095]
其中,产物表征如下:
[0096]
mp 230-232℃;1h-nmr(400mhz,cdcl3)δ8.10(s,1h,nh),7.68(d,j=15.4hz,1h,ch=ch),7.49(d,j=8.3hz,2h,ph-h),7.37(d,j=8.3hz,2h,ph-h),7.23(d,j=8.7hz,1h,ph-h),6.94(1h,d,j=10.3hz,ch=ch),6.83(dd,j=8.7,2.3hz,1h,ph-h),5.87(q,j=6.1hz,1h,h-1),4.29(dd,j=13.5,3.4hz,1h,h-3),3.86(s,3h,och3),3.56(m,1h,h-3),2.82(m,2h,h-4),1.54(d,j=6.7hz,3h,ch3);
13
c-nmr(100mhz,cdcl3)δ165.5,154.1,141.6,136.1,135.5,133.7,131.3,129.1,129.0,127.0,118.3,111.8,111.4,107.0,100.5,56.0,46.2,40.4,22.6,19.3;esi-ms m/z:381.1[m+h]
+
。
[0097]
实施例11(2e)-3-(4-氟苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮(b5)的制备
[0098]
结构式如下:
[0099][0100]
取30mg 4-氟肉桂酸于50ml茄型瓶中,用3ml dmf溶解,缓慢滴加3当量的n,n-二异丙基乙胺(dipea),再加入1.5当量2-(7-氮杂苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(hatu),将混合物在室温下搅拌0.5h后,再加入等当量的化合物b,室温搅拌12h,使其充分反应,通过tlc薄层色谱监测反应完全,将产物用饱和碳酸氢钠萃取三遍后,将有机相旋干,通过柱色谱得到纯品化合物,棕色粉末,产率44.64%;经鉴定为(2e)-3-(4-氟苯基)-1-{6-甲氧基-1-甲基-1h,2h,3h,4h,9h-吡啶[3,4-b]吲哚-2-基}丙-2-烯-1-酮。
[0101]
其中,产物表征如下:
[0102]
mp 205-212℃;1h-nmr(400mhz,cdcl3)δ8.29(1h,s,nh),7.70(d,j=15.4hz,1h,ch=ch),7.54(2h,m,ph-h),7.23(1h,d,j=8.7hz,ph-h),7.09(2h,t,j=8.3hz,ph-h),6.93(2h,m,ph-h),6.82(1h,dd,j=8.6,1.9hz,ph-h),5.88(1h,d,j=6.4hz,h-1),4.29(1h,dd,j=12.9,2.5hz,h-3),3.85(3h,s,och3),3.56(1h,m,h-3),2.83(2h,ddd,j=18.2,14.4,4.1hz,h-4),1.54(d,j=6.5hz,3h,ch3);
13
c-nmr(100mhz,cdcl3)δ165.6,154.1,141.8,136.1,131.5,131.5,131.3,129.6,127.0,117.5,116.1,115.9,111.8,111.4,107.0,100.4,56.02,46.21,40.42,22.59,19.26;esi-ms m/z:365.1[m+h]
+
。
[0103]
如表1所示,本发明制得的β-卡巴林-肉桂酸骨架衍生物,结构式如下:
[0104][0105]
表1本发明制得的β-卡巴林-肉桂酸骨架衍生物
[0106]
[0107][0108]
本发明的β-卡巴林-肉桂酸骨架衍生物对胰岛β细胞增殖的影响
[0109]
实验原理
[0110]
胰岛β细胞增殖能够增加胰岛功能,促进降糖激素胰岛素的合成和分泌。若合成的化合物有促胰岛细胞增殖活性,则加入化合物能够促进min6胰岛β细胞增殖。因此,采用cell counting kit(cck-8试剂盒)评价化合物对min6胰岛β细胞的增殖活性。
[0111]
细胞的传代和培养
[0112]
细胞培养于37℃、含5%co2的培养箱中,细胞融合度达80%时可进行细胞传代。
[0113]
吸出完全培养基,并用pbs缓冲液清洗两遍,加入0.25%含edta胰酶1ml,消化1.5min后加入完全培养基(dmem培养基+1%三抗+10%胎牛血清)将细胞吹打混悬。1000r/min离心5min,弃上清收集细胞,细胞沉淀加入新鲜培养基重悬后均匀铺至t25培养瓶中,而后放置细胞培养箱中培养。
[0114]
溶液配置
[0115]
10%牛血清白蛋白(bsa):精密称取bsa粉末1.0g,用pbs缓冲液充分溶解并定容至10ml,滤过除菌,分装后于-20℃保存备用。
[0116]
化合物溶液的配制:分别精密称取一定量的化合物,加入一定体积的二甲基亚砜溶解化合物配置成100mmol/l的存储液,再用pbs缓冲液稀释成1mmol/l的工作液,于-20℃保存备用;临用时,将工作液用无fbs-dmem稀释成10μmol/l和1μmol/l的待测液。
[0117]
细胞增殖检测
[0118]
收集对数期细胞,在96孔板中接种细胞悬液(100μl/孔),使待测细胞密度调整至(1000-10000)/孔。将培养板放入37℃、5% co2的培养箱中过夜。取出96孔板,在超净台中用移液器吸出弃掉上清,加入100μl不同化合物的待测液,放入培养箱中孵育24h。向每孔加入10μl cck-8溶液,将培养板置于培养箱内孵育1h,用酶标仪测定在450nm处的吸光度。
[0119]
公式计算
[0120]
细胞增殖活力(100%)=[a(加药)-a(空白)]/[a(无药)-a(空白)]
×
100。
[0121]
a(加药):具有细胞、cck-8溶液和药物溶液的孔的吸光度;
[0122]
a(空白):具有培养基和cck-8溶液而没有药物溶液的孔的吸光度;
[0123]
a(无药):具有细胞、cck-8溶液而没有药物溶液的孔的吸光度。
[0124]
备注:正常细胞的增殖活力为100%。
[0125]
实验结果
[0126]
表2 10μmol/l和1μmol/l化合物与细胞增殖活力的关系
[0127]
[0128][0129]
上述结果表明,合成的β-卡巴林-肉桂酸骨架化合物在1μmol/l浓度下对β细胞均有良好的增殖活性。其中,a-1、a-4、b-4化合物对化合物的存活率在380%左右,说明合成的化合物可以在较低浓度下具有良好的药理活性。
[0130]
在10μmol/l时,使用a1~a5、b1~b5化合物的β细胞增殖活力比使用a、b化合物的β细胞存活率明显要小。分析其原因可能是,由于在10μmol/lβ-卡巴林-肉桂酸骨架化合物浓度过大,从而抑制了β细胞的增殖。此外,在a1~a5、b1~b5化合物的浓度降低到1μmol/l对β细胞存活率反而更好,总体来说,所合成β-卡巴林-肉桂酸骨架衍生物对胰岛β细胞均具有明显的促增殖作用。
[0131]
β-卡巴林-肉桂酸骨架衍生物对棕榈酸刺激下胰岛β细胞的保护作用
[0132]
(1)实验原理
[0133]
胰岛细胞分泌的胰岛素能够发挥降血糖作用。因此,降糖药物具有胰岛细胞保护作用。棕榈酸诱导胰岛β细胞凋亡是体外常用的糖尿病损伤模型。通过对比化合物和棕榈酸损伤模型的细胞活力,判断化合物是否对胰岛β细胞有保护作用。
[0134]
(2)细胞培养和传代
[0135]
细胞培养于37℃、含5%co2的培养箱中,细胞融合度达80%时可进行细胞传代。吸出完全培养基,并用pbs缓冲液清洗两遍,加入0.25%含edta胰酶1ml,消化1.5min后加入完全培养基(dmem培养基+1%三抗+10%胎牛血清)将细胞吹打混悬。1000r/min离心5min,弃上清收集细胞,细胞沉淀加入新鲜培养基重悬后均匀铺至t25培养瓶中,而后放置细胞培养箱中培养。
[0136]
(3)溶液的配置
[0137]
10%牛血清白蛋白(bsa):精密称取bsa粉末1.0g,用pbs缓冲液充分溶解并定容至10ml,滤过除菌,分装后于-20℃保存备用。
[0138]
棕榈酸(palmitate,pa)工作液的配制:精密称取30.77mg的pa粉末,加入1ml无水乙醇超声溶解或60℃水浴加热溶解,再加入3ml 50nmol/l naoh溶液配制成30mmol/l的工作液,滤过除菌,现用现配。临用前,用含0.55%fattyacid free-bsa的dmem培养基按1:100稀释后使用。
[0139]
化合物溶液的配制:分别精密称取一定量的化合物,加入一定体积的二甲基亚砜溶解化合物配置成100mmol/l的存储液,再用pbs缓冲液稀释成1mmol/l的工作液,于-20℃保存备用;临用前,将工作液用无fbs-dmem稀释成10μmol/l和1μmol/l的待测液。
[0140]
(4)测定棕榈酸刺激下药物对胰岛细胞的保护作用
[0141]
min6细胞融合度达到80%时,将细胞均匀接种于96孔培养板中,于37℃、5%co2培养箱中培养过夜。加入终浓度为10μmol/l或1μmol/l的化合物溶液并加入终浓度为0.3mmol/l的pa继续孵育24h,随后采用cck8试剂测定细胞活力。
[0142]
(5)实验结果
[0143]
表3筛查化合物在10μmol/l和1μmol/l下对pa刺激的min6细胞的保护活性
[0144][0145]
从表中可以看出,10个化合物中与pa损伤造模相比所有化合物都有明显的胰岛细胞保护作用,其中化合物a、b、b1、b3和b4的化合物胰岛细胞保护作用强,总体来说,所有的β-卡巴林-肉桂酸骨架衍生物均具有不同程度的胰岛细胞保护作用,是抗糖尿病的一种新的化学实体。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1