一种不对称合成木槿曼粉蚧性信息素的方法
1.本发明涉及生物农药技术领域,具体涉及一种新的不对称合成木槿曼粉蚧性信息素的方法。
背景技术:
2.木槿曼粉蚧(maconellicoccus hirsutus)为多食性害虫,主要危害桑、木槿、葡萄、柑橘、大豆、玉米等多种植物,通过吸取寄主植物叶片、茎干、果实等幼嫩组织的汁液,分泌蜜露诱发“煤烟病”,导致叶片萎蔫与果实掉落(吴福中;李惠萍;付海滨.环境昆虫学报2020, 42,760.刘丹竹;张萌;高宇;崔娟;史树森.大豆科学2016,35,649.)。zhang等鉴定其性信息素活性成分为(s)-2-甲基丁酸(r)-苨肉酯与(s)-2-甲基丁酸(r)-薰衣草酯(1),而且田间实验研究表明,该性信息素具有引诱雄虫的生物活性(zhang,a.;amalin,d.;shirali,s.;serranomiguel,s.;franqui rosa,a.;oliver james,e.;klun jerome,a.;aldrich jeffrey,r.;meyerdirkdale,e.;lapointe stephen,l.proc natl acad sci u s a 2004,101,9601.zhang,a.;amalin,d. environmental entomology 2005,34,264.)。利用昆虫性信息素进行害虫防控,具有用量低、对环境与天敌安全、不易产生抗性等优势(xia,y.-h.;ding,b.-j.;dong,s.-l.;wang,h.-l.; hofvander,p.;loefstedt,c.bmc biology 2022,20,80.)。因此,研究木槿曼粉蚧性信息素1 (式1)的不对称合成具有重要的意义。目前,已报道的合成方法主要包括手性助剂法、手性源法与不对称催化法。
[0003][0004]
(1)2005年,zhang等以(4s,5r)-1,5-二甲基-4-苯基咪唑烷-2-酮为手性助剂,经酰化、不对称烷基化与lah还原得到(r)-薰衣草醇,然后与(s)-2-甲基丁酸发生酯化反应制得(s)-2-甲基丁酸(r)-薰衣草酯(zhang,a.;nie,j.journal of agricultural and food chemistry 2005,53, 2451.)。
[0005]
(2)2013年,fernandes等以(r)-丙酮缩甘油醛为手性源,经wittig偶联、dibal-h还原、脱保护、naio4氧化与nabh4还原等7步反应制得(r)-薰衣草醇,然后与(s)-2-甲基丁酸发生酯化反应制得(s)-2-甲基丁酸(r)-薰衣草酯(fernandes,r.a.;chowdhury,a.k.european journal of organic chemistry 2013,2013,5165.)
[0006]
(3)2017年,bhosale与waghmode利用d-脯氨酸催化的硝基苯与3-苄氧丙醛的不对称α-氨氧化反应,构建手性中心,然后经环己酮保护二醇,dmso氧化制得关键中间体环己酮缩甘油醛,再经wittig偶联、claisen重排、nabh4还原、保护伯羟基、臭氧化、格氏试剂加成等共计17步反应,合成得到(r)-薰衣草醇,最后与(s)-2-甲基丁酸发生酯化反应制得(s)-2
‑ꢀ
甲基丁酸(r)-薰衣草酯(bhosale,v.a.;waghmode,s.b.chemistryselect 2017,2,
1262.)。
[0007]
虽然已有文献报道木槿曼粉蚧性信息素1的合成研究,但存在合成路线繁琐、反应条件苛刻等多种问题,因此,需要发展新的、简捷高效的合成木槿曼粉蚧性信息素1的方法。
技术实现要素:
[0008]
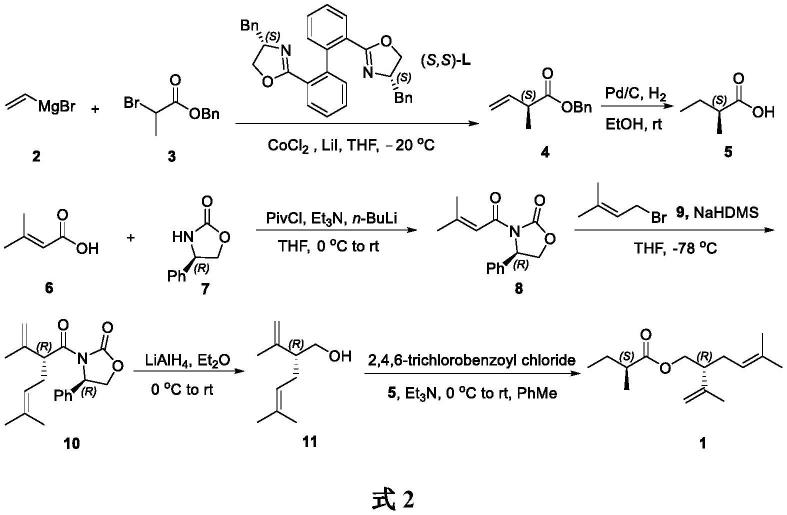
本发明旨在提供一种新的合成木槿曼粉蚧性信息素1的方法。本发明利用双噁唑啉/co (ii)催化的乙烯格氏试剂与溴代丙酸苄酯的不对称kumada偶联反应,制得烯酸苄酯4,然后经pd/c催化氢化,制得(s)-2-甲基丁酸(5);再利用(r)-4-苯基噁唑烷-2-酮(7)为手性助剂,与原位生成的3-甲基-2-丁烯酸酐反应,制得噁唑烷酮酰胺8,接着与3-甲基-1-溴-2-丁烯(9)发生不对称烷基化反应,制得异戊烯基噁唑烷酮酰胺10,然后利用lialh4还原得到 (r)-薰衣草醇,最后与(s)-2-甲基丁酸发生酯化反应制得(s)-2-甲基丁酸(r)-薰衣草酯(1)。本发明利用钴催化的不对称kumada偶联反应构建羧酸部分的手性甲基,利用evans手性诱导法构建醇部分的手性异戊烯基,具有反应条件温和、合成路线简捷等优势。本发明合成木槿曼粉蚧性信息素1的合成路线参见式2。
[0009][0010]
本发明合成木槿曼粉蚧性信息素1的方法包括如下步骤。
[0011]
(1)(s)-2-甲基-3-丁烯酸苄酯(4)的合成
[0012]
在氩气保护与室温下,在cocl2与lii的混合物中,加入thf和配体(s,s)-l的混合溶液。室温下搅拌2h,冷却至-20℃。加入外消旋2-溴丙酸苄酯(3),再加入乙烯基溴化镁(2) 悬浮液。在-20℃下搅拌48h,停止反应。然后依次淬灭反应、分液、萃取、洗涤、干燥与浓缩,最后用硅胶柱色谱纯化制得(s)-2-甲基-3-丁烯酸苄酯(4)。
[0013]
(2)(s)-2-甲基丁酸(5)的合成
[0014]
在氢气氛围与室温下,在钯碳中加入meoh与烯基酯4,室温下反应6h,停止反应。依次过滤、浓缩与硅胶柱色谱纯化,得到(s)-2-甲基丁酸(5)。
[0015]
(3)(r)-4-苯基-3-(3-甲基-2-丁烯酰基)唑烷酮(8)的合成
[0016]
0℃下,在thf与3-甲基-2-丁烯酸(6)的混合液中,滴加三乙胺与特戊酰氯,搅拌反
应 30min,停止反应。浓缩得到3-甲基-2-丁烯酸酐粗品。
[0017]
在0℃下,在thf与(r)-4-苯基唑烷酮(7)的混合液中加入正丁基锂,搅拌10min。加入3-甲基-2-丁烯酸酐粗品的thf溶液,在室温下搅拌反应12h,停止反应。然后依次淬灭反应、分液、萃取、洗涤、干燥与浓缩,最后用硅胶柱色谱纯化制得(r)-4-苯基-3-(3-甲基
ꢀ‑
2-丁烯酰基)唑烷酮(8)。
[0018]
(4)(r)-4-苯基-3-((r)-2-异丙烯基-5-甲基-6-己烯酰基)唑烷酮(10)的合成
[0019]
在氩气保护与-78℃下,在唑烷酮酰胺8与thf的混合溶液中先滴加nahmds溶液,搅拌1h;再滴加3-甲基-1-溴-2-丁烯(9),搅拌反应4h,停止反应。然后依次淬灭反应、分液、萃取、干燥与浓缩,最后用硅胶柱色谱纯化制得(r)-4-苯基-3-((r)-2-异丙烯基-5
‑ꢀ
甲基-6-己烯酰基)唑烷酮(10)。
[0020]
(5)(r)-薰衣草醇(11)的合成
[0021]
氩气保护与0℃下,在四氢铝锂与et2o的混合物中,滴加唑烷酮酰胺10的thf溶液,在室温下搅拌反应1.5h,停止反应。然后依次中和、分液、萃取、洗涤、干燥与浓缩,最后用硅胶柱色谱纯化制得(r)-薰衣草醇(11)。
[0022]
(6)木槿曼粉蚧性信息素1的合成
[0023]
在氩气保护与0℃下,在手性酸5、et3n与甲苯的混合液中加入2,4,6-三氯苯甲酰氯,在室温下搅拌1.5h。再加入4-二甲氨基吡啶的甲苯溶液与手性醇11,在室温下搅拌反应 2.5h,停止反应。然后依次淬灭反应、分液、萃取、干燥与浓缩,最后用硅胶柱色谱纯化制得木槿曼粉蚧性信息素1。
具体实施方式
[0024]
实施例1
[0025]
(s)-2-甲基-3-丁烯酸苄酯(4)的合成
[0026]
将无水cocl2(0.013g,0.10mmol)和无水lii(0.027g,0.20mmol)置于50ml史莱克管中,用加热套在80℃下真空加热2h。在氩气气氛下冷却至室温,加入无水thf(2 ml)和配体(s,s)-l(0.057g,0.12mmol)的混合溶液。将所得混合物在室温下搅拌2h,冷却至-20℃。通过注射器加入外消旋2-溴丙酸苄酯(3)(0.061g,0.25mmol),然后通过注射泵在2.5h内,滴加用thf(5ml)稀释的乙烯基溴化镁(2)(1.25mmol,1.0m四氢呋喃溶液,1.25mmol)悬浮液。将反应混合物在-20℃下搅拌48h,停止反应。加入饱和nh4cl 水溶液(3ml)萃灭反应,分离水层与有机层。用et2o(3
×
15ml)萃取水相,合并有机层与乙醚萃取液。然后用饱和nacl水溶液(10ml)洗涤和无水na2so4干燥。用旋转蒸发仪浓缩,除去溶剂,得到粗产物。最后用硅胶柱色谱(石油醚/乙酸乙酯50:1)纯化,得到淡黄色液体(s)-2-甲基-3-丁烯酸苄酯(4)(0.027g,产率57%,90%ee)1h nmr(500mhz,cdcl3) δ7.37
–
7.32(m,5h),5.94(ddd,j=17.4,10.2,7.4hz,1h),5.13(s,2h),5.12
–
5.10(m,2h),3.24
ꢀ–
3.18(m,1h),1.30(d,j=7.0hz,3h);
13
c nmr(126mhz,cdcl3)δ174.31,137.00,136.05, 128.56,128.17,128.02,116.09,66.36,43.69,16.70.
[0027]
实施例2
[0028]
(s)-2-甲基丁酸(5)的合成
[0029]
在氩气保护下,在50ml史莱克瓶中加入钯碳(0.019g,10%pd,with 55%h2o),重复抽真空冲氩气三次,用氢气球将体系内的气体置换为氢气。在室温下加入meoh(10ml),用微量进样器加入烯基酯4(0.019g,1.00mmol),室温下反应6h,停止反应。过滤除去钯碳,用旋转蒸发仪浓缩,除去溶剂,得到粗产物。最后用硅胶柱色谱(石油醚/乙酸乙酯10:1) 纯化,得到无色液体(s)-2-甲基丁酸(5)(0.058g,产率57%)。1h nmr(500mhz,cdcl3)δ 10.07(br s,1h),2.40(p,j=7.0hz,1h),1.71(dq,j=14.7,7.3hz,1h),1.50(dq,j=14.2,7.2hz, 1h),1.18(d,j=7.1hz,3h),0.95(t,j=7.5hz,3h);
13
c nmr(126mhz,cdcl3)δ183.35, 41.02,26.67,16.49,11.66.
[0030]
实施例3
[0031]
(r)-4-苯基-3-(3-甲基-2-丁烯酰基)唑烷酮(8)的合成
[0032]
0℃下,在200ml史莱克瓶中依次加入thf(30ml)、3-甲基-2-丁烯酸(6)(2.03g, 20.23mmol),缓慢滴加三乙胺(4.84g,47.80mmol),混合均匀。然后缓慢滴入特戊酰氯 (2.88g,23.91mmol)。在0℃下搅拌反应30min,停止反应。用旋转蒸发仪浓缩,除去反应溶剂,得到浅黄色固体3-甲基-2-丁烯酸酐粗品。
[0033]
室温下,在250ml三口瓶中加入thf(90ml)与(r)-4-苯基唑烷酮(7)(3.00g, 18.39mmol),混合均匀。用冰水浴将混合液降温至0℃,缓慢滴加正丁基锂(8.43ml,2.4 m四氢呋喃溶液,20.23mmol),在0℃下继续反应10min。然后将3-甲基-2-丁烯酸酐粗品溶于thf(30ml),缓慢加入上述体系中。再将反应液缓慢升温至室温,继续搅拌反应 12h,停止反应。0℃下,加入饱和nh4cl水溶液(10ml),淬灭反应,分离水层与有机层。水层用乙酸乙酯(3
×
30ml)萃取,合并有机层与乙酸乙酯萃取液。然后用饱和nacl 水溶液(50ml)洗涤与无水na2so4干燥,用旋转蒸发仪浓缩,除去溶剂,得到粗产物。最后用硅胶柱色谱(石油醚/乙酸乙酯5:1)纯化,得到白色固体(r)-4-苯基-3-(3-甲基-2-丁烯酰基)唑烷酮(8)(3.43g,产率76%)。1h nmr(500mhz,cdcl3)δ7.37(dd,j=8.4,6.5hz, 2h),7.33
–
7.30(m,3h),6.96(t,j=1.8hz,1h),5.47(dd,j=8.8,4.1hz,1h),4.65(td,j=8.9, 1.6hz,1h),4.20(ddd,j=8.7,4.4,1.9hz,1h),2.09(d,j=1.5hz,3h),1.97(d,j=1.5hz, 3h);
13
c nmr(126mhz,cdcl3)δ164.48,159.91,159.89,153.80,139.51,129.20,128.55, 125.87,115.76,77.17,69.78,57.68,28.15,21.43.
[0034]
实施例4
[0035]
(r)-4-苯基-3-((r)-2-异丙烯基-5-甲基-6-己烯酰基)唑烷酮(10)的合成
[0036]
在氩气保护与室温下,在250ml三口瓶中加入唑烷酮酰胺8(2.40g,9.78mmol) 的thf溶液(50ml)。用低温浴将该溶液冷却至-78℃,缓慢滴加nahmds(5.87ml,2.0 m thf溶液,11.74mmol),控制滴加时间为15min。将所得混合液在-78℃下搅拌反应1 h。然后缓慢滴加3-甲基-1-溴-2-丁烯(9)(5.83g,39.14mmol),在-78℃下搅拌反应4h,停止反应。加入饱和nh4cl水溶液(10ml)淬灭反应,分离有机层与水层。水层用乙酸乙酯 (3
×
60ml)萃取,合并有机层与乙酸乙酯萃取液。然后用饱和nacl水溶液(200ml)洗涤与无水na2so4干燥,用旋转蒸发仪浓缩,除去溶剂,得到粗产物。最后用硅胶柱色谱 (石油醚/乙酸乙酯20:1)纯化,得到白色固体(r)-4-苯基-3-((r)-2-异丙烯基-5-甲基-6-己烯酰基)唑烷酮(10)(1.84g,产率60%)。1h nmr(500mhz,cdcl3)δ7.34
–
7.29(m,3h), 7.28
–
7.23(m,2h),5.37
(dd,j=8.7,3.6hz,1h),4.88
–
4.84(m,3h),4.60(t,j=8.8hz,1h), 4.45(dd,j=9.3,5.6hz,1h),4.17(dd,j=8.9,3.6hz,1h),2.42(dt,j=14.1,8.4hz,1h),2.18
–ꢀ
2.14(m,1h),1.77(t,j=1.1hz,3h),1.52(d,j=1.6hz,3h),1.40(d,j=1.4hz,3h);
13
c nmr (126mhz,cdcl3)δ173.03,153.51,143.07,139.43,133.91,129.18,128.61,125.92,121.16, 113.63,69.68,58.07,50.32,30.18,25.80,21.33,17.69.
[0037]
实施例5
[0038]
(r)-薰衣草醇(11)的合成
[0039]
氩气保护下,在100ml三口瓶中加入四氢铝锂(0.42g,11.17mmol)与et2o(30 ml),冰浴冷却至0℃,缓慢滴加唑烷酮酰胺10(1.75g,5.58mmol)的thf溶液(10 ml),控制滴加时间为30min。将反应液缓慢升温至室温,搅拌反应1.5h,停止反应。加入hcl水溶液(2.5m)中和反应液至ph为6,分离水层与有机层。水层用et2o(3
×
30 ml)萃取,合并有机层与乙醚萃取液。依次用饱和nahco3水溶液(20ml)与饱和nacl 水溶液(20ml)洗涤,再经无水na2so4干燥,然后用旋转蒸发仪浓缩,除去溶剂,得到粗产物。最后用硅胶柱色谱(石油醚/乙酸乙酯5:1)纯化得到白色固体(r)-薰衣草醇(11) (0.63g,产率73%,83%ee)。1h nmr(500mhz,cdcl3)δ5.10
–
5.06(m,1h),4.93(p,j=1.6 hz,1h),4.82
–
4.81(m,1h),3.57(dd,j=10.7,5.0hz,1h),3.50(dd,j=10.7,8.2hz,1h),2.28 (qt,j=7.7,3.8hz,1h),2.14
–
2.01(m,2h),1.70
–
1.69(m,6h),1.61(s,3h);
13
c nmr(126 mhz,cdcl3)δ145.54,132.83,122.15,113.17,63.75,50.05,28.48,25.83,19.60,17.91.
[0040]
实施例6
[0041]
木槿曼粉蚧性信息素1的合成
[0042]
在氩气保护与0℃下,在50ml史莱克管中依次加入手性酸5(0.02g,0.19mmol)、 et3n(54μl,0.39mmol)与甲苯(5ml),搅拌溶解。在0℃下搅拌30min,随后用微量进样器加入2,4,6-三氯苯甲酰氯(27μl,0.26mmol),将混合液升温至室温,在室温下搅拌 1.5h。将反应体系用冰水浴冷却至0℃,加入4-二甲氨基吡啶(0.022g,0.39mmol)的甲苯溶液(0.5ml),随后用微量进样器缓慢加入手性醇11(0.020g,0.13mmol)。加完后,将反应液升温至室温,在室温下继续搅拌反应2.5h,停止反应。加入饱和nh4cl水溶液(2ml) 淬灭反应,分离有机层与水层。水层用乙醚(3
×
10ml)萃取,合并有机层与乙醚萃取液。然后用饱和nacl水溶液(30ml)洗涤与无水na2so4干燥,用旋转蒸发仪浓缩,除去溶剂,得到粗产物。最后用硅胶柱色谱(石油醚/乙酸乙酯20:1)纯化,得到无色液体木槿曼粉蚧性信息素1(0.029g,94%产率)。1h nmr(500mhz,cdcl3)δ5.09
–
5.04(m,1h), 4.83
–
4.81(m,1h),4.74
–
4.73(m,1h),4.08
–
4.02(m,2h),2.40
–
2.33(m,1h),2.19
–
2.03(m, 2h),1.69(d,j=6.5hz,6h),1.67
–
1.64(m,1h),1.62(s,3h),1.49
–
1.41(m,1h),1.13(d,j= 7.0hz,3h),0.89(td,j=7.5,1.5hz,3h);
13
c nmr(126mhz,cdcl3)δ176.84,145.02,133.01, 121.82,112.55,65.62,46.37,41.33,28.75,26.87,25.89,20.01,17.95,16.80,11.78。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1