一种腈水合酶底物通道氨基酸基序的改造用于肉桂酰胺的制备的制作方法
1.本发明涉及一种腈水合酶底物通道氨基酸基序的改造用于肉桂酰胺的制备,属于生物工程技术领域。
背景技术:
2.携带独特酰胺基团的酰胺类物质,拥有特殊的生理功能和潜在的生物活性,是合成大量精细化工品、多聚体和合成中间体的优势资源。目前,已经开发了许多合成方法用于酰胺类物质的制备。肉桂酰胺及其衍生物的合成就是其中经典的案例,它们可以作为很多天然产物的载体支架。比如,这类支架可以作为有效的模板用于设计和生产新型的具有药理活性的药物类分子。目前,肉桂酰胺及其衍生物的获取在工业生产中主要还是以传统的化学合成为主,有关生物酶法催化的文献报道非常少。在化学法生产过程中,操作比较繁琐,并且需要极端温度、强碱、有毒试剂三乙胺等。这些苛刻的反应条件安全系数低,与绿色生产理念不一致,急需改善。
3.腈类是合成中的宝贵中间体,它们可以较为容易地从许多简单、直接和经济高效的合成方法中获得。腈水合酶(nitrilehydratase,简称nhase,ec4.2.1.84),是一类可以催化腈类物质通过水合反应转化为高附加值酰胺类化合物的金属酶,在烟酰胺和丙烯酰胺的工业生产上已经被广泛应用。目前,酰胺类的生物法生产技术以其绿色环保、反应条件温和、安全系数高等优势,而逐渐替代传统的化学法,符合可持续发展和绿色生产理念。
4.腈水合酶通常由α和β两个亚基构成,研究发现,目前已报道的原核生物来源的腈水合酶大都存在稳定性差、催化活性低、催化底物谱窄的问题。也有很多研究尝试对其进行了改造,来提高其相关的性质。但是目前的催化效率不高、底物谱窄等问题仍然限制着腈水合酶进一步的开发和应用。尤其是对于像肉桂腈这样较大位阻的底物,活性更低。
技术实现要素:
5.针对现有的技术难点及存在的问题,本发明通过对来源于嗜热假诺卡氏菌(pseudonocardia thermophila)的腈水合酶的底物通道氨基酸进行改造,以期能拓宽底物谱并提升催化性能。
6.本发明提供了一种腈水合酶突变体,所述腈水合酶包含α亚基和β亚基,以来源于pseudonocardia thermophila的腈水合酶ptnhase为亲本;所述腈水合酶亲本的α亚基的氨基酸序列如seq id no.1所示,β亚基的氨基酸序列如seq id no.2所示;所述突变体为将β亚基的第37苯丙氨酸、β亚基的第48位亮氨酸或α亚基的第89位谷氨酰胺中的至少一处进行突变。
7.在一种实施方式中,所述突变体为如下(a)~(e)任一所述:
8.(a)所述突变体为将β亚基的第37位苯丙氨酸和第48位亮氨酸突变发生取代;
9.(b)所述突变体为将α亚基的第89位谷氨酰胺突变发生取代;
10.(c)所述突变体为将β亚基的第37位苯丙氨酸、第48位亮氨酸和将α亚基的第89位谷氨酰胺突变发生取代;
11.(d)所述突变体为将β亚基的第37位苯丙氨酸和将α亚基的第89位谷氨酰胺突变发生取代;
12.(e)所述突变体为将β亚基的第48位亮氨酸和将α亚基的第89位谷氨酰胺突变发生取代。
13.在一种实施方式中,所述突变体为将β亚基的第37位突变为脯氨酸或缬氨酸,第48位突变为丙氨酸、半胱氨酸、谷氨酸、甘氨酸、组氨酸、赖氨酸、脯氨酸、精氨酸或苏氨酸。
14.在一种实施方式中,所述突变体为将β亚基的第37位突变为脯氨酸,第48位突变为丙氨酸脯氨酸或苏氨酸。
15.在一种实施方式中,所述突变体为将α亚基的第89位突变为半胱氨酸、天冬氨酸、赖氨酸、天冬酰胺、丝氨酸、缬氨酸。
16.在一种实施方式中,所述突变体为将α亚基的第89位突变为天冬酰胺。
17.本发明提供了编码所述突变体的基因。
18.本发明提供了携带所述基因的重组质粒。
19.在一种实施方式中,所述重组质粒以pet系列为表达载体。
20.在一种实施方式中,所述重组质粒以pet-24a(+)为表达载体。
21.本发明提供了表达所述突变体,或含有所述基因的宿主细胞。
22.在一种实施方式中,所述宿主细胞包含原核或真核微生物。
23.在一种实施方式中,所述宿主细胞为大肠杆菌。
24.在一种实施方式中,所述宿主细胞为e.coli bl21(de3)。
25.本发明提供了一种重组菌株,所述重组菌株表达所述腈水合酶突变体。
26.在一种实施方式中,所述重组菌株以大肠杆菌e.coli bl21(de3)为宿主,以pet-24a(+)为表达载体。
27.本发明提供了一种提高腈水合酶催化活性的方法,所述方法为以来源于pseudonocardia thermophila的腈水合酶ptnhase为亲本;所述腈水合酶亲本的α亚基的氨基酸序列如seq id no.1所示,β亚基的氨基酸序列如seq id no.2所示;所述突变体为将β亚基的第37苯丙氨酸、β亚基的第48位亮氨酸或α亚基的第89位谷氨酰胺中的至少一种进行突变。
28.在一种实施方式中,所述方法为如下(a)~(e)任一所述:
29.(a)所述方法为将β亚基的第37位苯丙氨酸和第48位亮氨酸突变发生取代;
30.(b)所述方法为将α亚基的第89位谷氨酰胺突变发生取代;
31.(c)所述方法为将β亚基的第37位苯丙氨酸、第48位亮氨酸和将α亚基的第89位谷氨酰胺突变发生取代;
32.(d)所述方法为将β亚基的第37位苯丙氨酸和将α亚基的第89位谷氨酰胺突变发生取代;
33.(e)所述方法为将β亚基的第48位亮氨酸和将α亚基的第89位谷氨酰胺突变发生取代。
34.在一种实施方式中,所述方法为将β亚基的第37位突变为脯氨酸或缬氨酸,第48位
突变为丙氨酸、半胱氨酸、谷氨酸、甘氨酸、组氨酸、赖氨酸、脯氨酸、精氨酸或苏氨酸。
35.在一种实施方式中,所述方法为将β亚基的第37位突变为脯氨酸,第48位突变为丙氨酸、脯氨酸或苏氨酸。
36.在一种实施方式中,所述方法为将α亚基的第89位突变为半胱氨酸、天冬氨酸、赖氨酸、天冬酰胺、丝氨酸、缬氨酸。
37.在一种实施方式中,所述方法为将α亚基的第89位突变为天冬酰胺。
38.本发明提供了一种制备肉桂酰胺的方法,所述方法是以肉桂腈为底物,利用所述腈水合酶突变体催化生成肉桂酰胺。
39.本发明还提供了所述腈水合酶突变体,或所述基因,或所述重组质粒,或所述宿主细胞在制备肉桂酰胺中的应用。
40.在一种实施方式中,表达载体上的基因连接顺序依次为编码β亚基基因、编码α亚基基因、编码调控蛋白基因。
41.有益效果:
42.本发明发现pt-nhase的β亚基上的37、48位和α亚基上第89位的氨基酸残基可能在腈水合酶的关键结构域,对于腈水合酶的催化活性具有重要作用,本发明提供了pt-nhase突变体,所述突变体相对于野生型,是对β亚基上的37和48号位的苯丙氨酸和亮氨酸进行了突变,得到突变体f37p-l48a、f37p-l48p、f37p-l48t;对α亚基上第89号位的谷氨酰胺进行突变,得到突变体q89n。对于肉桂腈催化,本发明中的突变体f37p-l48a、f37p-l48p、f37p-l48t和q89n的酶活较野生酶均有显著的提高,最高的提升了10倍以上,开拓腈水合酶的进一步的开发和应用,在工业生产肉桂酰胺上存在着巨大的潜力。
附图说明
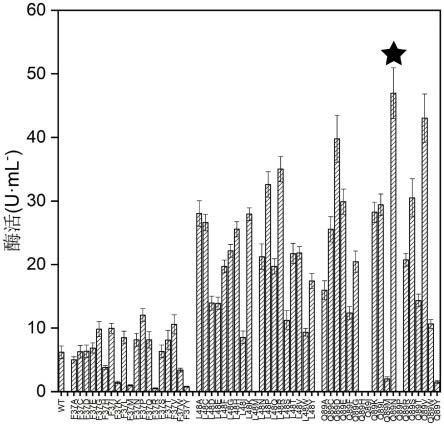
43.图1为ptnhase底物通道的三个氨基酸残基构建的突变体文库初筛及酶活测定。
44.图2为ptnhase的突变体文库复筛及酶活测定。
具体实施方式
45.(一)培养基
46.lb培养基:胰蛋白胨10.0g/l,酵母提取物5.0g/l,nacl10.0g/l,卡那霉素终浓度50μg/ml。
[0047]2×
yt培养基:胰蛋白胨16.0g/l,酵母提取物10.0g/l,nacl5.0g/l,卡那霉素终浓度50μg/ml。
[0048]
(二)酶活力的检测方法
[0049]
腈水合酶的酶活力(u):单位酶活力定义为25℃下,每分钟催化腈类底物生成1μmol酰胺产物所需要的酶量。
[0050]
腈水合酶的酶活(u/ml):每毫升腈水合酶所具有的酶活力。
[0051]
实施例1:pt nhase的各突变体的构建
[0052]
将编码β亚基的基因(氨基酸序列如seq id no.2所示)、编码α亚基的基因(氨基酸序列如seq id no.1所示)和编码调控蛋白的基因按先后顺序依次连接至表达载体pet-24a(+)的酶切位点ndei(catatg)和bamhi(ggatcc)之间,将其转化至e.coli jm109中,在lb平
板培养后、挑取单克隆由安升达(苏州)生物科技有限公司进行测序验证,得到阳性转化子,从阳性转化子中提取质粒,即为野生型质粒pet24a(+)-ptnhase wt。
[0053]
首先以野生型质粒pet24a(+)-ptnhase wt为模板,突变序列设计在引物上,通过pcr扩增出碱基序列发生突变的dna片段,不同突变质粒所用的相应引物序列如表1所示,采用全质粒pcr的方法构建先构建得到单点突变体质粒pet24a(+)-f37p、pet24a(+)-l48a、pet24a(+)-l48p、pet24a(+)-l48t以及pet24a(+)-q89n,再分别以单点突变质粒为模板,构建得到突变体质粒pet24a(+)-f37p-l48a、pet24a(+)-f37p-l48p、pet24a(+)-f37p-l48t。
[0054]
扩增体系如表2所示,pcr扩增反应条件为98℃预变性1min,98℃变性10s,55℃退火15s,72℃延伸1min30s,72℃延伸5min,共30个循环。
[0055]
表1引物序列
[0056][0057][0058]
表2 pcr扩增体系
[0059][0060]
实施例2:pt nhase的野生型及突变体对于肉桂腈的催化效率
[0061]
将实施例1中的野生型质粒pet24a(+)-ptnhasewt及突变质粒pet24a(+)-f37p-l48a、pet24a(+)-f37p-l48p、pet24a(+)-f37p-l48t及pet24a(+)-q89n分别转化至e.coli bl21(de3),挑取单菌落至5mllb培养基,37℃、200rpm条件下培养7-8h。将种子液按1%(v/v)转接至100ml2
×
yt培养基,37℃、200rpm条件下培养至od
600
至0.6-0.8,加入终浓度为0.4mm的异丙基硫代半乳糖苷(iptg)以及0.1g/l的cocl2·
6h2o,改变培养温度为25℃,诱导表达16h,离心,获得野生型wt及突变体细胞f37p-l48a、f37p-l48p、f37p-l48t和q89n。
[0062]
用10mmkpb(按k2hpo4:kh2po4=4:1配制,ph7.4)缓冲液将wt及f37p-l48a、f37p-l48p、f37p-l48t和q89n突变体细胞的od
600
调至0.5,取10μl至1.5ml离心管中,置于25℃金
属浴上。向离心管中加入490μl底物(5mm肉桂腈溶液,含10%甲醇),充分涡旋混匀,25℃下反应5min,然后加入500μl纯乙腈溶液进行终止。将反应液过0.22μm滤膜,进行液相检测。
[0063]
液相检测方法:流动相组成为乙腈:水=1:2(v/v),流速为1ml/min,检测波长为261nm,柱温为40℃,测定反应体系中产物肉桂酰胺的生成量。
[0064]
wt及各突变体的酶活计算结果如图1及2所示,野生酶wt的酶活为5u/ml,突变体f37p-l48a、f37p-l48p、f37p-l48t和q89n的酶活分别为53.6u/ml、50.1u/ml、46.5u/ml和47.0u/ml。
[0065]
即当上述β亚基上的37和48位氨基酸残基同时发生突变,或α亚基上的89位氨基酸残基发生突变时,腈水合酶的酶活有显著地提高,说明上述37、48和89位的氨基酸残基可能在酶的关键结构域,对于腈水合酶的催化活性具有重要作用。
[0066]
表3野生型与突变体对肉桂腈的酶活比较
[0067]
样品wtf37p-l48af37p-l48pf37p-l48tq89n酶活(u/ml)5.0
±
1.053.6
±
2.750.1
±
3.046.5
±
2.547.0
±
2.1
[0068]
对比例1
[0069]
具体实施方式参见实施例,区别在于,对于野生型ptnhase做单点饱和突变,将β亚基上第37位的苯丙氨酸和48位的亮氨酸以及α亚基上第89位的谷氨酰胺分别替换为其他19个氨基酸(分别突变为a/c/d/e/f/g/h/i/k/l/m/n/p/q/r/s/t/v/w/y)。待突变体经培养和诱导表达之后,将细胞调至相同od至0.5,测定其酶活,结果显示当37位突变为脯氨酸,48位突变为丙氨酸、半胱氨酸、组氨酸、赖氨酸、脯氨酸、精氨酸和苏氨酸以及89位突变为天冬氨酸、天冬酰胺、丝氨酸和缬氨酸时,酶活性较高(图1)。
[0070]
表4野生型与突变体的全细胞对肉桂腈催化活性的比较
[0071]
样品酶活(u/ml)样品酶活(u/ml)样品酶活(u/ml)wt5.0
±
1.0————f37a5.0
±
1.0l48a28.1
±
2.5q89a15.9
±
1.8f37c6.3
±
0.8l48c26.6
±
2.3q89c25.5
±
2.0f37d6.4
±
1.0l48d13.9
±
1.9q89d39.8
±
3.9f37e6.9
±
0.9l48e13.9
±
1.6q89e29.9
±
3.0f37g9.8
±
1.2l48f19.7
±
2.1q89f12.4
±
1.0f37h3.8
±
0.5l48g22.2
±
2.4q89g20.4
±
2.0f37i10.0
±
1.0l48h25.6
±
2.1q89h—f37k1.5
±
0.3l48i8.5
±
1.8q89i—f37l8.5
±
1.2l48k27.9
±
2.6q89k28.2
±
2.5f37m1.0
±
0.1l48m—q89l29.4
±
3.0f37n8.2
±
1.5l48n21.2
±
1.4q89m2.0
±
0.2f37p12.0
±
2.0l48p32.6
±
2.6q89n47.0
±
4.5f37q8.2
±
1.3l48q19.7
±
2.0q89p—f37r0.5
±
0.1l48r35.0
±
3.1q89r20.7
±
1.9f37s6.3
±
1.1l48s11.2
±
2.1q89s30.5
±
3.0f37t8.1
±
1.4l48t21.7
±
1.8q89t14.4
±
1.4
f37v10.6
±
1.7l48v21.8
±
1.9q89v43.1
±
4.3f37w3.4
±
0.7l48w9.3
±
1.4q89w10.7
±
1.1f37y0.8
±
0.1l48y17.4
±
2.0q89y1.5
±
0.2
[0072]
对比例2
[0073]
具体实施方式参见实施例及对比例1,区别在于,对于上述对比例1中活性较高的单点突变体进行第二轮pcr,得到两两组合的突变体。结果显示f37p-l48a、f37p-l48h、f37p-l48p、f37p-l48t和q89n-l48t的酶活较高(图2)。
[0074]
表5野生型与突变体的全细胞对肉桂腈催化活性的比较
[0075]
样品酶活(u/ml)样品酶活(u/ml)wt5.0
±
1.0——f37p-l48a55.7
±
4.0q89d-l48a23.8
±
2.2f37p-l48c39.8
±
4.0q89d-l48h13.4
±
1.3f37p-l48h36.9
±
4.2q89d-l48p23.5
±
2.5f37p-l48k17.5
±
1.5q89d-l48t23.8
±
2.4f37p-l48p46.5
±
2.9q89n-l48a28.9
±
3.0f37p-l48r39.2
±
4.0q89n-l48h5.1
±
0.9f37p-l48t47.2
±
4.5q89n-l48p30.5
±
3.0f37p-q89d25.9
±
2.3q89n-l48t46.4
±
4.6f37p-q89n29.8
±
3.0q89s-l48a17.0
±
1.7f37p-q89s29.5
±
3.0q89s-l48h14.5
±
1.5f37p-q89v26.0
±
2.7q89s-l48p11.6
±
1.2
ꢀꢀ
q89s-l48t22.3
±
2.3
ꢀꢀ
q89v-l48a25.3
±
2.6
ꢀꢀ
q89v-l48h3.8
±
0.5
ꢀꢀ
q89v-l48p23.2
±
2.6
ꢀꢀ
q89v-l48t23.9
±
2.4
[0076]
对比例3
[0077]
具体实施方式参见实施例及对比例1和2,区别在于,将上述对比例2中活性较高的组合突变体f37p-l48a、f37p-l48p、f37p-l48t分别作为模板,进行第三轮pcr,与单点突变体q89d、q89n、q89s、q89v进行迭代,得到12个三点组合突变体。结果显示f37p-l48t-q89s和f37p-l48t-q89n的酶活较高,分别为23.3和15.9u/ml。但是相较实施例中4个突变体f37p-l48a、f37p-l48p、f37p-l48t和q89n的酶活,还是显著降低(图2)。
[0078]
表6野生型与突变体的全细胞对肉桂腈催化活性的比较
[0079][0080][0081]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1