一种化合物的制备方法及其应用与流程
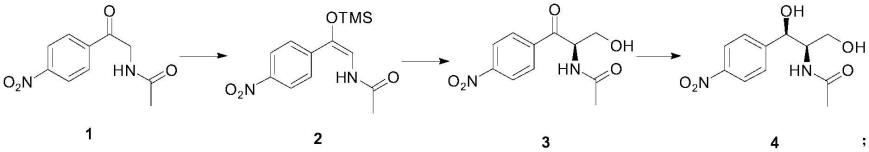
1.本发明属于医药中间体合成技术领域,尤其涉及一种化合物的制备方法及其应用,即n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的制备方法及其应用。
背景技术:
[0002]
n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺(通用名:n-[(1r,2s)-2-hydroxy-1-hydroxymethyl-2-(4-nitro-phenyl)-ethyl]-acetamide,cas:15376-53-1)是一种重要的医药和农药合成中间体。目前,n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的对映选择性合成方法主要采用酒石酸手性拆分来实现。这一过程成本高,效率低,不符合绿色经济化学的发展要求,因此,迫切需要对现有合成方法进行改进。
[0003]
长期以来n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的对映选择性合成难以实现规模化生产,主要原因是所使用的手性催化剂价格昂贵,而且催化效率低,对映选择性差。
技术实现要素:
[0004]
本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明第一个方面提出n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的制备方法,该方法的催化剂价格便宜,能够回收循环使用,反应的收率高,对映选择性好,是不对称合成光学纯n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的有效方法。
[0005]
本发明的第二个方面提出了一种所述n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的制备方法在制备氯霉素中的应用。
[0006]
根据本发明的第一个方面,提出了一种n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的制备方法,包括以下步骤:
[0007][0008]
s1:n-[2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺(式1化合物)进行烯醇硅醚化反应制得n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺(式2化合物);
[0009]
s2:n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺(式2化合物)进行不对称aldol反应制得n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺(式3化合物);
[0010]
s3:n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺(式3化合物)进行不对称催化氢化反应制得n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺(式4化合物)。
[0011]
在本发明的一些实施方式中,所述烯醇硅醚化反应的碱剂包括碳酸钾、碳酸钠、氢氧化钠、氢氧化钾、三乙胺和吡啶中的至少一种;优选的,所述碱剂与所述n-[2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺的摩尔比为(2~4):1。
[0012]
在本发明的一些优选的实施方式中,所述烯醇硅醚化反应的催化剂包括碘化钾、碘化钠、碘单质、甲醇钠、叔丁醇钾和三乙胺中的至少一种;优选的,所述催化剂与所述n-[2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺的摩尔比为(2~4):1。
[0013]
在本发明的一些更优选的实施方式中,所述烯醇硅醚化反应的羰基保护剂为烷基氯硅烷,所述烷基氯硅烷包括三甲基氯硅烷、三乙基氯硅烷、三异丙基氯硅烷或叔丁基二甲基氯硅烷中的任意一种。优选的,所述羰基保护剂与所述n-[2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺的摩尔比为(2~4):1。
[0014]
在本发明的一些更优选的实施方式中,所述烯醇硅醚化反应的溶剂为乙醚。
[0015]
在本发明的一些更优选的实施方式中,所述烯醇硅醚化反应的温度为-30℃~-10℃。
[0016]
在本发明的一些更优选的实施方式中,所述烯醇硅醚化反应的时间为30h~36h。
[0017]
在本发明的一些更优选的实施方式中,所述烯醇硅醚化反应的具体操作为:将n-[2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺、碱剂、催化剂置于溶剂中,惰性氛围中,在-30℃~-10℃下加入羰基保护剂,20℃~35℃下搅拌30h~36h,制得n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺。
[0018]
在本发明的一些更优选的实施方式中,s1中还包括对所述烯醇硅醚化反应的产物进行纯化的步骤,所述纯化的具体操作为:反应结束后将过量羰基保护剂、碱剂、催化剂旋出,得泥状物,再用溶剂洗涤、过滤,旋去溶剂后减压蒸馏制得纯化n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺。
[0019]
在本发明的一些更优选的实施方式中,所述不对称aldol反应的醛包括甲醛或多聚甲醛;优选的,所述醛与所述n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺的摩尔比为1:(150~300);优选为1:(180~250);进一步优选为1:200。
[0020]
在本发明的一些更优选的实施方式中,所述不对称aldol反应的催化剂为cu-box配体催化剂。优选的,所述cu-box配体催化剂与所述n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺的摩尔比为1:(150~300);优选为1:(180~250);进一步优选为1:200;进一步优选的,所述cu-box配体催化剂由cu催化剂和box配体络合形成,所述cu催化剂包括cu(otf)2、cu(oac)2、cui、cucl的任意一种;所述box配体选自ch
2i
pr-box、4-phenyl-box、ipr-box、ipr-pyox的任意一种;更进一步优选的,所述cu催化剂和box配体的摩尔比为1:(1~4)。
[0021]
在本发明的一些更优选的实施方式中,所述不对称aldol反应的溶剂包括二氯甲烷、三氯甲烷,1,2-二氯乙烷或1,4-二氧六环的任意一种。
[0022]
在本发明的一些更优选的实施方式中,所述不对称aldol反应的温度为20℃~35℃。
[0023]
在本发明的一些更优选的实施方式中,所述不对称aldol反应的具体操作为:在惰性氛围中向cu催化剂和手性双噁唑啉配体加入溶剂进行络合反应,再加入醛和n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺进行反应,制得n-[(1r)-1-羟甲基-2-(4-硝基苯
基)-2-羰基-乙基]-乙酰胺。
[0024]
在本发明的一些更优选的实施方式中,s2中还包括对所述不对称aldol反应的产物进行纯化的步骤,所述纯化的具体操作为:反应结束后用溶剂萃取后干燥、过滤、真空浓缩、柱层析后制得纯化n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺。
[0025]
在本发明的一些更优选的实施方式中,所述不对称催化氢化反应的催化剂为包含金属催化剂的手性膦配体;优选的,所述含金属催化剂的手性膦配体与所述n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺的摩尔比为1:(150~300);优选为1:(180~250);进一步优选为1:200;进一步优选的,所述金属催化剂包括cu(otf)2、cu(oac)2、cui、cucl的任意一种;所述手性膦配体包括binap、p-tol-binap、indol-phos、(r)-siphos的任意一种;更进一步优选的,所述金属催化剂与手性膦配体的摩尔比为1:(1~4)。
[0026]
在本发明的一些更优选的实施方式中,所述不对称催化氢化反应的溶剂为甲醛或乙醇。
[0027]
在本发明的一些更优选的实施方式中,所述不对称催化氢化反应的氢源为氢气。
[0028]
在本发明的一些更优选的实施方式中,所述不对称催化氢化反应的具体操作为:将金属催化剂、手性膦配体、n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺溶于溶剂中,氢气范围下反应过夜,制得n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺。
[0029]
在本发明的一些更优选的实施方式中,s3中还包括对所述不对称催化氢化反应的的产物进行纯化的步骤,所述纯化的具体操作为:反应结束后进行过滤、浓缩后制得纯化n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺。
[0030]
根据本发明的第二个方面,提出了一种所述n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的制备方法在制备氯霉素中的应用。
[0031]
本发明的有益效果为:
[0032]
1.本发明的合成方案,反应高效、条件温和,反应整体操作安全简便,收率及对映选择性数值理想,具有潜在的商业价值和使用价值。
[0033]
2.本发明所使用的催化剂价格便宜,能够回收循环使用,反应的收率高,对映选择性好,是不对称合成光学纯n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的有效方法。
具体实施方式
[0034]
以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
[0035]
实施例1
[0036]
本实施例制备了n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺,具体过程为:
[0037]
s1:n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺的制备:
[0038][0039]
在配有磁力搅拌的100ml圆底烧瓶中加入9.7g n-[2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺和4.6g无水三乙胺搅拌均匀使其溶于40ml无水乙醚中。然后用氮气排气,将反应温度降低到-30℃。用10ml注射器将5.07g重蒸的三甲基氯硅烷一次性加入,搅拌10分钟后,将反应移至室温,搅拌36小时。反应完毕后,将过量的三甲基氯硅烷和三乙胺旋出,得泥状物并用100ml乙醚洗涤,过滤,旋去乙醚后,剩余物通过减压蒸馏纯化得到n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺(产率89%,hplc纯度97.8%)。
[0040]
s2:n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺的制备:
[0041][0042]
将cu(otf)2(0.018g,0.05mmol)和手性双噁唑啉配体ch
2i
pr-box(16mg,0.055mmol)溶于2ml干燥的二氯甲烷中,氮气保护条件下室温搅拌2小时,此时会得到深蓝色的ch
2i
pr-box-cu(ii)络合物。然后将多聚甲醛溶于0.5ml干燥的二氯甲烷中用注射器注入到反应体系中,室温搅拌20分钟。然后,将温度降低到-78℃,10分钟后依次加入三氟乙醇(0.060g,1.2mmol)和n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺(2mmol)。通过tlc检测反应进度,当反应完全后用注射器注入5ml水,淬灭反应。然后用二氯甲烷(3
×
10ml)萃取,合并有机层,用无水硫酸镁干燥,过滤,真空浓缩后得到粗品n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺,硅胶柱层析纯化(石油醚:乙酸乙酯=1:1)得白色固体0.122g,产率90%,92%ee。
[0043]
s2产物结构表征:1h-nmr(400mhz,cdcl3)δ8.37-8.34(m,4h),5.16(t,j=2.8hz,1h),4.94(s,1h),4.06-3.84(m,2h),1.83(s,3h).ms:calcd for[c
11h13
n2o5,m+h]
+
:253.0819,found:253.0820。
[0044]
92%ee[daicel chiralpak id,hexane/2-propanol=90/10,ν=1.0ml/min,λ=254nm,t(major)=23.24min,t(minor)=42.05min]。
[0045]
s3:n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的制备:
[0046][0047]
将过渡金属催化剂(0.05mmol),商品化的膦配体(0.05mmol),n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺(5mmol)依次加入反应瓶中,之后加入150ml甲醇,在5bar氢气下反应6h,反应完,用硅藻土过滤,将甲醇旋去,硅胶柱纯化,得到n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺为白色固体,收率98%,81%ee.
[0048]
合成n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺三步反应总收率为79%。
[0049]
s3产物的结构表征:1h-nmr(400mhz,cdcl3)δ8.16(d,j=8.3hz,2h),7.65(d,j=8.3hz),5.39(d,j=7.2hz,1h),5.17(s,1h)4.48(s,1h),3.98-3.86(m,1h),3.56-3.25(m,2h).ms:calcd for[c
11h15
n2o5,m+h]
+
:255.0907,found:255.0910。
[0050]
81%ee[daicel chiralpak id,hexane/2-propanol=90/10,ν=1.0ml/min,λ=254nm,t(major)=16.90min,t(minor)=28.00min]
[0051]
实施例2
[0052]
本实施例制备了n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺,具体过程为:
[0053]
s1:n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺的制备:
[0054][0055]
在配有磁力搅拌的100ml圆底烧瓶中加入9.7g n-[2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺和4.6g无水三乙胺搅拌均匀使其溶于40ml四氢呋喃中。然后用氮气排气,将反应温度降低到-20℃。用10ml注射器将5.07g重蒸的三甲基氯硅烷一次性加入,搅拌30分钟后,将反应移至室温,搅拌32小时。反应完毕后,将过量的三甲基氯硅烷和三乙胺旋出,得泥状物并用100ml四氢呋喃洗涤,过滤,旋去四氢呋喃后,剩余物通过减压蒸馏纯化得到n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺(产率87%,hplc纯度98.8%)。
[0056]
s1产物的结构表征:1h-nmr(400mhz,cdcl3)δ8.72-7.60(m,5h),1.86(s,3h),0.21(s,9h).ms:calcd for[c
13h19
n2o4si,m+h]
+
:295.1109,found:295.1108。
[0057]
s2:n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺的制备:
[0058][0059]
将cu(otf)2(0.018g,0.05mmol)和手性双噁唑啉配体ch
2i
pr-box(16mg,0.055mmol)溶于2ml干燥的二氯乙烷中,氮气保护条件下室温搅拌2小时,此时会得到深蓝色的ch
2i
pr-box-cu(ii)络合物。然后将多聚甲醛溶于0.5ml干燥的二氯乙烷中用注射器注入到反应体系中,室温搅拌20分钟。然后,将温度降低到-60℃,10分钟后依次加入三氟乙醇(0.060g,1.2mmol)和n-[2-(4-硝基苯基)-2-三甲基硅醚-乙烯基]-乙酰胺(2mmol)。通过tlc检测反应进度,当反应完全后用注射器注入5ml水,淬灭反应。然后用二氯乙烷(3
×
10ml)萃取,合并有机层,用无水硫酸镁干燥,过滤,真空浓缩后得到粗品n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺,硅胶柱层析纯化(石油醚:乙酸乙酯=1:1)得白色固体0.122g,产率91%,94%ee。
[0060]
s2产物的结构表征:1h-nmr(400mhz,cdcl3)δ8.37-8.34(m,4h),5.16(t,j=2.8hz,1h),4.94(s,1h),4.06-3.84(m,2h),1.83(s,3h).ms:calcd for[c
11h13
n2o5,m+h]
+
:253.0819,found:253.0820。
[0061]
92%ee[daicel chiralpak id,hexane/2-propanol=90/10,ν=1.0ml/min,λ=254nm,t(major)=23.24min,t(minor)=42.05min]。
[0062]
s3:n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺的制备:
[0063][0064]
将过渡金属催化剂(0.05mmol),商品化的膦配体(0.05mmol),n-[(1r)-1-羟甲基-2-(4-硝基苯基)-2-羰基-乙基]-乙酰胺(5mmol)依次加入反应瓶中,之后加入150ml乙醇,在5bar氢气下反应6h,反应完,用硅藻土过滤,将甲醇旋去,硅胶柱纯化,得到n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺为白色固体,收率95%,84%ee.
[0065]
合成n-[(1r,2s)-2-羟基-1-羟甲基-2-(4-硝基苯基)-乙基]-乙酰胺三步反应总收率为75%。
[0066]
s3产物的结构表征:1h-nmr(400mhz,cdcl3)δ8.16(d,j=8.3hz,2h),7.65(d,j=8.3hz),5.39(d,j=7.2hz,1h),5.17(s,1h)4.48(s,1h),3.98-3.86(m,1h),3.56-3.25(m,2h).ms:calcd for[c
11h15
n2o5,m+h]
+
:255.0907,found:255.0910。
[0067]
81%ee[daicel chiralpak id,hexane/2-propanol=90/10,ν=1.0ml/min,λ=254nm,t(major)=16.90min,t(minor)=28.00min]。
[0068]
上面对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1