一种靶向c-Src激酶SH3结构域的化合物及其应用
一种靶向c-src激酶sh3结构域的化合物及其应用
技术领域
1.本发明属于医药领域,涉及一种靶向c-src蛋白sh3结构域的化合物及其应用。具体地,本发明化合物具有式(ⅰ)所示结构。本发明公开了所述化合物作为靶向c-src蛋白用于预防和/或治疗弥漫性大细胞淋巴瘤等肿瘤疾病方面的用途。本发明化合物是通过靶向sh3结构域调控c-src激酶活性的作用机制来发挥抗肿瘤活性的,故能够克服目前临床上通过靶向c-src激酶催化结构域发挥抗肿瘤活性的药物的易引起肿瘤细胞耐药的缺陷。
背景技术:
2.src蛋白酪氨酸激酶家族成员包括src、lyn、fyn、yes、lck、blk和hck,其中c-src是影响细胞增殖、分化、运动和存活等一系列信号转导通路的中枢。src的功能调控是通过在两个位点的酪氨酸磷酸化进行的,但具有相反作用。其中,tyr416位点的磷酸化会上调src的催化活性,而在羧基末端尾区,在tyr527位点的磷酸化会降低src的催化活性。激活后的c-src参与到正常生理和癌症发生过程包括增殖、分化、生存率和血管生成等。
3.src作为一个经典的原癌基因,编码具有酪氨酸激酶活性的c-src蛋白。已经有多篇研究报道,c-src在多种人类肿瘤中处于高表达状态或具有高激酶活性,并参与到癌症发生发展的多个过程中,包括细胞增殖、分化、血管生成和预后生存率等,在来自结肠、肝脏、肺、乳腺和胰腺的肿瘤中,有超过50%的c-src激活已被证实,此外,c-src还能促进细胞增殖、迁移、侵袭和血管生成;大量研究证实蛋白酪氨酸激酶是治疗肿瘤的重要靶点。
4.目前,靶向src蛋白催化结构域的atp竞争性抑制剂已在临床上用于肿瘤治疗。但是肿瘤细胞极易对该类药物产生耐药性,这也是目前靶向c-src蛋白催化结构域的抗肿瘤药物面临的主要问题。c-src蛋白由四个src同源结构域(sh4、sh3、sh2、sh1)组成。sh4结构域定位于n末端,包含锚定上膜的豆蔻酰化序列,因此靶向src家族激酶到质膜上。sh3结构域结合富含脯氨酸残基的氨基酸序列,籍此对c-src活性、细胞内定位和招募c-src底物起到重要作用。sh2结构域结合包含磷酸化酪氨酸的短模体(motif)。sh2和sh3结构域共同协作调节src家族激酶的催化活性。sh1(催化结构域)具有激酶活性在失活的构象中,人源c-src 527位酪氨酸被磷酸化,和它自身的sh2结构域相互作用。这种作用使得sh3结构域和富含脯氨酸的linker结构域相互作用,使c-src维持在一个紧密结合的失活状态。一旦酪氨酸527发生去磷酸化,分子内的相互作用使c-src处于不稳定状态导致酪氨酸416的自身磷酸化。一系列的事件使得分子打开并且释放出sh2和sh3结构域,进而和其它受体酪氨酸激酶、g蛋白偶联受体和局部黏附激酶(fak)等发生相互作用。该蛋白在sh3结构域和多聚脯氨酸-ii(ppii)螺旋之间以及sh2结构域和c端磷酸化尾巴(ctpt)之间分别含有两个自结合肽(sbp)位点,这两个位点是抗癌药物调节激酶活性的潜在靶点。
5.传统非受体酪氨酸激酶药物多作用于激酶催化结构域如舒尼替尼、达沙替尼、尼洛替尼、伯舒替尼、凡德他尼等,易产生耐药性,而sh3结构域作为调节src家族激酶的催化活性的重要部分,目前尚无相关靶向该位点的抗肿瘤药物上市。
技术实现要素:
6.通过蛋白热迁移实验进行高通量筛选,发现了一种新型靶向src蛋白sh3结构域的src激酶小分子抑制剂;并测定了其对人b细胞淋巴瘤的抗细胞增殖活性。由此本发明的一个目的在于提供一种新型的靶向c-src蛋白sh3结构域的src激酶小分子抑制剂,式(ⅰ)所示:(ⅰ)。
7.式(ⅰ)所示化合物为靶向c-src蛋白sh3结构域的抗肿瘤小分子先导化合物的发现提供了新的骨架,为设计新型靶向src蛋白抗肿瘤药物提供了化学结构上的启示。
8.本发明的另一个目的在于提供式(ⅰ)所示的化合物作为靶向src蛋白在抗肿瘤中的用途。
9.。
10.式(ⅰ)所示的化合物能够靶向c-src蛋白sh3结构域并能有效抑制c-src发生活化,从而抑制src蛋白对细胞增殖、迁移、侵袭和血管生成促进活性。进而有效地预防和治疗与生发中心b细胞淋巴瘤相关的恶性淋巴瘤疾病。
附图说明
11.图1.化合物n-(3-(4-溴苯基)-1,2,4-噻二唑-5-基)-2-甲基-丙酰胺的结构式。
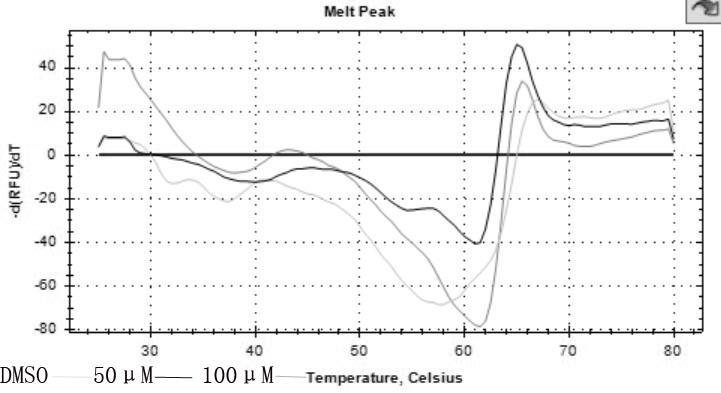
12.图2.化合物与sh3结构域蛋白热迁移实验曲线。
13.图3.化合物抑制弥漫大b细胞淋巴瘤细胞活性的ic50测定曲线。
14.图4.化合物的抗肿瘤细胞增殖活性。
具体实施方式
15.在本发明中,采用蛋白热迁移法对候选化合物进行高通量筛选,蛋白热迁移实验是确定小分子化合物与目标蛋白是否结合的方便可靠的实验方法,广泛应用于蛋白质与小分子结合的高通量筛选中。蛋白热迁移实验的基本原理是在目标蛋白的缓冲液中加入荧光染料,使用pcr仪器将体系的温度从25℃逐步提升到80℃,在升温过程中,目标蛋白的疏水基团会从内部暴露到表面,荧光染料与暴露的疏水基团结合的程度会变高,荧光信号会增加,达到最大值后荧光会逐渐淬灭信号会下降。通过玻尔兹曼方程拟合信号曲线可求出tm(熔解温度)值,对应为蛋白半数解链时的温度。在体系中加入小分子后,如果小分子与蛋白结合,会使蛋白的稳定性增加,即对应tm值升高,因此,加药组与对照组相比,熔解曲线会向右迁移。
16.本发明中,我们通过蛋白热迁移实验发现化合物n-(3-(4-溴苯基)-1,2,4-噻二唑-5-基)-2-甲基-丙酰胺与c-src蛋白sh3结构域有结合。细胞水平的增殖抑制实验显示化
合物80(45)对人b细胞淋巴瘤细胞系的db细胞的抗细胞增殖活性较强,且具有剂量依赖性。
17.本发明提供了能够靶向c-src蛋白sh3结构域的c-src激酶的小分子抑制剂,以及其对b细胞淋巴瘤细胞增殖的影响。
18.本发明的化合物ⅰ是通过与c-src蛋白sh3结构域结合发挥肿瘤细胞增殖抑制活性。
19.下面结合具体实施例对本发明作进一步阐述,这些实施例并非限制性的,而仅作为示例说明本发明。
20.实施例1:蛋白质的表达和纯化。
21.将src-sh3构建于rosetta(de3)表达载体上,载体表达的融合蛋白带有n端trx标签和his标签,在16℃表达重组蛋白,收集菌株,超声,离心(18000 rpm, 30 min, 4℃),取上清液。用镍亲和层析色谱(ge healthcare)纯化蛋白质,将蛋白洗脱液收集测定浓度后,根据其浓度加入thrombin,在25℃下酶切12-16小时,次晨,以3kd的浓缩管离心浓缩,将蛋白用蠕动泵过镍柱,穿出液即为目的蛋白。蛋白质储存在含有20mm tris ph8.0,100mm nacl的缓冲液中。
22.实施例2:蛋白热迁移实验(protein thermal shift assay)检测小分子与蛋白的结合。
23.蛋白质通常以native状态存在,加热会导致蛋白质转化为 denatured状态,暴露出疏水基团。暴露出的疏水基团可以与荧光染料sypro orange相结合,从而提高荧光染料的发射光,于是可以通过检测荧光强度来反映蛋白质的稳定性。从100 mm母液制备一系列稀释浓度的待测化合物。分别加入buffer缓冲液(20mm tris ph8.0,100mm nacl)、c-src sh3蛋白、待测化合物、 50
×
荧光染料构成20μl反应体系,为防止蛋白变性全程保持低温进行操作,使用bio-rad 荧光定量pcr,以1%升温速率,将体系温度从25℃逐渐升温至 80℃,同时以20秒为间隔记录荧光强度随温度的变化情况。进一步,在bio-rad cfx程序中,利用boltzmann拟合方法,计算化合物不同浓度条件下sh3的熔解温度(tm)。
24.实施例3:体外细胞活性分析实验检验化合物对c-src活性抑制引起的db癌细胞增殖活性的影响。
25.在含有10%胎牛血清(fbs)和1%青霉素/链霉素的rpmi 1640培养基中,培养指数生长的细胞,以每孔2 x 104个细胞的密度接种于96孔板,使用6.25μm和1.5625μm的苗头化合物孵育细胞。孵育三天后,用cell counting kit-8(cck8)检测细胞活性,实验结果见图3、图4。结果表明化合物80(45)对db细胞表现出剂量依赖性抗增殖活性。我们的工作为发现更多的c-src抑制剂的提供了新的骨架,并为克服目前临床上通过靶向c-src激酶催化结构域发挥抗肿瘤活性的药物的易引起肿瘤细胞耐药的缺陷提供了新的思路。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1