碳酸钙在提高普鲁兰多糖产量中的应用及应用方法
1.本发明属于微生物发酵技术领域,具体涉及一种在高渗培养基中加入轻质碳酸钙以实现高效发酵生产普鲁兰多糖的方法。
背景技术:
2.普鲁兰糖是由出芽短梗霉(aureobasidium pullulans)分泌的胞外水溶性多糖,鉴于其独特的结构特征,具有高水溶性、良好的成膜性、阻氧性、生物相容性及可降解等特性,被广泛应用于食品工业、农产品保鲜等领域。
3.普鲁兰糖极具应用价值,但生产成本较高,而且其产糖机制尚未得到完全阐明,大大限制了它的广泛应用。
4.目前已报道的大多数普鲁兰糖生产菌株在碳源浓度高于50g/l培养基中发酵培养时,普鲁兰糖的合成会受到抑制,这可能是参与普鲁兰糖合成关键酶—α-磷酸葡糖变位酶、尿苷二磷酸焦磷酸化酶(udpg-焦磷酸化酶)、葡糖基转移酶的活性受到抑制所造成的。
5.近年来,可利用高浓度蔗糖或葡萄糖作为碳源高效合成普鲁兰糖的耐高渗菌株相继被报道,而碳源浓度的高低直接影响着普鲁兰糖产量的高低,因此,寻找耐高渗的普鲁兰糖生产菌株是提高普鲁兰糖产量的有效手段。但是这些已报道的耐高渗菌株高效合成普鲁兰糖其产量并不高,需要进一步的对这些技术进行改进,以期提高普鲁兰糖的产量。
6.此外,文献报道,出芽短梗霉分泌普鲁兰的同时普遍会同时生成黑色素,给后期多糖的分离纯化造成了不利的影响,加大分离纯化的工作成本。(liu et al.,2021)(liu,f.,zhang,j.h.,zhang,l.j.,diao,m.q.,ling,p. x.,&wang,f.s.(2021).correlation between the synthesis of pullulan andmelanin in aureobasidium pullulans.international journal of biological macromolecules, 177,252-260.)。
7.因此,寻找不产黑色素的普鲁兰糖高产菌株以及通过优化其发酵条件以进一步提高普鲁兰糖产量,具有重要的实际应用价值,是有效降低其生产成本的重要手段。
技术实现要素:
8.为了解决上述的技术问题,本发明提供了一种利用轻质碳酸钙作为出芽短梗霉ncps007发酵过程中的其中一种培养基原料,促进出芽短梗霉 ncps007发酵生产普鲁兰多糖从而提高普鲁兰多糖产量的方法。本发明中首次提出将轻质碳酸钙应用于提高普鲁兰生产菌株的普鲁兰产量中,从而可使得普鲁兰的生产成本大大降低。
9.将碳酸钙应用在发酵生产普鲁兰多糖中,具体是将碳酸钙应用于出芽短梗霉ncps007发酵生产普鲁兰多糖的培养基中,是本发明所要重点保护的内容。出芽短梗霉ncps007在高渗培养条件下,利用轻质碳酸钙作为其培养基中的一种原料,再利用其它的特定的原料比如以果糖为碳源、以豆粕水解物为氮源、以氯化钾、硫酸铵、氯化钠、硫酸镁为无机盐,可以极大的提高普鲁兰多糖的产量。
10.上述的出芽短梗霉ncps007,其保藏编号为:cctcc no:m20221271,保藏中心地址
为:中国武汉武汉大学。在实验过程中,本发明人对上述的菌株曾命名为ncps2016,待保藏时将其命名为ncps007;其拉丁文名称为:aureobasidium pullulans ncps007,是发明人于2022年8月12日保藏在中国典型培养物保藏中心的菌株。
11.上述的碳酸钙为轻质碳酸钙,更具体来说是食品级的轻质碳酸钙;在培养基中,碳酸钙浓度为10~20g/l。
12.上述的发酵培养基是含有180~220g/l碳源的高渗培养基。
13.优选的,在发酵过程中,保持培养基中碳源的浓度为180~220g/l,氮源浓度为5~12g/l,无机盐浓度为6~15g/l,轻质碳酸钙为10~20g/l;
14.上述的碳源为果糖,氮源为豆粕水解液;无机盐为硫酸铵、氯化钠、氯化钾、硫酸镁;
15.豆粕水解液的制备方法如下:将63g豆粕与0.25m hcl(123ml)在 121℃下酸水解30min,冷却至常温,定容至1l制备豆粕水解物。
16.上述的培养基中,碳源浓度为200g/l,氮源浓度为7.89g/l,无机盐浓度为11.35g/l,轻质碳酸钙浓度为15g/l;所述的碳源为果糖,所述的氮源为豆粕水解液;
17.无机盐中,硫酸铵0.4g/l、氯化钠为3.45g/l、氯化钾为7.5g/l、硫酸镁2g/l。
18.利用碳酸钙提高普鲁兰多糖产量的方法,包括以下的步骤:
19.(1)培养出芽短梗霉菌ncps007,获得种子培养物;
20.(2)在摇瓶中加入培养基,接种步骤(1)中的种子培养物,发酵生产普鲁兰多糖;
21.或者是,步骤(2)在发酵罐中加入培养基,取步骤(1)中的种子培养物,转移到发酵罐中发酵培养,离心,获得含有普鲁兰多糖的上清液;
22.步骤(2)中,所述的培养基中含有:碳源、氮源、无机盐、轻质碳酸钙;培养基中碳源的浓度为180~220g/l,氮源浓度为5~12g/l,无机盐浓度为6~15g/l,轻质碳酸钙为10~20g/l。
23.更具体的,上述的方法中,步骤(1)将野生型菌株出芽短梗霉菌ncps007 在28℃下在含有蛋白胨20g/l、酵母提取物10g/l、葡萄糖20g/l和琼脂2 g/l的ypd琼脂培养基中生长2d,然后,将单个菌落从琼脂平板转移到含有100ml种子培养基的500ml摇瓶中,培养基由葡萄糖20g/l、k2hpo
4 6.6 g/l、nacl 1g/l、(nh4)2so
4 0.6g/l和mgso
4 0.2g/l组成,将培养物在28℃和220rpm的振荡器上好氧培养24h,将菌株储存在1.5ml eppendorf管中,在-80℃下用体积浓度为20%的甘油保存。
24.若是将步骤(1)中的种子接种物在摇瓶中培养,其具体的培养条件如下:步骤(2)在摇瓶中加入培养基,接种步骤(1)中的种子培养物,准备如下的培养基,200g/l果糖、smhs为7.89g/l、硫酸铵0.4g/l、氯化钠为3.45g/l、kcl为7.5g/l、硫酸镁2g/l、轻质碳酸钙为15g/l;
25.将4ml步骤(1)中的种子接种物接种到含有80ml发酵培养基的500 ml锥形瓶中用于生产普鲁兰多糖,并在28℃和220rpm的旋转振荡器上发酵96h。
26.若是将步骤(1)中的种子接种物在发酵罐中培养,其具体的培养条件如下:在发酵罐中加入如下的培养基,果糖200g/l、smhs为7.89g/l、硫酸铵0.4g/l、氯化钠为3.45g/l、kcl为7.5g/l、硫酸镁2g/l、轻质碳酸钙为15g/l;所述的碳源为果糖,所述的氮源为豆粕水解液,无机盐为硫酸铵、氯化钠、氯化钾、硫酸镁,其中,硫酸铵、氯化钠、氯化钾、硫酸镁分别
为:0.4g/l、3.45g/l、7.5g/l、2g/l;并将上述的培养基在115℃下灭菌 30min;
27.然后将1l步骤(1)中的种子培养物转移到灭菌后的培养基中,发酵在28℃和400rpm下进行,曝气速率为20l/min,168h后取培养物,在10000 rpm和4℃下离心10min,获得含有普鲁兰多糖的上清液。
28.本发明的有益效果在于:
29.(1)本发明涉及的菌株在高产普鲁兰糖的同时,极大简化了后期多糖的分离纯化步骤,大大节约了成本;同时采用本发明的方法,生产所获得的普鲁兰多糖,在其生产过程中不产黑色素,产品的品质优异,克服了绝大部分方法生产普鲁兰多糖会产生黑色素这一缺陷;
30.(2)通过改变培养基的成分,引入了轻质碳酸钙,并结合其它的原料用于出芽短梗霉菌发酵培养普鲁兰多糖中,在该高渗条件下,上述的培养基配方能显著的促进了菌株ncps007在高浓度果糖培养基中发酵生产,转化率具有竞争力,大大提高了普鲁兰糖产量;具体来说,是使得普鲁兰糖的产量提高至160.2g/l,mw为3.26
×
105g/mol,转化率为0.81g/g,产率为0.965g/l/h;
31.(3)相较于改进之前的培养基配方,本发明中生产1公斤普鲁兰糖的成本比含k2hpo4的原培养基低27.8%,大大的降低了普鲁兰多糖的生产成本。
附图说明
32.图1为培养基的变化对普鲁兰糖产量的影响结果;
33.图2为不同碳源浓度下普鲁兰糖产量的结果;
34.图3为无机盐对普鲁兰糖产量影响的结果;
35.图4为三个自变量中每两个变量对普鲁兰多糖生产影响的等高线和曲面图;
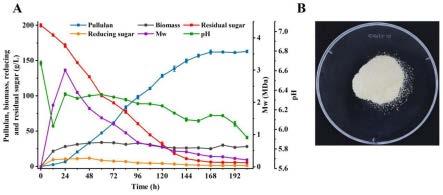
36.图5为发酵罐中(30l)菌株生产普鲁兰糖情况。
具体实施方式
37.下面结合附图和具体实施方式来对本发明作更进一步的说明,以便本领域的技术人员更了解本发明,但并不以此限制本发明。
38.附图1-4中,均是在摇瓶中进行的实验,附图5是在发酵罐中进行的实验。
39.实施例1
40.1.1菌株的培养
41.将野生型菌株出芽短梗霉菌ncps007在28℃下在含有蛋白胨20g/l、酵母提取物10g/l、葡萄糖20g/l和琼脂2g/l的ypd琼脂培养基中生长2d,然后,将单个菌落从琼脂平板转移到含有100ml种子培养基的500ml摇瓶中,培养基由葡萄糖20g/l、k2hpo
4 6.6g/l、nacl 1g/l、(nh4)2so
4 0.6g/l 和mgso
4 0.2g/l组成,将培养物在28℃和220rpm的振荡器上好氧培养24 h。将菌株储存在1.5ml eppendorf管中,在下用20%(v/v)甘油储存。
42.1.2在摇瓶中生产普鲁兰多糖
43.a.pullulans ncps007生产普鲁兰多糖的初始培养基包含80g/l果糖, 10g/l豆粕水解液(smhs),5g/l k2hpo4,1g/l nacl,0.6g/l(nh4)2so4,0.2 g/l mgso4。
44.组分改变的培养基由果糖80g/l,豆粕水解液10g/l,kcl 7.5g/l,nacl1g/l,
(nh4)2so
4 0.6g/l,mgso
4 0.2g/l和食品级轻质caco
3 2g/l组成。通过将豆粕与0.25m hcl在121℃下酸水解30min来制备豆粕水解物。将4 ml种子接种物接种到含有80ml发酵培养基的500ml锥形瓶中用于生产普鲁兰,并在28℃和220rpm的旋转振荡器上发酵96h。
45.1.3通过30l发酵罐生产普鲁兰多糖
46.按1.1的方法制备种子培养物,生物反应器配备了一个30l的容器作为发酵罐,其工作容积为20l,将该发酵罐用于普鲁兰多糖的生产。
47.将1l种子培养物转移到含有200g/l果糖的19l优化的普鲁兰生产培养基中,并在115℃下灭菌30min,发酵在28℃和400rpm下进行,曝气速率为20l/min。在12h的间隔内仅收获50ml培养物,并在发酵过程中在10000rpm和4℃下离心10min,并测定所获得的上清液中的普鲁兰多糖产量,残留果糖和还原糖。
48.优化的普鲁兰生产培养基是指:碳源的浓度为200g/l,氮源浓度为7.89 g/l,无机盐浓度为11.35g/l,轻质碳酸钙浓度为15g/l;所述的碳源为果糖,所述的氮源为豆粕水解液,无机盐为硫酸铵、氯化钠、氯化钾、硫酸镁,其中,硫酸铵、氯化钠、氯化钾、硫酸镁分别为:0.4g/l、3.45g/l、 7.5g/l、2g/l。
49.1.4中试生产普鲁兰糖
50.1吨发酵罐中试发酵培养步骤:将种子培养液按5%接种量转接到已灭菌的发酵罐培养基中,发酵温度为28℃,通风搅拌发酵160h,搅拌速度为 250rpm,通风比为1:0.6。
51.配制种子培养基:种子罐50l,按照75%的装液量计算,需配置37.5l:配方同实施例3种子培养基,ph 6.5,定容至37.5l。121℃灭菌20min,冷却。
52.配制上罐培养基:发酵罐1.0m3,按照75%的装液量计算,需要配制 0.75吨培养基:配方同实施例1.3中优化的上罐培养基,ph 6.5,定容至0.75 吨,121℃灭菌20min,冷却。
53.种子液的培养:取一支出芽短梗霉菌株斜面培养物,将其全部转接至种子培养基中,28℃恒温、220rpm,振荡培养24h,所得培养液按2%接种量750ml转接于50l发酵罐中,28℃恒温、330rpm搅拌,通风量0.45m3/h 发酵24h。
54.发酵罐中发酵普鲁兰多糖:将种子液全部接种于发酵培养基中,28℃恒温、250rpm搅拌,通风量30.24m3/h发酵160h。1.0m3发酵罐普鲁兰多糖产量约为161-168g/l,比小批量发酵罐缩短8h。
55.实施例2
56.2.1对普鲁兰多糖进行分析
57.在实施例中的1.2摇瓶培养发酵结束时,将10ml发酵培养物从烧瓶中取出到15ml离心管中,并以10000rpm离心10min。然后,将发酵液离心后的细胞用去离子水洗涤三次,并在80℃下干燥至恒重,用于细胞生物质测量。在上清液中的普鲁兰用3体积的预冷的95%乙醇析出,并将沉淀物干燥至80℃下恒重。将干燥的普鲁兰称重,粉碎并收集。发酵液中还原糖的浓度由3,5-二硝基水杨酸(dns)法测定。使用安捷伦1200高效液相色谱(hplc)测定残留果糖,该色谱柱配有zorbax nh2色谱柱,规格为: 4.6
×
250mm,5μm和40℃下的示差检测器,流动相为乙腈和超纯水,体积比为7:3,流速为1ml/min。生产的普鲁兰多糖的分子量由hplc系统 (美国安捷伦1260)测量,该系统在35℃下配有两个凝胶色谱柱,一个激光检测器和一个示差检测器,流动相为生理盐水,以1ml/min的流速,使用ph计动态检测ph值。
58.2.2经济分析方法
59.原材料成本计算如下:
[0060][0061]
2.3统计分析方法
[0062]
所有实验均一式三份进行,数据取平均值并表示为均值
±
标准差(sd)。执行学生t检验和邓肯检验以评估统计差异,p≤0.05的样本被认为在统计学有显著差异。
[0063]
2.4实验结果
[0064]
2.4.1普鲁兰多糖在初始培养基和组分调整后培养基中的生产
[0065]
普鲁兰多糖生物合成的最适ph范围一般在5.0-7.5之间,普鲁兰多糖发酵过程中会产生酸性物质并释放到培养液中,导致培养基的ph值下降。a. pullulans ncps007生产普鲁兰糖的初始培养基使用k2hpo4来调节发酵液中的ph条件。
[0066]
在本发明中改变了原料的培养基中,k2hpo4被kcl和食品级轻质caco3替代,可以消耗菌株分泌的酸性物质。
[0067]
培养基组分的变化导致普鲁兰糖的产量和分子量的变化情况见表1和图1。
[0068]
表1不同培养基组分的普鲁兰多糖产量和分子量的变化情况
[0069][0070]
如图1所示,培养基成分的变化导致普鲁兰糖的产量和分子量显著增加,而生物量的增加不显著。普鲁兰糖由50.1g/l提高到56.3g/l,增长了 12.4%,而普鲁兰糖的分子量从1.56
×
105da提高到2.29
×
105da,这表明轻质caco3是一种极具竞争力的培养基组分候选物。
[0071]
2.4.2不同浓度轻质caco3对普鲁兰糖产量的影响
[0072]
为考察不同浓度果糖培养基中轻质caco3对ncps007生产普鲁兰糖的影响,将轻caco3梯度浓度设定为140g/l、160g/l、180g/l、200g/l和250 g/l的果糖培养基。
[0073]
不同浓度果糖培养基中轻质caco3对ncps007生产普鲁兰糖的影响结果见表2和图2。
[0074]
表2不同浓度轻质caco3对ncps007生产普鲁兰糖的影响情况
[0075]
[0076][0077]
[0078]
很显然,从表格2中的数据可以看出,ncps007的多糖产量随着碳源浓度的升高而不断增加。在相同浓度果糖培养基中,多糖的产量、转化率和产率随着轻质碳酸钙浓度的升高而先升高后降低,而生物量却是随着轻质碳酸钙的增量而不断攀升,说明菌株的生长和多糖合成并不同步,生物量的增加反倒不利于多糖的合成,这与之前的多个研究结果一致。
[0079]
同时从图2中可观察到在较低浓度果糖培养基中,轻质碳酸钙浓度为 10g/l时,多糖产量达到最高,转化率和产率也达到最大值;而继续提高碳源浓度至180g/l,乃至碳源浓度高达250g/h,多糖产量最高值出现在轻质碳酸钙浓度为15g/h,同时转化率和产率也达到峰值,并且碳源浓度为200 g/l时,产率为0.91g/l/h,为所有条件下最高的产率,此时普鲁兰多糖产量为153.3g/l,转化率为0.77g/g。当碳源为250g/l,轻质碳酸钙浓度为 15g/l时,普鲁兰多糖产量为182.8g/l,产率为0.846g/l/h,转化率为0.731 g/g。这是目前报道的为数不多的耐高渗普鲁兰多糖生产菌株,既可以在250 g/l糖液中高效合成普鲁兰多糖,又可保持很高的转化率和产率。
[0080]
之前报道的菌株a.melanogenum a4,可利用300g/l麦芽糖生产122.3 g/l的普鲁兰糖,而转化率却只达到0.4g/g,说明还有大量碳源未被菌株用于普鲁兰糖的合成,对于后期的工业化大规模生产,势必造成资源的浪费,不利于成本的控制。
[0081]
同时上述结果也表明由于轻质碳酸钙的加入,尽管在高渗条件下, ncps007仍可持续高效利用果糖合成多糖,并保持高转化率,说明轻质碳酸钙吸收菌体外排的酸性物质的能力优于磷酸氢二钾,更有利于稳定培养液的条件,更有利于普鲁兰糖的合成。综合考虑普鲁兰糖的产量、转化率和产率,本研究选择200g/l果糖作为后续进一步研究的碳源浓度。
[0082]
至于氮源利用方面,如图2f所示,ncps007的普鲁兰糖产量随着豆粕水解液浓度的增加先升高后降低,当氮源浓度提高至7.5g/l时,多糖产量最高,为153.3g/l,转化率为0.77g/g,而氮源浓度再提高时,产量持续下降,但是生物量却是随着氮源浓度的升高而升高,说明氮源的提高有利于菌体的生长和繁殖,导致碳源流向细胞菌体的积累而非次级代谢物的合成,这说出菌体的生物量和多糖的产量需要某一种的平衡,既要保证一定的生物量用于多糖的合成,又不能有过多生物量积累减少多糖的合成。
[0083]
2.4.3选择合适种类和用量的无机盐
[0084]
如表3和图3所示为四种无机盐对普鲁兰糖产量的影响情况:
[0085]
表3不同浓度的无机盐对普鲁兰多糖产量的影响
[0086]
[0087][0088]
此外,分别来看,如图3a所示,kcl浓度的提高可显著提高普鲁兰糖的产量和生物量,当浓度提高至7.5g/l时,普鲁兰糖的产量达到最大,显著高于其他浓度条件下的产量,而生物量在不同浓度kcl培养基中显著变化;
[0089]
如图3b所示,在浓度0.2-5g/l的nacl培养基中,普鲁兰糖的产量呈现先升高后降低的趋势,在3g/l的nacl培养基产量最高,这与之前报道的菌株ccgcc 12566在不同浓度氯化钠培养基中的普鲁兰糖生产情况是一致的,提高氯化钠的浓度可提高菌株合成普鲁兰糖的能力,这是因为氯化钠可以提高菌株普鲁兰糖合成酶类的酶活,进而提高普鲁兰糖的产量。
[0090]
无机氮源对ncps007生产多糖的影响,可以从图3c中看到,一定浓度的硫酸铵既可保证出芽短梗霉的生长,形成生物量积累,又可促进多糖的生产,当其浓度上升至0.4g/l时,多糖产量最高,而生物量却随着铵盐浓度的提高不断增加,说明氮源的增加有利于菌体
的生长。
[0091]
至于另一无机盐硫酸镁对ncps007生产多糖的影响,结果如图3d所示,多糖产量也是随着硫酸镁浓度的升高先增加后减少,当硫酸镁浓度为0.2 g/l时达到峰值,而对生物量影响不显著。
[0092]
2.4.4利用响应面优化法优化ncps007生产普鲁兰糖的培养基组成
[0093]
为了进一步提升普鲁兰糖的产量,利用pb试验对培养基中各个组份进行了显著性分析,结果显示,显著影响多糖产量的3个因子为豆粕水解液、硫酸铵和氯化钠,因此对这三者进行了响应面优化,最终,三个自变量中每两个变量对普鲁兰多糖生产影响的等高线和曲面图见图4,具体的数据见表4-6。
[0094]
表4响应面设计三因素三水平试验取值情况
[0095][0096]
表5box-behnken设计试验方案及普鲁兰多糖产量
[0097]
runabc普鲁兰多糖(g/l)1000161.0
±
3.23210-1152.3
±
1.563-101158.2
±
2.604000161.8
±
1.925-1-10151.7
±
2.2760-11157.9
±
0.967000162.5
±
1.5380-1-1156.5
±
3.079-110155.5
±
2.1510000161.7
±
2.4911101153.1
±
1.27121-10156.8
±
1.7513-10-1148.9
±
2.161401-1151.2
±
2.6015000159.7
±
0.7416011158.5
±
2.2717110150.3
±
1.96
[0098]
表6回归模型系数显著性检验及方差分析
[0099]
变异来源平方和自由度均方f-值p-值显著性模型302.04933.5642.27《0.0001显著a0.4110.410.510.4982/
b6.8516.858.620.0218/c44.18144.1855.650.0001/ab26.52126.5233.410.0007/ac18.06118.0622.750.0020/bc8.7018.7010.960.0129/a2119.731119.73150.82《0.0001/b224.91124.9131.380.0008/c234.98134.9844.070.0003/残项5.5670.79///失拟项1.0730.360.320.8144不显著纯误差4.4941.12///总离差307.6016////
[0100]
以上结果表明,经过对显著影响普鲁兰多糖产量的3个因子-豆粕水解液、硫酸铵和氯化钠的响应面优化后,最终普鲁兰糖的产量提高至160.2 g/l,转化率为0.80g/g,多糖分子量为1.879
×
105da,最优培养基配方为200g/l果糖,smhs为7.89g/l、硫酸铵0.4g/l、氯化钠为3.45g/l、kcl为 7.5g/l、硫酸镁2g/l,轻质碳酸钙为15g/l。
[0101]
2.4.5 30l发酵罐生产普鲁兰糖
[0102]
为了确认优化的培养基配方在发酵罐中菌株多糖的产量,使用了30l 的发酵罐进行扩大发酵培养,检测了菌株的生物量、多糖产量以及分子量分布等指标(表7、图5)。
[0103]
表7菌株的生物量、多糖产量以及分子量分布情况表
[0104][0105]
随着发酵的进程,发酵液中多糖浓度不断增加,从24h至120h,是多糖浓度快速增长的阶段,从6.5g/l增加到了128.3g/l,在发酵进行的168 小时,也就是第7天,产量为162.1g/l,转化速率为0.965g/l/h。随着发酵的继续,在204h,多糖产量最终达到162.9g/l,
其转化率为0.815g/g,转化效率为0.798g/l/h,与摇瓶发酵相比,转化率得到了稍微的提高,这说明ncps007在发酵罐中多糖的生产也可以保持很高的转化水平和转化效率,保证了将来工业化生产时菌株多糖产量以及成本的控制,也从而说明轻质碳酸钙的加入的确可以大大提高菌株对于高浓度碳源的利用率,对于降低生产多糖的成本起着非常积极的显著作用。
[0106]
普鲁兰多糖的分子量随着产量的增加而不断下降,在12~24h之间,分子量逐渐上升,此时多糖产量也在上升,说明这个阶段是多糖开始合成的阶段,多糖链不断得到延长,分子量增加,而随着发酵的进行,多糖水解酶类也不断增加积累,对已经合成的多糖链进行水解切割,从而导致多糖分子量的不断下降。
[0107]
至于生物量方面,前12h是菌体细胞快速积累的阶段,24h以后,增长速率趋于平缓,说明发酵初期积累的生物量足以满足后续发酵生产多糖的需要。发酵液的ph随着菌体的快速生长,在前12h有所下降,从6.7下降至大约6.0,然后回升至6.36,并且在相当长的发酵进程中保持在6.3上下,这是由于菌体生长不断向发酵液中外排酸性物质,导致发酵开始时发酵液ph的降低,但是得益于轻质碳酸钙的存在,它迅速中和了发酵液中菌体外排的酸性物质,使得发酵液ph得以维持,使得菌体快速进入多糖合成阶段并在发酵过程中保持很高的转化效率。发酵液ph的维持对于多糖的合成至关重要,酸性条件对于菌体的快速生长是有利的,但是却不利于多糖的合成,在我们早期的研究中,发酵培养基的初始ph为3时,菌体快速大量生长,但是却不合成多糖。有研究表明,多糖合成的最佳ph为5.0-5.5 之间。发酵进行至168h,发酵液中总糖几乎耗尽,多糖产量达到162.1g/l,为发酵204h多糖产量的99.5%,多糖分子量为3.26x105 da,至此可作为发酵的终点,收集这个时间点的多糖,进行沉淀纯化,烘干后得到如图5b 所示的不含黑色素的乳白色多糖粉末,说出ncps007可在高渗果糖轻质碳酸钙培养基中高效合成普鲁兰糖且不产生黑色素。
[0108]
关于不同的出芽短梗霉产普鲁兰多糖的结果,如下表8所示:
[0109]
表8不同的菌株发酵产普鲁兰多糖的结果比较
[0110][0111]
以上表格中的菌株除了a.pullulansncps007,为其他文献报道菌株。
[0112]
从以上的结果比较来看,a.pullulansncps007发酵生产普鲁兰多糖能达到162.1g/l,其发酵所获得的普鲁兰多糖的产量要远远的高于其它的出芽短梗霉菌株。
[0113]
具体的参考文献如下:
[0114]
1.jiang,h.,xue,s.j.,li,y.f.,liu,g.l.,chi,z.m.,hu,z.,chi,z.(2018).efficienttransformationofsucroseintohighpullulanconcentrationsbyaureobasidiummelanogenumtn1-2isolatedfromanaturalhoney.foodchemistry257,29
–
35.
[0115]
2.xue,s.j.,chen,l.,jiang,h.,liu,g.l.,chi,z.m.,hu,z.,chi,z.(2019a).highpullulanbiosynthesisfromhighconcentrationofglucosebyahyperosmoticresistant,yeast-likefungalstrainisolatedfromanaturalcomb-honey.foodchemistry286,123
–
128.
[0116]
3.xue,s.j.,jiang,h.,chen,l.,ge,n.,liu,g.l.,hu,z.,chi,z.m.,chi,z.(2019b).over-expressionofvitreoscillahemoglobin(vhb)andflavohemoglobin(fhb)genesgreatlyenhancespullulanproduction.internationaljournalofbiologicalmacromolecules132,701
–
709.
[0117]
4.chen,g.q.,zhu,y.s.,zhang,g.,liu,h.b.,wei,y.x.,wang,p.g.,wang,f.,
xian,m.,xiang,h.y.,zhang,h.b.(2019a).optimizationandcharacterizationofpullulanproductionbyanewlyisolatedhigh-yieldingstrainaureobasidiummelanogenum.preparativebiochemistry&biotechnology49,557
–
566.
[0118]
5.chen,l.,chi,z.,liu,g.l.,xue,s.j.,wang,z.p.,hu,z.,chi,z.m.(2019b).improvedpullulanproductionbyamutantofaureobasidiummelanogenumtn3-1fromanaturalhoneyandcapsuleshellpreparation.internationaljournalofbiologicalmacromolecules141,268
–
277.
[0119]
6.an,c.,ma,s.j.,xue,w.j.,liu,c.,ding,h.(2019).comparativestudyofdifferentmolecularweightpullulanproductionsbyaureobasidiumpullulanscgmccno.11602.3biotech9,156.
[0120]
7.haghighatpanah,n.,mirzaee,h.,khodaiyan,f.,kennedy,j.f.,aghakhani,a.,hosseini,s.s.,jahanbin,k.(2020).optimizationandcharacterizationofpullulanproducedbyanewlyidentifiedstrainofaureobasidiumpullulans.internationaljournalofbiologicalmacromolecules152,305
–
313.
[0121]
2.5原料成本估算
[0122]
不同发酵条件下普鲁兰生产的经济分析。
[0123]
为了评估轻质碳酸钙的引入在多大程度上降低了原材料成本,表9总结了三种不同培养基中普鲁兰糖生产的经济分析。
[0124]
在添加80g/l碳源的培养基中,生产成本含有轻碳酸钙的培养基中的普鲁兰糖比不含轻碳酸钙的原培养物低10.7%。在200g/l果糖和15g/l轻质caco3条件下,优化培养基(iii)生产普鲁兰糖的成本比初始培养基低27.8%。优化后,普鲁兰多糖的收率大大提高,培养基中氮源的使用减少,这两者都导致原料成本降低。
[0125]
表9成本分析
[0126]
[0127][0128]
上述的原料是从http://www.21food.cn获得的(1usd=6.4rmb)。
[0129]
结果表明,由于引入轻质caco3,菌株ncps007可以在高浓度果糖培养基中发酵,转化率具有竞争力,不仅大大提高了普鲁兰糖产量,而且降低了生产成本。本发明中比较了优化之前的未引入轻质caco3时,出芽短梗霉ncps007发酵产普鲁兰多糖的效果,本发明改进培养基后的a.pullulansncps007在30l发酵过程中,在200.0g/l的果糖和15g/l的轻质caco3培养基中可在168h内产生162.1g/l的普鲁兰糖,mw为3.26
×
105g/mol。转化率为0.81g/g,产率为0.965g/l/h。
[0130]
此外,经济分析表明,在优化后的含轻caco3培养基中生产1公斤普鲁兰糖的成本比含k2hpo4的原培养基低27.8%。
[0131]
从附图5中的b可以看出,普鲁兰多糖呈现出乳白色,可以证明其在生产过程中是不产黑色素的。同时,通过色度检测,其数值如下:色度计显示l=94.31,a=-0.16,b=2.66。这也验证了本发明的普鲁兰多糖不含有黑色素(色度计的厂家:上海仪电物理光学仪器有限公司)。
[0132]
综上所述,本发明涉及的菌株在高产普鲁兰糖的同时,不分泌黑色素,极大简化了后期多糖的分离纯化步骤,大大节约了成本;甚至本发明在加入了轻质碳酸钙后,菌株不仅可以在高浓度碳源中高效合成普鲁兰糖,分子量相较于低浓度碳源培养基中加入磷酸氢二钾的还要高,能达到3.26
×ꢀ
105da,说明轻质碳酸钙在发酵生产普鲁兰糖中有显著优势,既可大幅提高产量,又可保证分子量,给后续的普鲁兰糖材料开发利用提供了更多可能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1