一种CYP1A1酶激活反应型荧光探针及其制备方法与应用
一种cyp 1a1酶激活反应型荧光探针及其制备方法与应用
技术领域
1.本发明属于精细化工技术领域,具体涉及一种cyp 1a1酶激活反应型荧光探针及其制备方法与应用。
背景技术:
2.大量研究表明,癌症的发生伴随着各种酶表达水平的异常变化,同时酶因其在许多生理、病理和药理过程中具有重要作用而受到越来越多的关注。因此酶的可激活原位信号对于酶的表达位点和活性的高分辨率研究具有重要意义。人类细胞色素p450酶(cyp 450s)是细胞内血红素蛋白,也被称为单加氧酶,用于多种亲脂性有机化学物质的氧化代谢,是生物体内最重要的代谢酶之一。cyp 450s的异常表达会激活生物体内的惰性致癌物,使其转变为具有高活性的致癌代谢物,大大提高了肿瘤的发病几率。在此氧化过程中起重要作用的为cyp 1a1酶,因此对该酶的变化水平的及时和长期监测可以实现对肿瘤的早发现及早治疗。
3.为了实现对cyp 1a1酶的实时监测,荧光成像技术是最有力的工具之一。已报导的可检测cyp 1a1酶的探针,斯托克斯位移较小,在成像时较难避免探针的自身荧光,背景信号高,信噪比较低;其次,由于cyp 450家族在细胞中表达量均较低,已报道的可检测cyp 1a1酶的探针灵敏度较低,无法检测痕量的cyp 1a1酶,容易造成漏检等现象;同时,小分子探针的代谢速度较快,无法实现对cyp 1a1酶的表达水平的实时长期监测。为解决现有探针存在的问题,开发一种高灵敏度、高信噪比以及可长滞留的酶激活型荧光探针对于准确识别cyp 1a1酶和实时监测该酶的水平波动具有重要研究意义。
技术实现要素:
4.本发明针对现有技术存在的问题,提供了一种cyp 1a1酶激活反应型荧光探针及其制备方法与应用。该类探针以双氰基异弗尔酮为探针母体,对母体结构进行修饰,使其能被cyp 1a1酶特异性识别,其本身在水或有机溶剂中荧光极其微弱。但在cyp 1a1酶存在条件下,此类探针可被酶有效切断,在脱去识别部分后,荧光母体发生消除重排反应,与cyp 1a1酶上的巯基、氨基等基团结合,发出显著荧光。本发明所述探针可长时间原位监测细胞组织中异常表达的酶的水平变化,并通过荧光的变化实现精确和灵敏的响应。由于酶切反应的专一性,探针与酶蛋白的结合以及探针荧光的“开关”性质,此类探针可以实现对cyp 1a1酶的高选择性、高信噪比、高灵敏度和长期成像。
5.本发明采用如下技术方案:
6.本发明首先提供了一种cyp 1a1酶激活反应型荧光探针,所述cyp 1a1酶激活反应型荧光探针,具有如下分子结构通式:
[0007][0008]
本发明其次提供了cyp 1a1酶激活反应型荧光探针的制备方法,以双氰基异弗尔酮类染料作为荧光母体,合成反应如下:
[0009][0010]
合成步骤如下:
[0011]
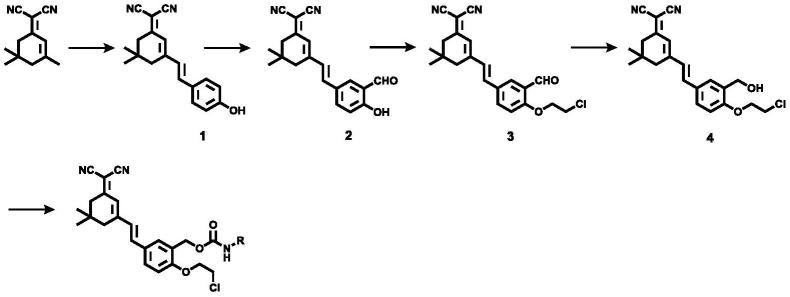
(1)将2-(3,5,5-三甲基环己-2-烯-1-亚基)丙二腈与对羟基苯甲醛溶在无水乙醇中,再加入催化量哌啶,反应混合物回流;去除溶剂、纯化,得到化合物1;
[0012]
(2)将化合物1溶解到三氟乙酸中,再向其中加入乌洛托品,反应混合物回流;反应完成后,去除溶剂、纯化,得到化合物2;
[0013]
(3)将化合物2和碳酸钾溶解在乙腈中,n2气氛下搅拌,再向反应混合物中加入1-溴-2-氯乙烷,随后回流反应;反应结束后,纯化,得到化合物3;
[0014]
(4)将化合物3和硼氢化钠按照比例加入无水乙醇中搅拌,反应结束后,用饱和氯化铵淬灭硼氢化钠,纯化、去除溶剂,得到化合物4;
[0015]
(5)将化合物4与异氰酸酯类化合物和催化剂按照比例溶在无水二氯甲烷中,室温搅拌;反应结束后,纯化,得到所述荧光探针。
[0016]
进一步地,上述技术方案中,所述异氰酸酯类化合物为异氰酸甲酯,异氰酸乙酯,异氰酸丙酯,异氰酸丁酯,异氰酸戊酯中的一种。
[0017]
进一步地,上述技术方案中,所述催化剂为无水三乙胺、二月桂酸二丁基锡中的一种。
[0018]
进一步地,上述技术方案中,所述去除溶剂的方法包括减压蒸发;所述纯化的方法包括柱层析、萃取。
[0019]
进一步地,上述技术方案中,步骤(2)和步骤(4)的反应进行时,进行实时tlc监测。
[0020]
进一步地,上述技术方案中,步骤(1)中反应混合物回流反应时间为2-4h;步骤(3)中n2气氛下搅拌10-50min;步骤(5)中室温搅拌2-4h。
[0021]
本发明最后提供了一种cyp 1a1酶激活反应型荧光探针的应用,通过对cyp 1a1酶的高选择性离体荧光响应,应用于检测活细胞、组织以及活体中的cyp 1a1酶成像,同时利用此荧光探针的长滞留荧光特性对cyp 1a1酶相关的癌细胞进行长期监测,对其转移和侵袭进行进一步探究。
[0022]
进一步地,上述技术方案中,用于测定细胞中荧光探针与cyp 1a1酶反应产生的水解产物的荧光强度随时间变化的变化作为cyp 1a1酶活性的评价指标,以及测定荧光持续时间,监测cyp 1a1酶的实时变化水平。
[0023]
进一步地,上述技术方案中,通过所述荧光探针的荧光成像结果来监测高表达cyp 1a1酶的癌细胞的转移和侵袭路径。
[0024]
本发明中荧光探针检测cyp 1a1酶活性时,以该荧光探针作为cyp 1a1酶的酶促切割反应的底物,在特定条件下检测酶促反应产物的荧光强度来评估活细胞以及活体中cyp 1a1酶的活性。由于酶促反应底物探针和反应后产物在相同条件下荧光差异较为明显,因此本发明提供的探针可在多种生物体系下检测并长时间监测cyp 1a1酶的活性及水平波动。
[0025]
其中,所述荧光探针对体外细胞中cyp 1a1酶的检测过程为:将荧光探针溶于二甲基亚砜溶液中,制备得到5mm母液。针对体外细胞,取8μl母液,溶于2ml培养基中,配置为20μm的孵育液备用。此时,孵育液的ph值为7.4~7.5,温度为37℃;将细胞mc-38或lo2活细胞用含有荧光探针的培养基孵育,测定随时间变化时,荧光探针与细胞内cyp 1a1酶反应产生的水解产物的荧光强度的变化,并以此作为cyp 1a1酶活性以及水平波动的评价指标。
[0026]
其中,所述荧光探针对高表达cyp 1a1酶的癌细胞在生物体内转移过程的检测过程为:配置含荧光探针的培养基,培养基中荧光探针的浓度为20μm。用含有荧光探针的培养基预先孵育mcf-7肿瘤细胞,待细胞中荧光强度最强时,将孵育后肿瘤细胞经尾静脉注射进入小鼠体内,测定随时间变化时老鼠体内荧光分布区域的变化,并以此作为高表达cyp 1a1酶的肿瘤细胞在体内的转移和侵袭路径的评估指标。
[0027]
其中,所述荧光探针在体内测定其在细胞中的荧光持久性的检测过程:配置含荧光探针的培养基,培养基中荧光探针的浓度为20μm。用含有荧光探针的培养基预先孵育mc-38肿瘤细胞,待细胞中荧光强度最强时,将孵育后肿瘤细胞皮下注射到老鼠背部。测定随时间变化时,注射细胞位点的荧光强度变化以及持续时间,并以此作为该荧光探针的荧光持久性的评价指标。
[0028]
本发明荧光探针分子中特定的邻氯乙氧基的结构使之只能进入cyp 1a1酶的反应空腔中发生酶解反应,因此该荧光探针可以实现对cyp 1a1酶的特异性检测。荧光探针分子中的2-氯乙氧基通过酶水解反应断开碳氧键后发生分子内1,4-消除,生成高度亲电子的醌式结构,与cyp 1a1酶上的亲核基团如(氨基、巯基)以共价键形式结合,探针与cyp 1a1酶一起保留在细胞内,延长滞留时间并在光激发后有显著的荧光发射;通过检测不同时间内的荧光强度来测定不同生物体系中cyp 1a1酶的浓度以及荧光持续时间。
[0029]
反应式如下:
[0030][0031]
选用本发明所述的荧光探针用于检测cyp 1a1酶的活性及长时间监测该酶表达水平的波动具有以下突出优势:
[0032]
(1)高特异性:荧光探针中引入的邻氯乙氧基可特异性被cyp 1a1酶识别,对多种干扰物质(如生物酶、生物大分子、无机盐)均无明显荧光响应;
[0033]
(2)高灵敏度:采用酶激活型荧光“开关”策略,未被cyp 1a1酶识别前,探针dcbem只有微弱性能,而识别后产物具有良好的荧光性能,且斯托克斯位移较大,可以更好的避免背景荧光,同时荧光保留时间久,提高灵敏度;
[0034]
(3)荧光持久性好:探针被识别后产生的高活性的醌式结构与蛋白酶上的亲核基团以共价键的形式结合,以蛋白标签的形式被保留在细胞中,随蛋白的运动而运动,且荧光增强,同时不影响cyp 1a1酶的活性,可较长时间存在于细胞中。
[0035]
(4)荧光探针可用于溶液中重组单酶、活细胞、小鼠体内cyp 1a1酶活性的测定,应用范围较广。测试表明,本发明所述的荧光探针对cyp 1a1酶具有高选择性的荧光响应和低的检测限(1.66ng/ml),并在cyp 1a1酶高表达的肿瘤细胞进行长期监测和体内追踪两方面表现出优良性质:在体外细胞中可保持长达36h的荧光存续时间;而在体内该荧光标记可保持4天,表现出优良的荧光持久性;用本发明所述荧光探针标记的mcf-7细胞可以追踪到它的转移和侵袭路径为“肠道-肝脏-肺部-肾脏”。
附图说明
[0036]
图1为探针dcbem对cyp 1a1酶以及其他干扰分子的选择性测试。其中,a)为探针dcbem对gsh、arg、ala、tyr、lys、trp、met、val、phe、cys、glu、cyp 1a1酶的选择性测试结果;b)为为探针dcbem对cyp1a2、cyp2j2、ggt、apn、cyp 1a1酶的选择性测试结果。
[0037]
图2为探针dcbem与不同浓度的cyp 1a1酶的荧光响应谱图及线性关系。其中,a)为不同浓度cyp 1a1酶催化下的荧光强度曲线,b)为cyp 1a1蛋白浓度与荧光强度的线性关系以及对cyp 1a1酶的最低检测限。
[0038]
图3为探针dcbem与cyp 1a1酶结合的凝胶电泳机理验证图。
[0039]
图4为探针dcbem在mc-38细胞中的时间依赖荧光成像。
[0040]
图5为探针dcbem用于活体追踪癌细胞的转移和侵袭路径的时间依赖荧光成像。
[0041]
图6为探针dcbem在活体小鼠中的时间依赖荧光成像。
[0042]
图7为探针dcbem的质谱图。
[0043]
图8为探针dcbem的核磁氢谱。
具体实施方式
[0044]
以下结合具体实施例对本发明的技术方案做进一步说明。
[0045]
实施例1:
[0046]
本发明所述cyp 1a1酶激活反应型荧光探针,
[0047]
合成路线为:
[0048][0049]
采用如下方式制备而成:
[0050]
(1)将2-(3,5,5-三甲基环己-2-烯-1-亚基)丙二腈(1.512g,8.11mmol)与对羟基苯甲醛(0.611g,4.99mmol)溶在20ml无水乙醇中,再加入催化量哌啶,反应混合物在80℃下回流2h。反应结束后减压蒸发溶剂,利用柱层析法提纯(dcm:etoh=40:1v/v),得到橙色固体粉末的化合物1(1.275g,88.1%产率);1h nmr(400mhz,chloroform-d)δ7.45(d,j=8.5hz,2h),7.04(d,j=16.0hz,1h),6.92
–
6.80(m,4h),2.62(s,2h),2.48(s,2h),1.10(s,6h);
[0051]
(2)将化合物1(600mg,2.06mmol)溶解到5ml三氟乙酸中,再向其中加入乌洛托品(678mg,4.84mmol),反应混合物在72.4℃下回流2h。反应通过tlc(pe:ea=7:1)监测,结束后,用饱和氯化钠水溶液和乙酸乙酯萃取,减压蒸发有机相,粗产物柱层析纯化得淡黄色固体产物化合物2(215mg,32.81%产率);1h nmr(400mhz,dmso-d6)δ0.99
–
1.05(s,6h),2.52
–
2.55(s,2h),2.58
–
2.64(s,2h),6.85
–
6.90(s,1h),6.99
–
7.09(s,1h),7.28
–
7.34(s,2h),7.86
–
7.93(s,1h),7.94
–
8.00(s,1h),10.22
–
10.34(s,1h),11.08
–
11.22(s,1h);
[0052]
(3)将化合物2(109mg,0.34mmol)和碳酸钾(143mg,1.03mmol)溶解在乙腈中,n2气氛下搅拌30min后,再向反应混合物中加入1-溴-2-氯乙烷(243.7mg,1.7mmol),随后回流过夜。反应结束后,粗产物柱层析纯化(dcm:pe=4:1),得到淡黄色产物化合物3(20mg,15.5%产率);1h nmr(400mhz,dmso-d6)δ10.43(s,1h),8.02(s,2h),7.42(s,1h),7.36(s,1h),7.33(s,1h),6.93(s,1h),4.51(s,2h),4.05(s,2h),2.62(s,2h),2.55(s,2h),1.02(s,6h);
[0053]
(4)将化合物3和硼氢化钠按照2:1的摩尔比例加入无水乙醇中搅拌0.5h,通过tlc检测反应。反应结束后,用饱和氯化铵淬灭硼氢化钠后用二氯甲烷和饱和食盐水萃取,取有机相,旋干后直接投入下一步反应,得到化合物4;
[0054]
(5)将化合物4与异氰酸乙酯和无水三乙胺按照1:10:5的摩尔比溶在无水二氯甲烷中,室温搅拌4h。反应结束后,柱层析纯化(pe:ea:dcm=4:2:1v/v/v),得到淡黄色固体(10mg,21.4%产率);1h nmr(400mhz,chloroform-d)δ7.56(s,1h),7.47(s,1h),7.02(s,
1h),6.92(s,1h),6.88(s,1h),6.84(s,1h),5.22(s,2h),4.32(s,3h),4.13(s,2h),3.86(s,2h),2.62(s,2h),2.48(s,2h),1.10(s,6h);经质谱(如图7)以及核磁(如图8)分析,所得淡黄色固体即为目标产物,记为dcbem。
[0055]
实施例2:探针dcbem对cyp 1a1酶以及其他干扰分子的选择性测试
[0056]
孵育体系nadph还原系统的构成:β-烟酰胺腺嘌呤二核苷磷(1.0mm);葡萄糖-6-磷酸(10.0mm);葡萄糖-6-磷酸脱氢酶(1.0unit/ml);,氯化镁(4.0mm),上述辅酶系统均由0.1m的pbs缓冲液(ph=7.4)进行溶解。
[0057]
在酶参与的响应测试中,在终体积为200μl孵育体系中分别加入上述葡萄糖-6-磷酸溶液2μl,β-烟酰胺腺嘌呤二核苷磷酸溶液20μl,葡萄糖-6-磷酸脱氢酶溶液0.2μl,以及3μl的cyp 1a1酶(终浓度0.15mg/ml)和0.8μl的5mm的探针母液溶液(dcbem在孵育体系中的终浓度20μm),最后加入174.2μl的pbs缓冲液。然后将上述混合物混合均匀,置于37℃恒温摇床中,孵育2h,结束孵育后,向该体系中加入等体积的二甲基亚砜(dmso)停止孵育并混合均匀。
[0058]
在其他生物小分子参与的响应测试中,各生物小分子(终浓度为0.15mg/ml)在pbs缓冲液中与探针在37℃恒温摇床中孵育2h,同样在孵育结束后加入等体积的dmso。将上述反应液送去荧光分析,激发波长为550nm,由图1可知,本发明荧光探针dcben对cyp 1a1酶具有高的选择性。
[0059]
实施例3:探针dcbem对cyp 1a1酶的荧光响应谱图及线性关系
[0060]
在与实施例2相同的孵育体系中,改变cyp 1a1酶的浓度,进行孵育以及结束反应。实验在酶标仪上使用96孔板进行测定,产物的荧光强度与蛋白浓度做标准曲线。同时,通过dl=3σ/k公式来计算探针对cyp 1a1酶的最低检测限,其中,σ为代表空白样品的标准方差,k代表探针分子识别后荧光强度与酶浓度之间的线性系数。如图2所示,a)图为不同浓度cyp 1a1酶催化下的荧光强度曲线,b)为cyp 1a1蛋白浓度与荧光强度的线性关系以及对cyp 1a1酶的最低检测限;激发波长为550nm。由图可知,在0~0.01mg/ml范围内,672nm处的荧光峰强度逐渐增加,并与酶浓度呈良好的线性关系,即使cyp1a1的浓度低至1.66ng/ml,也可以完全检测到dcbem荧光强度的增强,这接近于组织中cyp1a1的表达水平(约2.27fmol/μg)。上述结果证明了dcbem对cyp1a1表达变化的超敏反应。
[0061]
实施例4:探针dcbem与cyp 1a1酶蛋白结合的凝胶电泳机理验证
[0062]
通过聚丙烯酰胺凝胶电泳(sds-page)实验来验证探针与cyp 1a1酶蛋白的结合。将cyp 1a1酶,α-糜蛋白酶(cht),牛血清白蛋白(bsa)按照相同浓度(0.5mg/ml)分别在cyp 1a1酶孵育体系,pbs缓冲溶液中与探针37℃孵育2h,孵育结束后,向反应液中加入蛋白上样缓冲液(5x),95℃水浴加热使蛋白变性分别制备蛋白样品。按照蛋白上样量为20μg来计算上样体积,将样品加入10%的聚丙烯酰胺凝胶电泳槽中,90v恒压电泳0.5h,再110v恒压电泳1h。电泳结束后,对凝胶进行荧光成像,之后再用考马斯亮蓝进行染色。由图3可知,只有在cyp 1a1酶的泳道中出现了荧光信号,验证了探针与cyp 1a1酶结合而保留的机理。
[0063]
实施例5:探针dcbem在mc-38细胞中的时间依赖荧光成像
[0064]
将mc-38细胞(小鼠结肠癌细胞)接种至共聚焦细胞培养皿中,加入2ml相应的培养基(含10%胎牛血清),在恒温培养箱中(37℃,5%co2)培育24小时。观测到mc-38细胞长至70%-80%时,倒掉旧的培养基,然后用pbs(1ml)洗涤3次,再加入含有dcbem(20μm)的培养
基与细胞共同孵育。在单光子共聚焦显微镜下,观测荧光随时间的变化情况。在抑制剂对照组中,细胞先用含白藜芦醇(20μm)抑制剂的培养液培养30分钟,然后用pbs(1ml)洗涤3次,最后含有dcbem(20μm)的培养基与细胞共同孵育。30分钟后,用pbs(1ml)洗涤细胞3次。最后在共聚焦显微镜下观察细胞内的荧光分布状态。激发波长560nm,荧光采集范围610-710nm,通过图4可知,本发明荧光探针dcbem可用于mc-38细胞内cyp 1a1酶的定性检测和长期监测。
[0065]
实施例6:探针dcbem用于活体追踪癌细胞的转移和侵袭路径的时间依赖荧光成像
[0066]
据文献报道,人乳腺癌细胞(mcf-7)中cyp 1a1酶的表达水平较高,同时,mcf-7细胞的转移和侵袭能力很强,但mcf-7细胞的转移和侵袭并不是短时间内就可以观察到的,本发明所述的探针对于该细胞的转移和侵袭路径的探索具有重要意义。将mcf-7细胞接种至10cm大圆皿中,加入6ml相应的培养基(含10%胎牛血清),在恒温培养箱中(37℃,5%co2)培育24小时。观测到mcf-7细胞长至70%-80%时,倒掉旧的培养基,然后用pbs(1ml)洗涤3次,再加入含有dcbem(20μm)的培养基与细胞共同孵育。待探针达到最大荧光亮度时,将圆皿中的已被荧光标记的细胞经尾静脉注射至小鼠体内,通过小动物成像仪观测随时间变化小鼠体内的荧光变化,同时观测对应时间时小鼠脏器的荧光变化。选用的滤光片激发波长为530
±
20nm,发射波长为650
±
20nm。由图5可知,本发明荧光探针dcbem可用于监测活体追踪癌细胞的转移和侵袭路径,荧光标记的mcf-7细胞尾静脉注射24h后,依然有微弱荧光存在,从解剖后的脏器荧光图中,可以发现荧光主要存在肠道、肝脏、肾脏和肺部这些脏器中,存在“肠道-肝脏-肺部-肾脏”的转移路径。
[0067]
实施例7:探针dcbem在活体小鼠中的时间依赖荧光成像。
[0068]
小白鼠在参与实验前禁食24h,期间只提供蒸馏水,接种肿瘤部位提前脱毛处理。提前一天将mc-38细胞接种至10cm细胞培养皿中,加入6ml相应的培养基(含10%胎牛血清),在恒温培养箱中(37℃,5%co2)培育24小时。观测到mc-38细胞长至70%-80%时,倒掉旧的培养基,然后用pbs(1ml)洗涤3次,再加入含有dcbem(20μm)的培养基与细胞共同孵育。待探针达到最大荧光亮度时,将圆皿中的已被荧光标记的细胞通过皮下注射到小鼠背部,通过小动物成像仪观测皮下注射位点的荧光随时间的变化程度,同时观测小鼠肿瘤的生长情况。由图6可知,本发明荧光探针dcbem在活体肿瘤细胞中荧光可以持续4天,且皮下肿瘤模型成功构建,同时说明本发明所述的荧光探针生物安全性优良。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1