酯化基因用于对虾青素进行酯化的应用
1.本公开属于生物工程技术领域,特别涉及一种酯化基因用于对虾青素进行酯化的应用。
背景技术:
2.雨生红球藻是一种单细胞淡水微藻,由于能大量累积虾青素而呈现红色,是自然界中合成天然虾青素产量最高的生物之一。雨生红球藻合成的虾青素一般可占细胞干重的3-4%。目前,雨生红球藻中虾青素合成途径已被解析。由乙酰辅酶a起始,经磷酸甲基赤藓醇途径(mep)路径形成异戊烯焦磷酸(ipp),异戊二烯单元逐步缩合形成第一个类胡萝卜素-八氢番茄红素(phytoene),随后去饱和生成番茄红素(lycopene),环化反应生成β-胡萝卜素(β-carotene),β-胡萝卜素酮化酶(crtw)引入酮基生成海胆酮(echinenone)和角黄素(cant axanthin),然后β-胡萝卜素羟化酶(crtz)在角黄素中引入羟基形成凤凰黄质(phoenicoxanthin),最后形成虾青素。
3.尽管雨生红球藻中虾青素合成路径比较清楚,但是其酯化虾青素的基因尚未被报道。相关技术中,酯化虾青素可以通过生物法得到。例如,基于雨生红球藻合成酯化虾青素。在高温下用有机酸或无机酸对雨生红球藻红色相的被囊细胞进行预处理,并用裂解酶或其他酶从厚细胞壁的雨生红球藻细胞中释放成分,然后用丙酮或植物油进行萃取提取酯化虾青素。
4.然而,通过以上方法形成酯化虾青素时,合成效率低,不利于批量合成。
技术实现要素:
5.本公开实施例提供了一种酯化基因用于虾青素酯化的应用,利用雨生红球藻的二酰基甘油酰基转移酶编码hpdgtt4基因作为酯化基因可以辅助产游离虾青素的菌株,得到酯化虾青素。所述技术方案如下:
6.本公开实施例提供了一种酯化基因用于对虾青素进行酯化的应用,所述应用包括:将所述酯化基因用于对虾青素进行酯化,所述酯化基因为雨生红球藻的二酰基甘油酰基转移酶编码hpdgtt4基因。
7.具体地,所述酯化基因用于对游离型虾青素进行酯化。
8.具体地,所述应用还包括:
9.采用所述酯化基因构建酯化虾青素的表达载体;
10.将所述表达载体转化至产游离虾青素的菌株中,所述菌株分泌虾青素单酯或者虾青素二酯,得到酯化虾青素。
11.进一步地,所述应用还包括:获取所述酯化基因,获取所述酯化基因包括:
12.获取所述雨生红球藻的多个dgtt基因;
13.从所述多个dgtt基因中,筛选出二酰基甘油酰基转移酶编码hpdgtt4基因,作为所述酯化基因。
14.更进一步地,采用所述酯化基因构建酯化虾青素的表达载体,包括:
15.对所述酯化基因进行密码子优化;
16.将优化后的所述酯化基因克隆到线性载体上,得到所述表达载体。
17.又进一步地,将优化后的所述酯化基因克隆到线性载体上,包括:
18.将载体进行双酶切,得到多个线性化的载体片段;
19.通过凝胶电泳对多个所述线性化的载体片段进行分离,回收目的载体片段,得到线性化载体;
20.将所述线性化载体和优化后的所述酯化基因通过连接酶进行连接,使得优化后的所述酯化基因克隆到所述线性化载体片段上。
21.再进一步地,采用与所述载体配合的内切酶进行双酶切。
22.进一步地,所述将所述表达载体转化至产游离虾青素的菌株中,得到酯化虾青素,包括:
23.对所述产游离虾青素的菌株进行活化处理;
24.将所述表达载体转化至经活化处理后的所述产游离虾青素的菌株中,并进行培养,得到培养液;
25.对所述培养液进行处理,得到所述酯化虾青素。
26.进一步地,所述产游离虾青素的菌株为细菌、酵母和微藻中的至少一种。
27.更进一步地,所述产游离虾青素的菌株为解脂耶式酵母工程菌株。
28.本公开实施例提供的技术方案带来的有益效果是:
29.本公开实施例提供的酯化基因用于对虾青素进行酯化的应用,利用雨生红球藻的二酰基甘油酰基转移酶编码hpdgtt4基因作为酯化基因可以辅助产游离虾青素的菌株,能够批量得到酯化虾青素。
附图说明
30.为了更清楚地说明本公开实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本公开的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
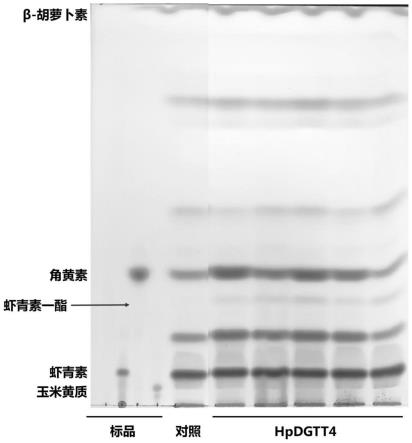
31.图1是本公开实施例提供的从重组解脂耶氏酵母工程菌株hpdgtt4中提取的总类胡萝卜素的薄层层析分离图;
32.图2a是本公开实施例提供的重组解脂耶氏酵母工程菌株hpdgtt4总类胡萝卜素在薄层层析板上新出现条带的lc/ms分析图;
33.图2b是本公开实施例提供的重组解脂耶氏酵母工程菌株hpdgtt4总类胡萝卜素中新鉴定出ast-c18:1的分析图;
34.图2c是本公开实施例提供的重组解脂耶氏酵母工程菌株hpdgtt4总类胡萝卜素中新鉴定出ast-c18:2的分析图;
35.图2d是本公开实施例提供的重组解脂耶氏酵母工程菌株hpdgtt4总类胡萝卜素中新鉴定出ast-c18:0的分析图;
36.图2e是本公开实施例提供的重组解脂耶氏酵母工程菌株hpdgtt4总类胡萝卜素中
新鉴定出ast-c16:0的分析图;
37.图2f是本公开实施例提供的重组解脂耶氏酵母工程菌株hpdgtt4总类胡萝卜素中新鉴定出ast-c16:1的分析图;
38.图3是本公开实施例提供的重组解脂耶氏酵母工程菌株hpdgtt4总类胡萝卜素中新鉴定出虾青素二酯ast-c18:2/c18:2的分析图。
具体实施方式
39.为使本公开的目的、技术方案和优点更加清楚,下面将结合附图对本公开实施方式作进一步地详细描述。
40.虾青素的化学名称为3,3
’‑
二羟基-4,4’-二酮基-β,β
’‑
胡萝卜素,为萜烯类不饱和化合物,分子式为c
40h52
o4。虾青素极易被氧化。虾青素是一种天然红色的酮基类胡萝卜素。
41.本公开实施例还提供了一种酯化基因用于对虾青素进行酯化的应用,该应用包括:
42.将酯化基因用于对虾青素进行酯化,酯化基因为雨生红球藻的二酰基甘油酰基转移酶编码hpdgtt4基因。
43.具体地,酯化基因用于对游离型虾青素进行酯化。
44.采用酯化基因构建酯化虾青素的表达载体。
45.表达载体是在克隆载体基本骨架的基础上增加表达元件(如启动子或终止子等),使目的基因能够表达的载体。
46.在本公开实施例中,目的基因指前文的酯化基因。也就是说,表达载体就是在克隆载体的基础上,增加以上酯化基因。
47.本实施例中,克隆载体为质粒。
48.将表达载体转化至产游离虾青素的菌株中,菌株分泌虾青素单酯和虾青素二酯中的至少一种,获得的重组菌株命名为hpdgtt4,重组菌株能够合成酯化虾青素。
49.具体地,产游离虾青素的菌株可以为细菌、酵母和微藻中的至少一种。本实施例中,产游离虾青素的菌株可以为解脂耶式酵母工程菌株,具体为,解脂耶式酵母工程菌株uhpda*16(本实验室保存)。当然,在其他实施例中,该菌株也可以为其他类型的产游离虾青素的菌株。
50.hpdgtt4基因在能够在合成游离虾青素的菌株(工程菌株或野生菌株)中表达,并合成对应的蛋白,从而催化游离虾青素转化为酯化虾青素。该hpdgtt4基因可用于高效制备酯化虾青素,提高虾青素稳定性。
51.也就是说,以上方法可以配合生物合成获得非天然来源的酯化虾青素,大大提高了合成酯化虾青素的稳定性以及效率。
52.获取酯化基因。
53.该应用还包括:获取酯化基因,获取酯化基因包括:
54.获取雨生红球藻的多个dgtt基因。
55.雨生红球藻的多个dgtt基因均可以基因库中获取。本实施例中提供的二酰基甘油酰基转移酶编码hpdgtt4基因的序列号为qoy44187.1。
56.为了进一步明确雨生红球藻中的hpdgtt4基因是否为以上所说的酯化基因,本公开实施例在从dgtt基因中,获取和hpdgtt4基因,以hpdgtt4基因作为酯化基因,以pylxp’2空载作为对照。
57.采用酯化基因构建酯化虾青素的表达载体。
58.将表达载体转化至产游离虾青素的菌株中,菌株分泌虾青素单酯和虾青素二酯中的至少一种,得到酯化虾青素。
59.具体地,对酯化基因进行密码子优化。
60.密码子是生物信息从基因流向蛋白质的重要桥梁,每一个密码子(包含三个碱基)最终会被翻译成一个氨基酸(终止密码子除外)。三个密码子对应一个氨基酸,但一个氨基酸可能对应多种密码子。
61.根据排列组合知识,可知一条长度为n的氨基酸序列,理论上有3n条基因序列与之对应。如果一条蛋白质有100个氨基酸,则会有3
100
条相对应的基因序列。所以,密码子优化就是为了从每一条蛋白质序列对应的所有可能碱基序列选出最优的碱基序列。也就是说,密码子优化就是从酯化基因所对应的多种密码子中找出适用于在解脂耶式酵母工程菌株进行表达的密码子。而解脂耶式酵母工程菌株适用的密码子可以通过实验进行确定。
62.通俗一点说,就是将酯化基因进行密码子优化之后,可以使得酯化基因在进入到后续的产游离虾青素的菌株中进行表达时,能够被高效的转录和表达。
63.将优化后的酯化基因克隆到pylxp’2线性载体上,得到表达载体,表达载体为pylxp’2::hpdgtt4载体。
64.(1)将pylxp’2载体进行双酶切,得到多个线性化的pylxp’2载体片段,各线性化pylxp’2载体片段具有粘性末端。
65.示例性地,pylxp’2载体来自umbc化学生化与环境工程实验室。
66.pylxp’2载体为环形质粒载体,且pylxp’2载体中包括启动子和终止子。在其它实施例中,pylxp’2载体还是为其它异源表达载体,例如:pyes3/ct或pyc52等。
67.双酶切为用两个限制性核酸内切酶进行切割,这样环形质粒载体被切割为多个线性化的pylxp’2载体片段,每个线性化的pylxp’2载体片段分别具有两个粘性末端的缺口。也就是说,环形质粒载体会变成多段线化性的载体片段。然后回收目的载体片段(即为需要的那一段线性化的载体片段),因为目的载体片段的两端具有与目的基因(也就是酯化基因)片段互补的粘性末端,这样,在t4 dna连接酶的作用下,目的基因便可以与目的载体片段的粘性末端连接在一起,得到环状且克隆有酯化基因的表达载体。
68.线性化的pylxp’2载体片段为pylxp’2载体通过双酶切后形成的基因片段。
69.本实施例中,pylxp’2载体使用kpni(内切酶1)-snabi(内切酶2)双酶切。在其它实施例中,当载体为pyes3/ct载体时,相应地,双切酶则为与该载体对应的kpni(内切酶1)-xbai(内切酶2)双酶切。
70.相关反应体系参照表1,其中,反应条件为37℃,反应时间为60min。
71.表1为双酶切反应体系
72.组分体积(μl)kpni5snabi5
cutsmart酶切缓冲液12pylxp’2载体80双蒸馏水18总体积120
73.本实施例中,当双酶切反应结束后,可以使用凝胶电泳来分离不同长度的dna片段,进而确定双酶切反应是否成功。
74.(2)通过凝胶电泳对多个线性化的pylxp’2载体片段进行分离,并用dna凝胶回收试剂盒对线性化的pylxp’2载体片段中的目的载体片段进行片段回收,得到pylxp’2线性化载体片段。
75.示例性地,凝胶电泳可以为琼脂糖凝胶电泳。琼脂糖凝胶电泳是一种根据dna片段长度不同,用于dna片段分离的方法。
76.dna凝胶回收试验盒是一种用于从dna琼脂糖凝胶中回收需要的基因片段的试剂盒,采用omage的凝胶回收试剂盒。
77.也就是说,通过dna凝胶回收试验盒能够将pylxp’2载体中酶切出来的目的载体片段进行回收。
78.(3)将pylxp’2线性化载体片段和优化后的酯化基因二酰基甘油酰基转移酶编码基因通过同源重组酶进行连接,使得优化后的酯化基因二酰基甘油酰基转移酶编码基因克隆到pylxp’2线性化载体片段上,得到pylxp’2::hpdgtt4。
79.将pylxp’2线性化载体片段和优化后的酯化基因二酰基甘油酰基转移酶编码基因使用同源重组酶进行dna片段连接,可以使得优化后的酯化基因二酰基甘油酰基转移酶编码基因克隆到pylxp’2线性化载体片段上。
80.具体dna连接体系参见表2,其中,连接体系的反应条件为37℃,反应时间为60min。
81.表2为连接体系
82.组分体积(μl)pylxp’2线性化载体片段1hpdgtt4基因3重组酶混合物5双蒸馏水1总体积10
83.本实施例提供的重组酶混合物为全式金seamless cloning and assembly kit试剂盒中的2
×
basicassembly mix。
84.对产游离虾青素的菌株进行活化处理。
85.由于产游离虾青素的菌株在使用之前,均是冷藏保存,所以使用前需要进行解冻,以使其复苏活化。
86.本实施例中,对解脂耶式酵母工程菌株uhpda*16进行活化处理。
87.将表达载体转化至经过活化处理后的产游离虾青素的菌株中,并进行培养,得到培养液。
88.将活化处理后的产游离虾青素的菌株的菌液涂抹在培养基平板上进行培养,得到
底盘菌株。
89.将活化24~36h后的解脂耶式酵母工程菌株uhpda*16的菌液涂于固体活化培养基,并在28~30℃条件下静置培养48h。
90.然后在固体活化培养基平板挑取出游离虾青素含量最高的菌株,作为底盘菌株。
91.将表达载体转化至底盘菌株中进行培养,得到培养液。
92.取300ng pylxp’2::hpdgtt4、90μl聚乙二醇6000、2mol/l醋酸锂、5μlssdna(single-stranded dna,单链dna)和一定量的底盘菌株(uhpda*16)混匀放至30℃温浴30min,随后热激10min,得到菌液。
93.再将菌液涂至尿嘧啶缺陷型平板,28℃培养2~3天。从尿嘧啶缺陷型平板上挑取单菌落用尿嘧啶缺陷培养基活化发酵得到培养液。
94.对培养液进行处理,得到酯化虾青素。
95.将培养液进行离心、漩涡震荡和萃取,得到提取液。
96.本实施例中,取30ml培养液4000rpm下离心10min,得到沉淀(菌体),收集菌体,加入5ml乙酸乙酯和2~3ml的直径为2mm的玻璃珠,在多功能涡旋混匀仪上以2500rpm萃取50min。
97.经过短暂的离心收集上层油相,得到提取液。
98.对提取液进行薄层色谱法(tlc)分离和高效液相色谱(hplc)检测,得到酯化虾青素并加以鉴定。
99.本实施例中,tlc分离条件:将上述得到的提取液经过氮气浓缩并用10μl氯仿复溶后点至薄层色谱板,在载层剂(乙醚:正己烷=2:3,v/v)中进行分离,回收酯化虾青素条带并复溶至氯仿中。
100.在跑完一次后,换新载层剂(乙醚:正己烷=2:3,v/v)再次进行第二次分离。
101.hplc检测条件:色谱柱为ymc carotenoid c 30(4.6mm
×
250mm,5μm)反向液相色谱柱。
102.流动相为a-b液进行梯度洗脱,0~90min,0~100% b液,100%~0% a液。体积流量1.0ml/min,柱温30℃,进样量10μl,检测波长450nm。
103.流动相a液:甲醇/甲基叔丁基醚/水=81/15/4。
104.流动相b液:甲醇/甲基叔丁基醚/水=7/90/3。
105.本实施例中,经过上述处理后,实际上得到的是总虾青素,所谓的总虾青素包括酯化虾青素和非酯化虾青素。
106.对酯化虾青素进行鉴定。
107.酯化虾青素的鉴定使用赛默飞u3000高效液相色谱仪,dad检测器,qexactive静电场轨道肼质谱。
108.质谱条件:离子源为apci源,雾化气45arb。
109.辅助气15arb;喷雾电压5000v,离子传输毛细管温度320℃;辅助气温度300℃;扫描模式:正离子full ms/dd-ms2,扫描范围m/z;500-1400,正负离子切换。
110.以上在进行了薄层层析分离,uhpda*16::hpdgtt4挑取5个转化子进行活化发酵(对照组为uhpda*16::pylxp’2)。
111.同源重组后的载体pylxp’2-hpdgtt4转化到大肠杆菌dh5α中,氨苄抗性筛选,转化
子先采用pcr检测后进行测序,选取正确的转化子提取质粒,进行酵母转化到产游离虾青素的解脂耶氏酵母工程菌株中,命名过表达hpdgtt4基因的重组解脂耶氏酵母工程菌株为hpdgtt4。
112.hpdgtt4的所有转化子中在游离虾青素的上方出现了一条新的条带,如图1所示。将这条新条带回收后,进一步进行了lc-ms鉴定,如图2a~2f所示。分析结果,图2a中显示含有多种酯化虾青素。基于ms结果提取的离子峰,可以检测到五种酯化虾青素,五种酯化虾青素的酯化形式分别为c16:0、c16:1、c18:0、c18:1和c18:2。其中astaxanthin-c18:2是主要的酯化虾青素形式,其次为astaxanthin-c18:1,再次为astaxanthin-c16:1,astaxanthin-c16:0,astaxanthin-c18:0。而在解脂耶式酵母工程菌株的脂肪酸谱中,c18:1(约占总脂肪酸的30-40%)和c18:2(约占总脂肪酸的40-45%)为主要脂肪酸共占总脂肪酸70-80%,c16:1和c16:0次之各占10%左右,c18:0含量最少,且少于5%,与酯化虾青素的脂肪酸谱一致。
113.同时将提取的总类胡萝卜素样品进一步进行lc-ms鉴定,发现了虾青素二酯(图3),图中给出了其一级谱和二级谱数据,确定该二酯为astaxanthin-c18:2/c18:2,其他二酯并未鉴定到,可能是含量太低。说明hpdgtt4有使虾青素一酯与脂肪酸酯化形成虾青素二酯的能力,且对底物c18:2具有一定的偏好性。
114.也就是说,通过以上图谱分析,可以说明hpdgtt4可以将游离虾青素转化为酯化虾青素,这进一步说明,以上方法能够快速有效的合成酯化虾青素。
115.综上所述,将雨生红球藻中的hpdgtt4基因在合成游离虾青素的解脂耶式酵母工程菌株中过表达。其中过表达的hpdgtt4基因编码的蛋白成功催化游离虾青素合成了酯化虾青素。由此可见,雨生红球藻中的hpdgtt4基因是酯化虾青素合成的关键基因。
116.本公开实施例提供的酯化基因用于对虾青素进行酯化的应用,利用雨生红球藻的二酰基甘油酰基转移酶编码基因hpdgtt4基因作为酯化基因可以辅助产游离虾青素的菌株,能够批量得到酯化虾青素。此外,该应用酯化虾青素的提取效率高,能够降低酯化虾青素的价格。同时,本实施例利用高产游离虾青素的解脂耶氏酵母工程菌株,在该解脂耶氏酵母工程菌株中过表达hpdgtt4后,不仅检测到了虾青素单酯,还检测到了虾青素二酯,由此可见,该雨生红球藻的二酰基甘油酰基转移酶不仅可以催化游离虾青素形成一酯,还能进一步催化虾青素一酯形成虾青素二酯。
117.以上所述仅为本公开的可选实施例,并不用以限制本公开,凡在本公开的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本公开的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1