苯并咪唑基异噁唑类化合物在制备与多发性骨髓瘤有关药物方面的应用
1.本发明涉及药物化学和药物治疗学领域,具体涉及苯并咪唑基异噁唑类化合物,以及该化合物在制备与多发性骨髓瘤有关药物方面的应用,特别是与c-myc g-四链体(c-myc g4)稳定剂有关的药物方面的应用。
背景技术:
2.多发性骨髓瘤(multiple myeloma,mm)是血液系统常见的浆细胞恶性肿瘤,多发于中老年人,约占血液系统肿瘤的13%。近年来,随着造血干细胞移植技术不断成熟,免疫调节剂,蛋白酶体抑制剂等一线治疗药物的问世,多发性骨髓瘤患者的生存期不断延长,但是至今仍无法完全治愈。在mm的克隆进化过程中,关键的分子事件之一是c-my c基因的激活;另外,抑制c-myc蛋白活性会减少多发性骨髓瘤的发生。因此,合理设计c-myc靶向药物有望有效、安全地治疗多发性骨髓瘤及其相关疾病。
3.c-myc蛋白属于碱性螺旋-环-螺旋亮氨酸拉链(b-hlh-lz)dna结合蛋白超家族,c-myc蛋白的半衰期仅为20-30分钟,且缺乏明确的分子结合位点,因此很难设计直接靶向c-myc蛋白的药物。c-myc蛋白通常与其分子伴侣max形成异二聚体,发挥转录调控作用,我们前期专利(吡咯烷-2-酮类化合物在制备与多发性骨髓瘤有关药物方面的应用,申请号:202011215542.2)报道的化合物25就是一个靶向c-myc/max异二聚体的抑制剂,能够抑制c-myc蛋白的表达,显示出良好的抑制多发性骨髓瘤的作用。硼替佐米作为蛋白酶体抑制剂,是治疗多发性骨髓瘤的一线药物,但是其具有耐药性且不良反应较多。
4.除了直接抑制c-myc蛋白或者其翻译后调控以外,另一种策略是从上游调控c-myc蛋白的表达。c-myc蛋白表达的转录调控是复杂的,涉及多个启动子和转录起始位点。大量研究表明,位于p1启动子附近核酸酶超敏元件iii1(nhe iii1)控制着c-myc基因80-95%的转录活性。nhe iii1是由富含鸟嘌呤(g)碱基组成的dna单链序列,正常生理条件下,存在转录活性双链形式、瞬时单链dna和沉默g-四链体(g4)形式,并且三者之间动态平衡以发挥生理作用。当nhe iii1序列处于单链状态时,转录激活因子cnb p及hnrnp k和单链dna结合,会促进c-myc转录进行;当该序列被k
+
或na
+
稳定时,形成g4会阻碍cnbp及hnrnp k与nhe iii1结合,c-myc基因的转录就会被抑制。如果能够设计小分子化合物靶向并稳定c-myc g4,就能实现从上游抑制c-myc蛋白的表达。
5.目前,已有多种类型的c-myc g4稳定剂被报道出来,其中包括天然产物类,如黄酮类、玫瑰树碱、白叶藤碱和小檗碱及其衍生物等。然而,这些天然产物本身的亲和力和特异性远低于其结构改造后的衍生物。而通过化学合成方法得到的c-myc g4稳定剂是目前研究的热点,一些小分子化合物如bmvc、izcz-3和qn-1,等虽属于较好的c-myc g4稳定剂,这些化合物的结构特点是具有多芳香环的共轭平面区域,在细胞或者动物水平上也可以显著减轻肿瘤的相关症状,但多数化合物尚处于早期开发阶段,其稳定活性有待于进一步提高。因此,亟需开发出更多结构新颖的高活性c-myc g4稳定剂。
技术实现要素:
6.本发明的目的是在前期专利中化合物25(专利号为202011215542.2)的基础上结合c-myc g4的稳定剂的芳香共轭的结构特点对其进行结构改造,提供一类苯并咪唑基异噁唑类化合物,以及该化合物、异构体或其药学上可接受的盐,在制备与多发性骨髓瘤有关药物方面的应用。为了增加其芳香共轭性我们将吡咯烷-2-酮环变为异噁唑环,设计合成了一系列苯并咪唑基异噁唑类化合物。这类化合物同样具有抑制多发性骨髓瘤的细胞活性,但是其抑制c-myc蛋白表达的方式与化合物25不同。苯并咪唑基异噁唑类化合物能够明显抑制c-myc mrna的表达,然而化合物25不能抑制c-myc mrna表达。另外,圆二色光谱实验(cd)研究表明,化合物ep12能稳定c-myc g4。因此,苯并咪唑基异噁唑类化合物有望开发成为靶向c-myc基因启动子区域g-四链体的稳定剂,以更好的治疗多发性骨髓瘤。
7.本发明提供的上述苯并咪唑基异噁唑类化合物,具有良好的c-myc g4稳定活性,可以用于制备与多发性骨髓瘤有关的药物。
8.本发明的另一个目的是提供一种用于治疗多发性骨髓瘤的药物组合物,它以上述提及的化合物、异构体或其药学上可接受的盐为活性成分或主要活性成分,辅以药学上可接受的载体。
9.本发明的技术方案如下:
10.式i所示的化合物、异构体,或其药学上可接受的盐,以及该化合物、异构体或其药学上可接受的盐,在制备与多发性骨髓瘤有关药物方面的应用,
[0011][0012]
其中,
[0013]
r1代表氢、羟基、硝基、羧基、氰基、氨基、卤素、c
1-c4烷基、c
1-c4烷氧基或c
1-c4烷氧基羰基;
[0014]
m代表1-3的整数;
[0015]
r2代表氢、羟基、硝基、羧基、氰基、氨基、卤素、c
1-c4烷基、c
1-c4烷氧基或c
1-c4烷氧基羰基;
[0016]
n代表1-3的整数。
[0017]
在一种优选方案中,r1代表氟、氯、甲基、乙基、甲氧基、乙氧基、甲氧基羰基或乙氧基羰基。
[0018]
在一种更优选方案中,r1代表氟或甲氧基。
[0019]
m代表1或2;优选地,m代表1。
[0020]
在一种优选方案中,r2代表氢、硝基、氟、氯、甲基、乙基、甲氧基、乙氧基、甲氧基羰基或乙氧基羰基。
[0021]
在一种更优选方案中,r2代表氢、硝基、氟、甲基、乙基、甲氧基、乙氧基或甲氧基羰基。
[0022]
进一步地,n代表1或2。
[0023]
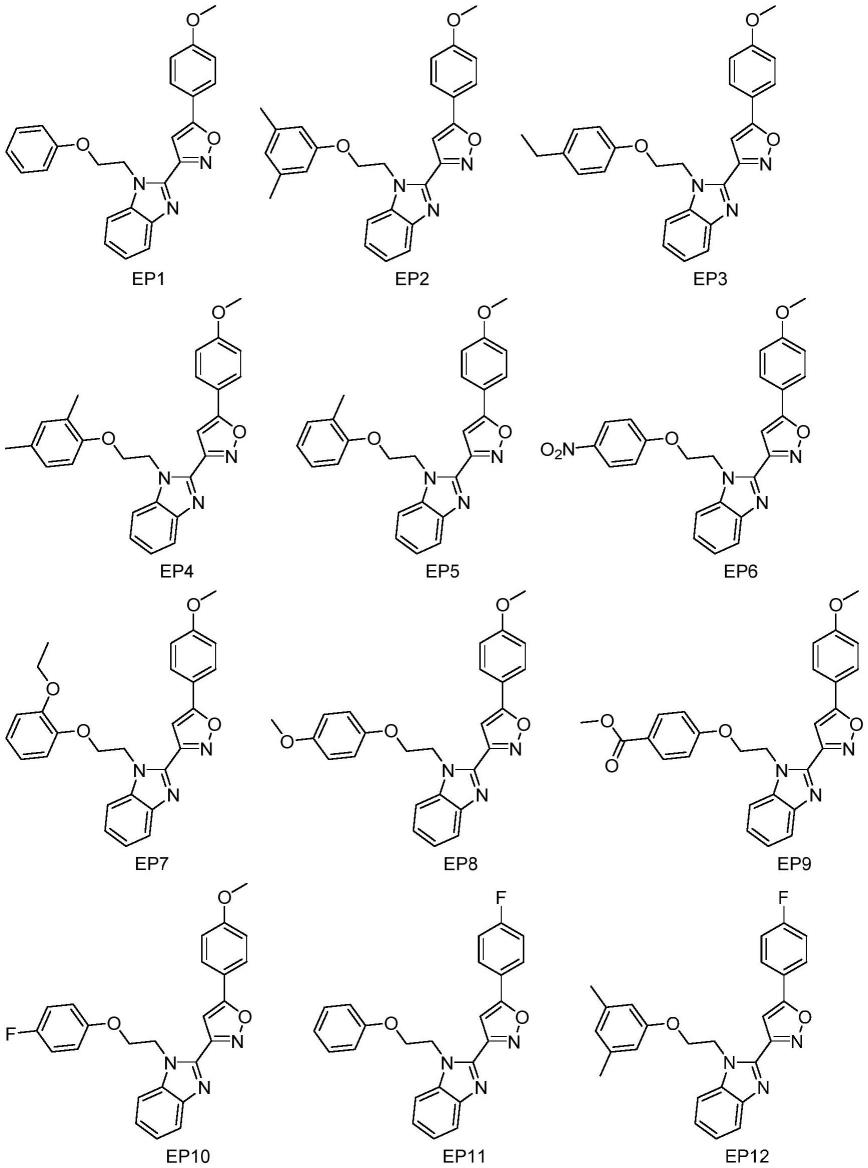
进一步地,式i所示的化合物、异构体,或其药学上可接受的盐中,所述化合物选自下列化合物:
[0024]
[0025][0026]
本发明提供的上述化合物的命名如下:
[0027]
ep1化合物命名:5-(4-甲氧基苯基)-3-(1-(2-苯氧基乙基)-1h-苯并[d]咪唑-2-基)异噁唑;
[0028]
ep2化合物命名:3-(1-(2-(3,5-二甲基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑;
[0029]
ep3化合物命名:3-(1-(2-(4-乙基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑;
[0030]
ep4化合物命名:3-(1-(2-(2,4-二甲基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑;
[0031]
ep5化合物命名:5-(4-甲氧基苯基)-3-(1-(2-(邻甲苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异恶唑;
[0032]
ep6化合物命名:5-(4-甲氧基苯基)-3-(1-(2-(4-硝基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异恶唑;
[0033]
ep7化合物命名:3-(1-(2-(2-乙氧基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑;
[0034]
ep8化合物命名:3-(1-(2-(4-甲氧基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑;
[0035]
ep9化合物命名:4-(2-(2-(5-(4-甲氧基苯基)异恶唑-3-基)-1h-苯并[d]咪唑-1-基)乙氧基)苯甲酸甲酯;
[0036]
ep10化合物命名:3-(1-(2-(4-氟苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑;
[0037]
ep11化合物命名:5-(4-氟苯基)-3-(1-(2-苯氧基乙基)-1h-苯并[d]咪唑-2-基)异噁唑;
[0038]
ep12化合物命名:3-(1-(2-(3,5-二甲基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑;
[0039]
ep13化合物命名:3-(1-(2-(4-乙基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑;
[0040]
ep14化合物命名:5-(4-氟苯基)-3-(1-(2-(邻甲苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异噁唑;
[0041]
ep15化合物命名:5-(4-氟苯基)-3-(1-(2-(4-硝基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异噁唑;
[0042]
ep16化合物命名:3-(1-(2-(2-乙氧基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑;
[0043]
ep17化合物命名:5-(4-氟苯基)-3-(1-(2-(4-甲氧基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异恶唑;
[0044]
ep18化合物命名:4-(2-(2-(5-(4-氟苯基)异恶唑-3-基)-1h-苯并[d]咪唑-1-基)乙氧基)苯甲酸甲酯;
[0045]
ep19化合物命名:3-(1-(2-(4-氟苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑。
[0046]
具体地讲,通式i所述化合物进一步优选自下列化合物:
[0047][0048]
更具体地讲,通式i所述化合物进一步更优选自下列化合物:
[0049][0050]
本发明公开了ep1-ep19化合物的合成,通式i所示化合物的合成路线如下:
[0051][0052]
以化合物ep11的制备方法为例,该化合物的合成路线的具体制备方法包括如下步骤:
[0053]
将1-(4-氟苯基)乙-1-酮(1)与草酸二乙酯(2)通过克莱森缩合反应得到4-(4-氟苯基)-2-羟基-4-氧代丁-2-烯酸乙酯(3),在乙醇溶剂中化合物(3)与盐酸羟胺反应4h,得到5-(4-氟苯基)异噁唑-3-羧酸乙酯(4)。化合物(4)水解后,得到相应的5-(4-氟苯基)异恶唑-3-羧酸(5)首先在室温下与邻苯二胺(6)酰胺化,然后通过加热脱水环化反应,得到3-(1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异恶唑(7)。最后,通过中间体(7)与(2-溴乙氧基)苯(8)的亲核取代反应,生成通式i所示目标化合物ep11,具体合成路线如下:
[0054][0055]
本发明提供的上述化合物、异构体或其药学上可接受的盐在制备与多发性骨髓瘤有关药物方面的应用。
[0056]
在一种优选方案中,本发明提供了一种用于治疗多发性骨髓瘤的药物组合物,它以本发明的化合物、异构体或其药学上可接受的盐为活性成分或主要活性成分,辅以药学上可接受的载体。进一步的,该药物组合物可以制成液体制剂或固体制剂。更进一步的,该药物组合物可以制成注射剂、口服液、颗粒剂、片剂、粉剂或胶囊剂。
[0057]
除非另外说明,在说明书和权利要求中使用的以下术语具有下面讨论的含义:
[0058]“烷基”表示1-20个碳原子的饱和的脂烃基,包括直链和支链基团(本技术书中提到的数字范围,例如“1-20”,是指该基团,此时为烷基,可以含1个碳原子、2个碳原子、3个碳原子等,直至包括20个碳原子)。含1-4个碳原子的烷基称为低级烷基。当低级烷基没有取代基时,称其为未取代的低级烷基。更优选的是,烷基是有1-6个碳原子的中等大小的烷基,例如甲基、乙基、丙基、2-丙基、正丁基、异丁基、叔丁基、戊基等。最好是,烷基为有1-4个碳原子的低级烷基,例如甲基、乙基、丙基、2-丙基、正丁基、异丁基或叔丁基等。烷基可以是取代的或未取代的。当是取代的烷基时,该取代基优选是一或多个,更优选1-3个,最优选1或2个取代基。
[0059]“卤代烷基”表示卤素取代的烷基,优选如上所定义的卤素取代的低级烷基,它被一个或多个相同或不同的卤原子取代,例如-ch2cl、-cf3、-ch2cf3、-ch2ccl3等。
[0060]“卤素”表示氟、氯、溴或碘,优选为氟或氯。
[0061]“羟基”表示-oh基团。
[0062]“氰基”表示-cn基团。
[0063]“硝基”表示-no2基团。
[0064]“氨基”表示-nh2基团。
[0065]“羧基”表示-cooh基团。
[0066]“烷氧基”表示-o-(未取代的烷基)和-o-(未取代的环烷基)。代表性实例包括但不限于甲氧基、乙氧基、丙氧基、丁氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基等。
[0067]“羟基烷基”表示羟基取代的烷基,优选如上所定义的羟基取代的低级烷基,它被一个或多个相同或不同的羟基取代,例如-ch
2 ch
2-oh、-ch
2 ch
2 ch
2-oh等。
[0068]“氨基烷基”表示氨基取代的烷基,优选如上所定义的氨基取代的低级烷基,它被一个或多个相同或不同的氨基取代,例如-ch2nh2、-ch
2 nh2、-ch
2 c h
2 nh2等。
[0069]“烷基烷氧基”表示烷基上的至少一个氢为烷氧基取代的基团,例如2-甲氨基乙基、2-乙氧基乙基、3-甲氧基丙基等。
[0070]“c
1-c4烷氧基羰基”表示r-o-co-r’基团,其中r或r’是选自以下基团:氢、未取代的低级烷基、三卤甲基、未取代的环烷基或苯基,可选地被一或多个、优选被1、2或3个选自未取代的低级烷基、三卤甲基、未取代的低级烷氧基取代。
[0071]“c
1-c4烷氧基羰基”表示r-co基团,其中,r代表甲氧基、乙氧基或丙氧基等。
[0072]“药学上可接受的盐”表示保留母体化合物的生物有效性和性质的那些盐。这类盐包括:
[0073]
(1)与酸成盐,通过母体化合物的游离碱与无机酸或有机酸的反应而得,无机酸包括盐酸、氢溴酸、硝酸、磷酸、偏磷酸、硫酸、亚硫酸和高氯酸等,有机酸包括乙酸、三氟乙酸、丙酸、丙烯酸、己酸、环戊烷丙酸、羟乙酸、丙酮酸、草酸、(d)或(l)苹果酸、富马酸、马来酸、苯甲酸、羟基苯甲酸、γ-羟基丁酸、甲氧基苯甲酸、邻苯二甲酸、甲磺酸、乙磺酸、萘-1-磺酸、萘-2-磺酸、对甲苯磺酸、水杨酸、酒石酸、柠檬酸、乳酸、肉桂酸、十二烷基硫酸、葡糖酸、谷氨酸、天冬氨酸、硬脂酸、扁桃酸、琥珀酸或丙二酸等。
[0074]
(2)存在于母体化合物中的酸性质子被金属离子代替或者与有机碱配位化合所生成的盐,金属离子例如碱金属离子、碱土金属离子或铝离子,有机碱例如乙醇胺、二乙醇胺、三乙醇胺、氨丁三醇、n-甲基葡糖胺、奎宁等。
[0075]“药物组合物”指将本发明中的化合物中的一个或多个或其药学上可接受的盐、溶剂化物、水合物或前药与别的化学成分,例如药学上可接受的载体,混合。药物组合物的目的是促进给药给动物的过程。
[0076]
采用本发明的技术方案,优势如下:
[0077]
本发明提供的一类苯并咪唑基异噁唑类化合物在制备与多发性骨髓瘤有关药物方面的应用,该类化合物表现出较好的rpmi-8226细胞抑制活性,可用于制备与多发性骨髓瘤有关的药物。此外,化合物ep12诱导细胞凋亡并抑制c-myc mrna和c-myc蛋白的表达,圆二色光谱实验研究表明,化合物ep12能稳定c-myc g4。
附图说明
[0078]
图1中(a)是q-pcr检测不同活性化合物(ep8、ep9、ep12、ep18)处理骨髓瘤细胞中c-myc mrna表达情况;图1中(b)是通过western blotting检测化合物(ep8、ep9、ep12和ep18)对c-myc表达的影响;误差棒:来自至少三个独立实验的平均值
±
平均值标准误差值;**p《0.05。
[0079]
图2是流式细胞术实验,分析ep12对rpmi-8226细胞凋亡率的影响;所有细胞均采用rpmi-8226细胞,经5μm化合物处理48h;误差棒:来自至少三个独立实验的平均值
±
平均值标准误差值;**p《0.01。
[0080]
图3中左图是所研究的c-myc g4在有无ep12情况下的常温cd光谱;图3中右图是在有无ep12时c-myc g4的cd熔融变化曲线。
具体实施方式
[0081]
为了进一步阐明本发明,下面给出一系列实施例,这些实施例完全是例证性的,它们仅用来对本发明具体描述,不应当理解为对本发明的限制。
[0082]
实施例1
[0083]
5-(4-甲氧基苯基)-3-(1-(2-苯氧基乙基)-1h-苯并[d]咪唑-2-基)异噁唑(ep1)
[0084]
在0℃下,向500ml圆底烧瓶中加入7.19g(133.18mmol,2e.q)甲醇钠,加入300ml无水乙醇后搅拌至溶解后加入1-(4-甲氧基苯基)乙-1-酮(10g,66.59mmol,1e.q),继续搅拌30min,然后向混合液中加入草酸二乙酯(6.125ml,45.5mmol,1.1e.q)。在室温下搅拌6-8小时后,向溶液中加入6n稀盐酸溶液,边搅拌边滴加,直到ph调为5。将残余物倒入过量的冰水中,析出更多固体,过滤并在真空干燥箱中干燥,得到黄色固体2-羟基-4-(4-甲氧基苯基)-4-氧代丁-2-烯酸乙酯(15.04g,90.2%)。
[0085]
将2-羟基-4-(4-甲氧基苯基)-4-氧代丁-2-烯酸乙酯(16.165g,64.60mmol,1e.q)溶于适量无水乙醇中,加入盐酸羟胺(5.39g,77.51mmol,1.1e.q),加热回流6h。将反应混合物冷却至室温,用大量冰水洗涤,抽滤干燥后得黄色粗产物,通过柱色谱法纯化(pe/ea=10:1(v/v)),得到白色固体5-(4-甲氧基苯基)异噁唑-3-羧酸乙酯(13.45g,84.2%)。
[0086]
称取5-(4-甲氧基苯基)异噁唑-3-羧酸乙酯(13.45g,54.4mmol)溶解在100ml无水乙醇中,然后加入5% naoh(100ml)溶液。回流3小时后,冷却至室温。缓慢加入1n hcl水溶液,将溶液的ph值调节至3。过滤所得沉淀并在真空下干燥,得到中间体白色固体5-(4-甲氧基苯基)异恶唑-3-羧酸(11.4g,95.6%)。
[0087]
将5-(4-甲氧基苯基)异恶唑-3-羧酸(462mg,2.12mmol,1e.q)溶解在dmf(2ml)溶液中依次加入diepa(418μl,2.53mmol,1.2e.q)和hatu(962mg,2.53mmol,1.2e.q)。搅拌30分钟后,加入苯-1,2-二胺(251mg,2.32mmol,1.1e.q)并在室温下搅拌3小时。加入冰水以终止反应,然后用乙酸乙酯萃取反应溶液。用1n盐酸、饱和nahco3水溶液和蒸馏水洗涤有机层,用na2so4干燥。真空浓缩后,通过加入适量的乙酸直接溶解残留物,并回流过夜。冷却至室温后,溶液在减压下浓缩,得到粗产物,通过柱色谱法纯化(pe/ea=1:2(v/v)),得到白色固体3-(1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异恶唑(240mg,38.9%)。
[0088]
将3-(1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异恶唑(200mg,0.69mmol,1e.q)溶解于dmf溶液中并加入碳酸钾(250mg,1.8mmol,2.61e.q),搅拌30分钟。然后加入(2-溴乙
氧基)苯(277mg,1.38mmol,2e.q),并在90℃继续搅拌2小时。然后用蒸馏水淬灭反应,并用乙酸乙酯萃取。用盐水洗涤合并的有机提取物,用na2so4干燥,并蒸发以提供粗产物,通过柱色谱法(pe/ea=2:1(v/v))纯化粗产物,最终得到黄色固体(125mg,44.2%)。
[0089]1h nmr(400mhz,dmso-d6):δ7.94-7.92(m,2h,2
×
ar-h),7.80-7.77(m,1h,ar-h),7.74-7.72(m,1h,ar-h),δ7.58(s,h,ar-h),δ7.39-7.35(m,h,ar-h),δ7.31-7.27(m,h,ar-h),7.18-7.08(m,4h,4
×
ar-h),δ6.85-6.81(m,h,ar-h),δ6.76-6.73(m,2h,2
×
ar-h),5.06(t,j=5.2hz,2h,ch2),4.37(t,j=5.3hz,2h,ch2),3.81(s,3h,och3);
13
c nmr(100mhz,dmso-d6)δppm:170.11,161.73,158.40,157.34,143.08,142.93,136.95,130.00(2c),128.19(2c),124.47,123.28,121.36,120.20,119.46,115.33(2c),114.78(2c),112.33,100.32,67.03,55.98,44.91;esi-hrms(tof):m/z[m+h]
+
calcd for c
25h21
n3o3,412.1656,found 412.1656,found 412.1629.purity:95.1%.
[0090]
实施例2
[0091]
3-(1-(2-(3,5-二甲基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑(ep2)
[0092]
按实施例1的类似方法,得到白色粉末,42.4%。
[0093]1h nmr(400mhz,dmso-d6):δ7.94-7.91(m,2h,2
×
ar-h),δ7.78-7.72(m,2h,2
×
ar-h),δ7.55(s,1h,ar-h),δ7.40-7.35(m,1h,ar-h),δ7.31-7.27(m,1h,ar-h),7.11-7.08(m,2h,2
×
ar-h),6.45(s,1h,ar-h),6.34(s,2h,2
×
ar-h),5.03(t,j=6.2hz,2h,ch2),4.32(t,j=6.6hz,2h,ch2),3.81(br,3h,och3),2.08(s,6h,2
×
ch3);
13
c nmr(100mhz,dmso-d6)δppm:170.08,161.72,158.41,157.32,143.08,142.96,139.11(2c),136.91,128.15(2c),124.46,123.26,122.94,120.20,119.47,115.30(2c),112.49(2c),112.27,100.32,66.83,55.96,44.91,21.45(2c);esi-hrms(tof):m/z[m+h]
+
calcd for c
27h25
n3o3,440.1969,found 440.1943.purity:98.1%.
[0094]
实施例3
[0095]
3-(1-(2-(4-乙基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑(ep3)
[0096]
按实施例1的类似方法,得到淡黄色固体,36.5%。
[0097]1h nmr(400mhz,dmso-d6):δ7.94-7.91(m,2h,2
×
ar-h),7.78-7.72(m,2h,2
×
ar-h),7.56(s,1h,ar-h),δ7.39-7.35(m,1h,ar-h),δ7.31-7.26(m,1h,ar-h),7.11-7.07(m,2h,2
×
ar-h),6.98-6.95(m,2h,2
×
ar-h),6.66-6.63(m,2h,2
×
ar-h),5.04(t,j=5.2hz,2h,ch2),4.33(t,j=5.4hz,2h,ch2),3.81(br,3h,och3),2.41(q,j=7.5hz,2h,ch2),1.03(t,j=7.6hz,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:170.08,161.71,157.32,156.48,143.08,142.94,136.93,136.57,129.12(2c),128.16(2c),124.45,123.26,120.20,119.46,115.29(2c),114.63(2c),112.31,100.31,67.10,55.96,44.92,27.75,16.39;esi-hrms(tof):m/z[m+h]
+
calcd for c
27h25
n3o3,440.1969,found 440.1941.purity:95.0%.
[0098]
实施例4
[0099]
3-(1-(2-(2,4-二甲基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑(ep4)
[0100]
按实施例1的类似方法,得到白色固体,45.3%。
h),7.73(d,j=7.9hz,1h,ar-h),δ7.58(s,h,ar-h),7.36-7.26(m,2h,2
×
ar-h),δ7.11-7.06(m,2h,2
×
ar-h),δ6.87-6.83(m,1h,ar-h),δ6.80-6.71(m,3h,3
×
ar-h),5.06(t,j=5.1hz,2h,ch2),4.37(t,j=5.1hz,2h,ch2),3.80(br,3h,och3),3.76(q,j=7.1hz,2h,ch2),1.10(t,j=7.0hz,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:169.99,161.70,157.36,148.62,148.20,143.04,142.94,137.09,128.15(2c),124.39,123.19,121.89,121.12,120.04,119.50,115.32(2c),113.88,113.76,112.67,100.35,68.01,63.95,55.97,45.27,15.13;esi-hrms(tof):m/z[m+h]
+
calcd for c
27h25
n3o4,456.1918,found 456.1888.purity:97.1%.
[0114]
实施例8
[0115]
3-(1-(2-(4-甲氧基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑(ep8)
[0116]
按实施例1的类似方法,得到白色固体,39.8%。
[0117]1h nmr(400mhz,dmso-d6):δ7.96-7.90(m,2h,2
×
ar-h),7.78-7.72(m,2h,2
×
ar-h),δ7.58(s,h,ar-h),7.39-7.35(m,h,ar-h),7.31-7.27(m,h,ar-h),δ7.12-7.08(m,2h,2
×
ar-h),δ6.74-6.64(m,4h,4
×
ar-h),5.03(t,j=5.2hz,2h,ch2),4.30(t,j=5.3hz,2h,ch2),3.81(br,3h,och3),3.58(br,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:170.11,161.74,157.32,154.02,152.44,143.09,142.94,136.93,128.19(2c),124.45,123.26,120.20,119.47,115.68(2c),115.32(2c),115.06(2c),112.31,100.31,67.58,55.99,55.80,44.97;esi-hrms(tof):m/z[m+h]
+
calcd for c
26h23
n3o4,442.1761,found 442.1732.purity:97.7%.
[0118]
实施例9
[0119]
4-(2-(2-(5-(4-甲氧基苯基)异恶唑-3-基)-1h-苯并[d]咪唑-1-基)乙氧基)苯甲酸甲酯(ep9)
[0120]
按实施例1的类似方法,得到白色固体,53.4%。
[0121]1h nmr(400mhz,dmso-d6):δ7.92-7.90(m,2h,2
×
ar-h),7.80-7.72(m,4h,4
×
ar-h),δ7.54(br,h,ar-h),7.40-7.36(m,h,ar-h),7.31-7.27(m,h,ar-h),δ7.11-7.08(m,2h,2
×
ar-h),δ6.87-6.84(m,2h,2
×
ar-h),5.09(t,j=5.8hz,2h,ch2),4.48(t,j=5.4hz,2h,ch2),3.81(br,3h,och3),3.72(br,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:170.12,166.28,162.17,161.72,157.26,143.09,142.94,136.87,131.69(2c),128.17(2c),124.53,123.31,122.63,120.23,119.44,115.30(2c),114.87(2c),112.25,100.29,67.42,55.98,52.32,44.65;esi-hrms(tof):m/z[m+h]
+
calcd for c
27h23
n3o5,470.1710,found 470.1684.purity:98.1%.
[0122]
实施例10
[0123]
3-(1-(2-(4-氟苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-甲氧基苯基)异噁唑(ep10)
[0124]
按实施例1的类似方法,得到白色固体,67.8%。
[0125]1h nmr(400mhz,dmso-d6):δ7.95-7.90(m,2h,2
×
ar-h),7.78-7.72(m,2h,2
×
ar-h),δ7.57(s,h,ar-h),δ7.39-7.35(m,h,ar-h),δ7.31-7.27(m,h,ar-h),7.12-7.07(m,2h,2
×
ar-h),δ7.02-6.94(m,2h,2
×
ar-h),δ6.78-6.72(m,2h,2
×
ar-h),5.05(t,j=5.3hz,2h,
ch2),4.35(t,j=5.3hz,2h,ch2),3.81(s,3h,och3);
13
c nmr(100mhz,dmso-d6)δppm:170.10,161.71,157.31,157.28(d,1j
cf
=234.8hz),154.72,143.06,142.92,136.91,128.17(2c),124.48,123.29,120.21,119.44,116.33(2c,d,2j
cf
=23.4hz),116.04(2c,d,3j
cf
=8.0hz),115.30(2c),112.30,100.30,67.65,55.97,44.84;esi-hrms(tof):m/z[m+h]
+
calcd for c
25h20
fn3o3,430.1561,found 430.1534.purity:98.7%.
[0126]
实施例11
[0127]
5-(4-氟苯基)-3-(1-(2-苯氧基乙基)-1h-苯并[d]咪唑-2-基)异噁唑(ep11)
[0128]
在0℃下,将1-(4-氟苯基)乙-1-酮(5ml,41.4mmol,1e.q)加入到含有甲醇钠(4.47g,82.8mmol,2e.q)的无水乙醇(200ml)中,然后向溶液中加入草酸二乙酯(6.125ml,45.5mmol,1.1e.q)。在室温下搅拌6小时后,向溶液中加入6n hcl水溶液,搅拌30分钟以终止反应。将残余物倒入过量的冰水中,过滤沉淀物并在真空干燥箱中干燥,得到黄色固体2-羟基-4-(4-氟苯基)-4-氧代丁-2-烯酸乙酯(8.614g,87.4%)。
[0129]
将2-羟基-4-(4-氟苯基)-4-氧代丁-2-烯酸乙酯(8g,33.6mmol,1e.q)和盐酸羟胺(2.567g,36.9mmol,1.1e.q)加入无水乙醇(100ml),加热回流4h。将反应混合物冷却至室温,加入冰水洗涤,抽滤干燥后得粗产物,并通过柱色谱法纯化(pe/ea=10:1(v/v)),得到白色固体5-(4-氟苯基)异噁唑-3-羧酸乙酯(6.795g,86.0%)。
[0130]
将5-(4-氟苯基)异噁唑-3-羧酸乙酯(5.5g,22.5mmol)溶解在50毫升无水乙醇中,然后加入5% naoh(50ml)溶液。回流3小时后,冷却至室温。缓慢加入1n hcl水溶液,将溶液的ph值调节至3。过滤所得沉淀并在真空下干燥,得到中间体白色粉末5-(4-氟苯基)异恶唑-3-羧酸(4.3g,92.2%)。
[0131]
将5-(4-氟苯基)异恶唑-3-羧酸(2g,9.6mmol,1e.q)溶解在dmf(30ml)溶液中依次加入diepa(1.9ml,11.5mmol,1.2e.q)和hatu(4.37g,11.5mmol,1.2e.q)。搅拌30分钟后,加入苯-1,2-二胺(1.15g,10.6mmol,1.1e.q)并在室温下搅拌6小时。加入冰水以终止反应,然后用乙酸乙酯萃取反应溶液。用1n盐酸、饱和nahco3水溶液和蒸馏水洗涤有机层,用na2so4干燥。真空浓缩后,通过加入适量的乙酸直接溶解残留物,并回流过夜。冷却至室温后,溶液在减压下浓缩,得到粗产物,通过柱色谱法纯化(pe/ea=1:2(v/v)),得到白色固体3-(1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异恶唑(1.35g,50.4%)。
[0132]
将3-(1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异恶唑(200mg,0.7mmol,1e.q)溶解于dmf溶液中并加入碳酸钾(250mg,1.8mmol,2.57e.q),搅拌30分钟。然后加入(2-溴乙氧基)苯(281mg,1.4mmol,2e.q),并在100℃继续搅拌2小时。然后用蒸馏水淬灭反应,并用乙酸乙酯萃取。用盐水洗涤合并的有机提取物,用na2so4干燥,并蒸发以提供粗产物,通过柱色谱法(pe/ea=5:1(v/v))纯化粗产物,得到白色固体(89mg,31.9%)。
[0133]1h nmr(400mhz,dmso-d6):δ8.07-8.03(m,2h,2
×
ar-h),δ7.79-7.72(m,3h,3
×
ar-h),δ7.42-7.35(m,3h,3
×
ar-h),δ7.31-7.27(m,1h,ar-h),δ7.17-7.13(m,2h,2
×
ar-h),δ6.84-6.81(m,h,ar-h),δ6.75-6.72(m,2h,2
×
ar-h),5.06(t,j=5.2hz,2h,ch2),4.37(t,j=5.4hz,2h,ch2);
13
c nmr(100mhz,dmso-d6)δppm:169.11,163.95(d,1j
cf
=247.9hz),158.37,157.46,142.92,142.86,136.94,129.99(2c),128.97(2c,d,3j
cf
=8.8hz),124.54,123.51(d,4j
cf
=3.0hz),123.32,121.35,120.23,117.06(2c,d,2j
cf
=22.1hz),114.75(2c),112.33,101.78,66.98,44.90;esi-hrms(tof):m/z[m+h]
+
calcd for c
24h18
fn3o2,
400.1456,found 400.1454.purity:99.1%.
[0134]
实施例12
[0135]
3-(1-(2-(3,5-二甲基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑(ep12)
[0136]
按实施例11的类似方法,得到白色固体,45.2%;
[0137]1h nmr(400mhz,dmso-d6):δ8.08-8.03(m,2h,2
×
ar-h),δ7.79-7.73(m,2h,2
×
ar-h),7.70(s,1h,ar-h),δ7.43-7.36(m,3h,3
×
ar-h),δ7.31-7.27(m,1h,ar-h),6.44(s,1h,ar-h),6.34(s,2h,2
×
ar-h),5.04(t,j=5.4hz,2h,ch2),4.32(t,j=5.2hz,2h,ch2),2.08(s,6h,2
×
ch3);
13
c nmr(100mhz,dmso-d6)δppm:169.10,163.96(d,1j
cf
=248.2hz),158.39,157.46,142.96,142.91,139.10(2c),136.89,128.97(2c,d,3j
cf
=8.8hz),124.55,123.55(d,4j
cf
=3.4hz),123.31,122.94,120.24,117.07(2c,d,2j
cf
=22.0hz),112.49(2c),112.31,101.83,66.78,44.91,21.45(2c);esi-hrms(tof):m/z[m+h]
+
calcd for c
26h22
fn3o2,428.1769,found 428.1742.purity:98.2%.
[0138]
实施例13
[0139]
3-(1-(2-(4-乙基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑(ep13)
[0140]
按实施例11的类似方法,得到白色固体,29.4%。
[0141]1h nmr(400mhz,dmso-d6):δ8.07-8.04(m,2h,2
×
ar-h),δ7.79-7.72(m,3h,3
×
ar-h),δ7.43-7.35(m,3h,3
×
ar-h),δ7.31-7.27(m,1h,ar-h),6.98-6.96(m,2h,2
×
ar-h),6.65-6.63(m,2h,2
×
ar-h),5.05(t,j=5.3hz,2h,ch2),4.33(t,j=5.3hz,2h,ch2),2.41(q,j=7.6hz,2h,ch2),1.03(t,j=7.6hz,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:169.11,163.96(d,1j
cf
=247.8hz),157.46,156.46,142.95,142.91,136.92,136.58,129.10(2c),128.98(2c,d,3j
cf
=8.9hz),124.52,123.54(d,4j
cf
=3.3hz),123.30,120.23,117.06(2c,d,2j
cf
=22.1hz),114.64(2c),112.32,101.80,67.06,44.92,27.73,16.35;esi-hrms(tof):m/z[m+h]
+
calcd for c
26h22
fn3o2,428.1769,found 428.1747.purity:95.0%.
[0142]
实施例14
[0143]
5-(4-氟苯基)-3-(1-(2-(邻甲苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异噁唑(ep14)
[0144]
按实施例11的类似方法,得到黄色固体,36.0%。
[0145]1h nmr(400mhz,dmso-d6):δ8.07-8.04(m,2h,2
×
ar-h),δ7.81-7.71(m,3h,3
×
ar-h),δ7.43-7.34(m,3h,3
×
ar-h),δ7.31-7.27(m,1h,ar-h),7.04-7.00(m,1h,ar-h),6.94-6.92(m,1h,ar-h),6.83-6.81(m,1h,ar-h),6.73-6.69(m,1h,ar-h),5.15(t,j=5.0hz,2h,ch2),4.36(t,j=4.7hz,2h,ch2),1.68(s,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:169.03,163.95(d,1j
cf
=248.0hz),157.55,156.53,142.94,142.91,136.90,130.88,128.97(2c,d,3j
cf
=8.7hz),127.43,125.95,124.44,123.53(d,4j
cf
=3.2hz),123.32,121.00,120.23,117.06(2c,d,2j
cf
=22.1hz),112.39,111.39,101.83,66.94,44.92,16.25;esi-hrms(tof):m/z[m+h]
+
calcd for c
25h20
fn3o2,414.1612,found 414.1589.purity:97.5%.
[0146]
实施例15
[0147]
5-(4-氟苯基)-3-(1-(2-(4-硝基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异噁唑
(ep15)
[0148]
按实施例11的类似方法,得到淡黄色固体,32.6%。
[0149]1h nmr(400mhz,dmso-d6):δ8.06-8.02(m,4h,4
×
ar-h),7.81(d,j=8.1hz,1h,ar-h),7.74(d,j=8.1hz,1h,ar-h),7.70(s,1h,ar-h),δ7.43-7.37(m,3h,3
×
ar-h),δ7.32-7.28(m,1h,ar-h),6.98-6.94(m,2h,2
×
ar-h),5.12(t,j=5.1hz,2h,ch2),4.56(t,j=5.2hz,2h,ch2);
13
c nmr(100mhz,dmso-d6)δppm:169.13,163.71(d,1j
cf
=247.9hz),163.55,157.36,142.92,142.87,141.46,136.81,128.94(2c,d,3j
cf
=8.8hz),126.30(2c),124.65,123.45(d,4j
cf
=3.1hz),123.39,120.28,117.06(2c,d,2j
cf
=22.1hz),115.45(2c),112.25,101.77,68.05,44.52;esi-hrms(tof):m/z[m+h]
+
calcd for c
24h17
fn4o4,445.1307,found 445.1278.purity:95.4%.
[0150]
实施例16
[0151]
3-(1-(2-(2-乙氧基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑(ep16)
[0152]
按实施例11的类似方法,得到白色固体,44.1%。
[0153]1h nmr(400mhz,dmso-d6):δ8.08-8.04(m,2h,2
×
ar-h),7.83(d,j=8.1hz,1h,ar-h),δ7.77-7.69(m,2h,2
×
ar-h),δ7.43-7.27(m,4h,4
×
ar-h),δ6.86-6.84(m,1h,ar-h),6.80-6.72(m,3h,3
×
ar-h),5.07(t,j=5.1hz,2h,ch2),4.37(t,j=5.1hz,2h,ch2),3.76(q,j=7.0hz,2h,ch2),1.10(t,j=7.0hz,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:169.01,163.99(d,1j
cf
=250.2hz),157.51,148.64,148.21,142.96,142.86,137.08,128.97(2c,d,3j
cf
=8.8hz),124.46,123.59,123.23,121.91,121.13,120.09,117.08(2c,d,2j
cf
=21.9hz),113.95,113.81,112.68,101.86,67.99,63.97,45.28,15.12;esi-hrms(tof):m/z[m+h]
+
calcd for c
26h22
fn3o3,444.1718,found 444.1691.purity:98.3%.
[0154]
实施例17
[0155]
5-(4-氟苯基)-3-(1-(2-(4-甲氧基苯氧基)乙基)-1h-苯并[d]咪唑-2-基)异恶唑(ep17)
[0156]
按实施例11的类似方法,得到黄色固体,52.0%。
[0157]1h nmr(400mhz,dmso-d6):δ8.07-8.04(m,2h,2
×
ar-h),δ7.78-7.72(m,3h,3
×
ar-h),δ7.43-7.35(m,3h,3
×
ar-h),δ7.31-7.27(m,1h,ar-h),6.72-6.65(m,4h,4
×
ar-h),5.04(t,j=5.3hz,2h,ch2),4.30(t,j=5.2hz,2h,ch2),3.58(s,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:169.13,163.97(d,1j
cf
=247.5hz),157.46,154.01,152.41,142.94,142.92,136.92,129.00(2c,d,3j
cf
=8.8hz),124.54,123.54(d,4j
cf
=3.1hz),123.32,120.24,117.08(2c,d,2j
cf
=22.0hz),115.67(2c),115.04(2c),112.34,101.81,67.51,55.79,44.96;esi-hrms(tof):m/z[m+h]
+
calcd for c
25h20
fn3o3,430.1561,found 430.1533.purity:96.7%.
[0158]
实施例18
[0159]
4-(2-(2-(5-(4-氟苯基)异恶唑-3-基)-1h-苯并[d]咪唑-1-基)乙氧基)苯甲酸甲酯(ep18)
[0160]
按实施例11的类似方法,得到白色固体,47.4%。
[0161]1h nmr(400mhz,dmso-d6):δ8.06-8.01(m,2h,2
×
ar-h),7.81-7.79(m,h,ar-h),δ
7.77-7.73(m,3h,3
×
ar-h),7.70(br,h,ar-h),δ7.43-7.36(m,3h,3
×
ar-h),δ7.32-7.27(m,1h,ar-h),6.86-6.84(m,2h,2
×
ar-h),5.10(t,j=5.2hz,2h,ch2),4.48(t,j=5.2hz,2h,ch2),3.72(br,3h,ch3);
13
c nmr(100mhz,dmso-d6)δppm:169.13,166.26,163.96(d,1j
cf
=247.8hz),162.13,157.38,142.95,142.91,136.85,131.67(2c),128.97(2c,d,3j
cf
=8.8hz),124.60,123.50(d,4j
cf
=3.3hz),123.35,122.63,120.27,117.04(2c,d,2j
cf
=22.1hz),114.87(2c),112.27,101.79,67.35,52.30,44.63;esi-hrms(tof):m/z[m+h]
+
calcd for c
26h20
fn3o4,458.1511,found 458.1483.purity:96.4%.
[0162]
实施例19
[0163]
3-(1-(2-(4-氟苯氧基)乙基)-1h-苯并[d]咪唑-2-基)-5-(4-氟苯基)异噁唑(ep19)
[0164]
按实施例11的类似方法,得到白色固体,43.5%。
[0165]1h nmr(400mhz,dmso-d6):δ8.08-8.04(m,2h,2
×
ar-h),δ7.80-7.73(m,3h,3
×
ar-h),δ7.44-7.36(m,3h,3
×
ar-h),δ7.31-7.27(m,1h,ar-h),7.01-6.95(m,2h,2
×
ar-h),6.76-6.73(m,2h,2
×
ar-h),5.06(t,j=5.3hz,2h,ch2),4.36(t,j=5.3hz,2h,ch2);
13
c nmr(100mhz,dmso-d6)δppm:169.14,163.97(d,1j
cf
=247.9hz),157.45,157.32(d,1j
cf
=234.9hz),154.72,142.94,142.89,136.91,129.00(2c,d,3j
cf
=8.9hz),124.56,123.51,123.33,120.25,117.07(2c,d,2j
cf
=22.2hz),116.31(2c,d,2j
cf
=22.9hz),116.08(2c,d,3j
cf
=8.0hz),112.31,101.80,67.63,44.85;esi-hrms(tof):m/z[m+h]
+
calcd for c
24h17
f2n3o2,418.1362,found 418.1337.purity:96.1%.
[0166]
实验方法与结果
[0167]
一、细胞活力实验
[0168]
实验原理:试剂中含有wst-8,它在电子载体1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯(1-methoxy pms)的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲瓒产物(fo rmazan dye)。生成的甲瓒物的数量与活细胞的数量成正比。因此可利用这一特性直接进行细胞增殖和毒性分析。
[0169]
实验步骤:
[0170]
1.铺板:取对数生长期的rpmi-8226人源化骨髓瘤细胞接种96孔板,每孔细胞悬液100μl,细胞数为5
×
103/孔,空白对照组只加100μl含10% fbs完全培养基rpm i-1640,每组设置3~5个复孔。
[0171]
2.不同浓度梯度小分子化合物处理的rpmi-8226置于细胞培养箱(37℃、5% co2)培养,24h后每孔加入5μl cck-8溶液,继续培养3小时后酶标仪检测;
[0172]
3.检测:将空白对照组调零,检测450nm波长下的吸光度(od值),重复2-3次,取平均值,计算给药化合物的ic
50
值。
[0173]
实验结果:如下表1所示,本发明中的化合物ep8、ep9、ep12、ep18对人源化骨髓瘤细胞rpmi-8226增殖抑制能力明显优于前期专利化合物25(专利号为202011215542.2),更优于阳性对照药10074-g5。
[0174]
表1发明的19个化合物对人源化骨髓瘤细胞rpmi-8226的细胞活力的影响
[0175][0176]1ic
50
,三次测量的平均值
±
平均值标准误差值。
[0177]
二、生物实验
[0178]
1、q-pcr分析
[0179]
进行q-pcr以确定结构修饰的活性化合物(ep8、ep9、ep12和ep18)对rpmi-8226细胞中c-myc基因转录的作用。提取总rna并反转录成cdna。然后将该cdna用作模板,对c-myc序列进行定量pcr扩增。用5μm配体处理48小时后,收集靶细胞,提取总rna,并使用m-mlv逆转录酶合成cdna试剂盒(promega)合成cdna。然后通过sybr green reaction mix(roche)进行q-pcr实验,并使用2-δδct
方法分析数据。
[0180]
实验结果:如图1(a)所示,化合物ep12在5μm降低了c-myc mrna水平,而其它化合物对此没有影响。ep12可以降低c-myc mrna的表达水平。
[0181]
2、蛋白质印迹(wb)
[0182]
用5μm ep12处理rpmi-8226细胞48小时,然后收集细胞并用ripa裂解缓冲液
(beyotime biotechnology,shanghai,china)完全裂解。之后,将提取的所有蛋白质与用于后续sds-page的上样缓冲液混合。然后将蛋白质转移到pvdf膜上,该膜与初级β-肌动蛋白和c-myc(proteintech)抗体一起孵育。
[0183]
实验结果:如图1(b)所示,用ep12处理后,c-myc的表达水平也降低了,结果表明,ep12具有c-myc蛋白的抑制活性。
[0184]
3、细胞活力和流式细胞术分析
[0185]
将1
×
104个rpmi-8226细胞接种到96孔板中。在与不同剂量的化合物一起孵育48小时后,通过cck8试剂盒(keygen biotech,中国)检测细胞活力。根据制造商的方案,用annexin v-apc/7-aad凋亡试剂盒(keygen biotech,中国)测定细胞凋亡率,并用流式细胞仪(bd biosciences)分析。
[0186]
实验结果:如图2所示,ep12显著影响rpmi-8226细胞凋亡。ep12在5μm时的凋亡率为21.9%,其诱导rpmi-8226细胞更好的凋亡,证明ep12对增殖细胞中的c-myc具有优异的抑制作用。
[0187]
三、圆二色谱实验
[0188]
用j-815cd光谱仪(jasco)在25℃下在1mm光程的比色皿中记录圆二色性实验。为了退火寡核苷酸,将样品加热至95℃,稳定5分钟,然后冷却至室温30分钟,然后置于4℃冰箱中过夜。然后将寡核苷酸在10mm tris缓冲液(ph 6.8,含50mm kcl)中稀释至5m,加入4当量的化合物,得到在1% dmso中的20m化合物。cd信号以200纳米/分钟的扫描速度和2纳米的带宽从230纳米扫描到320纳米。通过跟踪最大cd强度波长(264nm)下cd信号的变化,在25-95℃的温度范围内以1℃/min的加热速率进行cd熔化。使用origin 9.0软件从曲线拟合确定熔融温度(tm)。δtm值确定为有配体和无配体的dna之间的解链温度差。所有实验重复三次,记录的值是三次测量的平均值。
[0189]
实验结果:如图3所示,圆二色性(cd)光谱通常用于确定蛋白质或核酸的二级结构。当c-myc g4含有k
+
时,它将在264nm附近有一个正峰,在240nm有一个负峰(图3左),表明形成了c-myc g4的平行构象。当加入ep12时,峰形略有变化,表明化合物ep12与c-myc g4的结合没有改变其构象。为了研究该化合物对c-myc g4的稳定性,进行了cd熔解实验。如图3右所示,ep12趋于稳定c-myc g4。
[0190]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可能对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1