一种核酸提取试剂盒及其应用的制作方法
1.本发明属于生物技术领域,具体涉及一种核酸提取试剂盒及其应用。
背景技术:
2.核酸是生物的主要遗传物质。在分子生物学和医学检测等领域中以dna为研究对象或目标的研究甚是广泛。而从不同生物样本(如:排泄物、组织、体液、病原体等)中获得高质量的核酸则是开展相关研究实验的基础。当前,针对核酸提取纯化的手段大致可分为如下几类:醇类沉淀、硅胶基质柱吸附、磁性材料的修饰基团吸附等。其中磁珠法作为可应用自动化的核酸提取方法,基本原理是基于磁珠在高盐溶液中可以对核酸进行特异性吸附,经过多次漂洗去除蛋白质和多糖等杂质,最后通过在低盐溶液中洗脱,从而获得适用于后续研究的核酸产物。
3.当前,在核酸纯化质量方面,不同的核酸提取试剂获得的核酸质量有着显著的差异。由于外源及内源性核酸酶的存在及其酶活性稳定等原因,使得提取高质量的核酸较为困难。目前常用的核酸提取技术存在提取流程复杂、时间长、核酸降解严重、得率较低或重复性不佳等无法同时兼顾的问题,使得其无法完全满足临床检测的需求,尤其在核酸载量较低的微小残留病检测、早期复发监测等领域尤为迫切。因此研发出一种快速高效、高得率的核酸提取试剂显得尤为重要。
4.中国发明专利cn112195177a公开了一种核酸提取方法及试剂盒,包括裂解液、抑制成分去除液、蛋白质去除剂、结合缓冲液、漂洗液、离子洗涤液。其中,裂解液为异硫氰酸胍、n-月桂酰肌氨酸钠盐,抑制成分去除液包括十二水合硫酸铝铵和pvpp的混合液以及乙酸铵,此方法采用所述核酸化学裂解液化学裂解样本,再经杂质去除、核酸吸附、洗涤、洗脱后,收集得到核酸。
5.中国发明专利cn101792756a公开了一种提取基因组脱氧核糖核酸的方法,其中裂解缓冲液的组成为三羟甲基氨基甲烷、edta和氯化钠。此方法将裂解缓冲液加入待测材料中,将材料研碎,加入蛋白酶k,孵育离心,得脱氧核糖核酸溶液。此方法的优点在于能够一步法提取dna,不需要酶解和长时间孵育,一次性裂解材料,材料范围广,操作时间短。
6.但目前的核酸提取方法虽然能够有效地获取dna,但针对特定样本的核酸得率较低,试剂盒提取稳定性不佳,部分方法存在核酸纯化质量较低,不能用于后续的qpcr和二代测序分析的问题。
7.针对现有的核酸提取试剂盒存在的稳定性差,核酸得率较低等问题,应寻找一种稳定性好、核酸得率高、能稳定存储的试剂盒,使得该试剂盒能够实现更好的核酸提取功能。
技术实现要素:
8.本发明针对现有技术存在的问题,提供了一种试剂盒。该试剂盒能够有效提高核酸得率,缩短核酸纯化时间,其中的核酸提取试剂可在室温下稳定储存2年以上。
9.为实现上述目的,本发明采用的技术方案如下:
10.一方面,本发明提供了一种试剂盒,包括裂解液1、裂解液2、结合液、漂洗液、洗脱液和磁珠。
11.所述的裂解液1包括异硫氰酸胍、三羟甲基氨基甲烷、edta和triton x-100;
12.所述的裂解液2包括蛋白酶k和sds;
13.所述的结合液包括盐酸胍、tris-hcl和异丙醇;
14.所述的漂洗液包括乙醇和tris-hcl;
15.所述的洗脱液包括tris-hcl和edta;
16.所述的磁珠选自超顺磁性二氧化硅磁珠、二氧化钛磁珠、羧基磁珠、氨基磁珠中的至少一种;
17.所述的裂解液1,以质量体积份计,包括15-50份异硫氰酸胍,0.3-4份三羟甲基氨基甲烷,1-7份edta和0.8-1.2份triton x-100。
18.优选地,所述的裂解液1还包括盐酸胍和脱氧胆酸钠。
19.进一步优选地,所述的裂解液1,以质量体积份计,还包括35-50份盐酸胍和0.1-0.5份脱氧胆酸钠。
20.优选地,所述的裂解液2中蛋白酶k的浓度为10mg/ml,sds的浓度为20mg/ml。
21.优选地,所述的结合液,以质量体积份计,包括30-50份盐酸胍。
22.优选地,所述的结合液,以体积份计,包括0.6-4份的tris-hcl和30-50份的异丙醇。
23.进一步优选地,所述的tris-hcl的浓度为1mol/l,ph为8.0。
24.进一步优选地,所述的结合液,以质量体积份计,还包括1-4份月桂酰基氨酸钠。
25.更进一步优选地,所述的结合液,以体积份计,还包括5-10份的edta。
26.更进一步优选地,所述的edta的浓度为0.5mol/l。
27.优选地,所述的漂洗液,以体积份计,包括70-80份乙醇、1-2份tris-hcl。
28.进一步优选地,所述的tris-hcl的浓度为1mol/l,ph为7.5-8.0。
29.优选地,所述的洗脱液,以体积份计,包括1-2份tris-hcl和1-2份edta。
30.进一步优选地,所述的tris-hcl的浓度为1mol/l,ph为8.0。
31.进一步优选地,所述的edta的浓度为0.5mol/l。
32.优选地,所述的磁珠为超顺磁性二氧化硅磁珠。
33.又一方面,本发明提供了一种核酸提取的方法。
34.具体地,所述的方法使用上述任一技术方案所述的试剂盒进行核酸提取。
35.具体地,所述的方法包括以下步骤:
36.步骤s1:对生物样品进行前处理,得待测样本;
37.步骤s2:向待测样本中加入裂解液1,混匀,离心后加入裂解液2,混匀,离心后孵育,得混合液;
38.步骤s3:将混合液进行提取,得洗脱核酸;
39.步骤s4:对洗脱核酸进行核酸质量检测。
40.具体地,所述的步骤s1中生物样品为细胞保存液;所述的细胞保存液主要用于保存宫颈、肠道等组织脱落细胞以及商业化培养的人源细胞系。
41.具体地,所述的步骤s1中前处理的步骤包括组织脱落细胞直接从细胞保存液中提取,人源细胞系通过胰蛋白酶细胞消化、细胞收集、pbs重悬后进行提取。
42.具体地,所述的步骤s2为:取离心管,每支加入200-500μl裂解液1和50-600μl待测样本,涡旋混匀30s后瞬时离心;向每支离心管中加入10-40μl裂解液2,涡旋混匀30s后瞬时离心;300rpm恒温金属浴65-75℃孵育5min,得混合液。
43.具体地,所述的步骤s3采用核酸自动化提取仪进行提取,包括以下步骤:
44.步骤s31:在槽位1加入磁珠、醇类溶剂和混合液,在槽位2加入结合液,在槽位3加入漂洗液,在槽位4加入洗脱液。
45.步骤s32:依次运行程序:槽位1运行醇洗程序,槽位2运行结合程序,槽位3运行漂洗程序,槽位4依次运行洗脱程序1和运行洗脱程序2,槽位3运行弃磁珠程序;
46.步骤s33:吸取槽位4液体,得洗脱核酸。
47.具体的,所述步骤s31中醇类溶剂选自甲醇、乙醇、异丙醇、正丙醇、正丁醇、叔丁醇中的至少一种。
48.进一步具体的,所述步骤s31中醇类溶剂为异丙醇。
49.具体的,所述槽位1、槽位2、槽位3、槽位4为自动化提取仪中对应槽位。
50.具体地,所述的步骤s31中,在槽位1加入磁珠20μl、异丙醇300μl和混合液100-600μl,在槽位2加入200μl结合液,在槽位3加入500μl漂洗液,在槽位4加入60μl洗脱液。
51.具体地,所述的步骤s32中醇洗程序为:混合时间2-4min,磁吸时间20-40s,混合速度2次/秒;所述的结合程序为:混合时间0.5-2min,磁吸时间20-40s,混合速度2次/秒;所述的漂洗程序为:混合时间0.5-2min,磁吸时间20-40s,混合速度2次/秒;所述的洗脱程序1为:等待时间4-6min,混合速度2次/秒;所述的洗脱程序2为:等待时间0.5-2min,混合时间2-4min,磁吸时间50-70s,混合速度2次/秒;所述的弃磁珠程序为:混合时间0.05-0.2min,混合速度2次/秒。
52.优选地,所述的步骤s32中醇洗程序中:混合时间3min,磁吸时间30s;所述的结合程序中:混合时间1min,磁吸时间30s;所述的漂洗程序中:混合时间1min,磁吸时间30s;所述的洗脱程序1中:等待时间5min;所述的洗脱程序2中:等待时间1min,混合时间3min,磁吸时间60s;所述的弃磁珠程序中:混合时间0.1min。
53.具体地,所述的步骤s4中洗脱核酸的检测量为1μl,采用紫外分光光度计进行质量检测。
54.又一方面,本发明提供了根据上述任一技术方案所述的试剂盒在组织脱落细胞中进行核酸提取的应用。
55.本发明中,所述异硫氰酸胍的分子式为c2h6n4s,cas号为593-84-0。
56.本发明中,所述triton x-100的化学名称为聚乙二醇辛基苯基醚,分子式为c
14h22
o(c2h4o)n。
57.本发明中,所述蛋白酶k是指一种从白色念珠菌分离出来的强力蛋白溶解酶,所述蛋白酶k的cas号为39450-01-6。
58.本发明中,所述sds的化学名称为十二烷基硫酸钠。
59.本发明中,术语“tris-hcl”表示“三羟甲基氨基甲烷盐酸盐”。
60.术语“edta”表示“乙二胺四乙酸”。
61.术语“ct值”表示每个pcr反应的荧光信号达到设定的阈值时所经历的循环数,每个模板的ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,ct值越小。
62.相对于现有技术,本发明具有以下有益效果:
63.1、本发明的试剂盒通过磁珠与核酸特异性的结合,提取得到的核酸纯度高、浓度大、纯化质量高,缩短核酸纯化时间;
64.2、本发明采用半自动化核酸提取的方法,操作简单,效率高;
65.3、本发明的试剂盒中的核酸提取试剂主要用于组织脱落细胞的提取,能够有效获得高质量的核酸产物,在低样本量的核酸检测中提供更高的检测灵敏度,如在早期疾病诊断、术后监测等领域有着广泛的应用价值;
66.4、本发明的试剂盒中的核酸提取试剂可在室温(25℃)下稳定储存2年以上。
附图说明
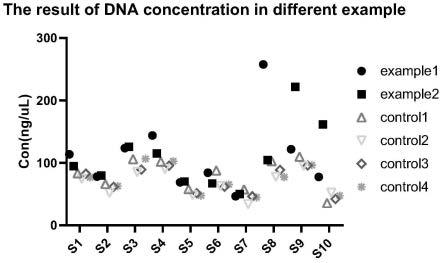
67.图1是实施例1-2与对比例1-4对样本的核酸检测浓度结果图;
68.图2是实施例1-2与对比例1-4对样本的核酸检测纯度结果图;
69.图3是实施例1-2与对比例1-4对样本的核酸检测浓度的结果统计图;
70.图4是实施例1-2与对比例1-4对样本的核酸检测纯度的结果统计图。
具体实施方式
71.下面结合具体实施例,对本发明作进一步详细的阐述,下述实施例不用于限制本发明,仅用于说明本发明。以下实施例中所使用的实验方法如无特殊说明,实施例中未注明具体条件的实验方法,通常按照常规条件,下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
72.下述实施例中,异硫氰酸胍购自sigma(sg927701),三羟甲基氨基甲烷购自sigma(t1503),edta购自sigma(e9884),triton x-100购自沪试(30188970),盐酸胍购自sigma(g3272),无水乙醇购自sigma(1.07017),脱氧胆酸钠购自sigma(d6750),蛋白酶k购自sigma(70663)。
73.在本发明的实施例中,所述ct值是指每个pcr反应的荧光信号达到设定的阈值时所经历的循环数,每个模板的ct值与该模板的起始拷贝数的对数存在线性关系,起始拷贝数越多,ct值越小。
74.试剂盒的制备
75.实施例1
76.裂解液1组成如下:
77.表1
[0078][0079]
[0080]
制备方法:
[0081]
按表格依次加入上述试剂,调节ph值为7.6,纯化水定容至100ml,涡旋混匀5min后常温保存。
[0082]
结合液组成如下:
[0083]
表2
[0084]
序号名称单位用量(100ml)1盐酸胍34.65g2三羟甲基氨基甲烷12.114g3异丙醇40ml
[0085]
制备方法:
[0086]
称量盐酸胍和三羟甲基氨基甲烷,调ph至8.0,加入40ml异丙醇,纯化水定容至100ml,涡旋混匀5min后常温保存。
[0087]
漂洗液组成如下:
[0088]
表3
[0089]
序号名称单位用量(100ml)1tris-hcl(1mol/l,ph8.0)1.5ml2乙醇80ml
[0090]
制备方法:
[0091]
配制1mol/l,ph8.0的tris-hcl,取1.5mltris-hcl加入80ml乙醇,纯化水定容至100ml,涡旋混匀5min后常温保存。
[0092]
洗脱液组成如下:
[0093]
表4
[0094]
序号名称单位用量(100ml)1tris-hcl(1mol/l,ph8.0)1ml
[0095]
制备方法:
[0096]
配制1mol/l,ph8.0的tris-hcl,取1mltris-hcl加入纯化水定容至100ml,涡旋混匀5min后常温保存。
[0097]
实施例2
[0098]
裂解液1组成如下:
[0099]
表5
[0100]
序号名称单位用量(100ml)1异硫氰酸胍17.724g2盐酸胍42.988g3三羟甲基氨基甲烷0.484g4edta1.169g5tritonx-1001.063g6脱氧胆酸钠0.3g
[0101]
制备方法:
[0102]
按表格依次加入上述试剂,调ph值为7.6,纯化水定容至100ml,涡旋混匀5min后常温保存。
[0103]
结合液组成如下:
[0104]
表6
[0105]
序号名称单位用量(100ml)1盐酸胍47.765g2tris-hcl(1mol/l,ph8.0)4ml3月桂酰基氨酸钠1.169g4edta(0.5mol/l)8ml5异丙醇30ml
[0106]
制备方法:
[0107]
配制1mol/l,ph8.0的tris-hcl和0.5mol/l的edta,取8mledta和4mltris-hcl,依次加入上述试剂,纯化水定容至100ml,涡旋混匀5min后常温保存。
[0108]
漂洗液组成如下:
[0109]
表7
[0110]
序号名称单位用量(100ml)1tris-hcl(1mol/l,ph8.0)2.0ml2乙醇75ml
[0111]
制备方法:
[0112]
配制1mol/l,ph8.0的tris-hcl,取2mltris-hcl,加入75ml乙醇,纯化水定容至100ml,涡旋混匀5min后常温保存。
[0113]
洗脱液组成如下:
[0114]
表8
[0115]
序号名称单位用量(100ml)1tris-hcl(1mol/l,ph8.0)1ml2edta(0.5mol/l)0.1ml
[0116]
制备方法:
[0117]
配制1mol/l,ph8.0的tris-hcl和0.5mol/l的edta,取0.1mledta和1mltris-hcl,纯化水定容至100ml,涡旋混匀5min后常温保存。
[0118]
对比例1
[0119]
选择德国凯杰货号为q51304核酸提取试剂盒为对比例1
[0120]
对比例2
[0121]
天根生化货号为dp341核酸纯化试剂盒为对比例2。
[0122]
对比例3
[0123]
与实施例2的区别在于,裂解液1成分中未加入异硫氰酸胍,其余皆相同。
[0124]
对比例4
[0125]
与实施例2的区别在于,裂解液1中成分含量不同,其余皆相同,裂解液1具体如下表9:
[0126]
表9
[0127]
序号名称单位用量(100ml)1异硫氰酸胍(gtc)55g2三羟甲基氨基甲烷5g3edta10g4triton x-1002g
[0128]
核酸提取及质量检测
[0129]
以采集的临床宫颈脱落细胞为样本进行核酸提取。
[0130]
对实施例1-2及对比例3-4所得核酸提取试剂,进行如下操作:取若干离心管,每支加入300μl裂解液1和200μl待测样本,涡旋混匀30s后瞬时离心;向每支离心管中加入20μl裂解液2,涡旋混匀30s后瞬时离心;300rpm恒温金属浴65℃孵育5min,得混合液。
[0131]
选用天根生化仪器(ose-s96)将混合液进行提取,在槽位1加入超顺磁性二氧化硅磁珠20μl、异丙醇300μl和混合液560μl,在槽位2加入200μl结合液,在槽位3加入500μl漂洗液,在槽位4加入60μl洗脱液。运行参数如下表:
[0132]
表10
[0133]
槽位名称等待时间min混合时间min磁吸时间s混合速度吸附模式1醇洗——330中强力2结合——130快强力3漂洗——130快强力4洗脱5————慢强力4洗脱1360慢强力3弃磁珠——0.1——中普通
[0134]
运行结束后,取下反应板,吸取槽位4中上清得待测的洗脱核酸。
[0135]
对于对比例1-2,根据说明书进行操作,得待测核酸。
[0136]
采用紫外分光光度计(thermo,nanodrop one)检测实施例1-2及对比例1-4所得核酸质量。具体步骤如下:
[0137]
(1)打开nanodrop one,选择dsdna检测模式;(2)移液器取2ul洗脱液进行空白检测,用新的抹布擦拭上下基座防止残留物;(3)移液器依次取2ul样本进行检测,每次检测后用新的抹布擦拭上下基座防止残留物。
[0138]
下表11为采用实施例1-2、对比例1-4对同一临床样本的核酸检测结果,根据ct值检测样本提取质量。
[0139]
表11
[0140]
[0141][0142]
结果分析
[0143]
通过表11及图1-4显示,实施例1-2的核酸提取量和核酸纯度大于对比例1-4,说明本技术提供的核酸检测试剂盒在核酸的提取量和核酸纯度方面优于市售产品,对比例3的核酸提取量和核酸纯度低于本技术的实施例1-2,说明当将裂解液1成分中缺少异硫氰酸胍时,其对核酸的提取效果差且提取的核酸的纯度较低。在对比例4中,裂解液1的组分含量在本技术的保护范围外,且高于本技术的保护范围,但其核酸提取效果差,核酸的纯度低。说明只有当裂解液中成分含量在本技术的保护范围之内时,对核酸有较好的提取效果且提取的核酸纯度较高。
[0144]
最后应当说明的是,以上内容仅用以说明本发明的技术方案,而非对本发明保护范围的限制,本领域的普通技术人员对本发明的技术方案进行的简单修改或者等同替换,均不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1