一种活性提高的肌酸脒基水解酶突变体的制作方法
id no.1示的氨基酸序列上d17v、g58d、t117p、t199s、k351e中任一单点突变位点的单点突变体。
12.进一步优选地,该肌酸脒基水解酶突变体,所述肌酸脒基水解酶突变体包括在seq id no.1所示的氨基酸序列上d17v/g58d、d17v/t117p、d17v/k351e、d17v/t199s、t199s/k351e、d17v/t199s/k351e、d17v/t117p/t199s、d17v/t117p/k351e。
13.本发明的第二个目的是提供编码肌酸脒基水解酶突变体的基因。
14.在本发明的一种实施方式中,所述基因含有seq id no.2所示的核苷酸序列。
15.本发明的第三个目的是提供含有所述基因的载体。
16.本发明的第四个目的是提供表达所述突变体的细胞。
17.在本发明的一种实施方式中,所述细胞包括真菌细胞或细菌细胞。
18.在本发明的一种实施方式中,所述细胞包括大肠杆菌、酵母或枯草芽孢杆菌。
19.本发明的第五个目的是提供一种提高肌酸脒基水解酶活性的方法,包括以下步骤:
20.1、在ncbi数据库中搜索seq id no.1的氨基酸序列,删除重复出现的相同序列,选取与seq id no.1氨基酸序列一致性大于50%的氨基酸序列;
21.2、然后通过clustalx2.1软件进行多序列比对,将剩余氨基酸质序列整理成fasta.文件导入到mega7.0软件,利用其phylogenetic模块中nj算法构建系统发育树;
22.3、根据系统发育树的分支距离引入权重,通过python脚本计算consensus sequence,结合同源建模结构筛选出活性相关的突变位点为d17v,g58d,t117p,t199s,k351e。
23.在本发明所述的野生型肌酸脒基水解酶genbank登录号为baa88830.1的野生型肌酸脒基水解酶的第6、17、20、52、58、73、108、166、351、33、59、109、162、117、165、199、251、349、362、340和331位氨基酸进行突变。
24.本发明技术方案,具有如下优点:
25.1.本发明提供的肌酸脒基水解酶突变体包括单点突变体和组合突变体,与野生型肌酸脒基水解酶(baa88830.1)相比,其单点突变体和组合突变体在55℃及57℃下活力均有提升,最佳突变体活力大约是野生型肌酸脒基水解酶(baa88830.1)的1.6倍。基于此,本发明所提供的肌酸脒基水解酶突变体的活性更好,通过本发明所提供的构建方法得到的肌酸脒基水解酶突变体在较高的温度下催化肌酸生成肌氨酸和尿素时表现出优良的催化活性。
26.2.本发明构建的肌酸脒基水解酶(baa88830.1)基因工程菌可以高效表达肌酸脒基水解酶突变体,且培养条件简单,培养周期短,表达产物纯化方便等优点。
具体实施方式
27.突变体命名方式:
28.采用“原始氨基酸位置替换的氨基酸”来表示突变体。如g58d,表示位置58的氨基酸由亲本肌酸脒基水解酶的glu替换成asp,位置的编号对应于亲本肌酸脒基水解酶的氨基酸序列。
29.实施例1:单点肌酸脒基水解酶(baa88830.1)突变体的构建
30.野生型肌酸脒基水解酶质粒pany1-cr-af-wt由实验室保藏,通过全质粒pcr方法
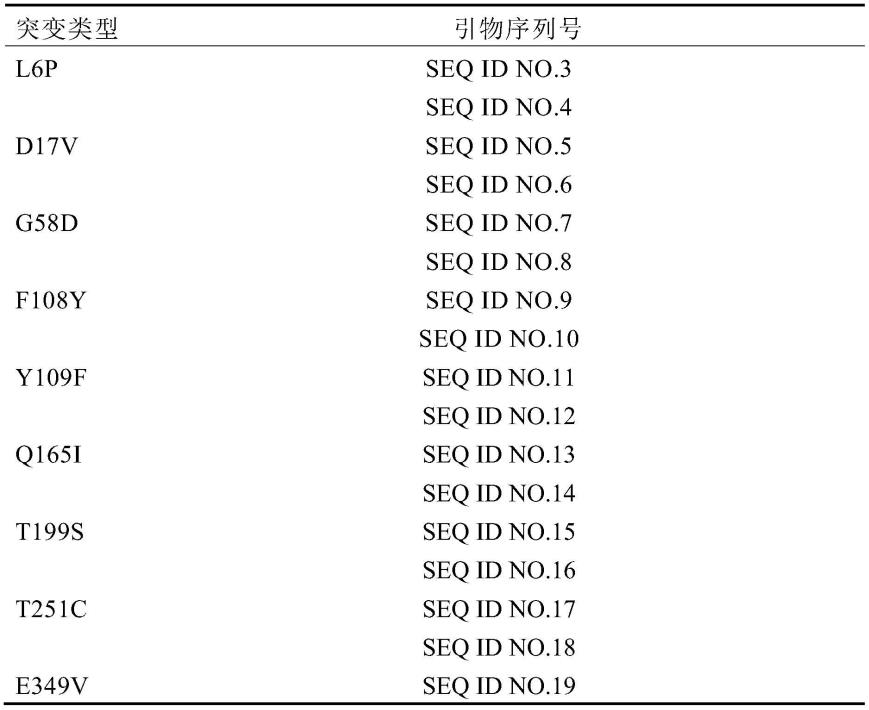
构建单点肌酸脒基水解酶突变体。细节如下:以pany1-cr-af-wt为模板,各突变位点的上下游引物列于表1中,分别以“突变位点取代氨基酸”的格式命名。使用高保真dna聚合酶primestar hs dna polymerase试剂盒,进行一轮进行pcr扩增以期获得含有突变体的基因重组质粒。反应体系如表2所示,pcr条件:预变性:95℃4min;变性:98℃10s;退火:55℃5s;延伸:72℃6min;循环25次;充分延伸:72℃10min。
31.表2引物表
[0032][0033][0034]
使用高保真dna聚合酶primestar hs dna polymerase试剂盒,进行一轮进行pcr扩增以期获得含有突变体的基因重组质粒。反应体系如表2所示,pcr条件:预变性:95℃4min;变性:98℃10s;退火:55℃5s;延伸:72℃6min;循环25次;充分延伸:72℃10min。
[0035]
表2第一轮pcr扩增的反应体系
[0036][0037]
实施例2:多点肌酸脒基水解酶(baa88830.1)突变体的构建
[0038]
为了进一步分析每个位点上不同氨基酸种类对酶催化特性的影响,参考定点突变的方法,仍然采用全质粒pcr技术以获得饱和突变文库基因,细节如下:使用高保真dna聚合酶primestar hs dna polymerase试剂盒,进行多轮进行pcr扩增以期获得含有突变体的基因重组质粒。反应体系、pcr条件和转化条件与定点突变条件相同。
[0039]
实施例3:突变工程菌构建
[0040]
参照超级感受态试剂盒说明书,稍作修改,构建工程菌,具体操作如下。首先,确认e.coli bl21(de3)不能在kan抗性下生长;第二步,将所述e.coli bl21(de3)划线分离活化;第三,取单菌落加入不含抗性的lb培养基中培养至od
600
在0.5到0.6之间,用试剂盒自带溶液制备感受态细胞;第四步,转化并涂于含kan抗性的lb固体培养基平板上,培养14h;最后,挑取5个单菌落,采用菌液pcr扩增其目的基因,琼脂糖凝胶电泳鉴定有目的条带后,选送苏州金唯智测序,确认工程菌。
[0041]
实施例4:肌酸脒基水解酶突变体(baa88830.1)蛋白的表达和纯化
[0042]
将甘油管中的工程菌按体积比1%接种到含100μg/ml卡那霉素(kan+)的4ml 2yt液体培养基试管中,在37℃、220rpm下培养11h;然后将该4ml菌液转接至含50μg/ml卡那霉素(kan+)的2yt液体培养基的1l摇瓶中,在37℃、220rpm下培养约3h,使od600达到0.8左右;再加入0.1mm iptg诱导剂,在25℃、200rpm下诱导培养11-17h,本实施例中诱导培养14h。将诱导表达后收获的大肠杆菌菌体悬液离心,再经过一步ni-nta亲和层析处理,得到纯度>95%的肌酸脒基水解酶蛋白。
[0043]
实施例5:肌酸脒基水解酶突变体的酶活测定
[0044]
将优化的野生型肌酸脒基水解酶(baa88830.1)以及实施例3提供的多种肌酸脒基水解酶突变体进行活性测试,肌酸脒基水解酶活力测定方法具体为:
[0045]
肌酸脒基水解酶的测活反应基于酶偶联催化体系,其在反应体系中催化肌酸生成肌氨酸和尿素,肌氨酸可以在肌氨酸氧化酶(sox)的催化下反应,同时可以生成过氧化氢(h2o2),过氧化氢可以在辣根过氧化酶的催化下与toos(n-乙基-n-(2-羟基-3-磺丙基)间甲苯胺钠盐)和4-ap(4-aminoantipyrine,4-氨基安替比林)反应,生成紫色的化合物。因此,我们通过uv-2550紫外可见光分光光度计(岛津)监测单个酶促反应体系在555nm波长处紫外吸收变化量,来评估肌酸脒基水解酶的活性变化,在此单位活性被定义为每分钟产生1μm过氧化氢的酶量。
[0046]
酶反应体系为:0.5mm toos(n-乙基-n-(2-羟基-3-磺丙基)间甲苯胺钠盐),0.45mm 4-ap(4-aminoantipyrine,4-氨基安替比林),900u/l辣根过氧化物酶,0.1m磷酸钾缓冲液(ph 7.5)。
[0047]
1)在肌氨酸氧化酶和辣根过氧化物酶的催化作用下,通过酶多级偶联方法测量肌酸脒基水解酶的活性,利用磷酸盐缓冲液(0.1m,ph 7.5)将待测样品酶浓度稀释至1mg/ml。底物溶液由500μm肌酸,0.45mm 4-aa(4-氨基安替比林),0.5mm toos(n-乙基-n-(2-羟基-3-磺丙基)-3-甲基苯胺)和磷酸盐缓冲液(0.1m,ph 7.5)配制而成,并在37℃下进行孵育。取950μl底物溶液并向其中添加50μl待测样品酶来测定酶的活性,通过uv2550分光光度计(shimadzu)监测酶反应体系中555nm处的紫外线吸收的变化,单位活性定义为每分钟产生1μm过氧化氢的酶量。
[0048]
本发明提供的肌酸脒基水解酶突变体包括单点突变体和组合突变体(见表3),通过测定野生型肌酸脒基水解酶(baa88830.1)、肌酸脒基水解酶突变体在57℃时活性发现,与优化的野生型肌酸脒基水解酶(baa88830.1)相比,肌酸脒基水解酶突变体中的四种在57℃的活性得到了明显的提高,这四种肌酸脒基水解酶突变体分别为:k351e/l6p/t199s/t251c、k351e/l6p/f108y/y109f、q165i/l6p/f108y/y109f/e349v、k351e/l6p/f108y/y109f/q165i,具体如表3所示。
[0049]
表3.野生型肌酸脒基水解酶及其突变体活性
[0050][0051][0052]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1