一种L-谷氨酸-α-叔丁脂的合成方法与流程
一种l-谷氨酸-α-叔丁脂的合成方法
技术领域
1.本发明涉及药物合成技术领域,具体而言,涉及一种l-谷氨酸-α-叔丁脂的合成方法。
背景技术:
2.谷氨酸是哺乳动物脑内含量最高的酸性氨基酸,参与蛋白质,多肽及脂肪酸的合成,与谷氨酰胺一起调节体内氨水平。
3.谷氨酸作为介导中枢神经系统内绝大多数突触兴奋的重要神经递质,涉及脑内的很多重要生理功能,包括:a、神经元和胶质细胞的增殖、发育、存活与死亡;b、学习和记忆密切相关的长时程增强效应(ltp)和长时程抑制效应(ltd)突触传递效率的可塑性变化。
4.此外,谷氨酸是中枢神经系统内含量最高、作用最广泛的兴奋性氨基酸。其主要集中在前脑,从新皮质到后脑逐渐减少。脊椎动物和无脊椎动物的中枢神经系统中,存在着谷氨酸能神经元系统:皮层和海马椎体细胞发出的下行通路。
5.当谷氨酸能神经元在某些病理情况下过度释放谷氨酸时又使之具有兴奋毒性作用,最终导致细胞死亡,参与许多病变的发病机理,包括脑缺血、缺氧、创伤、中风、低血糖、癫痫、hton舞蹈病、alzheimer氏病、肌萎缩侧索硬化、帕金森病、病理性疼痛等。
6.谷氨酸的兴奋毒性是各种原因(机械,化学,毒素)导致谷氨酸大量释放并堆积于突触间隙,使谷氨酸受体过度兴奋激活,从而引起一系列以神经细胞或其他组织细胞死亡为终结的病理生理变化。
7.由于谷氨酸无法直接用于多肽合成,故需要合成保护基,然后参与多肽合成反应,常见方法包括将谷氨酸合成为l-谷氨酸-α-叔丁脂。l-谷氨酸-α-叔丁脂是利拉鲁肽、索马鲁肽等glp-1受体激动剂类药物的重要合成原料。并且在合成多肽后的脱除过程,简单,易操作。
8.但目前l-谷氨酸-α-叔丁脂的合成方法存在以下问题中的至少一种:原子经济性差、成本高、操作复杂、收率较低、安全性不好。
9.鉴于此,特提出本发明。
技术实现要素:
10.本发明的目的在于提供一种l-谷氨酸-α-叔丁脂的合成方法,以解决上述问题中的至少一种。
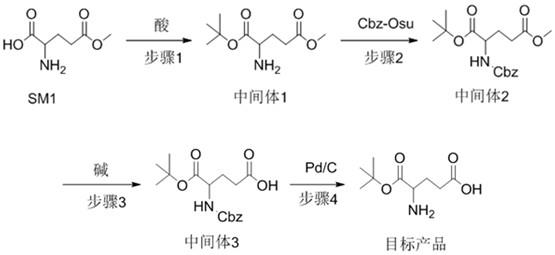
11.本发明可这样实现:本技术提供一种l-谷氨酸-α-叔丁脂的合成方法,包括以下步骤:s1:将l-谷氨酸-γ-甲酯与反应溶剂在酸催化下反应,生成中间体1;s2:将中间体1与cbz-osu反应,得到中间体2;
s3:将中间体2水解,生成中间体3;s4:在催化剂作用下,将中间体3进行氢解,得到l-谷氨酸-α-叔丁脂。
12.在可选的实施方式中,s1中:所用的酸包括浓硫酸和高氯酸中的至少一种,优选为高氯酸;和/或,所用的反应溶剂包括四氢呋喃与叔丁醇的混合物或乙酸叔丁酯,优选为乙酸叔丁酯。
13.在可选的实施方式中,s1中:l-谷氨酸-γ-甲酯与反应溶剂以及酸的质量比为1:3-6:0.2-0.8,优选为1:5:0.6;和/或,反应温度为-10℃至30℃,优选15℃;和/或,反应时间为2-8h,优选为4h。
14.在可选的实施方式中,s2中:中间体1与cbz-osu于碱以及互溶溶剂存在的条件下进行反应。
15.在可选的实施方式中,s2所用的碱包括碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾、氢氧化钠、n-甲基吗啉、吡啶及三乙胺中的任意一种,更优选为碳酸钠、碳酸钾及氢氧化钠中的任意一种,进一步更优选为氢氧化钠;在可选的实施方式中,s2所用的互溶溶剂包括乙酸乙酯、二氯甲烷、四氢呋喃、甲苯、乙腈、dmf、二氯甲烷、氯仿、甲醇、乙醇和水中的任意一种,更优选为二氯甲烷、乙酸乙酯或甲醇,进一步更优选为乙酸乙酯。
16.在可选的实施方式中,s2中:中间体1、cbz-osu及碱的摩尔比为1:0.9-1.1:1-2,优选为1:1:1.5;和/或,互溶溶剂与中间体1的用量比为50ml:10g;和/或,反应温度为0-40℃,优选为20℃;和/或,反应时间为2-6h,优选为4h。
17.在可选的实施方式中,s3中:中间体2于碱以及互溶溶剂存在的条件下进行水解。
18.在可选的实施方式中,s3所用的碱包括碳酸钠、碳酸钾和氢氧化钠中的任意一种,更优选为氢氧化钠。
19.在可选的实施方式中,s3所用的互溶溶剂包括二氯甲烷、四氢呋喃、乙腈、dmf及甲醇中的任意一种,更优选为dmf、四氢呋喃和甲醇中的任意一种,进一步地更优选为甲醇。
20.在可选的实施方式中,s3中:中间体2与碱的摩尔比为1:1-1.5,优选为1:1.2;和/或,互溶溶剂与中间体2的用量比为50ml:10g;和/或,反应温度为-10℃至-30℃,优选为15℃;和/或,反应时间为2-6h,优选为4h。
21.在可选的实施方式中,s4中:中间体3于反应溶剂存在的条件下进行氢解。
22.在可选的实施方式中,催化剂为pd/c;和/或,反应溶剂包括二氯甲烷、四氢呋喃、乙腈、dmf及甲醇中的任意一种,优选为dmf、四氢呋喃及甲醇中的任意一种,更优选为甲醇。
23.在可选的实施方式中,s4中:中间体3与反应溶剂以及催化剂的质量比为1:2-5:0.01-0.08,优选为1:4:0.05;和/或,反应温度为25-35℃;
和/或,反应时间为1-4h,优选为2h。
24.在可选的实施方式中,还包括:对各步骤所得的化合物先纯化,再进行后续步骤。
25.在可选的实施方式中,在进行s2之前,先将中间体1进行中和、水洗和浓缩。
26.在可选的实施方式中,在进行s3之前,先将中间体2加水淬灭,调节ph至4-5,收集有机相,干燥,浓缩;更优地,调节ph的ph调节剂为稀盐酸水溶液;进一步更优的,稀盐酸的浓度为3-5mol/l。
27.在可选的实施方式中,在进行s4之前,先将中间体3进行萃取、水洗、干燥、浓缩、结晶和烘干。
28.在可选的实施方式中,将s4所得的l-谷氨酸-α-叔丁脂进行浓缩、结晶、固液分离;更优地,结晶所用的溶剂为乙酸乙酯。
29.本技术的有益效果包括:本技术通过巧妙地采用液相方法合成l-谷氨酸-α-叔丁脂,合成过程可行且可控、成本低、产率高,工艺条件温和,反应副产物亲水性较好,容易去除,操作安全性高,适合于大规模生产。
附图说明
30.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
31.图1为本技术中l-谷氨酸-α-叔丁脂的合成路线图;图2为本技术实施例1提供的中间体3的hplc图;图3为s3步骤反应得到的中间体3的异构体图;图4为本技术实施例1提供的l-谷氨酸-α-叔丁脂的hplc图;图5为l-谷氨酸-α-叔丁脂的异构体图。
具体实施方式
32.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
33.下面对本技术提供的l-谷氨酸-α-叔丁脂的合成方法进行具体说明。
34.本技术采用的部分缩略语相对应的化学名称如下:谷氨酸-γ-甲酯:glu(ome);乙酸叔丁酯:acotbu;保护试剂:cbz-osu;氢氧化钠:naoh;乙酸乙酯:ea;碳酸氢钠:nahco3;四氢呋喃:thf;水:h2o;钯碳:pd/c;甲醇:ch3oh;高氯酸:hclo4;浓硫酸:h2so4。
35.本技术提出的l-谷氨酸-α-叔丁脂的合成方法,其合成路线如图1所示,合成的l-谷氨酸-α-叔丁脂的结构式如下:
。
36.上述合成方法包括以下步骤:s1:将l-谷氨酸-γ-甲酯与反应溶剂在酸催化下反应,生成中间体1;s2:将中间体1与cbz-osu反应,得到中间体2;s3:将中间体2水解,生成中间体3;s4:在催化剂作用下,将中间体3进行氢解,得到l-谷氨酸-α-叔丁脂。
37.作为参考地,上述s1中:所用的酸优选包括(为)浓硫酸和高氯酸中的至少一种,更优为高氯酸。
38.上述s1中:所用的反应溶剂优选包括(为)四氢呋喃与叔丁醇的混合物或乙酸叔丁酯,更优选为乙酸叔丁酯。
39.在s1中以上述物质作为酸和反应溶剂,有利于提高中间体1的产率和质量,缩短反应时间,经济效益高。下述其余反应中各反应试剂的选用同理。
40.较佳地,s1中:l-谷氨酸-γ-甲酯与反应溶剂以及酸的质量比为1:3-6:0.2-0.8,如1:3:0.2、1:3:0.3、1:3:0.4、1:3:0.5、1:3:0.6、1:3:0.7、1:3:0.8、1:4:0.2、1:4:0.3、1:4:0.4、1:4:0.5、1:4:0.6、1:4:0.7、1:4:0.8、1:5:0.2、1:5:0.3、1:5:0.4、1:5:0.5、1:5:0.6、1:5:0.7、1:5:0.8、1:6:0.2、1:6:0.3、1:6:0.4、1:6:0.5、1:6:0.6、1:6:0.7或1:6:0.8,也可以为1:3-6:0.2-0.8范围内的其它任意值。优选为1:5:0.6。
41.若酸使用过多,会导致对酸不稳定的中间体1酸解,变回原料;若酸使用过少,会导致反应效率低,大大延长反应时间。
42.s1中:反应温度为-10℃至30℃,如-10℃、-5℃、0℃、5℃、10℃、15℃、20℃、25℃或30℃等,也可以为-10℃至30℃范围内的其它任意值。优选为15℃。
43.由于反应为可逆反应,若温度过高,会使得产品分解,降低产率;若温度过低,会大大延长反应时间。
44.s1中:反应时间为2-8h,如2h、2.5h、3h、3.5h、4h、4.5h、5h、5.5h、6h、6.5h、7h、7.5h或8h等,也可以为2-8h范围内的其它任意值。优选为4h。
45.作为参考地,s2中:中间体1与cbz-osu于碱以及互溶溶剂存在的条件下进行反应。
46.cbz-osu用于对氨基进行保护。
47.上述s2中,所用的碱包括碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾、氢氧化钠、n-甲基吗啉、吡啶及三乙胺中的任意一种,优选为碳酸钠、碳酸钾及氢氧化钠中的任意一种,更优选为氢氧化钠。
48.上述s2中,所用的互溶溶剂包括乙酸乙酯、二氯甲烷、四氢呋喃、甲苯、乙腈、dmf、二氯甲烷、氯仿、甲醇、乙醇和水中的任意一种,优选为二氯甲烷、乙酸乙酯或甲醇,更优选为乙酸乙酯。
49.s2中:中间体1、cbz-osu及碱的摩尔比为1:0.9-1.1:1-2,如1:0.9:1、1:0.9:1.5、1:0.9:2、1:1:1、1:1:1.5、1:1:2、1:1.1:1、1:1.1:1.5、1:1.1:2,也可以为1:0.9-1.1:1-2范围内的其它任意值。优选为1:1:1.5。
50.s2中:互溶溶剂与中间体1的用量比为50ml:10g。
51.s2中:反应温度为0-40℃,如0℃、5℃、10℃、15℃、20℃、25℃、30℃、35℃或40℃等,也可以为0-40℃范围内的其它任意值。优选为20℃。
52.s2中:反应时间为2-6h,如2h、2.5h、3h、3.5h、4h、4.5h、5h、5.5h或6h等,也可以为2-6h范围内的其它任意值。优选为4h。
53.作为参考地,s3中:中间体2于碱以及互溶溶剂存在的条件下进行水解。
54.上述s3中,所用的碱包括碳酸钠、碳酸钾和氢氧化钠中的任意一种,优选为氢氧化钠。需说明的是,现有技术中有关上述类似的方案在水解过程中,会消旋,产生异构体,而本技术的设计大大减少了异构体的产生,减少了纯化过程,有利于提高收率和经济效益。
55.上述s3中,所用的互溶溶剂包括二氯甲烷、四氢呋喃、乙腈、dmf及甲醇中的任意一种,优选为dmf、四氢呋喃和甲醇中的任意一种,更优选为甲醇。
56.s3中:中间体2与碱的摩尔比为1:1-1.5,如1:1、1:1.1、1:1.2、1:1.3、1:1.4或1:1.5等,也可以为1:1-1.5范围内的其它任意值。优选为1:1.2。
57.s3中:互溶溶剂与中间体2的用量比为50ml:10g。
58.s3中:反应温度为-10℃至-30℃,如-10℃、-5℃、0℃、5℃、10℃、15℃、20℃、25℃或30℃等,也可以为-10℃至30℃范围内的其它任意值。优选为15℃。
59.s3中:反应时间为2-6h,如2h、2.5h、3h、3.5h、4h、4.5h、5h、5.5h或6h等,也可以为2-6h范围内的其它任意值。优选为4h。
60.作为参考地,s4中:中间体3于反应溶剂存在的条件下进行氢解。
61.上述s4中,所用的催化剂为pd/c(钯碳)。
62.上述s4中,反应溶剂包括二氯甲烷、四氢呋喃、乙腈、dmf及甲醇中的任意一种,优选为dmf、四氢呋喃及甲醇中的任意一种,更优选为甲醇。
63.s4中:中间体3与反应溶剂以及催化剂的质量比为1:2-5:0.01-0.08,如1:2:0.01、1:2:0.02、1:2:0.03、1:2:0.04、1:2:0.05、1:2:0.06、1:2:0.07、1:2:0.08、1:3:0.01、1:3:0.02、1:3:0.03、1:3:0.04、1:3:0.05、1:3:0.06、1:3:0.07、1:3:0.08、1:4:0.01、1:4:0.02、1:4:0.03、1:4:0.04、1:4:0.05、1:4:0.06、1:4:0.07、1:4:0.08、1:5:0.01、1:5:0.02、1:5:0.03、1:5:0.04、1:5:0.05、1:5:0.06、1:5:0.07或1:5:0.08等,也可以为1:2-5:0.01-0.08范围内的其它任意值。优选为1:4:0.05。
64.s4中:反应温度为25-35℃,可理解为室温。
65.s4中:反应时间为1-4h,如1h、1.5h、2h、2.5h、3h、3.5h或4h等,也可以为1-4h范围内的其它任意值。优选为2h。
66.在一些优选的实施方式中,还包括对各步骤所得的化合物先纯化,再进行后续步骤。
67.例如,在进行s2之前,先将中间体1进行中和、水洗和浓缩。
68.例如,在进行s3之前,先将中间体2加水淬灭,调节ph至4-5,收集有机相,干燥,浓缩。
69.其中,用于调节ph的ph调节剂可以为稀盐酸水溶液。示例性地,稀盐酸的浓度可以为3-5mol/l,优选为4mol/l。
70.收集有机相之前,还包括对有机相进行洗涤。
71.例如,在进行s4之前,先将中间体3进行萃取、水洗、干燥、浓缩、结晶和烘干。
72.例如,将s4所得的l-谷氨酸-α-叔丁脂进行浓缩、结晶、固液分离。
73.其中,结晶所用的溶剂示例性地可以为乙酸乙酯。固液分离可采用过滤方式进行。
74.承上,本技术提供的l-谷氨酸-α-叔丁脂合成方法设计科学,构思巧妙,采用液相方法进行合成,过程可行且可控、成本低、产率高,不存在柱层析纯化手段,适合于大规模生产。
75.并且,该合成方法工艺条件温和,不存在高温或超低温等类型反应,大大降低了生产的危险性。
76.此外,本技术整个过程涉及到的反应副产物,基本具有较好的亲水性,较易除去,大大提高了l-谷氨酸-α-叔丁脂的安全性。
77.需说明的是,l-谷氨酸-α-叔丁脂的系列类似物,也可参照上述方法进行合成,相应的生产工艺简单,反应过程易于控制,生产工艺的可重复性强。所得的产品可用于多肽化合物的合成以及成药后规模化生产。
78.以下结合实施例对本发明的特征和性能作进一步的详细描述。
79.实施例1本实施例公开了l-谷氨酸-α-叔丁脂合成方法,其合成路线如图1所示,具体过程如下:s1:将原料10.00gglu(ome)(62.10mmol)加入250ml反应瓶中,加入50gacotbu,降温至10-15℃,滴加hclo46g,控制温度为15℃保温反应4h,tlc点板观察,反应进行度80%。
80.将反应降温至0℃,加水40g后,用10mol/l的氢氧化钠溶液调ph=8-9,分液;饱和盐水洗两次,每次20g,干燥,过滤;再于40-50℃、真空度为-0.08mpa的条件下浓缩至干,得10.78g油状物中间体1,收率80%。
81.s2:将10g中间体1(46.1mmol)加入250ml反应瓶中,加入乙酸乙酯50ml,再加入2mol/l的氢氧化钠35ml,控制温度为20℃,分批加入11.48gcbz-osu(46.1mmol),加毕,保温反应8h,tlc点板观察,反应完全。
82.反应产物经加水淬灭,并用稀盐酸水溶液(稀盐酸的浓度为4mol/l)调节ph=4-5,有机相经水洗涤,收集有机相,干燥,浓缩至干,得中间体215.37g,收率95%。
83.s3:将10.00g中间体2(28.49mmol)加入250ml反应瓶中,加入50ml甲醇,控温15℃缓慢加入10mol/l氢氧化钠溶液3.5ml,加毕,保温反应4h,tlc点板观察,反应完全。
84.将反应降温至0℃,用4mol/l盐酸调ph=2-3,用乙酸乙酯萃取产品,有机相经水洗之后,干燥,浓缩干,加入石油醚析晶2h后,过滤,烘干得到中间体38.86g,收率92.3%,纯度99.89%。
85.s4:将8.00g中间体3(23.74mmol)加入250ml反应瓶中,加入32g甲醇,再加入0.4gpd/c,控制温度25-35℃,加压氢化2小时,tlc点板观察,反应完全。
86.反应液经过滤,浓缩,石油醚结晶2小时,抽滤,烘干,得到4.58gl-谷氨酸-α-叔丁脂,收率95%,纯度98.84%。
87.上述中间体3的hplc图谱如图2所示,图谱信息如表1所示。
88.表1图谱信息
保留时间(min)峰宽(min)峰面积(mau
×
s)高度(mau)峰面积(%)7.5480.07931.426410.2998450.052011.3230.09522739.42529437.6068499.891512.5170.13111.548290.1967880.0565上述反应过程中所产生的中间体3的异构体的hplc结果如图3和表2所示。
89.表2hplc结果
保留时间(min)面积(微伏
×
秒)高度(微伏)ep理论塔板数分离度对称因子面积(%)基线噪音(mv)118.2241024421638494615029.2828-2.2199.950.068221.032501581709010.72113.80-0.050.068
上述合成的l-谷氨酸-α-叔丁脂的hplc图谱(信号1:dad1a,sig=210,4ref=360,100)如图4所示,图谱信息如表3所示。内标使用乘积因子(1.0000)和稀释因子。
90.表3图谱信息峰保留时间(min)峰宽(min)峰面积高度峰面积(%)12.2650.067917.742884.352830.454022.5920.05873.920731.112960.1003313.2220.26903875.30493240.0982799.1570427.5010.06544.661771.101530.1193528.3120.06826.620581.480940.1694l-谷氨酸-α-叔丁的异构体(对应上述中间体3的异构体)的hplc结果如图5和表4所示。
91.表4图谱信息
保留时间(min)面积(微伏
×
秒)高度(微伏)ep理论塔板数分离度对称因子面积(%)15.8837408618245.54-1.410.05126.3621454827567381495.831.152.2999.949
实施例2本实施例以glu(ome)、乙酸叔丁酯为标准底物,在hclo4、hclo4/h2so4、h2so4催化下,对合成中间体1的其他反应条件进行研究,结果如表5所示。
92.表5序号酸溶剂时间(h)温度(℃)产率(%)1hclo4乙酸叔丁酯415802hclo4/h2so4乙酸叔丁酯415303h2so4乙酸叔丁酯41535实施例3本实施例以glu(ome)、hclo4为标准底物,在乙酸叔丁酯、二氯甲烷/叔丁醇、四氢呋喃/叔丁醇条件下,对合成中间体1的其他反应条件进行研究,结果如表6所示。
93.表6序号酸溶剂时间(h)温度(℃)产率(%)1hclo4乙酸叔丁酯415802hclo4二氯甲烷/叔丁醇415-3hclo4四氢呋喃/叔丁醇41515其中
“‑”
表示产率无效;由上表可知,当溶剂为二氯甲烷/叔丁醇,不能生成本发明
的中间体1。
94.实施例4本实施例以glu(ome)、hclo4为标准底物,在乙酸叔丁酯条件下,对合成中间体1的其他反应条件进行研究,结果如表7所示。
95.表7序号酸溶剂时间(h)温度(℃)产率(%)1hclo4乙酸叔丁酯215302hclo4乙酸叔丁酯415803hclo4乙酸叔丁酯615604hclo4乙酸叔丁酯81520实施例5本实施例以glu(ome)为标准底物,在15℃条件下,对合成中间体1的glu(ome)、hclo4和乙酸叔丁酯质量比进行研究,结果如表8所示。
96.表8
序号glu(ome)与hclo4、乙酸叔丁酯质量比时间(h)温度(℃)产率(%)11:0.2:34152021:0.2:64152531:0.8:34151541:0.8:641535
实施例6本实施例以glu(ome)、乙酸叔丁酯为标准底物,在hclo4催化条件下,对合成中间体1的反应温度进行研究,结果如表9所示。
97.表9序号酸溶剂时间(h)温度(℃)产率(%)1hclo4乙酸叔丁酯4-10102hclo4乙酸叔丁酯40203hclo4乙酸叔丁酯415804hclo4乙酸叔丁酯43015实施例7本实施例以中间体1、cbz-osu和氢氧化钠为标准底物(即中间体1:cbz-osu:碱的摩尔比为1:1.0:1.5),对合成中间体2的其他反应条件进行研究,结果如表10所示。
98.表10序号碱溶剂时间(h)温度(℃)产率(%)1碳酸氢钠乙酸乙酯420762碳酸氢钾乙酸乙酯420783碳酸钠乙酸乙酯420804碳酸钾乙酸乙酯420825氢氧化钠乙酸乙酯420956n-甲基吗啉乙酸乙酯42073
7三乙胺乙酸乙酯420758吡啶乙酸乙酯420689氢氧化钠乙酸乙酯406010氢氧化钠乙酸乙酯4209511氢氧化钠乙酸乙酯4407012氢氧化钠乙酸乙酯2207513氢氧化钠乙酸乙酯4209514氢氧化钠乙酸乙酯62070本实施例中选择乙酸乙酯做溶剂,反应完后直接水洗处理,节约处理时间和废水产生量,从而大量节约成本。
99.实施例8本实施例以中间体2和氢氧化钠为标准底物(即中间体1:碱的摩尔比为1:1.2),对合成中间体3的其他反应条件进行研究,结果如表11所示。
100.表11序号碱溶剂时间(h)温度(℃)产率(%)1碳酸氢钠甲醇415-2碳酸氢钾甲醇415-3碳酸钠甲醇415304碳酸钾甲醇415505氢氧化钠甲醇415936氢氧化钠甲醇215537氢氧化钠甲醇415938氢氧化钠甲醇615659氢氧化钠甲醇4-102010氢氧化钠甲醇4159311氢氧化钠甲醇4306312氢氧化钠dmf4157513氢氧化钠四氢呋喃4159014氢氧化钠乙腈4154015氢氧化钠二氯甲烷41510本实施例中选择甲醇和四氢呋喃做溶剂相同时间和温度,收率最高,但是四氢呋喃价格高,故选择经济的甲醇。
101.实施例9本实施例以中间体1、cbz-osu和氢氧化钠的摩尔比,对合成中间体2的反应条件进行研究,结果如表12所示。
102.表12
序号中间体1与cbz-osu、氢氧化钠的摩尔比时间(h)温度(℃)产率(%)11:0.9:14155021:0.9:241545
31:1.1:14155541:1.1:241548
实施例10本实施例以中间体2和碱的摩尔比对合成中间体3的反应条件进行研究,结果如表13所示。
103.表13
序号中间体2与氢氧化钠的摩尔比时间(h)温度(℃)产率(%)11:14155121:1.541543
实施例11本实施例以中间体3和溶剂、催化剂的质量比对合成最终产品的反应条件进行研究,结果如表14所示。
104.表14
序号中间体3与甲醇、钯碳的质量比时间(h)温度(℃)产率(%)11:2:0.01225-352021:2:0.08225-35产品大量析出,无法过滤31:5:0.01225-352141:5:0.08225-3598,溶剂用量过大,影响成本51:4:0.05125-354761:4:0.05425-3598,反应时间过长影响效率
实施例12本实施例以中间体1和氢氧化钠、cbz-osu为标准底物(中间体1和氢氧化钠、cbz-osu的摩尔比为1:1:1.5),对合成中间体2的反应溶剂条件进行研究,结果如表15所示。
105.表15
序号中间体1和氢氧化钠、cbz-osu的摩尔比为1:1:1.5溶剂时间(h)温度(℃)产率(%)11:1:1.5乙酸乙酯4209521:1:1.5四氢呋喃4209331:1:1.5甲苯4205041:1:1.5乙腈4206251:1:1.5dmf4209261:1:1.5二氯甲烷4204871:1:1.5氯仿4204581:1:1.5甲醇4208591:1:1.5乙醇42083101:1:1.5水42063
本实施例中选择乙酸乙酯和四氢呋喃、dmf做溶剂相同时间和温度,收率最高,但是四氢呋喃价格高,dmf后处理比较麻烦,而且选择乙酸乙酯做溶剂,反应后直接可以进行处理,节约时间和废水得产生量,从而大量节约成本。
106.实施例13本实施例以中间体3和钯碳为标准底物(中间体3和钯碳的摩尔比为1:0.05),中间体3与溶剂的质量比均为1:4,对合成目标产物的反应溶剂条件进行研究,结果如表16所示。
107.表16
序号中间体3和钯碳的质量比为1:0.05溶剂时间(h)温度(℃)产率(%)
11:0.05二氯甲烷225-356821:0.05四氢呋喃225-358031:0.05乙腈225-357541:0.05dmf225-359351:0.05甲醇225-3598.8
本实施例中选择dmf和甲醇做溶剂相同时间和温度,收率最高,但是,dmf沸点较高,产品中得残留溶剂不好除去,故选择甲醇做溶剂,沸点低,产品中不会残留。
108.综上所述,本技术巧妙地采用液相方法合成l-谷氨酸-α-叔丁脂,合成过程可行且可控、成本低、产率高,工艺条件温和,反应副产物亲水性较好,容易去除,操作安全性高,适合于大规模生产。
109.以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1