1.本发明属于细胞培养领域,特别涉及一种滋养层细胞共培养体系培养干细胞/类器官的方法及应用。
背景技术:2.成体干细胞和类器官培养已经成为再生医学基础研究领域不可或缺的技术,主要分为两种:基质胶培养法和滋养层细胞共培养法。目前,利用基质胶培养的3d类器官技术是应用最为广泛的方法。通过将原代的干细胞与基质胶混合,滴加到细胞培养皿中,待基质胶凝固后,加入干细胞生长所需的完全培养基,完全培养基包括了一定比例混合的条件性培养基和一系列细胞生长所需的成分。条件性培养基的制备主要是利用了改造的细胞系(如293细胞系),通过在细胞系中过表达r-spodin1和noggin两个基因,使得细胞在生长过程中会释放r-spodin1和noggin蛋白到周围的培养基中,这两种蛋白是维持干细胞干性所必需的细胞因子。通过在完全培养基中混入30%-50%的条件性培养基,来确保干细胞生长所必需的r-spodin1和noggin。但生产条件性培养基需要对细胞进行培养,该过程需要几天的时间,这期间对于细胞的数量,以及r-spodin1和noggin蛋白的合成与释放是一个极其动态的过程,无法准确定量,更不能准确控制,因此,制备出来的条件性培养基中r-spodin1和noggin蛋白的含量无法保证,且不同批次之间会存在较大的差异。同时,在制备过程中由于细胞系会不断的增殖,消耗培养基中的成分,并大量积累细胞代谢产物,部分代谢产物对干细胞的生长具有毒性作用。因此,条件性培养基制备过程中大量的不可控因素会增加实验结果的误差,引入了过多的人为因素,会导致实验结果的可重复性降低。
3.滋养层细胞共培养法是利用小鼠胚胎成纤维细胞作为滋养层细胞,替代了基质胶,来维持干细胞的体外扩增。滋养层细胞提供了更为优越的微环境去维持干细胞的干性,该体系下可以获得更多更纯的干细胞。此外,利用滋养层细胞共培养的气液界面分化技术,干细胞可以自发形成具有完善的上皮屏障结构和功能的3d气液界面类器官。虽然引入了胚胎成纤维细胞用于干细胞和类器官的培养,但是培养基中仍然离不开r-spodin1和noggin这两个细胞因子。然而,这两种细胞因子的价格昂贵,使得大部分实验室难以为继。
4.本发明欲解决条件性培养基不稳定的问题,给实验带来的误差和不可控因素,寻求更加稳定、高效且成本低廉的干细胞和类器官培养方案。
技术实现要素:5.针对上述问题,第一方面,本发明提出了一种滋养层细胞共培养体系培养干细胞/类器官的方法,所述方法包括:
6.利用纯化好的逆转录病毒感染小鼠胚胎成纤维细胞,形成稳定表达r-spodin1和noggin基因的胚胎成纤维细胞系;
7.将所述胚胎成纤维细胞系进行辐照筛选出单克隆细胞系,并以所述单克隆细胞系
为滋养层细胞与多种表达因子组合共同作为共培养体系用于培养干细胞或类器官。
8.进一步地,所述小鼠胚胎成纤维细胞为3t3-j2细胞。
9.进一步地,所述多种表达因子至少包括蛋白、小分子抑制剂、生长因子、维生素和激素或其类似物中的一种或多种。
10.更进一步地,所述蛋白包括:jagged-1;
11.所述小分子抑制剂包括:rockinhibitor和sb431542;
12.所述生长因子包括:egf;
13.所述维生素包括:nicotinamide;
14.所述激素类包括:insulin和hydrocortisone。
15.更进一步地,所述多种表达因子包括1μmjagged-1、2.5μmrock inhibito r、2μmnicotinamide和10ng/mlegf。
16.第二方面,本发明还提出了一种滋养层细胞,所述滋养层细胞为3t3-j2-rn,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:cgmcc no.22310。
17.第三方面,本发明提出了一种滋养层细胞共培养体系,所述共培养体系包括包括所述的滋养层细胞和所述的多种表达因子。
18.第四方面本发明提出了利用所述培养方法培养的一种干细胞。
19.进一步地,所述干细胞包括胃、十二指肠、小肠、结肠和肝脏来源的正常干细胞和/或疾病组织来源的干细胞。
20.第五方面,本发明提出了一种利用所述培养方法培养的类器官。
21.进一步地,所述类器官包括胃、十二指肠、小肠、结肠、肝脏和胰腺;所述类器官来源于成体组织、胎胎组织和/或各种疾病条件下的成体组织。
22.所述的干细胞和/或类器官可以在临床转化中应用,具体包括在干细胞移植和细胞治疗中应用。
23.第六方面,本发明提出了一种生物模型,所述生物模型基于所述的干细胞或类器官构建,或基于所述的干细胞和类器官共同构建。
24.进一步地,所述生物模型包括细菌模型、病毒感染模型、细胞因子模型、毒素致病模型、癌症发生模型、免疫细胞相互作用模型和衰老模型。
25.所述的生物模型可以在检测和验证胃肠道类器官对小分子药物、大分子药物、多肽类药物及核酸类药物吸收情况时应用。
26.本发明的有益效果:
27.本发明利用基因改造技术获得了稳定表达r-spodin1和noggin蛋白的3t3-j2-rn细胞,使得基因改造后的3t3-j2细胞的增殖不会受到影响,3t3-j2-rn细胞具有作为滋养层细胞的功能和特性,且可以作为r-spodin1和noggin这两个细胞因子的充足来源以全部替代培养基中r-spodin1和noggin蛋白,达到培养基中无需再添加这两个因子的目的。
28.利用3t3-j2-rn细胞作为滋养层细胞培养干细胞和类器官的技术体系,可以节约r-spodin1和noggin的购买成本,削弱了实验经费对科学研究的制约。同时,无需条件性培养基的制备,这样会减小条件性培养基批次差异对实验的影响。在此培养体系下,干细胞能够长期稳定的传代,干细胞的克隆形成、增殖与分化潜能没有受到影响,3d气液界面类器官培养在结构和功能上也没有受到影响。
29.获得本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在说明书、权利要求书以及附图中所指出的结构来实现和获得。
附图说明
30.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
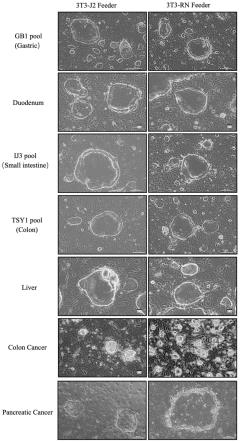
31.图1示出了本发明实施例2中以3t3-j2-rn和3t3-j2细胞为滋养层培养胃、十二指肠、小肠、结肠、肝脏、结肠癌、胰腺癌干细胞的细胞形态图;
32.图2a示出了本发明实施例3中利用h&e染色以3t3-j2-rn和以3t3-j2为滋养层培养的结肠干细胞在气液界面三维分化体系中形成的上皮组织切面图;
33.图2b示出了本发明实施例3中采用免疫荧光染色结肠干细胞在气液界面三维分化体系中形成的上皮组织染色图;
34.图3示出了本发明实施例4中以3t3-j2-rn和3t3-j2为滋养层培养结肠干细胞克隆细胞能力对比图;
35.图4a示出了本发明实施例5中以3t3-j2-rn和以3t3-j2为滋养层培养的结肠干细胞在基因mki67的表达水平对比图;
36.图4b示出了本发明实施例5中以3t3-j2-rn和以3t3-j2为滋养层培养的结肠干细胞在基因sox9的表达水平对比图;
37.图4c示出了本发明实施例5中两种滋养层细胞培养的结肠干细胞的rna-seq分析图;
38.图5a示出了本发明实施例6中以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官对沙奎那韦(saquinavir)的吸收情况分布图;
39.图5b示出了本发明实施例6中以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官对布洛芬(ibuprofen)的吸收情况分布图;
40.图6a示出了本发明实施例7中caco-2对荧光素异硫氰酸酯-葡聚糖(4kd,40kd)吸收情况分布图;
41.图6b示出了本发明实施例7中gastric organoids对荧光素异硫氰酸酯-葡聚糖(4kd,40kd)吸收情况分布图;
42.图6c示出了本发明实施例7中small intestine organoids对荧光素异硫氰酸酯-葡聚糖(4kd,40kd)吸收情况分布图;
43.图7示出了本发明实施例8中胃肠道类器官对多肽类药物吸收情况;
44.图8示出了本发明实施例9中胃肠道类器官对核酸类药物吸收情况。
具体实施方式
45.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地说明,显然,所描述的实施例是
本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。此外,除非另有定义,本公开中所提及的科学术语都具有与本发明要求保护的主体所属领域的技术人员一般理解相同的含义。另外,如无特别说明,未具体记载条件或者步骤的方法均为常规方法,所采用的试剂和材料均可从商业途径获得。
46.针对现有技术中基质胶培养3d类器官技术中r-spodin1和noggin蛋白无法准确定量和准确控制,而导致制备出来的条件性培养基中r-spodin1和noggin蛋白的含量无法保证,且不同批次之间会存在较大的差异的问题。利用3t3细胞表达r-spodin1和noggin这两个蛋白是否能够用于维持干细胞的生长尚不明确,同时,由于3t3-j2细胞作为滋养层细胞需要进行辐照,辐照后的3t3-j2细胞由于基因组的损伤会进入衰老阶段,衰老的3t3细胞能否合成以及能否合成足够量的r-spodin1和noggin也是未知的。另外辐照会引起dna的损伤,表达r-spodin1和noggin的基因整合到3t3-j2细胞的基因组中,因此,也不可避免的会导致dna序列的突变,从而引起蛋白的突变而不能翻译合成具有功能的r-spodin1和noggin蛋白,是否会直接导致3t3-j2细胞作为r-spodin1和noggin蛋白的技术方案的失败,也未可知。最关键的是,3t3-j2细胞的质量和状态对维持干细胞的自我更新能力和分化潜能尤为重要,基因工程操作流程是否影响滋养层细胞维持干细胞特性的功能也是面临的最大的难点。
47.3t3-j2小鼠胚胎成纤维细胞作为滋养层细胞,已经广泛应用于干细胞的培养中。本发明以3t3-j2小鼠胚胎成纤维细胞为基础,并考虑上述分析过程中的难点进行深入研究提出了一种滋养层细胞的培养方法和共培养体系。通过将3t3-j2细胞进行辐照,使其细胞的基因组受到损伤,导致细胞衰老而无法增殖。由于不再增殖,3t3-j2细胞会保持一个极低的基础代谢,消耗极少的培养基成分,且培养基中也少量的积累了3t3-j2细胞来源的代谢产物。同时,由于胚胎成纤维细胞本身的特点,会促进干细胞干性的维持,因此,3t3-j2细胞是干细胞培养中重要的支撑材料。3t3-j2细胞是可以稳定传代的细胞系,可以对细胞进行基因组上的操作。
48.基于上述原因本发明选择3t3-j2细胞为宿主细胞构建一种滋养层细胞共培养体系。
49.具体方法如下:首先构建r-spodin1和noggin两个基因的真核表达载体,两个载体分别带有puromycin(嘌呤霉素)和hygromycin(潮霉素)抗性基因。通过测序证实了两个基因的插入,且基因序列正确。
50.通过脂质体转染,将r-spodin1和noggin两个基因的真核表达载体同逆转录病毒包装载体pmdl,pvsvg共转染到293细胞中,收集培养基上清,通过超速离心的方法浓缩病毒并进行纯化。
51.将纯化好的病毒感染3t3细胞,通过对抗性基因的筛选,获得了稳定表达这两个基因的若干个单细胞克隆而来的细胞系,将这些细胞系进行辐照,作为滋养层细胞培养干细胞。最后鉴定、筛选出一株细胞系,命名为3t3-j2-rn。3t3-j2-rn细胞的增殖在基因编辑后不受影响,仍然具有滋养层细胞的功能和特性,最为重要的一点是3t3-j2-rn细胞可以稳定表达r-spodin1和noggin蛋白,在培养基中完全去除r-spodin1和noggin这两个细胞因子,干细胞仍然可以生长,并且可以稳定传代,其分化潜能也没有影响。此外,用3t3-j2-rn细胞
inhibitor(rock抑制剂,2.5μm)、sb431542(2μm)、nicotinamide(烟酰胺10mm)、egf(表皮生长因子,10ng/ml)、insulin(胰岛素)、hydrocortisone(氢化可的松)等多种因子成分,不添加r-sp ondin1和noggin这两个因子,培养胃(gastric)、十二指肠(duodenum)、小肠(small intestine)、结肠(colon)、肝脏(liver)、结肠癌(cancer co lon)、胰腺癌(pancreatic cancer)干细胞。细胞每2天更换一次培养液,每7-10天传代,传代时细胞用0.25%trypsin-edta(胰蛋白酶)在37℃消化8-10min,消化后的细胞离心收集后接种于新的3t3-j2-rn细胞饲养层上。细胞每2天更换一次培养液,每7-10天传代。
65.上述干细胞克隆的形态如图1所示,图1的左右两列分别示出了以3t3-j2-rn滋养层细胞(3t3-j2-rn feeder)和3t3-j2滋养层细胞(3t3-j2fe eder)为滋养层培养gastric、duodenum、colon、liver、cancer colon、pancre atic cancer干细胞的形态。
66.经过多次验证可以证实,上述干细胞细胞均可长期稳定传代,与以3t3-j2为滋养层培养的干细胞相比,细胞克隆状态“干性”更强。由此可见,3t3-j2-rn滋养层培养体系可以为干细胞提供更加优越的生长环境,更加有利于维持干细胞的良好状态,是一种新型并且非常稳定高效的干细胞培养体系,不仅可以适用于正常干细胞的培养,还可以适用于各种疾病类干细胞的培养。
67.实施例3上皮类器官组织的体外构建
68.将结肠干细胞在气液界面分化体系(ali)中分化为三维的结肠上皮类器官组织结构:
69.将实施例1中辐照过的3t3-j2-rn细胞铺在双层培养板(transwell)上层小室的底部培养过夜。第二天将结肠干细胞接种在小室的3t3-j2-rn饲养层细胞上,每天更新小室内、外的培养基(培养基即前述中所提到的干细胞培养基,内、外小室培养基相同),培养3-7天至融合状态,去掉小室里面的培养基,仅在小室外面添加和更新培养基,从而形成气液界面培养条件,6-10天后形成三维立体的上皮组织。应用福尔马林固定上皮组织,对形成的三维立体的上皮组织进行石蜡包埋切片。
70.利用h&e染色鉴定上皮组织形态,并利用免疫荧光染色检测不同细胞标志物的表达,本实施例中选用dapi染料鉴定干细胞分化的上皮细胞的类型及其空间分布、比例,其中结肠上皮组织主要的细胞类型及相应的检测标志物包括杯状细胞(muc2),肠内分泌细胞(chga),上皮细胞(e-cadheri n)。
71.h&e染色鉴定结果和免疫荧光染色结果分别如图2a和图2b所示,图2a是以3t3-j2-rn为滋养层细胞和以3t3-j2为滋养层细胞培养的结肠干细胞在气液界面三维分化体系中形成的上皮组织切面图,显示紧密排列的细胞构成上皮细胞层屏障,he染色;图2b结肠干细胞在气液界面三维分化体系中形成的上皮组织主要细胞类型。免疫荧光染色:muc2免疫荧光(红色)显示为杯状细胞,chga免疫荧光(红色)显示为肠内分泌细胞,e-cadherin免疫荧光(绿色)显示为上皮细胞。从2a和图2b可以看出,以3t3-j2-rn为滋养层和以3t3-j2为滋养层构建的结肠上皮组织的形态特征都与体内组织高度相似,并且具备上皮组织的主要的细胞类型。
72.实施例4克隆形成能力比较
73.分别以3t3-j2-rn和3t3-j2为滋养层培养结肠干细胞,并且对其进行克隆形成能力鉴定。首先,对消化处于对数期生长的细胞,计数后取1000个细胞接种到12孔板上,轻轻
摇晃混匀,每隔两天更换一次新鲜培养基,生长10-12天后去掉培养基,pbs清洗细胞两次,4%甲醛固定,罗丹明染色20min,用水清洗多余染色后晾干,统计形成的细胞克隆数量。其细胞克隆数量结果如图3所示,图中横坐标分别对应3t3-j2-rn和3t3-j2为滋养层,纵坐标表示细胞克隆能力,结果显示,以3t3-j2-rn为滋养层培养的结肠干细胞比以3t3-j2为滋养层培养的结肠干细胞克隆形成能力更强。
74.实施例5转录组测序分析
75.为鉴定3t3-j2-rn滋养层对干细胞基因表达的影响,以3t3-j2-rn为滋养层和以3t3-j2为滋养层培养的结肠干细胞进行了rna-seq分析,结果如图4c所示,从rna-seq分析结果来看,用以上两种滋养层细胞培养的结肠干细胞在转录组水平上基本相似,仅有少量差异基因,但是,与细胞增殖和干性维持相关的基因mki67和sox9的表达水平结果如4a和4b所示,图中纵坐标表示标准化计数,从中可以看出,以3t3-j2-rn为滋养层培养的结肠干细胞比以3t3-j2为滋养层培养的结肠干细胞的基因mki67和sox9表达量都要高一些,由此看出,以3t3-j2-rn为滋养层细胞对干细胞的干性维持和增殖能力的保持效果更好一些。
76.体外构建的胃肠道类器官的特征与体内组织高度相似,理论上可用来模拟检测药物在胃肠道上皮组织的吸收情况。主要包括检测和验证胃肠道类器官对小分子药物、多肽类大分子药物、核酸类药物的吸收情况,以下实施例逐一验证其作为药物吸收和筛选模型的实用性和有效性。
77.实施例6检测和验证胃肠道类器官对小分子药物吸收情况
78.将小分子药物沙奎那韦和布洛芬,加入以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官的transwell中,本实施例中选用了胃和小肠进行构建,一段时间后(4h)取小室底部的培养基进行液相色谱/质谱分析,检测培养基中的药物吸收情况,并与该药物在caco-2(人结直肠腺癌细胞)模型上的吸收情况进行对比,caco-2、gastric organoids(胃类器官)和small intesti ne organoids(小肠类器官)对沙奎那韦、布洛芬的吸收情况分别如图5a和5b所示,结果表明,沙奎那韦、布洛芬小分子药物在caco-2和以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官的渗透率基本相似。因此,运用以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官可以用来作为检测小分子药物在胃肠道上皮吸收情况的研究模型。
79.实施例7检测和验证胃肠道类器官对大分子物质的吸收情况
80.将荧光素异硫氰酸酯-葡聚糖(4kd,40kd)分别加入caco-2和以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官的transwell中,一段时间后(4h)取小室底部的培养基检测荧光强度。另外,为了进一步充分验证该模型的药物吸收功能,加入增加胃肠道上皮的渗透性、促进药物吸收的物质癸酸钠(c10),检测荧光强度的变化情况。caco-2、gastric organoids和small intestine organoids对大分子物质的吸收情况分别如6a、6b、6c所示,从图中可以看出,与caco-2相比,胃肠道类器官具有完整的上皮屏障功能,而且,加入c10之后显著地增加了荧光素异硫氰酸酯-葡聚糖(4kd,40kd)在caco-2、gastric organoids和small intestine organoids中的渗透率。
81.实施例8检测和验证胃肠道类器官对多肽类药物吸收情况
82.在后续的研究中,通过检测胃肠道类器官对于多肽类药物亮丙瑞林(leuprorelin)的吸收情况,将leuprorelin加入已形成的三维立体胃肠道上皮组织的
transwell中,一段时间后取小室底部的培养基进行液相色谱/质谱分析,检测培养基中的药物吸收情况,胃肠道类器官对多肽类药物吸收情况如图7所示。结果发现,亮丙瑞林大分子药物在以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官的渗透率与目前文献中报道的在大鼠动物实验中检测的渗透率(rat)更为接近,而且文献中统计分析发现,与caco-2模型相比,该药物在大鼠实验中所测的渗透率与人体对该药物的吸收情况相关性更高。因此,该数据表明运用以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官是可以用来作为检测大分子药物在胃肠道上皮吸收情况的更为合适的研究模型。
83.实施例9检测和验证胃肠道类器官对核酸类药物吸收情况
84.近年来,mrna疫苗因在新冠疫情中的突出表现,被更多人所知,相应地,由核酸药物引领的“第三次医药革命”亦愈发火热。由于口服给药途径具有方便、安全性高、患者顺应性好的优点,目前口服核酸类药物也成为国内外研究的热点。本实施例尝试将带有荧光标记的有纳米微囊包裹的核酸药物加入以3t3-j2-rn为滋养层构建的三维立体胃肠道类器官的transwell中,一定时间之后取小室底部的培养基检测荧光强度,鉴定核酸药物的吸收情况,具体如图8所示。结果发现,核酸药物由于分子量较大,没有明显地被三维立体胃肠道类器官模型所吸收。
85.尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。