一种噬菌体抗性工程菌株的筛选方法
1.本发明涉及一种噬菌体抗性工程菌株的筛选方法。属于大肠杆菌菌株技术领域。
背景技术:
2.大肠杆菌是常用重组蛋白表达宿主菌,具有易于操纵、培养成本低廉、目的蛋白产量大等优势,被发酵企业或实验室视为生产重组蛋白的首选菌种。噬菌体污染是微生物发酵过程中不容忽视的问题。噬菌体污染会导致发酵菌株被裂解,发酵产物回收率降低,科研实验失败,企业停产,给科研机构和企业造成极大的经济损失。针对噬菌体污染,可以用净化生产环境这一方法进行防治,但是无论实验室或工厂的做法和卫生条件有多好,噬菌体感染也仍时有发生;使用不同的发酵菌株进行菌种轮换也是常见的防治方法之一,但该方法不可能适用于任何发酵,而且轮换菌种也有被侵染的可能;也可以使用噬菌体抑制剂进行防治,但噬菌体抑制剂的使用对宿主菌的生长、发酵生产性能、产物分离纯化和毒理学方面都有一定的限制。因此,抗噬菌体发酵菌株的选育可以从根本上避免噬菌体污染。
3.现有的抗噬菌体发酵菌株的选育有突变和基因工程两种方式。用基因工程改造菌株使其获得抗性的方法面临着效率低这一短板,而且改造后的单个菌种的生长、表达能力也无法保证。可以用突变的方法获得抗噬菌体菌株,包括自然突变、物理诱变、化学诱变等方法,自然突变较为常用,但耗时长、效率低,而物理、化学诱变的方法不能仅做到突变与噬菌体相关的基因,其安全性不确定。
4.转座子是细菌基因组中一段特异序列,可以以片段的形式在细菌基因组中自由地插入,造成插入突变。tn5转座子具有随机性强、频率高、稳定新好等优点,目前对于tn5转座突变应用上的研究都是用其随机突变野生株,从而获得抗性突变体库,分析抗性菌株的基因突变位点做受体分析,可以用这一方法获得具有目标抗性的高通量突变体库。重要的是,tn5转座突变获得的突变株均为一些基因缺陷株,因其具有适应缺陷性,可能生长情况较野生型较差,不会导致生物污染问题。另一方面,自然界中不存在转座需要的tnp转座酶,因此不会发生因引入转座子而导致自然界中生物随机突变的现象,其安全性可以保证。
技术实现要素:
5.本发明的目的是为克服上述现有技术的不足,提供一种噬菌体抗性工程菌株的筛选方法,以解决以大肠杆菌为模板的工程菌株的噬菌体污染问题。
6.为实现上述目的,本发明采用下述技术方案:
7.一种噬菌体抗性工程菌株的筛选方法,具体步骤如下:
8.(1)先对发酵菌株进行tn5转座突变,获得tn5转座子突变体文库;
9.(2)然后将tn5转座子突变体文库与噬菌体混合培养,高通量筛选,获得具有噬菌体抗性的菌株突变体库;
10.(3)最后对菌株突变体库进行溶原菌株的筛除、突变株抗噬菌体能力验证、生长曲线及重组蛋白表达能力测定,获得噬菌体抗性工程菌株库。
11.优选的,步骤(1)中,所述发酵菌株为电穿孔导入温敏质粒pkd46-laci-ptrc-tnpa-cmr的大肠杆菌菌株bl21(de3),立即将样品转移到soc培养基(购自青岛海博生物,液体培养基)中。
12.进一步优选的,电穿孔使用eppendorf eporator、bio-rad micropulser或invitrogen neon等脉冲控制器,预设参数190~230ω,20~25μf,1.2~1.6kv。
13.优选的,步骤(1)的具体方法为:将tn5转座子加入到电穿孔合格的发酵菌株菌液中,接合转移后,将混合液点滴于涂布了1mm 2,6-dap(2,6-二氨基吡啶)、50mm mgcl2、和40mm iptg(异丙基-β-d-硫代半乳糖苷)的lb固体培养基,30℃培养9h,即得。
14.优选的,步骤(1)中接合转移的具体方法为:tn5转座子由mfdpir菌株(山东大学微生物技术国家重点实验室)提供,mfdpir菌株的培养条件如下:含100mg/ml amp(氨苄西林)+50mg/ml kan(卡那霉素)双抗生素及0.3mm 2,6-dap的lb液体培养基,37℃培养12h后离心(4℃,5000
×
g,10min)收集80~150μl菌体浓缩液。
15.优选的,步骤(1)中菌株bl21(de3)的培养条件如下:lb液体培养基,30℃培养12h;按照两菌株细胞个数比1:1混合两菌体,得到混合液。
16.优选的,步骤(2)中,混合培养的具体方法为:将tn5转座子突变体文库与感染率moi为50的噬菌体溶液加入含50mg/ml卡那霉素的新鲜lb液体中,37℃培养12h,离心保留培养基重悬细菌即可。
17.优选的,步骤(2)中,高通量筛选的具体方法如下:
18.(2-1)抗性菌株的筛选
19.取混合培养所得菌液于96孔板中,加入含10mm mgso4和50mg/ml卡那霉素的lb液体培养基,加入噬菌体后恒温孵育;在0、2、4、6、12和17小时读取od
600 nm
的数值,取od值高于不加菌液的阴性对照组的菌液,梯度稀释后涂布于带有kan抗性的大肠杆菌显色培养固体板(购买于青岛海博生物,卡那霉素浓度为50mg/ml)以作筛选。
20.(2-2)抗性菌株的分离纯化
21.挑取单菌落,在带有kan抗性的大肠杆菌显色培养固体板上划线纯化三轮及以上,获得突变菌株。
22.进一步优选的,步骤(2-1)中,所述噬菌体的感染率moi为50。
23.本发明的有益效果:
24.本发明通过高效转座子突变技术获得工程菌株突变体文库,公开了一种大肠杆菌噬菌体抗性突变体筛选方法。包括以下步骤:通过tn5转座突变技术获得发酵菌株突变体文库,利用模式噬菌体筛选构建具有噬菌体抗性的发酵菌株突变体库;通过验证部分突变体的抗噬菌体、生长以及表达能力,获得改造成功的性状优良的抗性突变发酵菌株库。
25.根据发酵产业不同菌株的噬菌体污染具有多样性的特点,可使用本发明所描述的系统化方法,用针对性的噬菌体筛选特异性抗性菌株。与现有技术相比,本发明克服了大肠杆菌噬菌体抗性突变体筛选工作量大、效率低、突变体菌株生产性能不佳等技术难题,获得噬菌体抗性突变体概率大大增加;抗性分离率提高菌株生产性能良好。本发明将为解决发酵菌种的噬菌体污染问题提供有力的解决方案。
26.具体如下:
27.(1)本发明克服了现有技术中以大肠杆菌为模板的工程菌株的噬菌体污染问题,
通过高效转座子突变技术获得工程菌株突变体文库,实现了大肠杆菌噬菌体抗性突变体的筛选。
28.(2)根据发酵产业不同菌株的噬菌体污染具有多样性的特点,可使用本发明所描述的系统化方法,用针对性的噬菌体筛选特异性抗性菌株。
29.(3)与现有技术相比,本发明克服了大肠杆菌噬菌体抗性突变体筛选工作量大、效率低、突变体菌株生产性能不佳等技术难题,获得的噬菌体抗性突变体概率大大增加;抗性分离率提高菌株生产性能良好。
30.(4)本发明利用高效率的高通量方法,对庞大的突变体库进行快速且准确的筛选,有效利用模式噬菌体杀灭不具备噬菌体抗性的突变菌株,获得样本数多的噬菌体抗性菌株。
31.(5)本发明对筛选得到的噬菌体抗性菌株进行溶原菌株的筛除、突变株抗噬菌体能力验证、生长曲线及重组蛋白表达能力测定,获得改造成功的性状优良的抗性突变发酵菌株库。
附图说明
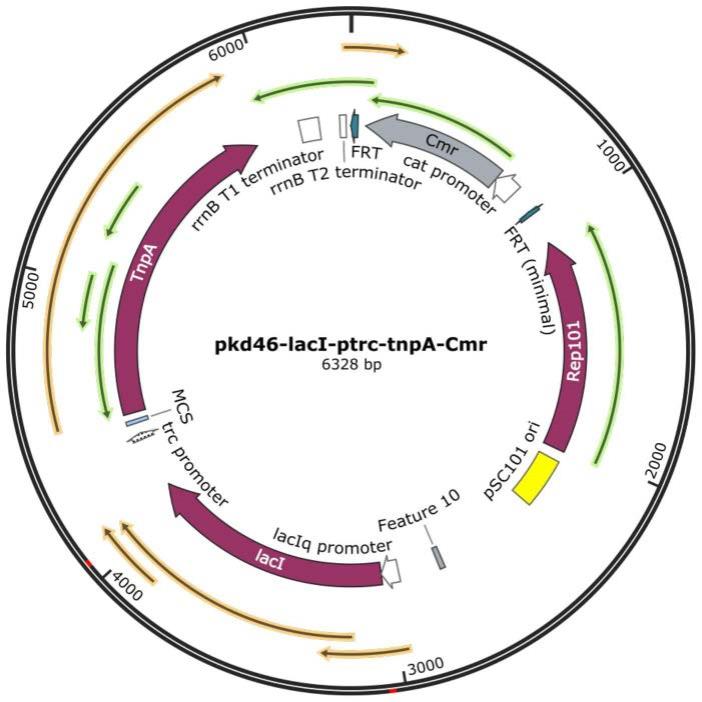
32.图1为温敏质粒pkd46-laci-ptrc-tnpa-cmr图谱。
33.图2为噬菌体抗突变体的获取示意图和噬菌体抗突变体高通量筛选流程图。
34.图3为噬菌体抗性菌株的高通量筛选结果的热图。
35.图4为溶原菌株的排除与实际有效突变的验证结果图。
36.图5为突变株抗噬菌体(梯度)能力点滴实验结果;其中,5:裂解充分,噬菌斑透亮;4:裂解较充分,有半透亮的噬菌斑;3:裂解较充分,呈不透亮的噬菌斑;2:裂解不充分,超小的噬菌斑;1:裂解不充分,只有个别超小的噬菌斑;0:完全不裂解。
37.图6为噬菌体抗性突变株生长曲线结果,其中,(a)ime281;(b)ime338;(c)ime339;(d)ime340;(e)ime347。
38.图7为噬菌体抗性突变株重组蛋白(mcherry)表达红色荧光值测定结果,其中,(a)大肠杆菌突变株与mcherry应用于重组蛋白生产的流程图。对应的噬菌体为(b)ime281;(c)ime338;(d)ime339;(e)ime340;(f)ime347。
具体实施方式
39.下面通过具体实施例,对本发明的技术方案作进一步的具体说明。应当理解,本发明的实施并不局限于下面的实施例,对本发明所做的任何形式上的变通和/或改变都将落入本发明保护范围。
40.在本发明中,若非特指,所有的份、百分比均为重量单位,所采用的设备和原料等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
41.本发明提供了一种噬菌体抗性工程菌株的构建及筛选方法。
42.更具体地,所述的一种噬菌体抗性工程菌株的构建及筛选方法为:通过tn5转座突变技术获得发酵菌株突变体文库,利用模式噬菌体高通量筛选构建具有噬菌体抗性的发酵菌株突变体库;通过验证部分突变体的抗噬菌体、生长以及表达能力,获得改造成功的性状
优良的抗性突变发酵菌株库。
43.下面结合具体的实施例对本发明提供的一种噬菌体抗性工程菌株的构建及筛选方法进行具体说明。
44.实施例1-3提供了一种噬菌体抗性工程菌株的构建及筛选方法,实施例1-3中所用的工程菌株模板为大肠杆菌e.coli bl21(de3)(购自上海生工生物科技有限公司),所用的噬菌体为ime281、ime338、ime339、ime340和ime347(实验室前期分离得到的,li,p.,lin,h.,mi,z.,xing,s.,tong,y.,wang,j.,2019.screening of polyvalent phage-resistant escherichia coli strains based on phage receptor analysis.front.microbiol.10,1
–
14.
45.https://doi.org/10.3389/fmicb.2019.00850)。
46.实施例1:
47.通过tn5转座突变技术获得发酵菌株突变体文库
48.(1)对发酵菌株进行tn5转座突变
49.将温敏质粒pkd46-laci-ptrc-tnpa-cmr电穿孔导入大肠杆菌菌株bl21(de3),立即将样品转移到soc培养基(购自青岛海博生物,液体培养基)中;将tn5转座子加入到电穿孔合格的发酵菌株菌液中,接合转移后,将混合液点滴于涂布了1mm 2,6-dap(2,6-二氨基吡啶)、50mm mgcl2和40mm iptg(异丙基-β-d-硫代半乳糖苷)的lb固体培养基,30℃培养9h,获得tn5转座子突变体文库(图2)。
50.温敏质粒pkd46-laci-ptrc-tnpa-cmr的核苷酸序列如seq id no.1所示,交予上海生工生物科技有限公司合成,质粒图谱见图1;bl21(de3)菌株购买于上海生工生物科技有限公司(不受限于此公司)。
51.电穿孔使用eppendorf eporator、bio-rad micropulser或invitrogen neon等脉冲控制器,预设参数190
–
230ω,20
–
25μf,1.2
–
1.6kv。
52.接合转移的具体方法为:tn5转座子由mfdpir菌株(山东大学微生物技术国家重点实验室)提供,mfdpir菌株的培养条件如下:含100mg/ml amp(氨苄西林)+50mg/ml kan(卡那霉素)双抗生素及0.3mm 2,6-dap的lb液体培养基,37℃培养12h后离心(4℃,5000
×
g,10min)收集150ul菌体浓缩液;菌株bl21(de3)的培养条件如下:lb液体培养基,30℃培养12h;按照两菌株细胞个数比1:1混合两菌体,得到混合液。
53.(2)抗噬菌体库的获取
54.将tn5转座子突变体库与感染率(moi,病毒颗粒与存活细菌细胞之比)为50的噬菌体溶液含50mg/ml卡那霉素的新鲜lb液体中,在200rpm,37℃下共同培养。培养12h后,以14,000
×
g离心10min,保留750μl培养基重悬细菌,获得抗噬菌体库。
55.实施例2:
56.利用模式噬菌体高通量筛选构建具有噬菌体抗性的发酵菌株突变体库
57.(1)抗性菌株的筛选
58.取80μl600nm处光密度(od)为0.6的突变体菌液菌液于96孔板,加入含有10mm mgso4和50mg/ml卡那霉素的lb液体培养基将菌液稀释到od=0.2,在稀释液中加入用于筛选的100μl噬菌体(moi=50)后在37℃下恒温孵育17h。阴性对照为100μl含80μl50mg/ml卡那霉素和10mm mgso4的lb培养基与100μl噬菌体溶液(均为200μl体积)的混合物。在0、2、4、
6、12和17h读取od
600nm
的数值。取od值高于不加菌液的阴性对照组的菌液,梯度稀释后涂布于带有kan抗性的大肠杆菌显色培养固体板以作筛选,42℃培养去除温敏型质粒(图2)。
59.(2)抗性菌株的分离纯化
60.挑取单菌落,在带有kan抗性的大肠杆菌显色培养固体板上划线纯化三轮及以上,获得突变菌株。
61.如图3,所有样品的od
600nm
值从0到6h有下降的趋势,其中一些在12h后达到0.5并继续上升。该方法侵染效率高,可先杀灭无抗性菌株。
62.实施例3:
63.获得改造成功的性状优良的抗性突变发酵菌株库
64.(1)溶原菌株的排除与实际有效突变的验证
65.根据噬菌体的全基因组序列设计引物,去检测获得的突变株中是否会包含噬菌体序列。
66.通过pcr实验验证tn5转位后bl21菌株的有效突变,并排除溶原菌。结果表明,这些菌株均为tn5转座子突变获得的bl21(de3)突变体,不含具有前噬菌体的溶原菌(图4)。
67.针对噬菌体ime338,设计引物:
68.上游:ime338-f ccgcaaaagtccttgaacg,如seq id no.2所示;
69.下游:ime338-r ggaaatacgcaccagaaccc,如seq id no.3所示;
70.针对噬菌体ime281,噬菌体ime339,噬菌体ime340,设计引物:
71.上游:imet-f ggccttcgggccttt,如seq id no.4所示;
72.下游:imet-r atgccgcgcttttgtgatgg,如seq id no.5所示;
73.针对噬菌体ime347,设计引物:
74.上游:ime347-f gggcatagacactgtaactaaggagc,如seq id no.6所示;
75.下游:ime347-r cgaaagcgagtggattcatagg,如seq id no.7所示;
76.pcr酶:2
×
rapid taq master mix(南京诺唯赞生物科技股份有限公司);
77.pcr条件:样本1μl;酶25μl;上下游引物各2μl;超纯水20μl;
78.pcr过程:95℃5min;循环流程为(95℃15s,58℃15s,72℃15s)30
–
35个循环;72℃5min。
79.(2)突变株抗噬菌体能力验证pcr
80.将100μlod600 nm=0.6的大肠杆菌溶液接种到含有5ml 55℃预热的lb半固体培养基的培养管中,倒在固体lb平板上,待其凝固,形成双层平板。将预先稀释到滴度为109pfu/ml的噬菌体溶液(5μl)点在各株大肠杆菌的平板上,37℃下培养8h,然后观察并记录斑块。用sm缓冲液替代的噬菌体稀释液作为阴性对照。通过斑块测定法确定斑块的效率(eop)。
81.结果如图5,相对于野生型bl21(de3),pr338-2到4和pr338-10获得了部分但不完全的噬菌体抗性,而其他突变株获得了完全的噬菌体抗性。
82.(3)生长曲线测定
83.将抗噬菌体突变体在lb肉汤中于37℃振荡(200rpm),直到od
600nm
值达到0.6。将20μl细菌肉汤稀释到180μl补充有10mm mgso4和50mg/ml卡那霉素的lb培养基中,并加入96孔板。20μl的大肠杆菌bl21(de3)肉汤和不含卡那霉素的lb培养基作为对照。培养板在37℃下
以200rpm的速度摇动,每2h读取一次od
600 nm
。
84.结果显示,噬菌体抗性株生长情况不因突变受影响(图6)。
85.(4)重组蛋白表达能力测定
86.将pet22b-mcherry质粒(shhebio,chn)通过电穿孔转化到大肠杆菌bl21(de3)和突变体菌株。将获得的单个重组菌落接种于含有100ml lb液体培养基和100mg/ml amp(氨苄西林)的三角瓶中,在37℃(200rpm)下培养至光密度(od)为600nm。之后,加入终浓度为1mm的iptg(异丙基-β-d-硫代半乳糖苷),接着在37℃下培养12h。然后,通过4000g下离心30min收集细胞,并重新悬浮在5ml的质量浓度0.9%盐水溶液中。测定菌株的荧光强度,mcherry的荧光在激发波长为550
–
590nm,发射波长为600
–
610nm。
87.以野生型bl21表达mcherry蛋白所产红色荧光值为参照标准,14个突变株高于标准的70%,pr281-7,pr338-8,pr339-3,pr340-8,pr347-9表现出了优良的蛋白表达能力(图7)。
88.上述虽然对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1