适用于悬浮培养LMH细胞生产禽腺病毒的无血清添加剂的制作方法
适用于悬浮培养lmh细胞生产禽腺病毒的无血清添加剂
技术领域
1.本发明涉及细胞培养生产疫苗领域,更具体地,本发明涉及一种适用于lmh细胞悬浮培养高密度高产禽腺病毒疫苗的无血清添加剂。
背景技术:
2.禽腺病毒是危害禽类养殖的一大传染性疾病,包括12个血清型。禽腺病毒血清4型引起鸡的肝炎-心包积液综合征;血清4型、血清8型、血清11型还能引起的鸭安卡拉病,造成禽类病死率增加,影响禽类养殖业的发展。对禽腺病毒的防治有赖于禽腺病毒疫苗的使用。
3.lmh细胞(鸡肝癌细胞)是用于生产禽腺病毒疫苗的敏感细胞株。传统的lmh细胞培养为贴壁培养形式,使用经典基础培养基添加10%含量的胎牛血清。血清成本高且批次间差异大,还可能携带动物源性病毒、支原体等,从而污染细胞培养过程,使生产的安全性受到质疑。贴壁培养使用的容器为滚瓶或细胞工厂,放大生产则需要大量增加细胞工厂或滚瓶数目,需要大量的人为操作,劳动密集且不利于产品的稳定性。而且贴壁细胞需要消化传代操作,较为繁杂,生产效率低。
4.随着对血清替代研究的逐步深入,培养基市场上出现越来越多针对不同种类细胞个性化的无血清培养基,也使得贴壁细胞驯化适应悬浮培养更可能实现,如bhk细胞、mdck细胞、293细胞、昆虫细胞。自2020年以来,市场上也陆续推出了商品化的无血清培养基用于悬浮培养lmh细胞,得以使lmh细胞密度和生产效率有了一定程度的提高;无血清培养也避免了血清带来的诸多弊端。目前商品化的lmh培养基利于细胞悬浮驯化、生长,但并非对各亚型的禽腺病毒生产都有优势。主要是接毒后细胞密度和活率的维持不足,细胞快速死亡不利于病毒二次感染。另外,如果没有根据禽腺病毒生产期的代谢特点有针对性地平衡营养成分,即便提高细胞密度,也不能相应地提升病毒产量,也就是所谓的“细胞密度效应”。
5.分析病毒的扩增过程,一方面,需要有足够多的细胞作为加工场所,产毒期一定程度提高细胞密度、维持细胞活率有助于提高病毒产量;另一方面,需要有足够的能量和物质基础来合成子代病毒。总之,病毒生产期的营养物质既要供给细胞生长也要供给子代病毒合成,该阶段对营养的需求量相比单纯的细胞生长有所不同。要进一步提高病毒的产量,需要充分了解病毒生产期的营养需求,根据产毒期代谢的实际情况,通过物料衡算来强化产毒期所需营养,打破“细胞密度效应”。
6.无血清培养基通常包含糖类、氨基酸、维生素、无机盐、微量金属离子和水六大类营养物质。通过检测可以发现,维生素、无机盐、微量金属离子通常非大量消耗型物质,而葡萄糖和多种氨基酸在细胞培养和病毒生产过程中大量消耗,对培养结果有显著影响。葡萄糖是糖酵解途径的起始底物,糖酵解产生的丙酮酸进入三羧酸循环,为哺乳动物细胞大量供能,是能量代谢的主要参与者。氨基酸是合成蛋白质的基本单元。蛋白质则是细胞活动的主要承担者,蛋白质既构成细胞骨架结构、病毒外壳,也是大多数酶的化学本质,在各种生物反应中起着催化剂的作用。
7.诸多研究发现,葡萄糖和氨基酸对细胞培养过程有至关重要的影响。2014年,张维
燕发现谷氨酰胺和天冬酰胺均对dhfr-cho细胞生产抗体有促进作用,且天冬酰胺比谷氨酰胺的贡献更大,抗体产量随着谷氨酰胺和天冬酰胺的补加而持续提高,直至两者添加总量达到13.5 mmo1/l时,抗体产量不再显著增加。2006年,y. genzel等发现mdck细胞接流感病毒组的葡萄糖消耗比不接毒组快;生长期和产毒期氨基酸消耗水平不同。2019年,谢盼通过设计接毒维持液时,增强糖酵解及提升多种氨基酸比消耗速率从而将提高单个细胞生产h9n2型流感病毒的产量提高126%。
8.综上所述,葡萄糖和氨基酸对细胞生长和病毒生产起相当重要的作用。目前禽类疫苗行业中,lmh细胞的培养逐渐从贴壁培养向悬浮培养工艺转型,针对悬浮培养生产禽腺病毒还有相当大的提升空间。要进一步提高病毒的产量,需要合理强化产毒期营养,做好细胞增殖与病毒扩增的平衡,同时也能避免培养基中其他组分的浪费,提高疫苗生产的经济性。
技术实现要素:
9.本发明的目的在于提供一种组分种类少、制备方法简单、无需添加血清,且能支持悬浮lmh细胞高密度培养、禽腺病毒高表达的培养基添加剂。
10.本发明的第一方面,提供一种无血清添加剂,所述添加剂由以下成分和水组成,其中,每一升水中包括:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150-350 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-14 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15-22 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
12-28 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9-20 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-5 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
7-16 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-15 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-8 g。
11.在另一优选例中,所述添加剂由以下成分和水组成,其中,每一升水中包括:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150-320 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-14 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15-20 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15-28 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10-20 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-5 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
7-10 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-12 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-8 g。
12.在另一优选例中,所述添加剂由以下成分和水组成,其中,每一升水中包括:d-葡萄糖
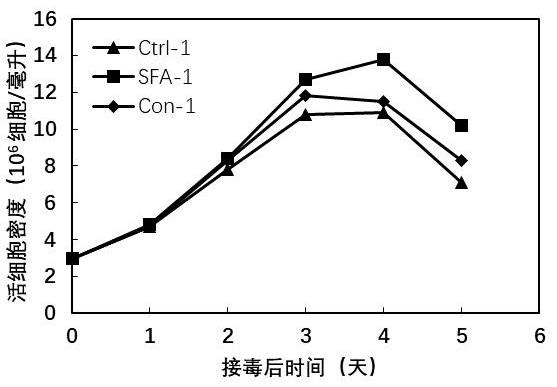
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
160-300 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8-12 g
l-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
16-18 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18-26 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
11-18 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-4 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8-9 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8-10 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5-7 g。
13.在另一优选例中,所述水为超纯水。
14.在另一优选例中,所述水为注射用水。
15.本发明提供的无血清添加剂配制所用水为超纯水或注射用水,采取常规方法配制并除菌过滤。
16.本发明的第二方面,提供第一方面所述的添加剂的制备方法,将以下成分溶于1升水中,除菌过滤后获得所述添加剂:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150-350 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-14 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15-22 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
12-28 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9-20 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-5 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
7-16 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-15 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-8 g。
17.在另一优选例中,将以下成分溶于1升水中,除菌过滤后获得所述添加剂:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150-320 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-14 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15-20 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15-28 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10-20 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-5 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
7-10 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-12 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-8 g。
18.在另一优选例中,将以下成分溶于1升水中,除菌过滤后获得所述添加剂:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
160-300 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8-12 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
16-18 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18-26 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
11-18 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-4 g
2生产8型禽腺病毒的细胞活率。
39.图5显示了lmh细胞在商业培养基lmh-sus iii中未添加(ctrl-3)或添加sfa-3生产11型禽腺病毒的活细胞密度。
40.图6显示了lmh细胞在商业培养基lmh-sus iii中未添加(ctrl-3)或添加sfa-3生产11型禽腺病毒的细胞活率。
具体实施方式
41.本技术的发明人经过广泛而深入地研究,研发出一种无血清添加剂,在禽腺病毒接毒时加入培养基中,能提高接毒后细胞密度,并提升禽腺病毒的产量。在此基础上,完成了本发明。
42.无血清添加剂无血清添加剂由以下成分和水组成,其中,每一升水中包括:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
150-350 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-14 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
15-22 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
12-28 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9-20 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2-5 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
7-16 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6-15 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4-8 g。
43.在体外悬浮培养lmh细胞、生产禽腺病毒过程中,每升培养液中添加10 ml无血清添加剂。
44.如本文所用,生产禽腺病毒疫苗的方法包括步骤:(1) 准备无血清培养基;(2) 悬浮细胞的复苏;(3) 悬浮细胞传代培养及种子细胞扩增;(4) 接种禽腺病毒种毒液及加入添加剂;(5) 毒液收获。
45.如本文所用,属于“产毒期”与“病毒生产期”意义相同,指种子细胞接入种毒后的培养时期。
46.如本文所用,术语“滴度”意指tcid
50
滴度或病毒dna浓度。tcid
50
滴度即半数组织培养感染剂量,又称50%组织细胞感染量,是指能在半数细胞培养板孔内引起细胞病变(cytopathic effect, cpe)的病毒量。病毒dna浓度是通过定量pcr方法(qpcr)检测,以病毒dna浓度表征病毒浓度。
47.本发明的添加剂可以通过单独称量各个组分分别溶解于水中,也可以将固体成分按照质量比称量混合并研磨成粉末混合物后溶解于水中。混合均匀得到澄清液体后使用常见的过滤除菌方式获得无菌添加剂。
48.除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意
义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。
49.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件(如sambrook等人,分子克隆:实验室手册(new york: cold spring harbor laboratory press,1989)中所述的条件)或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。
50.实施例1适用于lmh细胞高密度悬浮培养和高效生产4型禽腺病毒的无血清添加剂应用于商业培养基sf501本实施例中,无血清添加剂,包含葡萄糖和氨基酸,所述添加剂在一升水中包括:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
160 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
16 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
11 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6 g。
51.将所述组分充分溶解在超纯水中,采取常规方法配制并除菌过滤。该添加剂记为sfa-1。
52.将所述添加剂按每升培养基添加10 ml的方式加入上海倍谙基生物科技有限公司生产的lmh细胞商业无血清培养基sf501中,制成接毒培养基。
53.取sf501培养基传代的、处于对数期活率大于95%的lmh悬浮细胞,使用接毒培养基按2-3
×
106细胞/毫升接种于荷兰applikonbiotechnology公司生产的3 l生物反应器中,并接入4型禽腺病毒。同时采用不含上述添加剂的sf501培养基作为接毒培养基,其余培养条件相同,作为对照组,记为ctrl-1。
54.不添加本发明无血清添加剂的培养条件下,接毒后最大活细胞密度为10.90
×
106细胞/毫升;活率在第3天降到90%以下,至第5天活率降至65%;病毒滴度为10
9.0 tcid
50
/ml。添加本发明无血清添加剂的培养条件下,接毒后最大活细胞密度为13.8
×
106细胞/毫升,比未添加组提高27%(参见图1);活率在第4天降到90%以下,至第5天活率降至76%,接毒后整个过程比未添加组的活率维持更优(参见图2)。病毒滴度为10
9.5 tcid
50
/ml,提高了216%。
55.对比例1培养条件同实施例1,不同之处在于,每升无血清添加剂中d-葡萄糖含量为100 g,该添加剂记为con-1。
56.结果添加con-1的培养条件下,接毒后最大活细胞密度为11.8
×
106细胞/毫升,比未添加组仅提高8%(参见图1);活率在第3天降到90%以下,至第5天活率降至66%,接毒后对活率维持相比未添加组无显著提升(参见图2)。病毒滴度为10
9.0 tcid
50
/ml,没有变化。
57.实施例2适用于lmh细胞高密度悬浮培养和高效生产8型禽腺病毒的无血清添加剂应用于商业培养基sf501本实施例中,无血清添加剂,包含葡萄糖和氨基酸。所述添加剂在一升水中包括:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
200 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9 gl-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
11 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
8 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
5 g。
58.将所述组分充分溶解在注射用水中,采取常规方法配制并除菌过滤。该添加剂记为sfa-2。
59.将所述添加剂按每升培养基添加10 ml的方式加入上海倍谙基生物科技有限公司生产的lmh细胞商业无血清培养基sf501中,制成接毒培养基。
60.取sf501培养基传代的、处于对数期活率大于95%的lmh悬浮细胞,使用接毒培养基按2-3
×
106细胞/毫升接种于250 ml美国corning公司生产的摇瓶中,并接入8型禽腺病毒。摇瓶置于瑞士kuhner公司生产的摇床上进行培养。同时采用不含上述添加剂的sf501培养基作为接毒培养基,其余培养条件相同,作为对照组,记为ctrl-2。
61.不添加本发明无血清添加剂的培养条件下,接毒后最大活细胞密度为8.90
×
106细胞/毫升;活率在第3天降到90%以下,至第5天活率降至30%;病毒滴度为3.68
×
10
11
copies/ml。添加本发明无血清添加剂的培养条件下,接毒后最大活细胞密度为13.0
×
106细胞/毫升,比未添加组提高46%(参见图3);活率在第4天降到90%以下,至第5天活率降至50%,接毒后整个过程比未添加组的活率维持更优(参见图4)。病毒滴度为2.40
×
10
12
copies/ml,提高了552%。
62.对比例2培养条件同实施例2,不同之处在于,无血清添加剂中不含l-谷氨酰胺,该添加剂记为con-2。
63.结果添加con-2的培养条件下,接毒后最大活细胞密度为10.2
×
106细胞/毫升,比未添加组提高15%(参见图3);活率在第3天降到90%以下,至第5天活率降至43%,接毒后对活率维持相比未添加组略有提升(参见图4)。病毒滴度为5.85
×
10
11 copies/ml,仅提升59%。
64.实施例3适用于lmh细胞高密度悬浮培养和高效生产11型禽腺病毒的无血清添加剂应用于商业培养基lmh-sus iii本实施例中,无血清添加剂,包含葡萄糖和氨基酸。所述添加剂在一升水中包括:d-葡萄糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
300 gl-盐酸精氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
12 g
l-谷氨酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
17 gl-盐酸半胱氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
26 gl-天冬酰胺
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
18 gl-亮氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4 gl-苏氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
9 gl-甲硫氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
10 gl-色氨酸
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
7 g。
65.将所述组分充分溶解在超纯水中,采取常规方法配制并除菌过滤该添加剂记为sfa-3。
66.将所述添加剂按每升培养基添加10 ml的方式加入苏州沃美生物有限公司生产的lmh细胞商业无血清培养基lmh-sus iii中,制成接毒培养基。
67.取lmh-sus iii培养基传代的、处于对数期活率大于95%的lmh悬浮细胞,使用接毒培养基按2-3
×
106细胞/毫升接种于荷兰applikonbiotechnology公司生产的1 l生物反应器中,并接入11型禽腺病毒。同时采用不含上述添加剂的lmh-sus iii培养基作为接毒培养基,其余培养条件相同,作为对照组,记为ctrl-3。
68.不添加本发明无血清添加剂的培养条件下,接毒后最大活细胞密度为9.64
×
106细胞/毫升;活率在第3天降到90%以下,至第5天活率降至62%;病毒滴度为3.25
×
10
12.
copies/ml。添加本发明无血清添加剂的培养条件下,接毒后最大活细胞密度为11.3
×
106细胞/毫升,比未添加组提高17%(参见图5);活率在第4天降到90%以下,至第5天活率降至83%,接毒后整个过程比未添加组的活率维持更优(参见图6)。病毒滴度为8.31
×
10
12.
copies/ml,提高了156%。
69.在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1