培养单元、培养组件、芯片以及类器官共培养模型及其构建方法和构建装置以及应用与流程
1.本发明涉及生物工程领域,更具体地说,涉及一种芯片、类器官模型及其构建方法和构建装置以及该类器官模型的应用。
背景技术:
2.类器官(organoid)是指一种体外细胞培养模型,与体内来源组织或器官高度相似,与体内器官拥有高度相似的组织学特征,能够重现其生理功能并具有稳定的表型和遗传学特征,因而在培养个性化器官或组织、肿瘤个性化研究、药物筛选等方面有广阔的应用。
3.目前随着生物医学的发展,已经提出类器官共培养的需求。业内已经提出了用于多个或多种类器官共培养的解决方案。然而,传统的类器官共培养的解决方案专注于多种类器官的单独或共同培养,而有意或无意地忽视了类器官共培养场景中不同细胞在共培养场景下的个性化要求。
技术实现要素:
4.有鉴于此,本发明提出了关注不同细胞在类器官共培养场景下个性化需求的培养方案。
5.根据本发明的一个方面,提出了类器官共培养的培养单元,该培养单元包括:单元本体和形成于该单元本体的一个培养腔,该培养腔包括如下技术特征:第一储液孔和第一种植孔,该第一种植孔位于所述第一储液孔下方且与该第一储液孔相通;第二储液孔和第二种植孔,该第二种植孔位于所述第二储液孔下方且与该第二储液孔相通;和共培养连通区,该共培养连通区在所述培养腔内且位于所述第一储液孔和第二储液孔的上方,所述第一种植孔和所述第二种植孔具有不同的容积。
6.根据本发明的另一方面,还提供了一种类器官共培养的培养组件,该培养组件包括相邻布置的两个或两个以上的培养单元,其中,该培养单元为本发明所提供的培养单元,每个培养单元均具有相同的几何参数,相邻的培养单元的共培养连通区为相通的或不相通的。
7.根据本发明的又一方面,还提供了一种类器官共培养的芯片,该芯片包括芯片本体和在所述芯片本体上形成的多个培养组件,其中,该培养组件为本发明所提供的培养组件。
8.根据本发明的还一方面,提供了一种类器官共培养模型的构建方法,该构建方法包括:将第一细胞悬液种植于上述培养单元的第一种植孔中,固胶后,在第一储液孔中注入第一培养基;将第二细胞悬液种植于该培养单元的第二种植孔中,固胶后,在第二储液孔中注入第二培养基;其中,所述第一细胞和第二细胞为相同或不同的细胞且其中至少一者为类器官细胞,其中,所述第一种植孔和所述第二种植孔具有不同的容积,从而为不同细胞总
量的所述第一细胞和第二细胞提供不同的接种空间。
9.此外,本发明提供了一种类器官共培养模型,该类器官共培养模型由上述构建方法构建而成。
10.本发明还提供了一种类器官共培养模型的构建装置,该构建装置为实施上述构建方法的自动化装置或半自动化装置。
11.本发明还提供了一种类器官共培养模型的应用,该应用为上述类器官共培养模型在对外部刺激的响应测试中的应用,所述外部刺激包括病毒、细菌、化学药物、细胞药物、电刺激、磁刺激、各种辐射和基因编辑处理中的至少一种。
12.在传统的类器官共培养场景中,不同的细胞分别种植于各自的圆孔中(单一直径的圆孔或变直径的阶梯孔),而这些不同的圆孔形状和几何参数都是一致的。在本发明的技术方案中,打破了传统上将不同的细胞种植于相同的种植孔的方式,而是能够给不同的细胞提供不同结构特征的种植孔,从而满足其不同的培养特性的需求,以有利于实现类器官共培养的实现。本技术的技术方案中,既能满足不同细胞的共培养,又能使其在培养和检测阶段相对独立,能够精准控制条件变量。同时,由于具有标准化和高通量的特点,因此本技术所提供的芯片能够满足高通量的类器官应用场景,例如药物筛选。
13.本发明的其它特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
14.构成本发明的一部分的附图用来提供对本发明的进一步理解,本发明的示意性实施方式及其说明用于解释本发明。在附图中:
15.图1为本发明一种优选实施方式的类器官共培养的培养单元的结构示意图;
16.图2为图1的俯视图;
17.图3至图5分别为图2的a-a向的剖视图;
18.图6为本发明一种优选实施方式的类器官共培养的培养组件的剖面结构示意图;
19.图7为本发明优选实施方式的类器官共培养的培养组件的另一剖面结构示意图;
20.图8为本发明优选实施方式的类器官共培养的培养组件的俯视图;
21.图9为图8的b-b向剖视图;
22.图10为图8的c-c向剖视图;
23.图11为本发明一种优选实施方式的类器官共培养芯片的结构示意图;
24.图12为肿瘤相关成纤细胞的3d生长图;
25.图13为结肠癌类器官与基质胶混合后种植形成典型的3d类器官形态图;
26.图14为共培养模型类器官和单独培养组类器官的发光强度图;
27.图15为肿瘤类器官免疫荧光图;
28.图16为肿瘤相关成纤维细胞免疫荧光图;
29.图17为对芯片构建的类器官与纤维细胞共培养模型中的纤维细胞的功能因子hgf水平图;
30.图18为单独培养组类器官的生长形态图;
31.图19为共培养模型类器官的生长形态图;
32.图20为共培养模型和单独培养中上皮细胞-间质细胞转化图;
33.图21为芯片平台的药敏检测质量图;
34.图22为药敏实验测试曲线图;
35.图23为共培养模型和单独培养的药敏测试结果图;
36.图24为单独培养的类器官形态图;
37.图25为共培养的类器官形态图;
38.图26a为肝类器官串联共培养形态图;
39.图26b为肠类器官串联共培养形态图;
40.图26c为纤维细胞串联共培养形态图;
41.图27a为肝类器官单培养形态图;
42.图27b为肠类器官单培养形态图;
43.图27c为纤维细胞单培养形态图;
44.图28为肝-肠-纤维细胞串口共培养细胞活力值图;
45.图29a为5000细胞/10μl培养体积接种在容积不同的芯片形态图;
46.图29b为10000细胞/20μl培养体积接种在容积不同的芯片形态图;
47.图30a为5000细胞/10μl培养体积接种在容积相同的芯片形态图;
48.图30b为10000细胞/10μl培养体积接种在容积相同的芯片形态图;
49.图31为图29a和图29b的增殖倍数图;
50.图32为图30a和图30b的增殖倍数图
51.图33为图29a、图29b、图30a和图30b的功能因子hgf水平图;
52.图34为种植孔容积不同芯片和种植孔容积相同芯片的类器官-纤维细胞培养药筛数据图。
具体实施方式
53.下面将参考附图并结合实施方式来详细说明本发明的技术方案。
54.一、类器官共培养单元
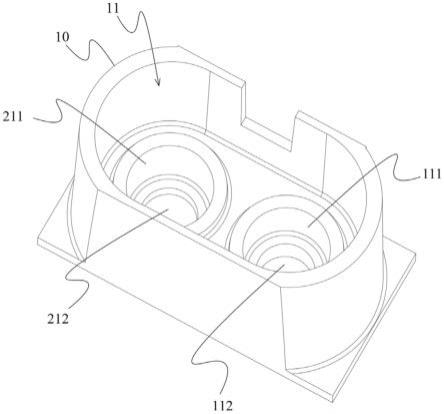
55.如图1-5所示,根据本发明的类器官共培养的培养单元包括:单元本体10和形成于该单元本体10的一个培养腔11,该培养腔11包括:第一储液孔111和第一种植孔112,该第一种植孔112位于所述第一储液孔111下方且与该第一储液孔111相通;第二储液孔211和第二种植孔212,该第二种植孔212位于所述第二储液孔211下方且与该第二储液孔211相通;和共培养连通区113,该共培养连通区113在所述培养腔11内且位于所述第一储液孔111和第二储液孔211的上方;其中,所述第一种植孔112和所述第二种植孔212具有不同的容积。
56.单元本体10可以为一体制成(如注塑),或多个部件组合而成(例如多层结构依次叠加粘接而成)。培养腔11内的种植孔用于类器官培养场景中细胞的种植培养,虽然在本技术中的示例性实施方式中图示有两个种植孔,但可以理解的是本技术并不限于此,还可以有三个或更多个种植孔。每个种植孔上方设置有相通的储液孔,用于存放培养基液体,从而为该储液孔下方对应的种植孔的细胞培养提供良好的营养环境。
57.在传统的类器官培养芯片中,种植孔的结构特征大都是一致的,结构一致性较高的种植孔在应对相同细胞的培养时是具有优势的,然而由于类器官共培养涉及不同细胞的培养,由于不同的细胞具有各自不同的培养特性(如细胞密度不同,细胞数量不同等),结构
特征一致的种植孔在面对培养特性不同的不同细胞的培养场景,无法满足不同细胞的个性化培养需求。举例来说,选择类器官与纤维细胞的共培养模型中,类器官与纤维细胞的共培养比例1:1-1:5之间不等,2种不同细胞数量需求的细胞,种植同样体积标准的种植孔,在满足相同的种植体积的同时,细胞密度将受到严重的干扰,导致细胞密度过高或过低,有潜在风险影响细胞生长。
58.而在本技术的技术方案中,不同的种植孔的容积设计为不同的,从而能够面对培养特性不同的不同细胞的培养场景,满足不同细胞的个性化培养需求。举例来说,在类器官与纤维细胞共培养模型中,类器官与纤维细胞共培养比例为1:3时,可以在保证相同的最合适的细胞密度的同时,通过调节接种体积比例为1:3,从而调整细胞总数比例。需要说明的是,本技术的技术方案虽然要求保护的是种植孔容积的差异化设计,但可以理解的是,在3个或更多个种植孔的情形中,并非要求每个种植孔均与其他种植孔的容积不同,只要存在任意两个之间容积的差别即可,其余种植孔的容积也可以设计为相同的。这些技术方案的变形方式均落入本技术的保护范围之内。
59.不同种植孔的容积差异性可通过多种方式来实现。例如,该不同的容积可以是孔的直径不同但深度相同,或孔的直径相同但深度不相同,或其他可以导致孔的容积不同的孔的几何参数;如,所述第一种植孔112的深度h1和第二种植孔212的深度h2不相等,如图4所示。此外,种植孔的横截面轮廓形状可以有多种形式,如规则平面图形或不规则平面图形。优选情况下,所述第一种植孔112和第二种植孔212具有相同的横截面轮廓形状,该横截面轮廓形状为圆形、椭圆形或多边形,该多边形包括:三角形、四边形、五边形或六边形等,具体可以是等边三角形、正方形、长方形、矩形、平行四边形、正五边形或正六边形等。根据本领域技术人员的理解,该横截面轮廓形状也可以不同,比如第一种植孔的横截面形状为圆形,第二种植孔的横截面形状为正方形。
60.根据本发明的一种优选实施方式,所述第一种植孔112和第二种植孔212均为径向尺寸相同的圆形盲孔。根据本领域技术人员的理解,该圆形盲孔的径向尺寸也可以不相同。需要说明的是,在图中(如图3-5中)所示种植孔不是盲孔,可以增加透明的底板加以覆盖,从而形成盲孔结构,该底板(未图示)可以分别设置于每个种植孔的底部,或者该底板为一块整板,而一体地布置于培养单元(以及下文中描述的培养组件、芯片)的底部。通过将该底板设计为透明的,从而能够在底部对种植孔内的细胞培育情况进行观察,进而获得分析信息。
61.除了种植孔设计为不同的容积之外,在优选情况下,各个储液孔也可以设计为具有不同的容积,例如所述第一储液孔111和第二储液孔211可以具有不同的容积。该不同的容积可以通过多种方式来实现,例如孔的直径不同但深度相同,或孔的直径相同但深度不相同,或其他可以导致孔的容积不同的几何参数;如,所述第一储液孔111的深度h1与第二储液孔211的深度h2不相等,具体如图4所示。
62.储液孔的横截面形状可以有多种选择,可以彼此相同或不相同。优选情况下,所述第一储液孔111和第二储液孔211具有相同的横截面轮廓形状,该横截面轮廓形状为圆形、椭圆形或多边形,该多边形包括:三角形、四边形、五边形或六边形等,具体可以是等边三角形、正方形、长方形、矩形、平行四边形、正五边形或正六边形等。根据本领域技术人员的理解,该横截面轮廓形状也可以不同,比如第一种植孔的横截面形状为圆形,第二种植孔的横
截面形状为正方形。优选情况下,所述第一储液孔111和第二储液孔211均为径向尺寸相同的圆形孔。
63.通过设计控制各个储液孔的结构特征和几何参数,能使不同的储液孔之间具有相同或不同的容积,从而与各自对应的种植孔具有容积的匹配关系,以适用于各自种植孔内不同或相同细胞的培养。技术优势在于如下两个方面:1、一个种植孔里面接种a细胞的时候,可以先用a细胞培养基进行培养稳定,同时另个一种植孔里面接种b细胞的时候,可以先用b细胞培养基进行培养稳定,待两种细胞都稳定之后,增加培养基体积到共培养连通区,则实现两种细胞的共培养,分别稳定对细胞生长更好,可调控性很强;2、检测的时候,检测a细胞的时候将检测液加到a细胞的储液孔中,检测b细胞的时候将检测液加到b细胞的储液孔中,可以实现每种细胞的单独检测。
64.根据不同的应用工况,相关的结构特征包括:所述第一储液孔111的容积为所述第一种植孔112的容积的2-4倍,优选为2-3倍;和/或所述第二储液孔211的容积为所述第二种植孔212的容积的2-6倍,优选为3-5倍;和/或所述第一储液孔111的容积为20-40立方毫米,优选为25-30立方毫米,最优选为26-28立方毫米,所述第一种植孔112的容积为3-9立方毫米,优选为4-9立方毫米;和/或所述第二储液孔211的容积为25-40立方毫米,优选为30-38立方毫米,最优选为32-35立方毫米,所述第二种植孔212的容积为10-20立方毫米,优先为12-18立方毫米,最优选为13-15立方毫米;和/或所述第一储液孔111的直径为3-6毫米,优选为3.5-5.5毫米,再优选为4-5毫米,所述第一种植孔112的直径为1.5-3.5毫米,优选为2-3毫米;和/或所述第二储液孔211的直径为3-6毫米,优选为3.5-5.5毫米,再优选为4-5毫米,所述第二种植孔212的直径为1.5-3.5毫米,优选为2-3毫米;所述第一储液孔111的深度h1为2-5毫米,优选为3-4毫米,所述第一种植孔112的深度h1为0.5-3毫米,优选为1-2毫米;和/或所述第二储液孔211的深度h2为2-8毫米,优选为3-6毫米,再优选为4-5毫米,所述第二种植孔212的深度h2为0.2-1.5毫米,优选为0.5-1.2毫米,再优选为0.8-1毫米。
65.优选情况下,如图3-5所示,所述第一种植孔112的径向尺寸小于所述第一储液孔111的径向尺寸,从而在所述第一种植孔112与所述第一储液孔111之间形成有第一台阶部31;和/或所述第二种植孔212的径向尺寸小于所述第二储液孔211的径向尺寸,从而在所述第二种植孔212与所述第二储液孔211之间形成有第二台阶部32。但本技术并不限于此,种植孔与其对应的储液孔也可以为径向尺寸相同的圆孔。
66.通过设计储液孔与种植孔之间的台阶部,因此在将储液孔中储存的培养基液体移走时,能将培养基液体移除干净而不会存有残留,这样在后续应用中(例如药物筛选),不会由于残留培养基液体产生负面影响。
67.如图3-5所示,培养腔11内位于多个储液孔的上方为共培养连通区113。该共培养连通区113具有底表面114,所述第一储液孔111和所述第二储液孔211的开口均开设于所述底表面114。因此,该底表面114相对于各个储液孔形成为台阶部,从而给培养基液体的布置方式提供多种可能性。例如,可以在第一种植孔种植第一种细胞,并在第一储液孔注入第一培养基,同时在第二种植孔种植第二种细胞,并在第二储液孔注入第二培养基(可以与第一培养基相同或不相同),此时可以进行分别不同的细胞进行单独培养;如果第一培养基和/或第二培养基从储液孔溢出,从而使得液面高于底表面114,则可以同时存在于各个储液孔中,此时可以对不同种植孔内的细胞进行共培养。
68.优选的情况下,所述第一储液孔111和所述第二储液孔211的开口均与所述底表面114齐平布置。作为另一种优选的实施方式,围绕所述第一储液孔111的开口突出地设置有第一周缘部115,围绕所述第二储液孔211的开口突出地设置有第二周缘部215,所述第一周缘部115与所述第二周缘部215的高度为相同的。根据实际需要,第一周缘部和第二周缘部的高度也可以是不相同的。通过设置上述周缘部,能够实现如下技术效果或技术优势:通过设置凸出的周缘部,可以使得第一储液孔和第二储液孔形成相对独立的单元,避免储液孔之间、储液孔与共培养连通区发生应液体张力引起的非实验设计的液体串流,保证条件的可控性;同时独立周缘部的设计也便于使用人员孔位区别和精准操作,提高精准操作的简便性。该设计可以满足共培养模型构建过程中,不同共培养成分之间的独立性,例如前期预培养阶段的独立培养需求,后期的样品精准的独立检测或收取。
69.此外,在本发明的优选实施方式中,所述培养腔11的共培养连通区113在所述第一周缘部115和第二周缘部215的外侧形成有内储液区116,如图3所示。在单独培养的情形中,可以在内储液区116预先布置合适的液体,从而补偿储液孔内培养基液体的蒸发。通常情况下,内储液区116非用于种植;但在某些情况下,也可以作为细胞的种植区域。此外,优选情况下,如图11所示,在芯片中培养单元或培养组件的外侧间隙设置有外储液区(防挥发槽),主要作用是在培养时加入无菌水,防止边缘培养单元或培养组件内液体的挥发,保证整个培养板中培养单元的一致性。
70.如上所述,虽然本发明的图示中仅图示有两个种植孔及其对应的储液孔,但本发明并不限于此,优选情况下,在具备两套储液孔和种植孔的基础上,还可以增加一套或一套以上的储液孔和种植孔,以在一个培养单元中对更多种的类器官细胞或组织进行统一条件的培养。具体来说,所述培养腔11还可包括:至少一个第三储液孔和至少一个第三种植孔,每个第三种植孔位于各自对应的第三储液孔下方且与各自的第三储液孔相通,其中,所述第三种植孔的容积与所述第一种植孔112的容积或所述第二种植孔212的容积相同或均不相同。
71.通过设计一个或更多个种植孔及其对应的储液孔,能够实现更多种不同细胞的单独培养和共培养,从而较大程度上提高了细胞培养的灵活性,以适应于类器官共培养众多不同工况场景的需求。
72.二、类器官共培养的培养组件
73.如图5-10所示,本发明还提供了一种类器官共培养的培养组件,该培养组件包括相邻布置的两个或两个以上的培养单元,其中,该培养单元为本发明所提供的上述培养单元,每个培养单元均具有相同的几何参数,相邻的培养单元的共培养连通区113为相通或不相通的,优选情况下,所述培养单元为三个,每个培养单元中具有两个种植孔。
74.在相邻的培养单元的共培养连通区113为不相通的实施方式中,相当于多个培养单元并行布置的方式,在使用时作为多个培养单元的简单组合。
75.而作为本发明优选方式,在相邻的培养单元的共培养连通区113为相通的实施方式中,由于除了单个培养单元内的共培养之外,还能够利用相通的共培养连通区113来实现不同培养单元之间的共培养,从而实现类器官共培养的更大的灵活性。
76.如图6-10所示,在本发明所提供的培养组件中,相邻的培养单元之间设置有隔壁12,该隔壁12贯穿设置有连通相邻的培养单元的共培养连通区113的贯通孔121,从而实现
共培养连通区的相通关系。贯通孔121可以具有多种结构形式,例如可以是隔壁12内形成的通孔,或者作为一种优选方式如图5和图7所示,所述贯通孔121形成为位于所述隔壁12的顶表面122的缺口槽123。如图5所示,所述缺口槽123的最低处高于所述第一储液孔111的开口和第二储液孔211的开口,高度差x为1-4毫米,优选为2-3毫米。因此,当相邻的培养单元内的培养基通过缺口槽123的底部而相互流动时,可以实现相邻培养单元之间的细胞共培养关系。这可以通过至少两种方式来实现。一种是静态培养:在静态培养方式中,培养组件保持静止不动,使培养组件中相邻的培养单元内的培养基液面高于贯通孔121的底边缘;另一种是动态培养:在动态培养方式中,培养组件可以进行摆动或旋转动作,从而使培养基液体在不同的培养单元之间通过上述贯通孔121来回流动。
77.因此,贯通孔121可以设计为如图所示的保持贯通的状态,从而允许培养组件不同的培养单元之间实现不同细胞的共培养,也允许单个培养单元内部不同细胞之间的共培养。此外,根据其他优选的实施方式,贯通孔可以设计为可选择打开或关闭的,例如通过可手动控制或自动控制的阀装置等。
78.三、类器官共培养芯片
79.如图11所示,本发明还提供了一种类器官共培养的芯片,该芯片包括芯片本体100和在所述芯片本体100上形成的多个培养组件,其中,该培养组件为本发明所提供的上述培养组件。
80.在培养组件的共培养连通区域为相通的方式中,每个培养组件中相邻的培养单元的通流方向为一致的,可以通过摇床对芯片进行摇摆旋转的方式来实现培养基液体在一个培养组件内相邻培养单元之间的往复流动,如图11中箭头所示。例如,以图11为例,当芯片右侧低于左侧时,培养基液体将从左向右流动;而当芯片左侧低于右侧时,培养基液体从右向左流动。本发明并不限于此,也可以实现上述静态培养的方式。这种通过摇摆操作的方式,既可以实现培养组件内多个培养单元之间的共培养,也可以用于实现一个培养单元内不同种植孔之间的共培养。此外,对于说明书附图所示的芯片来说,摇摆操作的中心旋转轴线可以与矩形形状的芯片的宽度方向一致,或者与长度方向一致,这可以根据具体的应用场景来加以选择。
81.上述芯片可以通过多种方式制造获得。例如,可以通过一体注塑制备获得,或者通过机械加工去除材料的方式制备获得,或者还可以通过多个层状部件彼此叠加结合制成。
82.该芯片既适用于上述静态培养,也适用于动态培养,可根据所需的工况场景而加以选择。此外,每个培养单元中的每个种植孔可分别独立地进行各自的细胞培养,也可以实现细胞共培养;每个培养组件中可以实现多个培养单元之间的细胞共培养;在芯片的多个培养组件之间,可以实现多个培养组件之间的并行培养,既可以并行培养相同的类器官共培养模型,也可以并行培养不同的类器官共培养模型。
83.四、类器官共培养模型的构建方法
84.本技术的技术方案中,类器官可以包括由人源或如鼠源的其他动物源的正常组织细胞和/或肿瘤细胞培养而成的类器官。所述类器官包括:结肠癌类器官、肺癌类器官、胃癌类器官、乳腺癌类器官、肝癌类器官、卵巢癌类器官、宫颈癌类器官、脑癌类器官、皮肤癌类器官、前列腺癌类器官、肾癌类器官、膀胱癌类器官、头颈部癌类器官、黑色素瘤类器官、食管癌类器官、甲状腺癌类器官、胰腺癌类器官等。本技术的技术方案尤其适用于类器官共培
养的场景中。
85.本发明还提供了一种类器官共培养模型的构建方法,该构建方法包括:将第一细胞悬液种植于上述培养单元的第一种植孔112中,固胶后,在第一储液孔111中注入第一培养基;将第二细胞悬液种植于该培养单元的第二种植孔212中,固胶后,在第二储液孔211中注入第二培养基;其中,所述第一细胞和第二细胞为相同或不同的细胞且其中至少一者为类器官细胞,其中,所述第一种植孔112和所述第二种植孔212具有不同的容积,从而为不同细胞总量的所述第一细胞和第二细胞提供不同的接种空间,换句话说利用容积不同的第一种植孔和第二种植孔可以接种不同的细胞总量。
86.上述第一或第二细胞悬液的制备可以采用传统方式。例如,为了制备单细胞悬液或细胞簇悬液,可以解离此前已经制得的类器官-基质胶混合物(如解离基质胶包埋的类器官或类器官-基质圆顶(dome)),收集类器官后使用消化液(如0.25vt%的胰酶)进行消化处理,经过离心处理后获得单细胞和/或细胞簇沉淀,再利用清洗液重悬沉淀,离心处理后使用完全培养基重悬,以制得所述单细胞悬液或细胞簇悬液。根据另一种实施方式,也可以利用新鲜的组织标本,用清洗液冲洗,经过机械剪碎、消化处理,离心重悬后制得单细胞悬液或细胞簇悬液。在制得单细胞悬液或细胞簇悬液后,对单细胞悬液或细胞簇悬液进行活细胞计数,其中,密度为(0.2-5.0)
×
106cell/ml,优选为5.0
×
106cell/ml。优选情况下,所述第一细胞悬液的细胞浓度为100-500个细胞每微升。所述第二细胞悬液的细胞浓度为200-500个细胞每微升。
87.在一种实施方式中,可以作为第一细胞悬液和第二细胞悬液的单细胞悬液(或细胞簇悬液)分别注入到上述第一种植孔和第二种植孔中。
88.作为另一种实施方式,可以将(如解冻后的)基质胶按照预定的比例(如体积比为(2-3)/(2-6),例如体积比可以为3/2或2.4/5.6)与单细胞悬液或细胞簇悬液进行混合,制得混合悬液(单细胞悬液和基质胶的混合悬液,或者细胞簇悬液和基质胶的混合悬液),其中,基质胶的终使用浓度为3-6mg/ml,优选为5mg/ml。然后,再将作为第一细胞悬液和第二细胞悬液的上述混合悬液分别注入上述第一种植孔和第二种植孔中。
89.种植于所述第一种植孔中的第一细胞悬液的使用量为10-60微升每孔,优选为20-50微升,再优选为25-45微升每孔。种植于所述第二种植孔中的第二细胞悬液的使用量为5-50微升每孔,优选为8-20微升每孔,最优选为10-15微升每孔。
90.如上所述,容积不同的第一种植孔和第二种植孔分别用于容纳不同细胞总量的细胞悬液。例如,如下表所示。因此,根据不同的应用场景的需求,通过利用容积不同的种植孔,可以分别种植细胞总量不同的细胞悬液,从而为不同细胞培养对细胞总量、细胞密度等参数的个性化需求提供解决方案。
91.细胞悬液体积(微升)细胞总量(个)101000-5000202000-10000303000-15000505000-25000
92.根据本技术的优选实施方式,当培养单元设置至少一个第三种植孔和第三储液孔时,构建方法还包括:将第三细胞悬液种植于上述培养单元的至少一个第三种植孔中。
93.完成接种后,将培养单元或培养组件或芯片置于合适温度条件下培养以进行固胶。所述合适的温度条件是指36摄氏度至37.5摄氏度,优选为36.5摄氏度至37摄氏度,最优选为37摄氏度。
94.在完成固胶后,在第一储液孔111中注入第一培养基;在第二储液孔211中注入第二培养基,以进行类器官的单独培养或共培养。
95.在单独培养的场景下,第一培养基与第二培养基彼此独立,从而实现第一细胞和第二细胞的分别独立培养。
96.在共培养的场景下,所述第一培养基与第二培养基为相同的培养基,且为液体相通的,从而同一种培养基的液面高度超过储液孔而同时分布于不同的储液孔中,以实现对第一细胞和第二细胞的共培养;或者在加入第一培养基之前,先清除所述第二培养基,然后将第一培养基同时用于第一细胞和第二细胞的培养。
97.也可以在从单独培养过度为共培养。例如,可以在加入第二培养基之前,先清除所述第一培养基,然后将第二培养基同时注入第一储液孔和第二储液孔且液面高度高于储液孔,从而同时用于第一细胞和第二细胞的培养(这里所谓的“第一”和“第二”为相对概念,反之亦然);或者将所述第一培养基和第二培养基全部清除后,加入不同的第三培养基注入第一储液孔和第二储液孔且液面高度高于储液孔,从而同时用于第一细胞和第二细胞的培养。
98.在共培养的优选实施方式,所述构建方法还包括:在将第一细胞悬液种植于所述培养单元的第一种植孔112中,并将第二细胞悬液种植于该培养单元的第二种植孔212中后,在该培养单元的共培养连通区113或者在第二储液孔211中或者第一储液孔111中种植附加细胞悬液,对附加细胞、第一细胞和/或第二细胞进行共培养。优选情况下,所述附加细胞为免疫细胞,该种免疫细胞包括天然的以及体外改造后的免疫细胞,如组织提取淋巴细胞til、其他免疫细胞如car-t、car-nk、dc等或外周血单个核细胞pbmc。例如,第一种植孔和第二种植孔以细胞-基质胶悬液的方式接种细胞,并固胶,附加细胞可选择立即混入第一种植孔或第二种植孔培养基,加入实验设计需要的种植孔内,此处两种植孔内附加细胞可为相同细胞也可以为不同细胞,可选择的只加一个种植孔或两个种植孔都加附加细胞,附加细胞沉降后再在共培养储液区加入培养基,实时相对精准的附加细胞直接接触共培养或非接触式共培养,同一附加细胞共培养或不同附加细胞共培养;同时可以直接将附加细胞混合在培养基中,直接加在共培养连通区,实现第一种植孔和第二种植孔相同条件下附加细胞的共培养。
99.根据本发明的另一优选实施方式的建方法,该构建方法包括:在上述培养组件的每个培养单元中,将第一细胞悬液种植于第一种植孔112中,固胶后,在第一储液孔111中注入第一培养基;将第二细胞悬液种植于该培养单元的第二种植孔212中,固胶后,在第二储液孔211中注入第二培养基;其中,同一培养单元中的所述第一细胞和第二细胞为相同或不同的细胞且其中至少一种为类器官细胞,不同培养单元的第一细胞和/或第二细胞与另一培养单元的第一细胞和/或第二细胞分别为相同的或不同的,其中,相邻的培养单元的共培养连通区113内的培养基选择为相通的或不相通的。
100.在利用上述培养组件的类器官共培养模型的构建方法中,假设一个培养组件中有n个培养单元(n为大于等于2的自然数),每个培养单元中有m个种植孔(m为大于等于2的自
然数),则该一个培养组件可以最多实现n*m种不同细胞的共培养模型。当然,如上所述,各个种植孔可以分别独立地培养自己的细胞,每个培养单元可以实现内部的共培养,培养单元之间也可以实现共培养方式。因此,利用本技术的技术方案,可以实现众多类器官共培养模型的构建,灵活性非常大。
101.这里虽然没有详细解释利用芯片实现类器官共培养模型的构建方法,但本领域技术人员可以理解的是,在对培养单元和培养组件的构建方法进行了详细地描述之后,可以在芯片上并行地在多个培养组件上进行类器官共培养模型的构建。
102.五、类器官共培养模型及其构建装置
103.本发明还提供了一种类器官共培养模型,该类器官共培养模型由上述构建方法构建而成。如上所述,假设一个培养组件中有n个培养单元(n为大于等于2的自然数),每个培养单元中有m个种植孔(m为大于等于2的自然数),则该一个培养组件可以最多实现n*m种不同细胞的共培养模型。在芯片中矩阵排布设置有多个培养单元或培养组件的情形中,能够实现更多不同细胞共培养的可能性,几乎不受类型数量的限制。
104.优选情况下,该类器官共培养模型包括:两种或两种以上相同种类或不同种类的类器官共培养模型,如肝类器官、肠类器官和胃类器官的共培养模型;类器官与免疫细胞共培养模型;肿瘤类器官与肿瘤相关成纤维细胞cafs共培养模型;类器官、肿瘤类器官与免疫细胞共培养模型。
105.例如,各种共培养的可能性如下表所示。
106.[0107][0108]
此外,本发明还提供了一种类器官共培养模型的构建装置,该构建装置为实施上述构建方法的自动化装置或半自动化装置。
[0109]
本发明可用于研究两种或更多种细胞的非接触式相互作用,如研究细胞非接触式免疫响应,细胞与饲养细胞的非接触式共培养,同时研究肝损伤和药物药效,研究肝代谢药物的体外药效等,同时也可以根据实验需求切换静动态模式、共培养因素数量、共培养方式等因素,可以适应更复杂更多样化的共培养模型构建。
[0110]
六、类器官共培养模型的应用
[0111]
本发明还提供了类器官共培养模型的应用,该应用为所述类器官共培养模型在对外部刺激的响应测试中的应用,该类器官共培养模型为本发明所提供的类器官共培养模型,所述外部刺激包括病毒、细菌、化学药物、细胞药物、电刺激、磁刺激、各种辐射和基因编辑处理中的至少一种。
[0112]
七、实施例
[0113]
实施例1类器官共培养芯片
[0114]
一种类器官共培养的芯片,该芯片包括芯片本体100和在所述芯片本体100上形成的十六个培养组件,所述培养组件中包括三个培养单元,每个培养单元中具有两个种植孔。
[0115]
所述培养单元包括:单元本体10和形成于该单元本体10的一个培养腔11,该培养腔11包括:
[0116]
第一储液孔111和第一种植孔112,该第一种植孔112位于所述第一储液孔111下方且与该第一储液孔111相通;
[0117]
第二储液孔211和第二种植孔212,该第二种植孔212位于所述第二储液孔211下方且与该第二储液孔211相通;和
[0118]
共培养连通区113,该共培养连通区113在所述培养腔11内且位于所述第一储液孔111和第二储液孔211的上方;
[0119]
所述第一种植孔112和第二种植孔212均为径向尺寸相同的圆形盲孔;
[0120]
所述第一储液孔111和第二储液孔211均为径向尺寸相同的圆形孔;
[0121]
所述第一种植孔112的径向尺寸小于所述第一储液孔111的径向尺寸,从而在所述第一种植孔112与所述第一储液孔111之间形成有第一台阶部31;和/或
[0122]
所述第二种植孔212的径向尺寸小于所述第二储液孔211的径向尺寸,从而在所述第二种植孔212与所述第二储液孔211之间形成有第二台阶部32。
[0123]
所述相邻的培养单元之间设置有隔壁12,该隔壁12贯穿设置有连通相邻的培养单元的共培养连通区113的贯通孔121。
[0124]
所述贯通孔121形成为位于所述隔壁12的顶表面122的缺口槽123。
[0125]
实施例2
[0126]
在一种可选的实施例中,提供动态共培养类器官芯片构建肿瘤类器官与肿瘤相关成纤维细胞共培养模型,并进行检测以及药物筛选等应用。
[0127]
基于上述芯片的药筛实验包括以下步骤:
[0128]
(一)、实验仪器及耗材
[0129]
不同规格移液枪、恒温金属浴、离心机、恒温二氧化碳培养箱、细胞计数仪、显微镜、实施例1所述类器官共培养芯片、离心管、细胞计数板等。
[0130]
(二)、实验试剂
[0131]
类器官完全培养基、类器官消化液、清洗液(dmem/f12基础培养基)、基质胶、台盼蓝。
[0132]
(三)、实验流程
[0133]
1.细胞种植
[0134]
(1)基质细胞的消化与计数(以3d种植肿瘤相关成纤维细胞为例)
[0135]
按照常规细胞消化方式消化基质细胞并收集至离心管内,使用台盼蓝法计数活性细胞,并调整细胞悬液至所需原始浓度,之后与基质胶混合,制备成细胞浓度为100-500个/微升。
[0136]
(2)基质细胞的种植
[0137]
将待用基质细胞悬液吹打均匀后,按照10-30微升/孔的使用量种植于第二种植孔。
[0138]
(3)固胶
[0139]
将种植细胞-基质胶悬液的芯片放置在37℃培养箱固胶15-20分钟,加入基质细胞培养基,置于培养箱静置培养。图12所示为肿瘤相关纤维细胞与基质胶混合后种植于第二
种植孔后的形态,其中形成3d生长形态,呈中心向外伸展束状结构。
[0140]
2.中心区域类器官的种植
[0141]
(1)类器官消化制备与种植
[0142]
将准备好的类器官样本消化并制备为基质胶悬液,并以200-500个/μl、30ul/孔的标准种植于类器官种植孔(第一种植孔),随后置于37℃固定10min。如图13所示为结肠癌类器官与基质胶混合后种植于第一种植孔后的形态,其中形成典型的3d类器官形态,呈实性或中空球状结构。
[0143]
(2)加入培养基
[0144]
补充共培养培养基,至共培养连通区。
[0145]
(3)动态培养模式
[0146]
平台稳定12h-24h,即可将芯片放置于动态摇床上进行动态培养,采用横向单孔动态模式,建议频率1cycle/min,角度10
°
。
[0147]
3.加药
[0148]
(1)制备待测药物溶液
[0149]
将培养3天的类器官芯片中的培养基去除干净,加入梯度浓度的待测试药物,并设置阴性对照组与阳性对照组。
[0150]
(2)药物处理
[0151]
将类器官药筛芯片,置于摇床动态培养,药物处理4-6天。
[0152]
4.收集数据
[0153]
(1)拍取形态学照片
[0154]
(2)使用atp检测液裂解类器官并使用酶标仪检测发光值,处理数据得出药物ic50。如图14所示,共培养组与单培养组相比,共培养模型中的类器官atp活性高于单独培养组类器官,表明共培养模型更利于类器官生长。如图18和19所示,从形态学上观察,共培养模型中的细胞生长密度要高于单独培养模型中的细胞,证明共培养模型的类器官与单独培养类器官具有显著的差异性。
[0155]
(四)共培养模型原位成像和表征
[0156]
(1)样本固定
[0157]
移除培养单元培养基,置于摇床用pbs洗涤3遍后,加入4%多聚甲醛(4% pfa),置于4℃冰箱过夜固定。
[0158]
(2)样本穿膜
[0159]
去除4%pfa并使用pbs清洗后,使用穿膜液破膜20分钟。
[0160]
(3)样本封闭
[0161]
去除穿膜液并使用pbs清洗后,使用3%牛血清白蛋白(bsa)孵育样本1-2h。
[0162]
(4)孵育一抗
[0163]
去除封闭液后,加入针对样本的特异性标志物抗体,置于4℃冰箱过夜孵育,如上皮细胞标志物、纤维细胞标志物等,并加入对应培养孔。
[0164]
(5)孵育二抗
[0165]
去除一抗后,pbs清洗3遍,随后室温孵育二抗2小时。
[0166]
(6)样本染核
[0167]
去除二抗并使用pbs清洗后,加入细胞核染料dapi,孵育20-30分钟。
[0168]
(7)样本拍照
[0169]
去除细胞核染料并使用pbs清洗后,加入pbs后即可置于荧光显微镜下拍取原位成像图片。如图15所示为肿瘤类器官免疫荧光图(类器官原位成像),蓝色荧光为细胞核定位染料,绿色荧光为细胞骨架蛋白染料,红色荧光为肿瘤细胞特征蛋白荧光;图16所示为肿瘤相关成纤维细胞免疫荧光图(肿瘤相关成纤维细胞原位成像),蓝色荧光为细胞核定位染料,红色荧光为肿瘤相关成纤维细胞特征蛋白荧光。
[0170]
(五)elisa检测
[0171]
(1)培养基上清样本收取
[0172]
在实验需求时间点收取共培养体系的培养基,如药筛模型的培养的第3天及药物处理后的第5天,收集至少3个复孔,并分成至少2份冻存在-80℃待用。
[0173]
(2)选择caf分泌因子相关的elisa测试盒
[0174]
如caf功能因子:hgf、il6等
[0175]
(3)elisa测试
[0176]
根据测试试剂盒的是要需求设计测试条件,简易流程主要是包被、封闭、加入待测样本、结合一抗、结合酶标二抗、显色、酶标仪读取od值、数据处理等过程。如图17所示,通过elisa检测法比对芯片构建的类器官与纤维细胞共培养模型中的纤维细胞的功能因子hgf(肝细胞生长因子)的表达水平,相较于单独培养组的因子水平,芯片共培养组与空白组相比显著增加,高达10ng/ml,证明该芯片平台的共培养模型是成功的且是可以维持7天以上的培养周期。
[0177]
(六)qpcr表征
[0178]
(1)样本收集
[0179]
根据实验需求使用rna样本收集液分别收集类器官和caf样本,冻存于-80℃待用;
[0180]
(2)制备rna样本
[0181]
根据trizol法或者rna提取试剂盒的方法纯化样本rna,并检测rna样本的质量;
[0182]
(3)制备cdna样本
[0183]
根据实验需求对收集完成的rna样本进行反转录实验制备cdna样品,冻存于-20℃待用;
[0184]
(4)qpcr加样
[0185]
使用已制备好的cdna样本、待测目的基因的qpcr引物、相应的qpcr试剂如sybr试剂配置成相应qpcr混悬液,并通过移液器加至qpcr专用微量反应板;
[0186]
(5)qpcr上机
[0187]
将加好的样品置于qpcr仪器并设置相应反应程序后进行运行;
[0188]
(6)数据分析
[0189]
通过对原始数据的处理,作出实验组与相应对照组的转录水平活性比对结果。如图20所示,肿瘤类器官与肿瘤相关成纤维细胞共培养的模型真实的模拟出肿瘤微环境中上皮细胞-间质细胞转化,上皮细胞标志物e-cadherin(分布在上皮组织中的钙依赖性单次跨膜搪蛋白)显著下降,间质细胞标志物vimentin(波形蛋白)显著上调。共培养模型更加仿生。
[0190]
(七)共培养模型药物筛选
[0191]
a)模型加药
[0192]
肿瘤类器官与成纤维细胞共模型构建完成并继续共培养72h之后,向第一储液层中加满需要筛选的特定种类和浓度的药物(以10μm抗5-fu为例)。再于37℃条件下继续动态培养120h。
[0193]
b)肿瘤药敏结果检测
[0194]
药物刺激120h后,移除带有药物的培养基,在分别向类器官储液池和caf储液池中,加入cell titer glo对3d培养细胞的atp进行评价。本实施案例适用于,但不限于上述表征方法。其他表征试剂或方法也兼容,如celltiter blue、高内涵成像技术对活死细胞的数量进行成像表征。
[0195]
如图21所示,是基于atp检测法对芯片平台的药敏检质量进行评价,相较于传统平台,芯片平台具有15%左右的变异系数(cv),传统平台变异细胞大于20%,证明芯片平台的复孔一致性与稳定性更高,更加标准化,药物筛选的cv值与传统方法比,更低,z factor大于0.8,满足高通量药物筛选的要求。如图22所示为药物筛序结果代表性的曲线展示,基于芯片平台对肿瘤类器官进行了药敏测试,并使用atp法检测,针对5-氟尿嘧啶脱氧核苷酸和奥沙利铂2种药物的联合用药进行评价,出现了典型的药物测试曲线,得出对应的半数杀伤浓度,满足药物检测的标准。如图23所示,针对肿瘤类器官进行了单独培养模型与肿瘤类器官和肿瘤相关纤维细胞共培养模型的药敏测试,在两个平台对肿瘤类器官对药物伊立替康(cpt-11)的药物敏感性进行评价,在得出典型的药物测试曲线与半数杀伤浓度的同时,也可以观察发现共培养模型中肿瘤类器官对药物的敏感性降低,表明纤维细胞对肿瘤细胞的耐药机制有一定的影响,可以更好的评价真实体内肿瘤微环境对药物的敏感程度。同时如图24、25所示,图24为单培养组cpt-11 1μm,图25为共培养组cpt-11 1μm,是在相同药物浓度(伊立替康,1μm)的药物处理条件下单独培养组与共培养组的类器官形态比对,单独培养组类器官的大部分崩解,表现出明显的药物敏感反应而共培养组因肿瘤纤维细胞的存在模拟再现了肿瘤微环境的耐药机制,类器官依旧保持较好的细胞形态,表明共培养模型能够更真实的还原肿瘤微环境。
[0196]
实施例3
[0197]
参考实施例2,按照细胞种植标准流程,设置肝类器官、肠类器官与纤维细胞3种细胞的串联共培养,如图26a、26b、26c并动态联通实现物质高效率置换培养;同时设置3种细胞的单独培养,如图27a、27b、27c,即不串联贯通的情况下进行培养,设置为对照组;共培养5天后,采集形态学图片,并检测细胞活性。
[0198]
如图28,从实验数据中可以得到,串联贯通孔可以实现3种以上细胞的共培养,而无串联贯通孔培养单元仅能实现1-2种细胞的共培养;串联共培养的细胞活性优于单培养组细胞,表明串联共培养模型更利于类器官生长,串联共培养可实现多细胞互作。
[0199]
实施例4
[0200]
1)将纤维细胞按照5000细胞/10μl培养体积,10000细胞/20μl培养体积接种在容积不同的芯片;
[0201]
2)将纤维细胞按照5000细胞/10μl培养体积,10000细胞/10μl培养体积接种在容积相同的芯片;
[0202]
3)检测第1天、第3天、第5天纤维细胞的活性并比对分析增殖速率;收取第5天培养基上清检测hgf蛋白丰度。
[0203]
通过实验对比,如图29a为纤维细胞按照5000细胞/10μl培养体积接种在容积不同的芯片的类器官形态图,如图29b为10000细胞/20μl培养体积接种在容积不同的芯片的类器官形态图,如图30a为按照5000细胞/10μl培养体积在容积相同的芯片的类器官形态图,如图30b为按照10000细胞/10μl培养体积接种在容积相同的芯片的类器官形态图,可以得到,1)容积不同的芯片在保证细胞密度一致性的前提下可以适应更多的细胞接种数量;2)容积不同的芯片针对高密度接种细胞可以保证更好的增殖活性,如图31,32所示;3)容积不同的芯片针对高密度接种的细胞可以分泌更多的功能因子(hgf),如下表所示,从而保证共培养体系高效的细胞互作(如图33所示)。
[0204][0205]
实施例5
[0206]
参考实施例2,类器官按照标准流程种植,将纤维细胞按照10000细胞/20μl培养体积接种在容积不同的芯片;按照细胞/10μl培养体积接种在容积相同的芯片;稳定培养后,实现共培养并使用靶向肿瘤相关纤维细胞的药物孵育处理5天后,进行细胞活性检测,评价类器官对药物的敏感性。
[0207]
通过实验对比,可以得到容积不同的芯片中类器官药物响应更加敏感(如图34所示)。
[0208]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0209]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
[0210]
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1