一种ADC样品高DAR值的盐析方法与流程
一种adc样品高dar值的盐析方法
技术领域
1.本发明涉及技术领域,具体为一种adc样品高dar值的盐析方法。
背景技术:
2.抗体偶联药物(adc)是由靶向特异性抗原的抗体与小分子细胞毒性药物通过连接子链接而成,兼具传统小分子化疗的强大杀伤效应及抗体药物的肿瘤靶向性。adc由三个主要部分组成:负责选择性识别癌细胞表面抗原的抗体,负责杀死癌细胞的药物有效载荷,以及连接抗体和有效载荷的连接子。adc的理化性质分析通常包括药物抗体偶联比(dar)和药物分布、分子大小变异体等。药物抗体比(dar)是连接到每个mab的有效载荷部分的平均数量,可通过hic、rp-hplc、hplc-ms等测试方法获得。
3.dar对药物药理学和活性有影响,dar值对adc药物研发后期阶段是必不可少的。adc药物在体内循环过程中被肿瘤细胞摄入数量有限,因此通常较高的dar有利于提高效力。然而adc药物中采用的小分子药物有着较强的疏水性,dar值过高时会引起adc药物聚集,导致在体内循环半衰期减少以及毒副作用提高,这就导致过高的dar不可取。
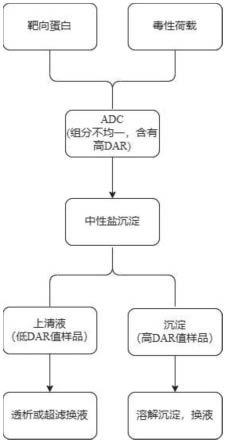
4.常规操作可以通过层析纯化方法对adc样品进行纯化从而去除高偶联荷载的adc成分,如d6和d8。具体操作步骤与制备疏水相互作用色谱相类似。此过程需要配备高价值设备,如纯化分析仪器akta,需要较长的工艺摸索,同时需要对纯化后样品进行ufdf超滤换液体,整体成本非常高。另外,通过调整工艺来实现低dar值样品会导致裸抗比例偏高,影响药物质量。
技术实现要素:
5.本发明的目的在于提供一种adc样品高dar值的盐析方法,以解决上述背景技术中提出的问题。
6.为实现上述目的,本发明提供如下技术方案:一种adc样品高dar值的盐析方法,盐析法应用步骤如下:
7.s1:adc样品制备,前期处理为靶向蛋白、毒性负载制备;
8.s2:中性盐沉淀,采用中性盐沉淀dar样品;
9.s3:hic检测抗体偶联率,采用高效液相色谱仪记录色谱图;
10.s4:sec检测纯度,采用高效液相色谱仪进行纯度检测;
11.s5:结果分析,根据色谱分析dar值,得出应用参数。
12.优选的,基于盐析法应用步骤的s2中:中性盐为硫酸铵或氯化钠。
13.优选的,基于盐析法应用步骤的s1中:
14.adc样品制备步骤如下:取两组10mg单抗置于5ml离心管,加入50mm pbs,ph7.4缓冲液稀释抗体浓度至5mg/ml,按照反应液总体积5%加入100mm edta水溶液,震荡混匀后加入2mg/ml的tcep水溶液进行抗体还原,tcep与抗体的摩尔比2.75∶1,震荡混匀后置于制冷型恒温混匀仪上反应,恒温条件为37℃,2h。
15.优选的,基于盐析法应用步骤的s1中:
16.按照药物与抗体终浓度摩尔比9∶1加入vc-mmae的dma溶液,按照反应液总体积10%补充dma,震荡混匀后置于制冷型恒温混匀仪上反应,恒温条件为4℃,1h,用超滤管置换样品保存buffer,分别计为adc-1、adc-2。
17.优选的,基于盐析法应用步骤的s2中:采用硫酸铵沉淀高dar样品:
18.配制饱和硫酸铵溶液:室温条件下,每100ml 30mm his-hac ph5.5加入76.7g硫酸铵固体配成饱和硫酸铵溶液;
19.在adc样品中逐步加入硫酸铵饱和溶液,发现在20%浓度时adc明显沉淀,接下来,分别取4支adc,为避免局部沉淀,缓慢、搅动加入饱和硫酸铵溶液,配制成含有饱和硫酸铵浓度分别为5%、10%、15%和20%的adc溶液,涡旋振荡混匀,静置10min。
20.优选的,基于盐析法应用步骤的s2中:采用氯化钠沉淀高dar样品:
21.配制饱和氯化钠溶液:室温条件下,每100ml 30mm his-hac ph5.5加入20.0g氯化钠固体配成饱和氯化钠溶液;
22.在adc样品中逐步加入氯化钠饱和溶液,发现在50%浓度时adc明显沉淀。接下来,分别取6支adc,为避免局部沉淀,缓慢、搅动加入饱和氯化钠溶液,配制成含有饱和氯化钠浓度分别为5%、10%、20%、30%、40%、50%的adc溶液,涡旋振荡混匀,静置10min。
23.优选的,基于盐析法应用步骤的s2中:
24.硫酸铵样本与氯化钠样本均通过离心机14000rcf,离心5min,取上清,用0.5ml脱盐柱处理样品,去除氯化钠,样品回收进行检测;离心后沉淀用30mm his-hac ph5.5复溶,样品回收进行检测。
25.优选的,基于盐析法应用步骤的s3中:hic检测抗体偶联率,采用高效液相色谱仪记录色谱图,色谱柱规格为mabpac
tm hic-butyl 5μm 4.6
×
100mm;
26.流动相记为:流动相a(mpa):1.5m(nh4)2s04+50mm磷酸钾盐(ph7.0);流动相b(mpb):50mm磷酸钠盐(ph 7.0)/异丙醇(75:25v/v)。
27.优选的,基于盐析法应用步骤的s3中:
28.洗脱过程如下:0-2min流动相a体积为100%-95%,流动相b体积为0%-5%;2-22min流动相a体积为95%-5%,流动相b体积为5%-95%;22-24min流动相a体积为5%-0%,流动相b体积为95%-100%;24-26min流动相a体积为0%-100%,流动相b体积为100%-0%;26-30min流动相a体积为100%-100%,流动相b体积为0%-0%;
29.检测条件:设置流动相流速为1ml/min,检测波长为280nm,柱温30℃。
30.优选的,基于盐析法应用步骤的s4中:sec检测纯度采用高效液相色谱仪选用规格为1260安捷伦液相色谱仪,色谱柱规格为waters xbridge beh200sec 7.8
×
300mm,3.5μm;
31.流动相:50mm pb+200mm arg(ph 6.80)+10%ipa,按照s3中的洗脱程序进行洗脱,0-30min流动相a体积为100%-100%,取偶联后样品20μl,注入高效液相色谱仪,利用s3中的洗脱程序洗脱,并记录色谱图。
32.与现有技术相比,本发明的有益效果是:本发明采用盐析法,在蛋白质水溶液中加入中性盐,随着盐浓度增大而使蛋白质沉淀出来的现象。中性盐是强电解质,溶解度又大,在蛋白质溶液中,一方面与蛋白质争夺水分子,破坏蛋白质胶体颗粒表面的水膜;另一方面又大量中和蛋白质颗粒上的电荷,从而使水中蛋白质颗粒积聚而沉淀析出。得到的蛋白质
一般不失活,一定条件下又可重新溶解,故这种沉淀蛋白质的方法在分离、浓缩,贮存、纯化蛋白质的工作中应用极广。本发明通过控制中性盐硫酸铵或者氯化钠的比例,利用不同偶联率组分的疏水性不同原理,实现高偶联率组分的去除。其中adc不同组分是疏水性为d8>d6>d4>d2,随着硫酸铵比例的升高,沉淀去除效率d8>d6>d4>d2。对盐浓度的控制实现高dar样品的去除。同时,沉淀中的高dar值样品亦可以通过复溶降低盐浓度后复性。有效节约时间、人工、设备成本。
附图说明
33.图1为本发明的操作流程示意图;
34.图2为本发明的硫酸铵处理样品数据表;
35.图3为本发明的硫酸铵纯化数据表;
36.图4为本发明的硫酸铵与dar趋势图;
37.图5为本发明的氯化钠处理样品数据表;
38.图6为本发明的氯化钠纯化数据表;
39.图7为本发明的氯化钠与dar趋势图;
40.图8为本发明的adc-1的hic、sec曲线图;
41.图9为本发明的adc-2的hic、sec曲线图;
42.图10为本发明的硫酸铵hic、sec抗体偶联率检测、检测纯度检测色谱图;
43.图11为本发明的氯化钠hic抗体偶联率检测色谱图;
44.图12为本发明的氯化钠sec纯度检测色谱图。
具体实施方式
45.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
46.在本发明的描述中,需要说明的是,术语“上”、“下”、“内”、“外”“前端”、“后端”、“两端”、“一端”、“另一端”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性。
47.在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语“安装”、“设置有”、“连接”等,应做广义理解,例如“连接”,可以是固定连接,也可以是可拆卸连接,或一体地连接;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本发明中的具体含义。
48.请参阅图1至图12,本发明提供的两种实施例:一种adc样品高dar值的盐析方法。
49.实施例一:
50.s1:adc样品制备,前期处理为靶向蛋白、毒性负载制备;
51.adc样品制备步骤如下:取10mg单抗置于5ml离心管,加入50mm pbs,ph7.4缓冲液稀释抗体浓度至5mg/ml,按照反应液总体积5%加入100mm edta水溶液,震荡混匀后加入2mg/ml的tcep水溶液进行抗体还原,tcep与抗体的摩尔比2.75∶1,震荡混匀后置于制冷型恒温混匀仪上反应,恒温条件为37℃,2h;
52.按照药物与抗体终浓度摩尔比9∶1加入vc-mmae的dma溶液,按照反应液总体积10%补充dma,震荡混匀后置于制冷型恒温混匀仪上反应,恒温条件为4℃,1h,用超滤管置换样品保存buffer,计为adc-1。
53.s2:中性盐沉淀,采用硫酸铵沉淀dar样品;配制饱和硫酸铵溶液:室温条件下,每100ml 30mm his-hac ph5.5加入76.7g硫酸铵固体配成饱和硫酸铵溶液;
54.在adc样品中逐步加入硫酸铵饱和溶液,发现在20%浓度时adc明显沉淀,接下来,分别取4支adc,为避免局部沉淀,缓慢、搅动加入饱和硫酸铵溶液,配制成含有饱和硫酸铵浓度分别为5%、10%、15%和20%的adc溶液,涡旋振荡混匀,静置10min;
55.离心机14000rcf,离心5min,取上清,用0.5ml脱盐柱处理样品,去除硫酸铵,样品回收进行检测;离心后沉淀用30mm his-hac ph5.5复溶,样品回收进行检测。
56.s3:hic检测抗体偶联率,采用高效液相色谱仪记录色谱图;
57.hic检测抗体偶联率,采用高效液相色谱仪记录色谱图,色谱柱规格为mabpac
tm hic-butyl 5μm 4.6
×
100mm;
58.流动相记为:流动相a(mpa):1.5m(nh4)2so4+50mm磷酸钾盐(ph7.0);流动相b(mpb):50mm磷酸钠盐(ph 7.0)/异丙醇(75∶25v/v);
59.洗脱过程如下:0-2min流动相a体积为100%-95%,流动相b体积为0%-5%;2-22min流动相a体积为95%-5%,流动相b体积为5%-95%;22-24min流动相a体积为5%-0%,流动相b体积为95%-100%;24-26min流动相a体积为0%-100%,流动相b体积为100%-0%;26-30min流动相a体积为100%-100%,流动相b体积为0%-0%;
60.检测条件:设置流动相流速为1ml/min,检测波长为280nm,柱温30℃。
61.s4:sec检测纯度,采用高效液相色谱仪进行纯度检测;
62.sec检测纯度采用高效液相色谱仪选用规格为1260安捷伦液相色谱仪,色谱柱规格为waters xbridge beh200 sec 7.8
×
300mm,3.5μm;
63.流动相:50mm pb+200mm arg(ph 6.80)+10%ipa,按照s3中的洗脱程序进行洗脱,0-30min流动相a体积为100%-100%,取偶联后样品20μl,注入高效液相色谱仪,利用s3中的洗脱程序洗脱,并记录色谱图,参阅附图8和附图10。
64.s5:结果分析,根据色谱图分析dar值可知,随着硫酸铵浓度的升高,上清液部分adc的dar值呈线性下降趋势,与此同时,复溶沉淀部分adc的dar值呈上升趋势,说明adc产品中,高dar值的部分确实被盐析纯化出来了,且adc的sec纯度没有显著改变。所以根据线性数据,我们可以在回收率可接受的范围内,通过特定浓度硫酸铵溶液纯化高dar值adc从而降低其dar值,或者通过特定浓度硫酸铵溶液纯化得到预期dar值的adc产品。
65.实施例二:
66.s1:adc样品制备,前期处理为靶向蛋白、毒性负载制备;
67.adc样品制备步骤如下:取10mg单抗置于5ml离心管,加入50mm pbs,ph7.4缓冲液稀释抗体浓度至5mg/ml,按照反应液总体积5%加入100mm edta水溶液,震荡混匀后加入
2mg/ml的tcep水溶液进行抗体还原,tcep与抗体的摩尔比2.75∶1,震荡混匀后置于制冷型恒温混匀仪上反应,恒温条件为37℃,2h;
68.按照药物与抗体终浓度摩尔比9:1加入vc-mmae的dma溶液,按照反应液总体积10%补充dma,震荡混匀后置于制冷型恒温混匀仪上反应,恒温条件为4℃,1h,用超滤管置换样品保存buffer,计为adc-2。
69.s2:中性盐沉淀,采用氯化钠沉淀高dar样品:
70.配制饱和氯化钠溶液:室温条件下,每100ml 30mm his-hac ph5.5加入20.0g氯化钠固体配成饱和氯化钠溶液;
71.在adc样品中逐步加入氯化钠饱和溶液,发现在50%浓度时adc明显沉淀。接下来,分别取6支adc,为避免局部沉淀,缓慢、搅动加入饱和氯化钠溶液,配制成含有饱和氯化钠浓度分别为5%、10%、20%、30%、40%、50%的adc溶液,涡旋振荡混匀,静置10min;
72.离心机14000rcf,离心5min,取上清,用0.5ml脱盐柱处理样品,去除氯化钠,样品回收进行检测;离心后沉淀用30mm his-hac ph5.5复溶,样品回收进行检测。
73.s3:hic检测抗体偶联率,采用高效液相色谱仪记录色谱图,参阅附图9和附图10;
74.hic检测抗体偶联率,采用高效液相色谱仪记录色谱图,色谱柱规格为mabpac
tm hic-butyl 5μm 4.6
×
100mm;
75.流动相记为:流动相a(mpa):1.5m(nh4)2so4+50mm磷酸钾盐(ph7.0);流动相b(mpb):50mm磷酸钠盐(ph 7.0)/异丙醇(75∶25v/v);
76.洗脱过程如下:0-2min流动相a体积为100%-95%,流动相b体积为0%-5%;2-22min流动相a体积为95%-5%,流动相b体积为5%-95%;22-24min流动相a体积为5%-0%,流动相b体积为95%-100%;24-26min流动相a体积为0%-100%,流动相b体积为100%-0%;26-30min流动相a体积为100%-100%,流动相b体积为0%-0%;
77.检测条件:设置流动相流速为1ml/min,检测波长为280nm,柱温30℃。
78.s4:sec检测纯度,采用高效液相色谱仪进行纯度检测;
79.sec检测纯度采用高效液相色谱仪选用规格为1260安捷伦液相色谱仪,色谱柱规格为waters xbridge beh200 sec 7.8
×
300mm,3.5μm;
80.流动相:50mm pb+200mm arg(ph 6.80)+10%ipa,按照s3中的洗脱程序进行洗脱,0-30min流动相a体积为100%-100%,取偶联后样品20μl,注入高效液相色谱仪,利用s3中的洗脱程序洗脱,并记录色谱图。
81.s5:结果分析,根据色谱图分析dar值可知,随着氯化钠浓度的升高,上清液部分adc的dar值呈线性下降趋势,与此同时,复溶沉淀部分adc的dar值呈上升趋势,说明adc产品中,高dar值的部分确实被盐析纯化出来,且adc的sec纯度没有显著改变。所以根据线性数据,我们可以在回收率可接受的范围内,通过特定浓度氯化钠溶液纯化高dar值adc从而降低其dar值,或者通过特定浓度氯化钠溶液纯化得到预期dar值的adc产品。
82.对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1