一种调控草莓叶色的FaPDS基因及其应用
一种调控草莓叶色的fapds基因及其应用
技术领域
1.本发明涉及基因工程领域,特别是涉及一种调控草莓叶色的fapds基因及其应用。
背景技术:
2.植物体内主要含有叶绿素、类胡萝卜素、花青素、甜菜碱等色素,果实色泽直接影响其外观品质,其中最常见的果实色素是花青苷(如草莓、苹果、蓝莓、葡萄等)、类胡萝卜素(如番茄、芒果、西瓜、柑橘、香蕉等)、甜菜素(火龙果)和叶绿素(未成熟果实)。草莓叶片主要含有叶绿素、类胡萝卜素,果实成熟早期主要含有叶绿素、类胡萝卜素,而成熟后期主要含有花青素。pds是叶绿素及类胡萝卜素合成途径的调控基因,在功能叶中对于叶绿素、类胡萝卜素的合成具有重要的作用。八氢番茄红素脱氢酶(phytoene desaturase,pds)是影响类胡萝卜素合成的限速酶之一,参与类胡萝卜素生物合成,直接影响类胡萝卜素的产率、光保护和光合作用。当编码该蛋白的pds基因发生突变后,拟南芥植株呈现矮小和白化的特点(qin et al.,2007),相类似的现象在苹果、大豆、卷心菜等多种植物上均有报道(wilson et al.,2019;nishitani et al.,2016;maet al.,2019;lu and tian,2022)。该酶催化八氢番茄红素脱氢生成9,9
’‑
二顺式
–
ζ
–
胡萝卜素,再经由ζ
–
胡萝卜素脱氢酶(zds)和类胡萝卜素异构酶(crtiso)生成番茄红素,进而合成其它下游类胡萝卜素(朱长甫等,2004)。该酶编码的基因(pds)与八氢番茄红素合酶基因(psy)、ζ
–
胡萝卜素脱氢酶基因(zads)等协调作用,在转录水平上调节花或成熟柑橘果实中类胡萝卜素的积累(kato et al.,2004)。pds的沉默会抑制叶绿素的正常合成,赋予植株清晰可见的光漂白现象。
3.草莓(fragaria ananassa duch.)是研究非呼吸跃变型果实成熟调控的模式植物,其果实花青苷成分主要是天竺葵素3-葡萄糖苷,使其呈现鲜红色。目前,普遍接受的观点是:myb-bhlh-wd40形成的mbm三元复合体共同调控植物花青苷的积累。前人已经报道了一系列与草莓花青苷积累相关的基因,如参与合成的结构基因fachs、faans和faufgt,参与转录调控的famyb10、fabhlh33、fahy5以及参与转运的fagst。花青苷赋予植物颜色不仅与其丰富的种类相关,还与分子堆积效应、金属离子络合作用及液泡ph值等密切相关。液泡ph值为1.0-2.0,花青苷表现为红色;ph值在6.0-6.5,花青苷表现为蓝色;当ph值大于7.0时,花青苷则表型为淡黄色。在矮牵牛中,ph5基因编码一种定位于液泡膜的h
+-atpase质子泵,ph5突变后会升高液泡中的ph值,从而导致矮牵牛花瓣的颜色由紫红色变为蓝紫色。草莓花青苷颜色主要有红色、白色和粉色,有关草莓紫红色花青苷积累的调控基因还未见鉴定。
技术实现要素:
4.本发明的目的是提供一种调控草莓叶色的fapds基因及其应用,以解决上述现有技术存在的问题,通过fapds基因调控草莓叶色,能提供新的种质资源、提高观赏价值的同时改善果实品质。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供fapds基因的应用,包括如下任一项应用:
7.(1)调控草莓叶片颜色;
8.(2)培育不同颜色草莓突变植株;
9.(3)促进草莓花青素苷累积,或者制备促进草莓花青素苷累积的产品;
10.其中,所述fapds的核苷酸序列如seq id no:1所示,或者与seq id no.1所示核苷酸序列具有80%以上同源性且具有相同功能的基因序列。
11.本发明还提供编码所述的fapds基因的蛋白的应用,包括如下任一项应用:
12.(1)调控草莓叶片颜色;
13.(2)培育不同颜色草莓突变植株;
14.(3)促进草莓花青素苷累积,或者制备促进草莓花青素苷累积的产品;
15.其中,所述蛋白的氨基酸序列如seq id no:2所示;
16.本发明还提供含有所述的重组载体的应用,包括如下任一项应用:
17.(1)调控草莓叶片颜色;
18.(2)培育不同颜色草莓突变植株;
19.(3)促进草莓花青素苷累积,或者制备促进草莓花青素苷累积的产品。
20.本发明还提供含有所述的重组载体的重组菌的应用,包括如下任一项应用:
21.(1)调控草莓叶片颜色;
22.(2)培育不同颜色草莓突变植株;
23.(3)促进草莓花青素苷累积,或者制备促进草莓花青素苷累积的产品。
24.本发明还提供一种培育不同颜色草莓突变植株的方法,包括利用crispr/cas9技术敲除草莓中fapds基因的步骤,以获取不同颜色草莓突变植株;所述fapds基因的核苷酸序列如seq id no:1所示,或者与seq id no.1所示核苷酸序列具有80%以上同源性且具有相同功能的基因序列。
25.优选的是,利用crispr/cas9技术敲除fapds基因的grna靶点包括:
26.fapds-grna-f:tgattgctagtactaggctgaggaa;
27.fapds-grna-r:aaacttcctcagcctagtactagca。
28.优选的是,不同颜色草莓突变体包括叶片为紫红、黄红、白红以及绿红的草莓突变体。
29.本发明公开了以下技术效果:
30.本发明通过crispr/cas9基因编辑技术,构建fapds基因敲除的植物表达载体,构建的植物表达载体经农杆菌介导法转化
‘
红颜’草莓的叶圆片,获得的fapds基因编辑植株,其植株整体表现出紫红、黄红、白红、绿红等不同的颜色。获得了不同叶色的新的种质资源,提高观赏价值的同时改善了果实品质。因此,本发明利用基因工程技术,对fapds调控草莓叶色的能力提供了理论依据与技术手段,具有很大的应用价值。
附图说明
31.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
32.图1为fapds的靶点定位图;
33.图2为fapds构建crispr/cas9的载体示意图(a)、crispr/cas9载体谱图(b)及双酶切电泳图(c,两个泳道一个为maker,另一个为样品);
34.图3为含有fapds靶点的载体测序结果比对;
35.图4为不同叶片颜色的突变植株dna提取电泳图(a)、cas9蛋白核苷酸序列部分特异性pcr检测电泳图(b);
36.图5为栽培草莓含有pds基因的四个基因组部分序列进行比对;
37.图6为fv4-1基因组pds扩增产物电泳图(a)、fv4-3、fv4-4基因组pds扩增产物电泳图(b);
38.图7为fv4-1基因组pds序列pcr扩增产物测序结果比对;
39.图8为fv4-3基因组pds序列pcr扩增产物测序结果比对;
40.图9为fv4-4基因组pds序列pcr扩增产物测序结果比对;
41.图10为单克隆pcr阳性检测电泳图;自左向右第一泳道为maker,其余24个泳道为紫红突变植株pds部分序列的24个单克隆;
42.图11为黄红突变植株的fv4-1的五个单克隆结果比对;
43.图12为绿红突变植株的fv4-1的五个单克隆结果比对;
44.图13为紫红突变植株的fv4-1的五个单克隆结果比对;
45.图14为白红突变植株的fv4-1的五个单克隆结果比对;
46.图15为绿红突变植株的fv4-3的五个单克隆结果比对;
47.图16为黄红突变植株的fv4-3的五个单克隆结果比对;
48.图17为紫红突变植株的fv4-3的五个单克隆结果比对;
49.图18为白红突变植株的fv4-3的五个单克隆结果比对;
50.图19为黄红突变植株的fv4-4的五个单克隆结果比对;
51.图20为绿红突变植株的fv4-4的五个单克隆结果比对;
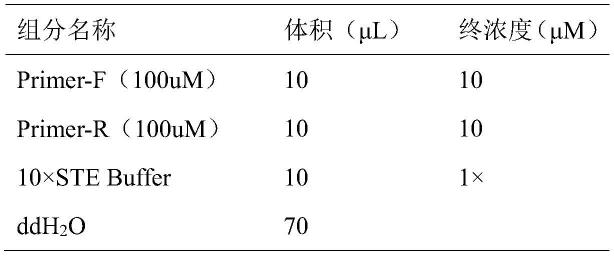
52.图21为紫红突变植株的fv4-4的五个单克隆结果比对;
53.图22为白红突变植株的fv4-4的五个单克隆结果比对;
54.图23为突变植株的花青素含量结果图;
55.图24为提取野生型及突变植株的rna电泳图;
56.图25为突变植株的花青素代谢相关基因的表达量结果图;a:myb10基因;b:ans基因;c:anr基因;d:f3’h基因;e:f3
’5’
h基因;f:lar基因;g:dfr基因;
57.图26为获得fapds基因编辑材料过程图以及愈伤组织和再生植株颜色图;a:草莓叶圆片的预培养;b:叶圆片的筛选培养;c:抗性黄色愈伤组织;d:抗性白色愈伤组织;e:抗性白红幼苗;f:抗性紫红幼苗;
58.图27为获得不同颜色的突变植株。
具体实施方式
59.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
60.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发
明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
61.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
62.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本技术说明书和实施例仅是示例性的。
63.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
64.实施例1
65.1、载体构建
66.1.1grna靶点的获得
67.将fapds基因的mrna序列通过http://www.rgenome.net/cas-designer/网站进行grna靶点的查找,根据综合得分,选择合适的grna靶点(如图1所示),并分别在靶点的正链和负链上分别添加tgatt和aaac,在生工生物工程有限公司合成正链和负链:
68.fapds-grna-f(seq id no:3):5
’‑
tgattgctagtactaggctgaggaa-3’;
69.fapds-grna-r(seq id no:4):5
’‑
aaacttcctcagcctagtactagca-3’;
70.将引物参照表1的反应体系进行退火复性,反应程序为95℃变性5min,1℃/30s降温至25℃,将得到的双链序列稀释至0.1μm,-20℃保存备用。
71.表1退火复性反应体系
[0072][0073]
表中10
×
ste buffer组成为:1m nacl,100mm tris-hcl,10mm edta,ph 8.0。
[0074]
1.2载体的酶切
[0075]
使用neb的bsai-hf或bsai内切酶参照表2的反应体系双酶切载体(图谱见图2中a、b),37℃酶切0.5-1h,酶切时间超过一小时不会显著提高酶切效率,随后进行1%琼脂糖电泳,电泳后进行切胶纯化,回收目的条带,回收方法参照omega回收试剂盒。如图2中c所示,为酶切产物电泳图。
[0076]
表2载体酶切反应体系
[0077][0078]
1.3靶点连接
[0079]
将以上两步得到的grna靶点和载体酶切产物参照表3进行连接反应,25℃反应10-20分钟,具体方法可参照全式金t4连接试剂盒。
[0080]
表3载体片段连接反应体系
[0081][0082]
将连接产物转化至大肠杆菌trans t1感受态,涂布在含有50mg/l卡那霉素的lb固体培养基上,37℃过夜培养,挑选单菌落,进行菌落pcr,反应程序为95℃预变性3min,95℃变性25s,58℃退火25s,72℃延伸30s,循环35次,72℃终延伸5min,12℃保存。扩增体系:菌液模板1μl,引物u6-f(tcgacttgccttccgcacaat)1μl,引物fapds-grna-r1μl,pcr酶mix10μl,用无菌水补足总体系至20μl。经电泳验证为阳性克隆的重组菌取200μl送至生物公司进行测序,测序结果如图3所示,表明含有fapds的靶点的载体构建成功,随后将重组菌扩大培养,提取质粒,放-20℃保存备用。
[0083]
2、遗传转化
[0084]
2.1草莓叶片预培养
[0085]
在灭菌培养皿中放入蒸馏水;取10-30d叶龄的草莓组培苗上幼嫩、平展的叶片,切除叶尖,叶缘及主脉,沿垂直于主脉的方向剪成5mm x 3mm的条状小块(或用4mm的打孔器),将得到的叶片及时转移至约含25ml液体培养基(ms培养基+维生素b5+tdz 2.0mg/l+iba0.5mg/l+3%蔗糖,ph 5.8)(无菌水)的培养皿中,每次剪出100-150个叶片;之后,将叶片放在滤纸上吸干表面的水,置于含预培养基(ms培养基+维生素b5+tdz 2.0mg/l+iba 0.5mg/l+3%蔗糖+0.7%琼脂)、ph 5.8.的培养皿中,以叶片背面与培养基接触(如图26中a),每个培养皿中放20-30个,parafilm膜封口,25℃暗培养7-10d。(注:叶片基部不定芽再生率较高,10-30d叶龄的叶片不定芽再生率较高,老叶片基本很难再生不定芽。)
[0086]
2.2质粒转化gv3101农杆菌
[0087]
取-80℃保存的农杆菌感受态于室温或手心片刻待其部分融化,处于冰水混合状态时插入冰中。每100μl感受态加1μg(体积不大于10μl)质粒dna,用手拨打管底混匀,依次于冰上静置30分钟、液氮5分钟、37℃水浴5分钟、冰浴5分钟。加入700μl无抗生素的yeb液体
培养基,于28℃振荡培养2~3小时。6000rpm离心一分钟收菌,留取100μl左右上清轻轻吹打重悬菌块涂布于含相应抗生素(50μg/ml卡那霉素+20μg/ml利福平+40μg/ml庆大霉素)的yeb平板上,倒置放于28℃培养箱培养2-3天。
[0088]
2.3gv3101农杆菌的培养
[0089]
挑单克隆于800μl含抗生素(50ug/ml卡那霉素+20μg/ml利福平+40μg/ml庆大霉素)的yeb液体培养基中,黑暗条件下28℃150rpm振荡培养过夜;次日,全部接种于25ml含抗生素(50μg/ml卡那霉素+20μg/ml利福平+40μg/ml庆大霉素)的yeb液体培养基中,黑暗条件下28℃150rpm振荡培养至od
600
=0.5-1.0,4000g离心5min收菌,用后述培养基洗涤菌体沉淀3次,将菌体沉淀重悬于培养基(ms培养基+维生素b5+2%蔗糖+10mm 2-吗啉乙磺酸(mes)+200μm乙酰丁香酮,ph5.5)中使od
600
=0.4-0.5,28℃50rpm振荡培养2-3h,此即为用于侵染的菌液(mes和乙酰丁香酮均采用过滤灭菌,分装后保存)。
[0090]
2.4浸染和共培养
[0091]
将预培养7-10d后的叶片放入制备好的农杆菌悬浮液中(浸染前在该悬浮液中加入终浓度为0.01%的silwetl-77),浸染20min,每隔5min轻轻摇动几次;浸染结束后将叶片放在滤纸上吸干(吹干)表面的菌液,置于含25ml共培养培养基(ms培养基+维生素b5+tdz 2.0mg/l+iba0.5mg/l+3%蔗糖+0.7%琼脂+100μm as,ph5.5)的培养皿中,每个培养皿放20-30个,封口,25℃暗培养2-4d。
[0092]
2.5延迟筛选
[0093]
将共培养结束后的叶片洗涤3次(洗涤液为:ms培养基+维生素b5+3%蔗糖+250mg/l羧苄青霉素(carb)+250mg/l头孢噻肟(cefotaxime),ph 5.2),每次20min(放在专用的水平摇床上洗涤)然后置于滤纸上吸干(吹干)表面液体。如果叶片菌液很少,也可以直接将共培养结束后的叶片接种于含25ml延迟筛选培养基(ms培养基+维生素b5+3%蔗糖+7%琼脂+250mg/l羧苄青霉素(carb)+250mg/l头孢噻肟(cefotaxime),ph 5.2)的培养皿上,每个培养皿放20-30个,封口,22℃暗培养14d。(该步结束后需要仔细观察农杆菌是否被完全抑制,若农杆菌已被抑制,后续步骤的培养基应降低对应的抗生素;反之,应加入)
[0094]
2.6筛选
[0095]
将延迟筛选结束后的叶片转移至含25ml筛选培养基(ms培养基+维生素b5+tdz 2.0mg/l+iba0.5mg/l+3%蔗糖+0.7%琼脂+200mg/l特美汀+5mg/l潮霉素,ph 5.8)的培养皿中,每个培养瓶皿放20-30个(如图26中b),22℃黑暗培养20-30d。将存活的幼嫩白色和黄色愈伤组织转移至新的筛选培养基(如图26中c、d),继续培养,直至长出不定芽(如图26中e、f)。
[0096]
2.7生根
[0097]
将2-3cm高的不定芽切下,转移至生根培养基(1/2ms+5mg/l潮霉素+3%蔗糖+0.7%琼脂,ph 5.8)中,培养条件同上,得到完整植株。
[0098]
2.8炼苗移栽
[0099]
当组培苗长到3~4cm,根系长到2~3cm时,进行炼苗。先把盛有生根苗的组培瓶打开封膜,在温度25℃、湿度75%的室内放置2d,然后取出小苗并洗净附着在根部的培养基,成簇栽植于消毒过(高压灭菌)的基质(营养土:珍珠岩:蛭石=1:1:1)中。小苗栽植后,立即浇透水,覆盖上聚乙烯膜进行保温保湿,每天喷雾1次,保持相对空气湿度80%~85%,温度
(25
±
2)℃,7d后揭膜。
[0100]
3、突变植株的鉴定
[0101]
3.1dna的提取
[0102]
用ctab法提取野生型及突变植株的dna,用1%琼脂糖电泳,确定dna的提取质量,结果如图4所示。
[0103]
3.2cas9蛋白的特异性检测
[0104]
将提取的基因组dna的浓度稀释到100ng/μl作为模板,设计cas9蛋白特异性引物进行扩增,反应程序为95℃预变性3min,95℃变性25s,58℃退火25s,72℃延伸30s,循环35次,72℃终延伸5min,12℃保存。扩增体系:基因组dna模板1μl,引物cas9-f 1μl,引物cas9-r 1μl,pcr酶mix 10μl,用无菌水补足总体系至20μl。pcr产物用1%琼脂糖电泳结果如图4所示。
[0105]
cas9-f:5
’‑
tcctcttcgattctggtgaaactgc-3’;
[0106]
cas9-r:5
’‑
gacttagagagcctagcagagagg-3’。
[0107]
3.3fapds序列pcr扩增测序
[0108]
本材料使用的是栽培草莓
‘
红颜’,栽培草莓属于八倍体,起源于四个二倍体野生草莓,因此,栽培草莓含有四个基因组,将含有fapds基因的四个基因组部分序列进行比对,如图5所示,四个基因组中三个基因组含有fapds-grna靶点,因此,需要对fv4-1、fv4-3及fv4-4三个基因组的pds基因进行pcr扩增测序。
[0109]
根据设计的fapds-grna靶位点,在三个基因组dna的靶位点上下游200-500bp设计特异性引物(注:引物一定要特异,确保测序的可靠性),对目标pds序列进行扩增测序,pcr产物用1%琼脂糖电泳,条带特异性如图6所示,三个条带大小分别为pds1含有1002bp、pds3含有750bp、pds4含有1010bp。
[0110]
将dna扩增产物送生工生物公司测序,fv4-1、fv4-3、fv4-4的测序结果如图7-图9,结果表明,野生型峰图整齐,与基因组序列一致,说明引物特异,实验结果可靠;紫红、绿红、黄红、白红突变植株的测序结果与野生型相比存在显著的差异,有缺失、插入、替换等突变类型,但峰图比较杂乱,有明显的重叠峰,为了实验的可靠性,需要进行单克隆测序。三个基因组pds的dna扩增引物如下:
[0111]
cxpds1-f:5
’‑
gccataataataataaaaaaatattaaaggaac-3’;
[0112]
cxpds1-r:5
’‑
accacaaccactatctctct-3’;
[0113]
cxpds3-f:5
’‑
caaattcatacaaagttaagagttaaagaat-3’;
[0114]
cxpds3-r:5
’‑
tctataggagacacctcaaactc-3’;
[0115]
cxpds4-f:5
’‑
gatttagccataataaaaaaatattttttctca-3’;
[0116]
cxpds4-r:5
’‑
ccacaaccattctctctcact-3’。
[0117]
3.4单克隆测序
[0118]
利用上述特异性引物再次扩增,扩增产物进行1%琼脂糖电泳,电泳后进行切胶纯化,回收目的条带并克隆到全式金公司的peasy-blunt克隆载体上,转化至大肠杆菌trans t1,涂布在含有50mg/l卡那霉素的lb固体培养基上,37℃过夜培养,挑选单菌落,进行菌落pcr,反应程序为95℃预变性3min,95℃变性25s,58℃退火25s,72℃延伸30s,循环35次,72℃终延伸5min,12℃保存。扩增体系:菌液模板1μl,引物m13-f 1μl,引物m13-r 1μl,pcr酶
mix 10μl,用无菌水补足总体系至20μl。扩增产物进行1%琼脂糖电泳,每个样本选取五个经电泳验证为阳性克隆的重组菌(部分结果图10),送至生物公司进行测序,测序结果如下
[0119]
m13-f:5
’‑
gtaaaacgacggccagt-3’;
[0120]
m13-r:5
’‑
caggaaacagctatgac-3’。
[0121]
3.4.1黄红突变植株fv4-1的五个单克隆结果比对
[0122]
从图11中可以看出,黄红突变植株fv4-1基因组的pds发生了四种突变,pds1是在靶点缺失了六个碱基,靶点上游9bp处发了替换,由a突变成了t;pds2是在靶点缺失了2个碱基,靶点上游56bp处发生了替换,由a突变成了t。pds3和pds4是相同的突变,在靶点缺失了3个碱基;pds5是在靶点缺失了2个碱基,并插入了c。
[0123]
3.4.2绿红突变植株的fv4-1的五个单克隆结果比对
[0124]
从图12中可以看出,绿红突变植株fv4-1基因组的pds发生了四种突变,pds1和pds5是相同的突变,是在靶点缺失了4个碱基,在靶点上游9bp处发生了替换,由a突变成了t,在靶点上游46bp处发生了替换,由a突变成了g,在靶点上游53bp处发生了替换,由t突变成了c;pds2在靶点缺失了3个碱基。pds3是在靶点缺失了六个碱基,靶点上游9bp处发了替换,由a突变成了t,靶点上游53bp处发了替换,由t突变成了c。pds4是在靶点缺失了2个碱基,并插入了c,靶点上游56bp处发了替换,由a突变成了g。
[0125]
3.4.3紫红突变植株的fv4-1的五个单克隆结果比对
[0126]
从图13中可以看出,紫红突变植株fv4-1基因组的pds发生了2种突变,pds1、pds4和pds5是相同的突变,在靶点缺失了4个碱基。pds2和pds3是相同的突变,在靶点缺失了2个碱基,在靶点上游9bp处发生了替换,由a突变成了t。
[0127]
3.4.4白红突变植株的fv4-1的五个单克隆结果比对
[0128]
从图14中可以看出,白红突变植株fv4-1基因组的pds发生了2种突变,pds2、pds3和pds5是相同的突变,在靶点缺失了4个碱基。pds1和pds4是相同的突变,在靶点缺失了2个碱基,在靶点上游9bp处发生了替换,由a突变成了t。
[0129]
3.4.5绿红突变植株的fv4-3的五个单克隆结果比对
[0130]
从图15中可以看出,绿红突变植株fv4-3基因组的pds发生了2种突变,pds1、pds2、pds3、pds4是相同的突变,在靶点缺失了39个碱基,pds5在靶点缺失了54个碱基。
[0131]
3.4.6黄红突变植株的fv4-3的五个单克隆结果比对
[0132]
从图16中可以看出,黄红突变植株fv4-3基因组的pds发生了2种突变,pds1、pds3、pds4、pds5是相同的突变,在靶点缺失了39个碱基,pds2在靶点缺失了54个碱基。
[0133]
3.4.7紫红突变植株的fv4-3的五个单克隆结果比对
[0134]
从图17中可以看出,紫红突变植株fv4-3基因组的pds发生了2种突变,pds1、pds2、pds4是相同的突变,在靶点缺失了5个碱基,pds3和pds5是相同的突变在靶点缺失了2个碱基。
[0135]
3.4.8白红突变植株的fv4-3的五个单克隆结果比对
[0136]
从图18中可以看出,白红突变植株fv4-3基因组的pds发生了2种突变,pds1、pds2、pds3、pds5是相同的突变,在靶点缺失了5个碱基;pds4在靶点缺失了2个碱基。
[0137]
3.4.9黄红突变植株的fv4-4的五个单克隆结果比对
[0138]
从图19中可以看出,黄红突变植株fv4-4基因组的pds发生了2种突变,pds1和pds5
是相同的突变,在靶点缺失了1个碱基;pds2、pds3和pds4是相同的突变,在靶点缺失了3个碱基。
[0139]
3.4.10绿红突变植株的fv4-4的五个单克隆结果比对图
[0140]
从图20中可以看出,绿红突变植株fv4-4基因组的pds发生了2种突变,pds1和pds2是相同的突变,在靶点缺失了3个碱基;pds3、pds4和pds5是相同的突变,在靶点缺失了1个碱基。
[0141]
3.4.11紫红突变植株的fv4-4的五个单克隆结果比对
[0142]
从图21中可以看出,紫红突变植株fv4-4基因组的pds发生了3种突变,pds1在靶点缺失1个碱基,在靶点上游62bp处也缺失1个碱基;pds2、pds3和pds5是相同的突变,在靶点缺失了1个碱基;pds4在靶点缺失1个碱基,在靶点上游42bp处出现了替换,由a突变成了g。
[0143]
3.4.12白红突变植株的fv4-4的五个单克隆结果比对图
[0144]
从图22中可以看出,白红突变植株fv4-4基因组的pds发生了3种突变,pds1、pds2和pds5是相同的突变,在靶点缺失了1个碱基;pds3在靶点插入了1个碱基,在靶点下游29bp处出现了替换,由t突变成了c;pds4在靶点插入了1个碱基。
[0145]
综上,含有fapds基因的三个基因组(fv4-1、fv4-3、fv4-4),在黄红、绿红、紫红、白红四个突变材料(见图27)中都发生了不同类型的突变,在一定程度影响了pds的正常功能,如缺失5、2、1个碱基或者插入1个碱基,不是3的倍数,则会引起移码突变,对pds的正常功能影响较大;缺失54、39、3个碱基,是3的倍数,则不会引起移码突变,对pds影响较小。
[0146]
4、花青素
[0147]
4.1花青素的测定
[0148]
花青素苷含量的测定方法为ph示差法,具体的:花青素苷提取液为丙酮:甲醇:水:冰醋酸=60ml:60ml:30ml:15ml,取适当材料0.5g左右(鲜重),液氮研磨后加提取液5ml,避光4℃浸提过夜,最大速度离心10min,取上清液用于测量。同一样品分别用ph4.5 naac缓冲液和ph1.0 kcl缓冲液稀释10倍,分别在496nm和700nm条件下进行吸光度测量,以双蒸水调零。花青素苷含量主要以天竺葵-3-葡萄糖苷(pelargonidin-3-glucoside)代表,计算公式:
[0149]
花青素苷含量(mg
·
g-1
)=(a
0-a1)
×v×n×
m/(ε
×
m),其中a0为在ph为1.0时a
496
nm-a
700
nm,a1为在ph为4.5时a
496
nm-a
700
nm,v代表提取液体积(ml),n代表稀释倍数,m为天竺葵-3-葡萄糖苷摩尔质量433.2,ε为吸光系数15600,m为称取样品质量(g)。
[0150]
结果表明,突变植株的花青素含量相对于野生型都有所提高,其中紫红提升最明显(图23)。
[0151]
4.2花青素代谢相关基因表达量
[0152]
为进一步探讨fapds基因敲除对花青素代谢调控的转录影响,采用ctab法提取野生型及突变植株的rna,随后进行1%琼脂糖电泳确定rna的质量,如图24所示,并采用全式金逆转录试剂盒获得cdna,进一步对花青素代谢相关基因进行了qrt-pcr定量分析,pcr mix为sybr green i。以草莓faactin基因(登录号:ab116565.1)为内参校正基因。荧光定量pcr仪为bio-rad公司的cfx96,采用20μl反应体系:10μl sybr green i mix,荧光定量上下游引物各0.8μl,0.8μl待测草莓样品cdna1.5μl模板,加水补至20μl。pcr反应程序为:95℃预变性3min,95℃变性15s,58℃退火30s,72℃延伸30s,共40次循环。利用2-δδct
法计算相对
表达量。本次定量使用的花青素代谢相关的结构基因和转录因子包括myb10、ans、anr、f3’h、f3
’5’
h、lar和dfr。具体引物序列如下:
[0153]
myb10-f:5
’‑
gagcttctgaaacagttcatcgaa-3’;
[0154]
myb10-r:5
’‑
tcagtctacagctcttcctgc-3’;
[0155]
ans-f:5
’‑
cgtcaacaaggagaaggtgag-3’;
[0156]
ans-r:5
’‑
agacagtttccggtagcgg-3’;
[0157]
anr-f:5
’‑
gccgtcagaaccactgttag-3’;
[0158]
anr-r:5
’‑
agtggactggtgtggctac-3’;
[0159]
f3’h-f:5
’‑
ctgcaacattggtccatgcg-3’;
[0160]
f3’h-r:5
’‑
gtgcagctcgttgtagagtg-3’;
[0161]
f3
’5’
h-f:5
’‑
accttgatgattgctatg-3’;
[0162]
f3
’5’
h-r:5
’‑
gagttgattgctatggaa-3’;
[0163]
lar-f:5
’‑
ggccgagtcctcattatcgg-3’;
[0164]
lar-r:5
’‑
gtgtcggacttggaaggacg-3’;
[0165]
dfr-f:5
’‑
ataccaactctggtcatcggtc-3’;
[0166]
dfr-r:5
’‑
catgaatcgtagcatcgtgcg-3’。
[0167]
如图25所示结果表明:fapds的突变会提高大部分花青素结构基因与转录因子的表达量,如myb10的表达量在黄红、紫红和白红突变植株中显著升高;黄红突变体的ans、anr、f3’h、f3
’5’
h、lar和dfr在四种突变体中均表达最高;dfr和f3’h的表达量在所有突变植株中较对照均显著升高。由此说明:fapds的突变激活了花青素结构基因与转录因子的表达,从而间接参与了草莓叶片花青苷的积累。
[0168]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1