用于CRISPR-Cas12a体系的底物DNA及其应用和通用型基因突变检测方法
本发明涉及基因检测,特别涉及用于crispr-cas12a体系的底物dna及其应用和通用型基因突变检测方法。
背景技术:
1、簇状规则间隔短回文重复序列(clustered regularly interspaced shortpalindromic repeats,crispr)系统为细菌提供了原核适应性免疫系统,其通过rna引导的核酸酶靶向降解外来核酸。crispr-cas12a属于cas酶第二家族,cas12a核酸酶(也称为cpf1核酸酶)识别前间区序列邻近基序(pam)相反链上与crrna(也称为grna)间隔区互补的靶标dna,识别后于ruvc域和nuc域处产生交错的dna双链断裂。这一过程中涉及到两种方式的剪切,其一为正式切割(cis-cleavage),即通过crrna与靶标dna(单链dna或双链dna)配对后,激活cas12a的剪切活性完成对靶标dna的剪切,另一种为反式切割(trans-cleavage),即激活的cas12a还可以非特异性切割其周围溶液中的任何单链dna(ssdna)。基于这一特性,作为新一代基因编辑技术的crispr-cas12a在核酸检测和生物传感领域展现出了巨大的应用前景。cas12a核酸酶的反式切割活性提供了一种新的信号放大模式,cas12a核酸酶在cas12a/grna复合物与靶标dna结合后激活其反式切割活性,从而连续切割溶液中丰富的荧光ssdna探针以实现信号放大,具有价格低廉、便于操作、简单快速和高信噪比的优点。
2、crispr-cas12a系统强大的信号放大能力导致靶标dna识别的超高灵敏度。然而,除了灵敏度之外,通用性和特异性对于crispr-cas12a系统也是非常重要的。灵敏度是指能够识别的目标的最小数量。在实际应用中,靶标dna序列可能变化,因此,crispr-cas12a系统的能力应推广到任何兴趣序列。此外,靶标dna不是孤立的,而是沉浸在大量干扰序列中,因此,crispr-cas12a系统的特异性对于区分靶标dna和干扰序列同样至关重要。然而,上述crispr-cas12a系统的工作机制表明,其通用性仅限于靶标ssdna,针对于靶标dsdna它需要识别pam序列以结合靶标dsdna。因此,在基于crispr-cas12a的检测系统中,研究人员通常需要将要检测的目标链设置为ssdna;如果目标链必须是dsdna,它需要通过酶解等手段消化为单链,这种限制性的普遍性不仅牺牲了靶向范围或程序上的便利性,而且给crispr-cas12a系统的特异性带来了额外的麻烦。通常,评估检测系统特异性的一个重要标准是其区分具有单一碱基差异的干扰链的能力。尽管crispr-cas12a可以通过精细地调整种子结构域(即pam序列后的1-6个碱基序列)内的错配位点来识别dsdna中的单碱基错配,但df(区分度)并不理想,仅为2至5倍。在核酸检测和生物传感领域,检测与疾病相关的基因突变具有巨大的临床意义和应用范围,尤其是区分单个碱基错配的能力对于检测疾病尤其是癌症相关的点突变至关重要。然而,在肿瘤液体和早期肿瘤组织活检中,点突变的丰度非常低(0.01%-10%)。因此,这对基因检测系统区分单碱基错配的能力提出了很高的要求。但是,目前的研究中,crispr-cas12a识别靶标dna中的单碱基错配的能力远远不能满足检测的需要。总而言之,基于crispr-cas12a的检测系统迫切需要在保持其高灵敏度的同时,扩展其通用性和/或大大提高其特异性。
技术实现思路
1、针对现有技术存在的问题,本发明提供了一种用于crispr-cas12a体系的底物dna,并提供了该底物dna在基因编辑或基因检测领域中的应用,以及提供了基于该底物dna的通用型基因突变检测方法,以解决或至少部分解决现有技术中基于crispr-cas12a的检测系统的通用性差和/或特异性低的技术问题。
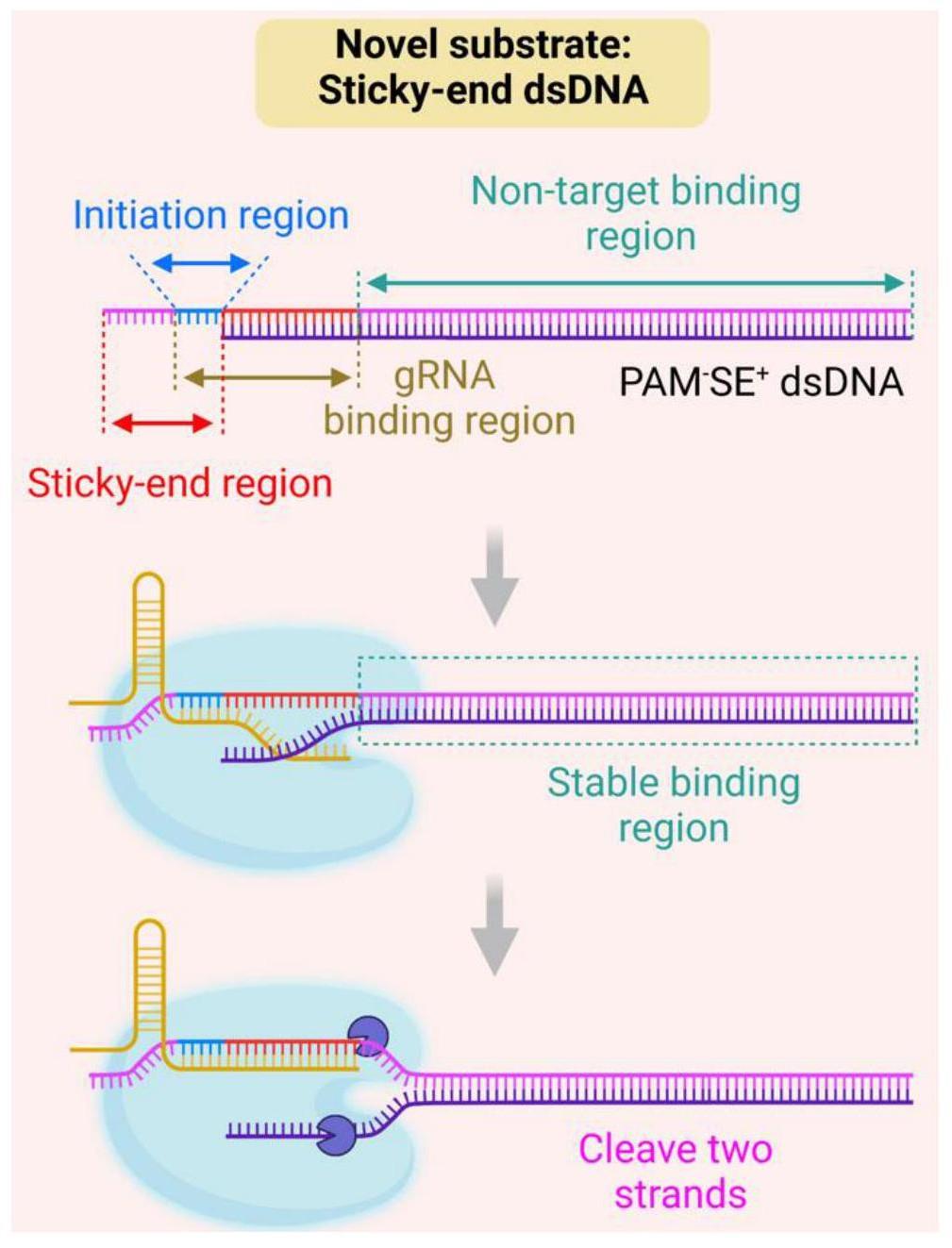
2、本发明的第一方面提供了一种用于crispr-cas12a体系的底物dna,包括互补结合的辅助链和靶标链,所述辅助链的长度小于所述靶标链的长度以使所述靶标链的5’端形成黏性末端,所述黏性末端靠近所述辅助链的一端包含与grna互补结合的起始区,所述起始区包括1-8nt的核苷酸。
3、进一步地,所述起始区包括3-7nt的核苷酸。
4、更进一步地,所述起始区包括5nt的核苷酸。
5、进一步地,所述靶标链上还包括分支迁移域,所述分支迁移域包括12-19nt的核苷酸,且所述分支迁移域的5’端与所述起始区的3’端连接,二者形成完整的grna结合区域。
6、更进一步地,所述分支迁移域与所述起始区的碱基之和为20nt。
7、本发明的第二方面提供了如上所述的用于crispr-cas12a体系的底物dna在基因编辑或基因检测领域中的应用。
8、进一步地,所述基因检测领域为基因突变检测领域。
9、本发明的第三方面提供了一种通用型基因突变检测方法,包括以下步骤:
10、s1、制备如上所述的用于crispr-cas12a体系的底物dna,所述底物dna包括野生型靶标链和/或突变型靶标链;
11、s2、将所述底物dna加入到crispr-cas12a体系中,低温孵育,之后加入单链dna荧光探针,形成待检反应体系,室温记录荧光强度;其中,所述crispr-cas12a体系中grna与所述突变型靶标链形成一个碱基错配且与所述野生型靶标链形成两个碱基错配。
12、进一步地,步骤s1中,所述用于crispr-cas12a体系的底物dna的制备方法包括以下步骤:
13、s11、扩增待检测样品中含有靶标链的目的基因;
14、s12、向所述目的基因溶液中加入辅助链,高温变性使所述靶标链与所述辅助链互补结合,之后低温退火,得到底物dna;其中,所述辅助链的摩尔浓度大于所述目的基因的摩尔浓度。
15、进一步地,步骤s12中,所述辅助链的摩尔浓度与所述目的基因的摩尔浓度比为10:1。
16、进一步地,步骤s2中grna与所述突变型靶标链的碱基错配的位置位于分支迁移域的第1-19个核苷酸。
17、更进一步地,grna 与所述突变型靶标链的碱基错配的位置位于分支迁移域的第1-10个核苷酸;更优选为位于分支迁移域的第7个核苷酸。
18、本发明的优点及积极效果为:
19、1、通过前述设置,crispr-cas12a体系对本发明的新型底物具有独特的pam独立性,这种新颖的结构和独特的性质将crispr-cas12a体系的序列通用性从分离的ssdna扩展到部分dsdna,而且针对底物dna内碱基错配具有超敏感性,使得其对单碱基差异识别的特异性得到较大提升。
20、2、本发明基于crispr-cas12a体系对底物dna内碱基错配的超敏感性,通过设置针对已知突变的grna并保证该grna与已知突变的核苷酸序列存在一个碱基错配、与野生型目的基因形成两个碱基错配,如此,当待检测样本存在或者不存在突变型靶标链时,荧光信号出现明显差异,进而通过比较荧光信号的差异便可知道是否有突变型靶标链的存在,基因组dna的检测极限为0.05%至0.01%,在多重基因突变检测方面具有极大的优势,且在临床应用中具有广泛的前景。
- 还没有人留言评论。精彩留言会获得点赞!