一种HEK293细胞培养基及其应用的制作方法
一种hek 293细胞培养基及其应用
技术领域
1.本发明涉及培养基技术领域,具体为一种hek 293细胞培养基及其应用领域。
背景技术:
2.人胚肾细胞293(human embryonic kidney 239 cell,hek 293)是1973年荷兰生物学家 alex van der eb通过腺病毒 5 (ad5) dna转染形成的。最初的hek 293细胞适应贴壁含血清的环境,可通过驯化适应无血清悬浮生长,从而易于实现规模化培养。同时由于hek 293细胞是一种易转染的细胞,也广泛应用于蛋白表达和病毒载体的制备。目前市面上大部分hek 293培养基仅支持细胞生长,而不支持转染或转染效率较低,与此同时,在转染之前往往需要另一种支持转染的培养基将原有培养体系进行稀释或更换,这大大提高了工艺的繁琐程度和培养基的使用成本。因此,为了提高蛋白表达量以及病毒包装效率,亟需在常规培养基配方的基础上添加几种关键的组分,通过优化组分浓度,获得更有利于维持细胞生长、能量代谢、蛋白表达量和包装病毒,且易于通过纯化方式去除培养基及宿主细胞残留的培养基配比,使细胞扩增、蛋白表达量或病毒包装可满足临床应用推广,符合最终药品质量要求。
技术实现要素:
3.本发明的目的在于提供一种hek 293细胞培养基及其应用,以解决上述背景技术中提出的问题。
4.为了解决上述技术问题,本发明提供如下技术方案:一种hek 293细胞培养基,所述培养基包括基础培养基和组合物,所述组合物包括:精氨酸/赖氨酸多肽、半胱氨酰甘氨酸和吡咯喹啉醌;所述组分各成分的浓度如下:精氨酸/赖氨酸多肽0.5-5 mg/l、半胱氨酰甘氨酸5-25 mg/l、吡咯喹啉醌1-10 mg/l。
5.较优化的方案,所述组合物各成分的浓度如下:精氨酸/赖氨酸多肽1 mg/l、半胱氨酰甘氨酸10 mg/l、吡咯喹啉醌2 mg/l。
6.较优化的方案,所述基础培养基为opm-293 cd03培养基、lv-max 293培养基、freestyle f17 293培养基中的任意一种。
7.较优化的方案,根据以上所述的一种hek 293培养基的应用,该培养基用于培养hek 293细胞。
8.与现有技术相比,本发明所达到的有益效果是:本技术为弥补现有hek 293细胞培养基的缺陷,提供一种安全可靠的含有精氨酸/赖氨酸多肽、半胱氨酰甘氨酸和吡咯喹啉醌的培养基,本发明的组合物来源明确,无动物源成分,对细胞无毒性,使用方法简单,性能优异,在保证细胞高活率,快速生长的同时,能够显著提高瞬转蛋白产量和病毒包装效率。
9.本发明的组合物的作用机理是:
本发明组合物中的精氨酸/赖氨酸多肽具有类似表面活性剂的作用,能够降低细胞膜的表面张力,通过改变细胞膜的通透性,促进载体质粒混合物进入细胞,从而提高转染效率和细胞瞬时表达水平。而半胱氨酰甘氨酸作为一种二肽,是谷胱甘肽生物合成的前体,在细胞培养过程中有利于产生活性氧物质,对于维持转染后正常细胞功能至关重要,可大幅度提高转染后细胞活率、提高蛋白表达效率。吡咯喹啉醌近些年来被逐渐发现其作为人类发育的必要因子,除了能够刺激人体免疫细胞的生长,提高人体的免疫功能,同时吡咯喹啉醌通过参与呼吸链电子传递,促进细胞对氨基酸的吸收,从而增加细胞密度,提高细胞生长速度。吡咯喹啉醌还作为一种氧化还原酶辅基,在细胞中可以起到氧化还原剂的作用,修饰信号传导和支持线粒体功能,促进细胞产生更多atp,从而促进细胞快速增殖和蛋白高表达,并且可减少细胞培养过程中葡萄糖的消耗和乳酸的生成,便于延长细胞维持期,从而提高细胞产量,为蛋白合成提供更多的能量,保证细胞转染后的正常生长功能。
10.本发明将此两种肽类精氨酸/赖氨酸多肽以及半胱氨酰甘氨酸联合吡咯喹啉醌进行同时添加,对细胞转染和蛋白表达具有协同作用,发挥其促进细胞的跨膜功能,维持细胞正常稳态,达到促进蛋白表达和提高病毒载体滴度的目的。
附图说明
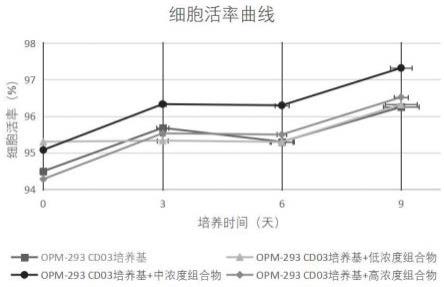
11.附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:图1为不同opm-293 cd03培养基对应培养的细胞活率曲线;图2为不同opm-293 cd03培养基对应培养的细胞传代曲线;图3为不同opm-293 cd03培养基对应培养的蛋白表达水平对比;图4为不同opm-293 cd03培养基对应培养的慢病毒包装滴度对比;图5为不同opm-293 cd03培养基对应培养的aav包装滴度对比;图6为不同lv-max 293培养基对应培养的细胞活率曲线;图7为不同lv-max 293培养基对应培养的细胞传代曲线;图8为不同lv-max 293培养基对应培养的蛋白表达水平对比;图9为不同lv-max 293培养基对应培养的慢病毒包装滴度对比;图10为不同lv-max 293培养基对应培养的aav包装滴度对比;图11为不同freestyle f17 293培养基对应培养的细胞活率曲线;图12为不同freestyle f17 293培养基对应培养的细胞传代曲线;图13为不同freestyle f17 293培养基对应培养的蛋白表达水平对比;图14为不同freestyle f17 293培养基对应培养的慢病毒包装滴度对比;图15为不同freestyle f17 293培养基对应培养的aav包装滴度对比。
具体实施方式
12.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
13.一:实验材料:opm-293 cd03培养基(奥浦迈,货号81070-001),lv-max 293培养基(赛默飞,货号a3583402)、freestyle f17 293培养基(赛默飞,货号a1383502),精氨酸/赖氨酸多肽(上海遐瑞医药,cas号31014-78-5),半胱氨酰甘氨酸(西格玛,货号c0166),吡咯喹啉醌(pqq)(aladdin,货号d134423),hek 293细胞(赛默飞,货号a14527),目标蛋白质粒(丰晖生物,货号fh2192),转染试剂pei(西格玛,货号919012),opti-mem培养基(赛默飞,货号a4124802),elisa试剂盒(南京善本生物,货号ae4106),慢病毒包装质粒prsv-rev(addgene,货号12253)、慢病毒包装质粒pmdlg/prre(addgene,货号12251)、慢病毒包装质粒vsv-g(addgene,12259)和慢病毒包装质粒 pcdh-ef1-copgfp-t2a-puro(addgene,72263),rt-qpcr滴度检测试剂盒(复能基因,货号lt006),aav病毒包装质粒paavs1-p-cag-gfp(丰晖生物,货号fh1875)、aav病毒包装质粒paav2/8(丰晖生物,fh1634)和aav病毒包装质粒paddeltaf6(丰晖生物,zt344),qpcr滴度检测试剂盒(复能基因,货号aa302)。
14.二:实验方法:(1)hek 293细胞传代培养:将悬浮hek 293细胞以0.6
×
106个活细胞/ml的密度接种于125ml摇瓶内,培养体系为30 ml hek 293细胞培养基,培养箱设定为37℃、8% co2,转速为95 rpm(50 mm转径摇床)或125 rpm(19 mm转径摇床),每72小时进行取样,计数,传代。
15.(2)瞬转蛋白方法:取已传代3次、且活率达到90%以上的hek 293细胞进行转染,转染前调整细胞密度为2
×
106个活细胞/ml。转染试剂pei用注射水溶解,配制浓度为1mg/ml,经过0.22 μm膜除菌过滤后使用,目标蛋白质粒获得后通过外包服务进行扩增和提纯从而得到已知浓度的质粒溶液。将目标蛋白质粒、转染试剂pei分别加入1200 μl的opti-mem培养基或无菌pbs中稀释,混匀后室温静置5分钟,将转染试剂pei稀释液缓慢加入到含目标蛋白质粒的稀释液中,混匀,室温孵育10-20分钟,将两者混合物加入悬浮hek 293细胞培养液中,目标蛋白质粒的终浓度为1.0 μg/ml,转染试剂pei的终浓度为3 μg/ml。最后将细胞培养混合物转移至培养箱中培养,无需换液,72小时后可进行蛋白收获。使用elisa试剂盒检测上清液中蛋白产量。
16.(3)慢病毒包装方法:取已传代3次、且活率达到90%以上的hek 293细胞进行转染,转染前调整细胞密度为3
×
106个活细胞/ml。转染试剂pei用注射水溶解,配制浓度为1mg/ml,经过0.22 μm膜除菌过滤后使用,4种慢病毒包装质粒获得后均通过外包服务进行扩增和提纯从而得到已知浓度的质粒溶液。将4种慢病毒包装质粒、转染试剂pei分别加入1200 μl的opti-mem培养基或无菌pbs中稀释,混匀后室温静置5分钟,将转染试剂pei稀释液缓慢加入到含质粒的稀释液中,混匀,室温孵育10-20分钟,将混合物加入悬浮hek 293细胞培养液中,4种慢病毒包装质粒混合物的终浓度为1.5 μg/ml,转染试剂pei的终浓度为4.5μg/ml,其中各慢病毒包装质粒的质量比例为:prsv-rev:pmdlg/prre:vsv-g:pcdh-ef1-copgfp-t2a-puro=2:2:1:5,最后将细胞培养混合物转移至培养箱中培养,无需换液,72小时后可进行转染效率检测、收获病毒。使用rt-qpcr滴度检测试剂盒检测病毒滴度。
17.(4)aav(adeno-associate virus,腺相关病毒)包装方法:取已传代3次、且活率达到90%以上的hek 293细胞进行转染,转染前调整细胞密度为2
×
106个活细胞/ml。转染试剂pei用注射水溶解,配制浓度为1mg/ml,经过0.22 μm膜除菌过滤后使用,3种aav病毒包装质粒获得后均通过外包服务进行扩增和提纯从而得到已知浓度的质粒溶液。将3种aav病毒包
装质粒、转染试剂pei分别加入1200 μl的opti-mem培养基或无菌pbs中稀释,混匀后室温静置5分钟,将转染试剂pei稀释液缓慢加入到含质粒的稀释液中,混匀,室温孵育10-20分钟,将混合物加入悬浮hek 293细胞培养液中,质粒的终浓度为1.5 μg/ml,转染试剂pei的终浓度为4.5μg/ml,其中aav病毒包装质粒的质量比例为:paavs1-p-cag-gfp:paav2/8:paddeltaf6=4:2:4。最后将细胞培养混合物转移至培养箱中培养,无需换液,72小时后可进行转染效率检测、收获病毒。使用qpcr滴度检测试剂盒检测病毒滴度。
18.实施例1:完全按照上述实验方法(1)hek 293细胞传代培养,对hek 293细胞进行培养与包装,在opm-293 cd03培养基中添加组合物。其中低浓度组合物:精氨酸/赖氨酸多肽浓度为0.5 mg/l,半胱氨酰甘氨酸浓度为5 mg/l,吡咯喹啉醌浓度为1 mg/l;中浓度组合物:组氨酸/赖氨酸多肽终度为1 mg/l,半胱氨酰甘氨酸浓度为10 mg/l,吡咯喹啉醌浓度为2 mg/l;高浓度组合物:组氨酸/赖氨酸多肽浓度为5 mg/l,半胱氨酰甘氨酸浓度为25 mg/l,吡咯喹啉醌浓度为10 mg/l。
19.实验结果见图1:opm-293 cd03培养基、opm-293 cd03培养基+不同浓度组合物所培养的hek 293细胞活率在传代过程中均能保持在95%以上,细胞活率通过细胞计数仪计countstar检测获得,表明组合物的添加对细胞活率无明显影响;实验结果见图2:opm-293 cd03培养基、opm-293 cd03培养基+不同浓度组合物均能较好支持细胞的传代,传代至0.6
×
106个活细胞/ml,培养72小时密度均可达4.5-5.5
×
106个活细胞/ml,细胞密度通过细胞计数仪计countstar检测获得。表明组合物的添加对细胞的扩增速度无明显影响;实验结果见图3:opm-293 cd03培养基+不同浓度组合物显著提高了细胞对瞬转质粒的表达水平,瞬转蛋白最高产量达到942 mg/l,比不添加任何组合物的opm-293 cd03培养基提高133%;实验结果见图4:opm-293 cd03培养基+不同浓度组合物显著提高了细胞的慢病毒包装效率,测得的最高滴度达到9.70
×
10
6 tu/ml,比不添加任何组合物的opm-293 cd03培养基提高113%;实验结果见图5:opm-293 cd03培养基+不同浓度组合物显著提高了细胞的aav包装效率,测得的最高滴度达到1.18
×
10
12 vg/ml,比不添加任何组合物的opm-293 cd03培养基提高494%,vg/ml是vector genomes/ml的缩写,意为每ml病毒液中含有的基因组拷贝总数,一般用于表示aav腺相关病毒载体的滴度,文献中常见的一种缩写形式。
20.实施例2:完全按照上述实验方法(1)hek 293细胞传代培养,对hek 293细胞进行培养与包装,在lv-max 293培养基中添加组合物。其中低浓度组合物:精氨酸/赖氨酸多肽浓度为0.5 mg/l,半胱氨酰甘氨酸浓度为5 mg/l,吡咯喹啉醌浓度为1 mg/l;中浓度组合物:组氨酸/赖氨酸多肽终度为1 mg/l,半胱氨酰甘氨酸浓度为10 mg/l,吡咯喹啉醌浓度为2 mg/l;高浓度组合物:组氨酸/赖氨酸多肽浓度为5 mg/l,半胱氨酰甘氨酸浓度为25 mg/l,吡咯喹啉醌浓度为10 mg/l。
21.实验结果见图6:lv-max 293培养基、lv-max 293培养基+不同浓度组合物所培养的hek 293细胞活率在传代过程中均能保持在95%以上,表明组合物的添加对细胞活率无明
显影响;实验结果见图7:lv-max 293培养基、lv-max 293培养基+不同浓度组合物均能较好支持细胞的传代,传代至0.6
×
106个活细胞/ml,培养72小时密度均可达4.0-5.5
×
106个活细胞/ml。表明组合物的添加对细胞的扩增速度无明显影响;实验结果见图8:lv-max 293培养基+不同浓度组合物显著提高了细胞对瞬转质粒的表达水平,瞬转蛋白最高产量达到910 mg/l,比不添加任何组合物的lv-max 293培养基提高161%;实验结果见图9:lv-max 293培养基+不同浓度组合物显著提高了细胞的慢病毒包装效率,测得的最高滴度达到9.37
×
10
6 tu/ml,比不添加任何组合物的lv-max 293培养基提高152%;实验结果见图10:lv-max 293培养基+不同浓度组合物显著提高了细胞的aav包装效率,测得的最高滴度达到1.17
×
10
12 vg/ml,比不添加任何组合物的lv-max 293培养基提高374%。
22.实施例3:完全按照上述实验方法(1)hek 293细胞传代培养,对hek 293细胞进行培养与包装,在freestyle f17 293培养基中添加组合物。其中低浓度组合物:精氨酸/赖氨酸多肽浓度为0.5 mg/l,半胱氨酰甘氨酸浓度为5 mg/l,吡咯喹啉醌浓度为1 mg/l;中浓度组合物:组氨酸/赖氨酸多肽终度为1mg/l,半胱氨酰甘氨酸浓度为10 mg/l,吡咯喹啉醌浓度为2 mg/l;高浓度组合物:组氨酸/赖氨酸多肽浓度为5 mg/l,半胱氨酰甘氨酸浓度为25 mg/l,吡咯喹啉醌浓度为10 mg/l。
23.实验结果见图11:freestyle f17 293培养基、freestyle f17 293培养基+不同浓度组合物所培养的hek 293细胞活率在传代过程中均能保持在95%以上,表明组合物的添加对细胞活率无明显影响;实验结果见图12:freestyle f17 293培养基、freestyle f17 293培养基+不同浓度组合物均能较好支持细胞的传代,传代至0.6
×
106个活细胞/ml,培养72小时密度均可达4.0-5.0
×
106个活细胞/ml。表明组合物的添加对细胞的扩增速度无明显影响;实验结果见图13:freestyle f17 293培养基+不同浓度组合物显著提高了细胞对瞬转质粒的表达水平,最高产量达到869 mg/l,比不添加任何组合物的freestyle f17 293培养基提高164%;实验结果见图14:freestyle f17 293培养基+不同浓度组合物显著提高了细胞的慢病毒包装效率,测得的最高滴度达到9.86
×
106tu/ml,比不添加任何组合物的freestyle f17 293培养基提高152%;实验结果见图15:freestyle f17 293培养基+不同浓度组合物显著提高了细胞的aav包装效率,测得的最高滴度达到1.11
×
10
12 vg/ml,比不添加任何组合物的freestyle f17 293培养基提高332%。
24.需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要
素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
25.最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1