一种基于双侧进样的高通量双凹形捕获配对结构阵列的细胞电融合芯片装置及制备方法
1.本发明涉及细胞电融合芯片领域,具体涉及一种基于双侧进样的高通量双凹形捕获配对结构阵列的细胞电融合芯片装置及制备方法。
背景技术:
2.电融合技术是上世纪80年代建立起来的一种新型促融合技术。当细胞置于非常高的电场中,细胞膜就变得具有通透性,能让外界的分子扩散进细胞内,这一现象称为电融合,又叫电穿孔。运用这一技术,许多物质,包括dna、rna、蛋白质、药物、抗体和荧光探针都能载入细胞。与其他常用的导入外源物质的方法相比,电融合具有很多有点:一、电融合不必象显微注射那样使用玻璃针,不需要技术培训和昂贵的设备,可以一次对成百万的细胞进行注射;二、与用化学物质相比,电融合几乎没有生物或化学副作用;三、因为电融合是一种物理方法,较少依赖细胞类型,因而应用广泛。
3.尽管细胞电融合技术在育种、杂交研究和细胞克隆方面得到了成功应用,但是还存在一些问题。传统细胞合技术由于依赖于待融合细胞的随机接触,这就造成了同种细胞自融合现象,大大降低了融合的效率,造成了珍贵细胞资源的浪费;而且待融合细胞如果尺寸差异较大,由于跨膜电位的巨大差异最终也会使得融合效率极低。
技术实现要素:
4.本发明意在提供一种基于双侧进样的高通量双凹形捕获配对结构阵列的细胞电融合芯片装置及制备方法,以解决现有技术中细胞融合技术存在的融合效率低的问题。
5.为达到上述目的,本发明采用如下技术方案:一种基于双侧进样的高通量双凹形捕获配对结构阵列的细胞电融合芯片装置,包括从下到上依次设置的电极层和pdms双侧流场捕获结构层,电极层连接有外细胞电融合仪,pdms双侧流场捕获结构层包括若干阵列排布的捕获配对结构和通道,捕获配对结构均包括位于中部的配对结构和位于配对结构两侧的捕获结构,两个捕获结构对称设置。
6.另一方面,本技术方案提供一种基于双侧进样的高通量双凹形捕获配对结构阵列的细胞电融合芯片装置的制备方法,包括如下步骤:
7.步骤一、采用湿法刻蚀法加工电极层;
8.步骤二、构建pdms双侧流场捕获结构层,利用pdms多聚物通过软光刻工艺和倒模构建;
9.步骤三、等离子清洗;
10.步骤四、键合。
11.本方案的原理及优点是:实际应用时,针对现有技术中细胞融合(尤其是尺寸差异较大的异源细胞融合)时由于随机接触与膜电位差异导致的融合效率低的现状,发明人聚焦于提高细胞电融合中异源细胞的配对效率,并拟对细胞融合芯片的结构进行革新,开发
一种高通量的微流控捕获配对融合芯片。芯片结构拟通过微流控芯片的结构设计,使异源细胞从不同的方向进入结构被捕获,控制异源细胞进行高效配对。本技术方案中,为了实现高效的细胞融合,对电融合芯片结构进行了优化设计,通过对通道结构及捕获结构的升级,当待融合的细胞沿通道进入捕获配对结构内后,电极层通过与外细胞电融合仪形成连接,外界电信号将引入到电极上,相邻的微电极间将形成足够强度的电场,实现芯片内部的细胞的高效电融合。通过流路控制模块可实现细胞的进样、捕获配对和出样。此外,为了实现高通量,本技术方案采用双侧流场的捕获结构,在保证了高通量的前提下提高了异源细胞配对效率。
12.优选的,作为一种改进,捕获结构由通道侧壁和微柱围成,捕获结构的一端与配对结构连通,捕获结构的另一端设置有内凹的圆弧段。
13.本技术方案中,通过在捕获结构上设置圆弧段,该圆弧段与微柱配合能够实现细胞的快速捕获,进而实现高效配对。
14.优选的,作为一种改进,圆弧段的半径为12~16μm。
15.本技术方案中,圆弧段的半径是基于选用的实验细胞的直径确定的,如果半径过大,在捕获过程中会使细胞直接进入配对腔室而不会先卡入捕获位点,造成多细胞捕获;如果半径过小会使细胞难以被捕获在捕获位点,影响捕获效率。
16.优选的,作为一种改进,配对结构包括捕获腔室和设置在捕获腔室内的两个凹形微柱,两个凹形微柱围成两个对称的捕获位点,捕获位点的中部设置有开口,用于实现连通和待配对细胞的接触。
17.本技术方案中,当细胞被捕获后会通过负压吸入操作使细胞沿通道进入到配对腔室内,并在配对位点的开口处,实现待配对两个细胞的接触。
18.优选的,作为一种改进,开口的宽度为8~14μm。
19.本技术方案中,开口的宽度是基于选用的实验细胞的直径同时考虑细胞融合需要的有效接触面积决定的。如果宽度过大,则在吸入细胞进配对腔时,细胞会通过开口穿到另一侧;如果宽度过小则细胞在融合过程中会由于接触不够紧密难以实现融合。
20.优选的,作为一种改进,还包括与通道配合的pdms融合结构芯片,pdms融合结构芯片上设置有两个进样口、两个出样口、结构微柱、微通道和储样池,结构微柱、微通道和储样池均设置在pdms融合结构芯片底部,两个进样口和出样口分别设置为垂直贯穿pdms融合结构芯片并位于储样池的上方。
21.本技术方案中,pdms融合结构芯片主要用于实现细胞缓冲液在上述结构的进样、捕获配对和出样。
22.优选的,作为一种改进,电极层上设置有叉指电极阵列,叉指电极阵列的相邻两个梳齿距离为60~80m范围,叉指电极的宽度为150~200μm。
23.本技术方案中,叉指电极的宽度既要使其在所给定的低电压条件下满足细胞穿孔所需的电场强度又要方便制备加工,上述的叉指电极的宽度为经过实践验证的合适宽度范围。此外,相邻两个叉指电极之间的距离对细胞穿孔的难易程度具有较大影响,距离过大则要达到细胞穿孔所需要施加的电压就越大,对于外界电器的要求变高;而距离太窄则可能在现有的工艺条件下无法将电极刻蚀出来,且施加很小的电压便有可能将细胞击穿电死。
24.优选的,作为一种改进,步骤三中,等离子清洗的条件为清洗时间10~15s。
25.本技术方案中,等离子清洗的时间主要影响芯片和ito电极的键合效果,清洗时间过长则会导致键合太紧,细胞液不易进入结构,清洗时间过短则会导致键合不紧容易漏液。
26.优选的,作为一种改进,步骤四中,键合工艺为热键和,键合温度为100~150℃。
27.本技术方案中,通过实践验证,上述的键合温度为较适宜温度,能够保证键合的效果达到预期要求。
附图说明
28.图1为本发明ito叉指电极结构示意图。
29.图2为本发明实施例中pdms双侧流场捕获结构层结构示意图。
30.图3为本发明实施例中捕获配对结构示意图。
31.图4为pdms融合芯片的结构示意图。
具体实施方式
32.下面通过具体实施方式进一步详细说明,但本发明的实施方式不限于此。若未特别指明,下述实施方式所用的技术手段为本领域技术人员所熟知的常规手段;所用的实验方法均为常规方法;所用的材料、试剂等,均可从商业途径得到。
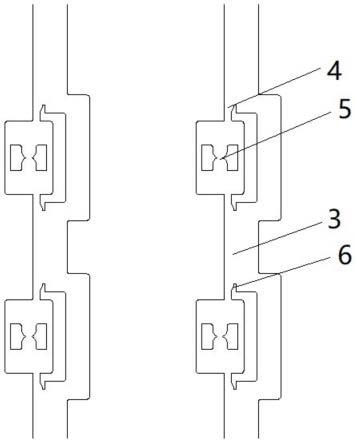
33.说明书附图中的附图标记包括:叉指电极阵列1、双侧流场捕获结构2、通道3、捕获结构4、配对结构5、圆弧段6、进样口i 7、进样口ii8、进口储样池i9、进口储样池ii10、出样口i11、出样口ii12、出口储样池i13、出口储样池ii14。
34.实施例基本如附图1-2所示:一种基于双侧进样的高通量双凹形捕获配对结构阵列的细胞电融合芯片装置,包括从下到上依次设置的电极层和pdms双侧流场捕获结构层。
35.电极层为ito电极层,在ito玻璃上利用湿法刻蚀出图案化的叉指电极阵列1,且ito电极层通过导电胶带与外细胞电融合仪形成连接,外界电信号将引入到ito叉指电极上,相邻的微电极间将形成足够强度的电场,实现芯片内部的细胞的高效电融合。叉指电极阵列1的梳齿距离控制在60~80μm范围内,以保证良好的导通性与可靠性;梳齿的宽度根据微电极阵列的密度确定,具体的宽度范围为150~200μm。
36.pdms双侧流场捕获结构层利用pdms多聚物构建了双侧流场捕获结构2和与之连通的通道3,主要用于实现细胞缓冲液的进样、捕获配对和出样。本实施例中,双侧流场捕获结构2和通道3的高度为30μm,双侧流场捕获结构2共由12
×
18个捕获配对结构组成,具体实施时,可以根据实际需要设置不同数量的捕获配对结构。单个捕获配对结构包括设置在两侧的捕获结构4和位于中部的配对结构5。其中,捕获结构4由通道侧壁和一个微柱围成,两个捕获结构4分别位于配对结构的上、下两侧,并对称设置,用于分别捕获两种不同的细胞;配对结构5由一个捕获腔室和双凹形微柱构成。捕获结构的捕获位点处一侧为通道壁,另一侧设置有圆弧段6,圆弧的半径为14μm,捕获结构4与配对结构5的捕获腔室之间通过一长12μm,宽14μm的通道连通。配对结构5为双凹配对结构,由两个独立的凹形微柱围成两个对称的12μm圆弧形捕获位点,中部有10μm的开口实现连通和用于配对细胞的接触。
37.通道包括主通道和旁路通道;主通道宽度57μm,总长度5806μm;旁路通道宽度35μm,长度180μm。本方案还包括pdms融合芯片,结合图3所示,pdms融合芯片上设置有两个进样口、两个出样口、储样池、微通道和捕获配对结构(捕获微柱),两个进样口分别为进样口i7
和进样口ii8,进样口i7与进样口ii8位于pdms融合芯片的两端。进样口i7与进样口ii8均竖向贯穿pdms融合芯片,且底部分别设置有进口储样池i9和进口储样池ii10。两个出样口包括出样口i11和出样口ii12,出样口i11和出样口ii12也分别位于pdms融合芯片的两端。出样口i11和出样口ii12均竖向贯穿pdms融合芯片,且底部分别设置有出口储样池i13和出口储样池ii14。进口储样池i9和进口储样池ii10、出口储样池i13和出口储样池ii14均与微通道和捕获配对结构位于同一平面内。
38.进口储样池i9与出口储样池i13的连线、进口储样池ii10与出口储样池ii14的连线相互交叉。这样交叉设置首先是为了满足捕获配对操作中两种细胞分别从两侧分别进样被捕获和吸入配对结构的需求,避免两种细胞从相同入口引入造成造成污染,影响配对;其次进出样口呈一条斜线设置,可以使得引入结构内的细胞可以流入每一条通道,避免压强影响下细胞只流入部分通道,造成不捕获配对降低的后果。本实施例中,进样口与出样口的直径均为3mm,具体使用时可以根据实际情况灵活调节。
39.一种基于双侧进样的双凹形捕获配对结构阵列的细胞电融合芯片装置的制备方法,包括如下步骤:
40.步骤一、加工ito电极阵列,采用湿法刻蚀工艺实现,具体包括:
41.s1、选用ito玻璃作为加工芯片的基片;
42.s2、在ito玻璃上旋涂一层5μm su-8 3005光刻胶;
43.s3、通过光刻和湿法刻蚀的方式在ito层上刻蚀出叉指微阵列结构。
44.步骤二、构建pdms双侧流场捕获配对结构:利用pdms多聚物构建双侧流场捕获配对结构和通道结构,具体包括:
45.(1)利用软光刻工艺,加工结构高度厚度为30μm的模具,模具结构为细胞悬浮液储样池、进样口、出样口和微通道阵列结构;
46.(2)将模具固定于一亚克力模具上;
47.(3)倒入混合好的pdms混合胶,静止后抽真空;
48.(4)置于加烘箱中65℃固化;
49.(5)揭下固化后pdms,根据ito叉指电极形状适配剪裁,并去除进样口、出样口的胶即可。
50.步骤三、等离子清洗,等离子清洗时间为10-15s;
51.步骤四、键合,将pdms双侧流场捕获配对结构pdms芯片反扣置于ito电极上,采用热键合工艺,与芯片形成一密闭腔体,仅通过进样口和出样口进行细胞悬浮液的进出样。
52.使用时的操作步骤如下:
53.步骤i:首先封住进样口ii8和出样口ii12,在进样口i7滴加细胞i的悬液,在出样口i11施加负压,使细胞i进入通道以较高流速被高效捕获在捕获结构。
54.步骤ii:将细胞i悬液更换为pm缓冲液冲洗通道1min。
55.步骤iii:在出样口i11施加更大压强,在极短时间内将位于捕获结构的细胞i吸入配对结构并卡在凹槽内。
56.步骤iv:封住进样口i7和出样口i11,打开进样口ii8和出样口ii12,以相同的步骤将细胞ii捕获在捕获结构然后吸入配对结构的凹槽内。由于结构的设计和短时间的高负压可使细胞i不至于被吸出配对腔室。
57.步骤v:利用ito电极先施加交流信号,让在配对腔室的两种细胞(细胞i和细胞ii)因介电电泳力卡入双凹形配对结构中并紧密接触,完成配对。
58.步骤vi:施加直流脉冲信号和促融信号,融合异源细胞。
59.以上所述的仅是本发明的实施例,方案中公知的具体技术方案和/或特性等常识在此未作过多描述。应当指出,对于本领域的技术人员来说,在不脱离本发明技术方案的前提下,还可以作出若干变形和改进,这些也应该视为本发明的保护范围,这些都不会影响本发明实施的效果和专利的实用性。本技术要求的保护范围应当以其权利要求的内容为准,说明书中的具体实施方式等记载可以用于解释权利要求的内容。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1