一种水解制备(+)γ-内酰胺的方法
一种水解制备(+)
γ-内酰胺的方法
技术领域
1.本发明属于生物工程技术领域,涉及一种水解制备(+)γ-内酰胺的方法,具体涉及一种微生物不对称水解制备(+)γ-内酰胺的方法。
背景技术:
2.γ-内酰胺酶是酰胺酶的一种,由于其能选择性降解工业上的(
±
)γ-内酰胺,因而被命名为γ-内酰胺酶。(
±
)γ-内酰胺则是一种可以合成数十种药物的医药中间体,如治疗艾滋病的阿巴卡韦以及治疗甲型流感的帕拉米韦。γ-内酰胺市场需求巨大,但(
±
)γ-内酰胺自身却是外消旋体,包含(
±
)两种旋光构型:(+)γ-内酰胺以及(-)γ-内酰胺。临床上已知阿巴卡韦的药理活性来源于(-)阿巴卡韦,因而科学工作者们的目光都锁定在了挖掘(+)γ-内酰胺酶上,试图利用(+)γ-内酰胺酶拆分(
±
)γ-内酰胺,从而得到光学纯的(-)γ-内酰胺以满足生产需要。但实际上(+)γ-内酰胺也可以通过溴化作用实现构型翻转,因而(+)γ-内酰胺在工业应用上同样具有价值。
3.目前制备单构型γ-内酰胺的方法主要有不对称合成法和外消旋体拆分法,外消旋拆分法又包括循环优先结晶法和生物不对称拆分法。不对称合成法是创造一个不对称的反应条件或环境,使反应按一定的方向进行,从而使两个对映体中的一个占优势的合成方法,但这种方法效果很差。循环优先结晶法操作太过繁琐,不适合工业化生产,且存在产率低等问题。
技术实现要素:
4.生物法具有反应条件温和,效率高,立体选择性高,环境友好,利于工业放大等等优点。本发明的目的在于提供一种水解制备(+)γ-内酰胺的方法,通过调控优化微生物产酶、对酶液进行浓缩,转化过程中采取抑菌措施,进而能高效、安全的降解(
±
)γ-内酰胺生产(+)γ-内酰胺产品。
5.为实现上述发明目的,本发明采用以下技术方案:
6.一种水解制备(+)γ-内酰胺的方法,包括以下步骤:
7.步骤一、微生物发酵产(-)γ-内酰胺酶
8.选产(-)γ-内酰胺酶的菌株作为种子,经28℃、150r/min培养得种子液,再以体积分数2.0%~8.0%接种量接入装有产酶发酵培养基的发酵罐,装液量15%~35%,培养温度25℃~32℃,转速为110~180rpm,通气量1vvm~3vvm,初始ph5.0~9.0,发酵20~60h后收集发酵液;
9.步骤二、粗酶液的获得
10.将步骤一获得的发酵液低温高速离心,分离菌体,收集菌体,得到的湿菌体经磷酸钠缓冲液洗涤3次,将菌体悬于磷酸钠缓冲液中,进行细胞破碎,破碎后10000rpm离心,取上清液为粗酶液,低温储存,备用;
11.步骤三、酶液浓缩
12.将步骤二所得的(-)γ-内酰胺酶粗酶液,低温透析浓缩得到浓缩酶液,浓缩时使用10kd离心超滤管;测粗酶液和浓缩酶液酶活,计算回收率;
13.步骤四、生产(-)γ-内酰胺
14.利用步骤三中获得的浓缩酶液无菌转化(
±
)γ-内酰胺;其中,转化体系的温度为24℃~35℃,搅拌速度为150rpm,转化24~60h,并向转化体系中加入抗生素,得到的(-)γ-内酰胺用液相法检测浓度。
15.优选地,步骤一中所述经28℃、150r/min培养的培养基包括酵母膏5g/l,葡萄糖5g/l,kh2po47g/l,na2hpo42g/l,mgso40.4g/l,feso40.02g/l,cacl20.02g/l,nh4cl 5g/l,调节ph7.0。
16.优选地,步骤一所述产酶发酵培养基为葡萄糖4g/l,蛋白胨10g/l,tween-801g/l,kh2po47g/l,na2hpo41.5g/l,mg2so40.4g/l,ph7.5。
17.优选地,所述的产(-)γ-内酰胺酶的菌株为嗜冷杆菌,购自中国菌种保藏中心,编号为bio-091077。
18.优选地,步骤二中所述低温高速离心的条件具体为4℃,12000rpm。
19.优选地,步骤二中所述磷酸钠缓冲液的浓度为0.05mol/l,ph为7.0。
20.优选地,步骤三中所述浓缩温度为4℃,浓缩条件为10000r/min离心30min。
21.优选地,步骤四中加入的抗生素占转化体系体积分数的0.1%~0.2%。
22.优选地,步骤四中所述的抗生素为卡纳或四环素。
23.酶活测定方法:将洗涤后的菌体悬浮于浓度为10g/l的n-乙酰-l-苯丙氨酸的ph 7.0的0.05mol/l磷酸盐缓冲液中,温度28℃、摇床转速150rpm条件下反应30min,在反应初速度线性范围内。10000rpm离心10min,取上清液。上清液经正丁醇萃取后,再经有机滤膜过滤制成上样样品,每组实验平行3次。手性hplc分析检测转化后样品中(
±
)γ-内酰胺的浓度,并计算每升发酵液的酶活(u/l)。
24.酶活定义:在28℃下,每分钟水解1μmol(+)γ-内酰胺所需要的酶量定义为一个酶活单位(u)。
25.与现有技术相比,本发明的有益效果为:
26.(1)利用超滤管及透析袋浓缩(-)γ-内酰胺酶液,较传统浓缩酶液的方法具有操作简单,成本低,高酶活回收率的优势。超滤管浓缩酶液节约时间,且能重复利用。
27.(2)采用高浓度酶液生产(+)γ-内酰胺效率高,快速,大大降低了生产成本。
28.(3)采用向转化体系中加入适量抗生素,可有效地防止染菌,降低了安全隐患。
29.(4)转化体系经过实验优化,转化效率高。
附图说明
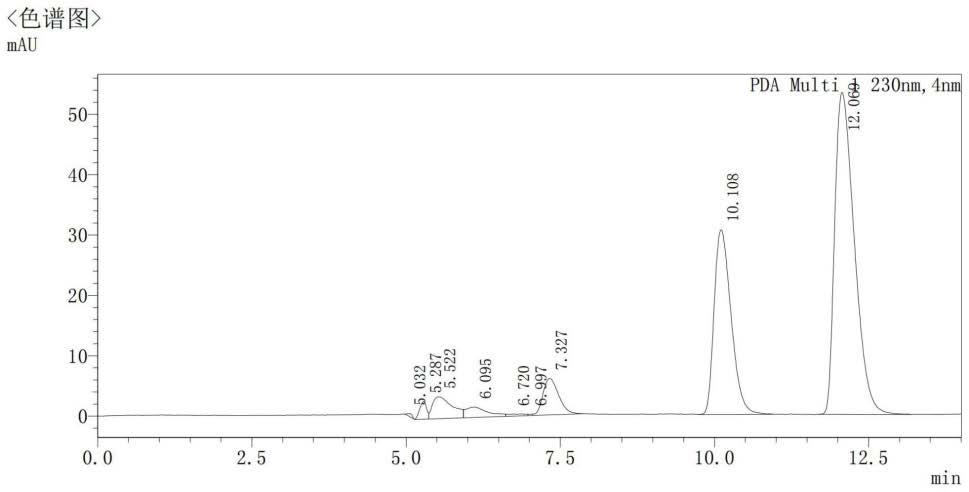
30.图1为本发明实施例1液相法检测(+)γ-内酰胺浓度的色谱图;
31.图2为本发明实施例2液相法检测(+)γ-内酰胺浓度的色谱图;
32.图3为本发明实施例3液相法检测(+)γ-内酰胺浓度的色谱图。
具体实施方式
33.下面结合附图和具体实施方式对本发明作进一步详细的说明。应理解,以下实施
例仅用于说明本发明而非用于限制本发明的范围。如无特殊说明,本发明所采用的实验方法均为常规方法,所用实验器材、材料、试剂等均可从商业途径获得。
34.实施例1
35.步骤一、微生物发酵产(-)γ-内酰胺酶
36.选用嗜冷杆菌作为种子,接种到培养基(酵母膏5g/l,葡萄糖5g/l,kh2po47g/l,na2hpo42g/l,mgso40.4g/l,feso40.02g/l,cacl20.02g/l,nh4cl 5g/l,调节ph7.0)上,28℃、150r/min培养16h,再以体积分数5%接种量接入装有产酶发酵培养基(葡萄糖4g/l,蛋白胨10g/l,tween-801g/l,kh2po47g/l,na2hpo41.5g/l,mg2so40.4g/l,ph7.5)的7.5l发酵罐,装液量2.5l,培养温度28℃,转速为150rpm,通气量1vvm,初始ph8.0,发酵24h后收集发酵液。
37.步骤二、粗酶液的获得
38.将步骤一获得的发酵液4℃、12000rpm离心,分离菌体,收集菌体,得到的湿菌体经磷酸钠缓冲液(0.05mol/l,ph 7.0)洗涤3次,将菌体悬于缓冲液中(0.05mol/l,ph 7.0),进行细胞破碎,破碎后10000rpm离心,取上清液为粗酶液,4℃储存,备用。
39.步骤三、酶液浓缩
40.将步骤二所得的(-)γ-内酰胺酶粗酶液,低温超滤浓缩得到浓缩酶液,浓缩温度为4℃,10000r/min离心30min,浓缩酶液体积为0.5倍体积分数,测粗酶液酶活为0.75u/ml和浓缩酶液酶活1.35u/ml,(-)γ-内酰胺酶回收率为87%。
41.步骤四、生产(+)γ-内酰胺
42.利用步骤三中获得的浓缩酶液无菌转化(
±
)γ-内酰胺,将1mm酶液作用于浓度为2g/l的(
±
)γ-内酰胺磷酸盐缓冲液中(0.05mol/l,ph7.0),温度28.0℃、摇床转速150r/min条件下分别反应10min、20min、30min、60min、120min、180min、240min、300min、360min、420min、480min,并加入抗生素,反应后10000rpm离心10min,取上清液。上清液经正丁醇萃取后,再经有机滤膜过滤制成上样样品,每组实验平行3次。液相法检测(+)γ-内酰胺浓度,结果见图1。
43.实施例2
44.步骤一、微生物发酵产(-)γ-内酰胺酶
45.选用嗜冷杆菌作为种子,接种到培养基(酵母膏5g/l,葡萄糖5g/l,kh2po47g/l,na2hpo42g/l,mgso40.4g/l,feso40.02g/l,cacl20.02g/l,nh4cl 5g/l,调节ph7.0)上,28℃、150r/min培养16h,再以体积分数5%接种量接入装有产酶发酵培养基(葡萄糖4g/l,蛋白胨10g/l,tween-801g/l,kh2po47g/l,na2hpo41.5g/l,mg2so40.4g/l,ph7.5)的7.5l发酵罐,装液量2.5l,培养温度28℃,转速为150rpm,通气量2vvm,初始ph8.0,发酵24h后收集发酵液。
46.步骤二、粗酶液的获得
47.将步骤一获得的发酵液低温高速离心,分离菌体,收集菌体,得到的湿菌体经磷酸钠缓冲液(0.05mol/l,ph 7.0)洗涤3次,将菌体悬于缓冲液中(0.05mol/l,ph 7.0),进行细胞破碎,破碎后10000rpm离心,取上清液为粗酶液,4℃储存,备用。
48.步骤三、酶液浓缩
49.将步骤二所得的(-)γ-内酰胺酶粗酶液,低温超滤浓缩得到浓缩酶液,浓缩温度为4℃,10000r/min离心30min,浓缩酶液体积为2/3倍体积分数,测粗酶液酶活为0.79u/ml和浓缩酶液酶活1.12u/ml,(-)γ-内酰胺酶回收率为90%。
50.步骤四、生产(+)γ-内酰胺
51.利用步骤三中获得的浓缩酶液无菌转化(
±
)γ-内酰胺,将1mm酶液作用于浓度为2g/l的(
±
)γ-内酰胺磷酸盐缓冲液中(0.05mol/l,ph7.0),分别在不同温度(24.0℃、26.0℃、28.0℃、30.0℃、32.0℃)下,摇床转速150rpm条件下反应30min(反应初速度线性范围内),并加入抗生素,反应后10000rpm离心10min,取上清液。上清液经正丁醇萃取后,再经有机滤膜过滤制成上样样品,每组实验平行3次。液相法检测(+)γ-内酰胺浓度,结果见图2。
52.实施例3
53.步骤一、微生物发酵产(-)γ-内酰胺酶
54.选用嗜冷杆菌作为种子,接种到培养基(酵母膏5g/l,葡萄糖5g/l,kh2po47g/l,na2hpo42g/l,mgso40.4g/l,feso40.02g/l,cacl20.02g/l,nh4cl 5g/l,调节ph7.0)上,28℃、150r/min培养16h,再以体积分数5%接种量接入装有产酶发酵培养基(葡萄糖4g/l,蛋白胨10g/l,tween-801g/l,kh2po47g/l,na2hpo41.5g/l,mg2so40.4g/l,ph7.5)的7.5l发酵罐,装液量2.5l,培养温度28℃,转速为180rpm,通气量2vvm,初始ph8.0,发酵24h后收集发酵液。
55.步骤二、粗酶液的获得
56.将步骤一获得的发酵液低温高速离心,分离菌体,收集菌体,得到的湿菌体经磷酸钠缓冲液(0.05mol/l,ph 7.0)洗涤3次,将菌体悬于缓冲液中(0.05mol/l,ph 7.0),进行细胞破碎,破碎后10000rpm离心,取上清液为粗酶液,4℃储存,备用。
57.步骤三、酶液浓缩
58.将步骤二所得的(-)γ-内酰胺酶粗酶液,低温超滤浓缩得到浓缩酶液,浓缩温度为4℃,10000r/min离心30min,浓缩酶液体积为1/3倍体积分数,测粗酶液酶活为0.82u/ml和浓缩酶液酶活2.21u/ml,低温γ-内酰胺酶回收率为85%。
59.步骤四、生产(+)γ-内酰胺
60.利用步骤三中获得的浓缩酶液无菌转化(
±
)γ-内酰胺,将1mm酶液作用于浓度为2g/l的(
±
)γ-内酰胺磷酸盐缓冲液中(0.05mol/l,ph7.0),分别在不同温度ph值(ph5.0、ph6.0、ph7.0、ph8.0、ph9.0),28℃,摇床转速150rpm条件下反应30min(反应初速度线性范围内),并加入抗生素,反应后10000rpm离心10min,取上清液。上清液经正丁醇萃取后,再经有机滤膜过滤制成上样样品,每组实验平行3次。液相法检测(+)γ-内酰胺浓度,结果见图3。
61.以上所述实施方式仅为本发明的优选实施例,而并非本发明可行实施的全部实施例。对于本领域一般技术人员而言,在不背离本发明原理和精神的前提下对其所作出的任何显而易见的改动,都应当被认为包含在本发明的权利要求保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1