工程化的巨噬细胞及其在治疗纤维化疾病中的应用的制作方法
1.本发明涉及分子生物学、基因工程、免疫细胞治疗和生物医药领域,具体涉及一种分泌抗纤维化蛋白的工程化巨噬细胞及其构建方法和在治疗纤维化疾病中的应用。
背景技术:
2.纤维化是由长期实质细胞损伤和/或炎症引起的与慢性损伤相关的常见瘢痕形成反应,其可能由多种因素引起,例如药物、毒素、辐射、任何干扰组织或细胞稳态的过程、中毒损伤、血流改变、感染(病毒、细菌、螺旋体和寄生虫)、沉积症以及导致有毒代谢产物积累的障碍。纤维化最常见于肝、心、肺、腹膜和肾。
3.肺纤维化(pulmonary fibrosis,pf) 是一种危及生命的肺间质疾病,从全球来看,发病率总体在1 /10 000 左右。在过去的10年,pf 的发病率和患病率总体呈上升趋势。包括博莱霉素、二氧化硅、百草枯等继发因素导致的肺纤维化以及不明原因的肺纤维化。pf的形成是由于肺组织损伤与修复失衡,形成了纤维化的瘢痕组织,肺组织结构重塑,肺通气-血流比例失调,最终发展为呼吸衰竭。肺纤维化的治疗主要集中在并发症的治疗上,糖皮质激素、免疫抑制剂及抗氧化药物的使用对纤维化的改善效果甚微,且有严重的副作用。肺移植为根治肺纤维化的手段,但由于供体较少,局限性很大。因此,迫切需要开发新一代治疗肺纤维化的药物和方法。
4.白细胞介素-10(il-10)是一种有效的抗炎、抗纤维化细胞因子,这使其成为肺纤维化极具吸引力的治疗候选药物。研究显示,转化生长因子-β1(tgf-β1)是肺纤维化发生与发展中发挥关键作用的介导因子,其主要与转化生长因子-β1 ii型受体的胞外结构域(ex-tβrii)结合,从而激活下游信号转导致肺纤维化发生。有文献报道,通过使用tgf-β ii型受体(tβrii)或抗tgf-β1抗体,阻断tgf-β1与ex-tβrii的结合,成为改善肺纤维化的一种选择。ecm的合成和降解主要受基质金属蛋白酶(matrix metalloproteinase, mmps)和金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinases, timps)调控。巨噬细胞是mmp的重要来源kupffer细胞(kcs)可表达多种基质金属蛋白酶,如mmp-9、mmp-12、mmp-13等对基质进行降解,有利于肝损伤和纤维化的修复。有研究表明,小鼠输注骨髓源性巨噬细胞可明显缓解肝纤维化,改善肝功能cd147,一种通过诱导mmp对ecm重构至关重要的膜分子在巨噬细胞中激活cd147是激活mmps和降解ecm的一种可行方法 。
5.巨噬细胞几乎存在于所有组织中,作为机体的第一道防线,巨噬细胞吞噬侵入的病原微生物,启动免疫反应。在肺组织中,存在两种类型的巨噬细胞,分别是肺泡巨噬细胞(alveolar)和间质巨噬细胞(interstitial),其中肺泡巨噬细胞在数量上占大多数。这些巨噬细胞通过吞噬肺泡沉积蛋白和外部颗粒或抗原、分泌细胞因子以及抗原提呈作用维持肺组织的稳态平衡。所以,一系列的肺部疾病都与这些巨噬细胞的功能和数量异常相关。在肺纤维化的发生发展过程中,巨噬细胞同样发挥关键作用。通常的观点认为,肺纤维化通常由感染或损伤导致的炎症引起。在肺部感染或损伤阶段,巨噬细胞被诱导为促进炎症的经典激活或称为m1类型,分泌肿瘤坏死因子(tnf-α)、白细胞介素-1(il-1)、il-6等促炎因子
维持肺组织的炎性状态。在促炎因素逐渐消除,炎症状态逐渐消退后,巨噬细胞转而极化为抑制炎症并促进组织修复的m2类型。在组织修复过程中,m2型巨噬细胞通过分泌转化生长因子(tgf-β),血小板源性生长因子(pdgf)等促进上皮细胞向肌成纤维细胞(myofibroblast)转化(emt),肌成纤维细胞在肺间质和破裂肺泡腔内过度增殖并分泌过量的胶原蛋白等细胞外基质,最终导致肺组织纤维化。综上所述,巨噬细胞在肺纤维化的起始和进展阶段均发挥促进作用。
6.有多种细胞因子或细胞因子衍生物被报道可以抑制肺纤维化的发生发展。例如众所周知的抗炎因子il-10既可以抑制纤维化初始阶段的炎症反应,又可以抑制纤维化形成期的胶原分泌。但是il-10非常短暂的半衰期(外周血中仅1-2分钟)限制了其作用的发挥。因此提高肺组织中il-10等治疗性蛋白的浓度和持续时间,成为治疗肺纤维化急需解决的关键问题。炎症和免疫紊乱被认为是肺纤维化发生、发展的主要因素,受巨噬细胞在炎症和免疫疾病过程中关键作用的启发,特别是能够介导和应答纤维化相关的炎症刺激和免疫因子,将巨噬细胞作为抗纤维化药物的递送载体显示出潜在的应用价值。
技术实现要素:
7.鉴于现有技术存在的问题,本发明提供了一种分泌抗纤维化蛋白的工程化巨噬细胞及其构建方法和在治疗纤维化疾病中的应用。
8.为实现上述目的,本发明采用以下技术方案。
9.一种工程化的巨噬细胞,所述巨噬细胞能够持续分泌或过表达抗纤维化蛋白。
10.进一步地,所述抗纤维化蛋白为il-10、转化生长因子-β ii型受体(tβr2-fc/tgfrcfc)或cd147。
11.所述工程化的巨噬细胞的制备方法为构建含抗纤维化蛋白基因的病毒表达体系,利用病毒表达体系将抗纤维化蛋白基因整合到巨噬细胞中。
12.进一步地,所述工程化的巨噬细胞的制备方法包括如下步骤:使巨噬细胞表达il-10、tβr2-fc或cd147蛋白,得到表达il-10、tβr2-fc或cd147蛋白的巨噬细胞。
13.进一步地,所述“使巨噬细胞表达il-10、tβr2-fc或cd147蛋白”为将含有编码il-10、tβr2-fc或cd147蛋白的基因的重组载体导入巨噬细胞,得到表达il-10、tβr2-fc或cd147蛋白的巨噬细胞。
14.进一步地,所述重组载体为重组慢病毒载体。
15.进一步地,所述方法包括如下步骤:步骤1、利用所述重组慢病毒载体和慢病毒包装质粒转染慢病毒包装细胞,培养,获得慢病毒;步骤2将步骤1得到的慢病毒感染巨噬细胞,从而获得表达il-10、tβr2-fc或cd147蛋白的巨噬细胞。
16.进一步地,所述工程化的巨噬细胞的制备方法为:利用基因工程的方法构建表达il-10、tβr2-fc的重组质粒,包装病毒,感染巨噬细胞,使其能持续稳定表达il-10或tβr2-fc或cd147。
17.进一步地,所述巨噬细胞为raw264.7细胞。
18.所述的巨噬细胞和所述方法制备的巨噬细胞在制备用于治疗纤维化疾病的产品中的应用。
19.进一步地,所述纤维化疾病为肺纤维化、肺损伤、心脏纤维化或肝纤维化。
20.一种用于治疗纤维化疾病的产品,所述产品包括所述的巨噬细胞和所述方法制备的巨噬细胞。
21.一种细胞群,其包含所述的工程化的巨噬细胞。
22.一种细胞治疗产品,其包含所述工程化的巨噬细胞。
23.进一步地,所述的细胞治疗产品还包含一种或多于一种细胞介质组分和/或治疗化合物。
24.进一步地,所述的细胞治疗产品还包含有效量的α-生育酚、干扰素-γ、槲皮素、ace抑制剂和ppar-δ中的一种或多于一种。
25.进一步地,所述的细胞治疗产品还包含适于治疗应用的药物试剂和/或赋形剂。
26.一种治疗个体的纤维化的方法,其包括施用所述的细胞治疗产品。
27.进一步地,所述纤维化是肝纤维化、心脏纤维化或肺纤维化。
28.进一步地,所述细胞治疗产品通过注射施用至所述个体。
29.进一步地,其中将细胞治疗产品注射到纤维化病变中。
30.进一步地,其中包含工程化的巨噬细胞的细胞治疗产品来自于所述个体。
31.一种在需要其的个体中逆转纤维化的方法,其包括:向个体施用能够表达重组il-10、tβr2-fc或cd147蛋白的基因工程化的巨噬细胞;将巨噬细胞靶向至个体的肺、心脏或肝;和逆转肺内的纤维化。
32.与现有技术比,本发明的有益效果如下。
33.本发明利用基因工程的方法,构建能够表达纤维化抑制因子il-10、tβr2-fc或cd147的重组质粒,包装慢病毒,感染raw264.7巨噬细胞,从而获得可以持续分泌il-10、tβr2-fc或cd147的工程化巨噬细胞raw-il10和raw-tβr2-fc或raw-cd147。以滴鼻的方式将工程化巨噬细胞进行注入肺内治疗肺纤维化,具有显著优势。一方面,滴鼻的方式操作简单方便,只需1-2次给药,避免重复给药,相对于气管内、腹腔注射等给药方式,损伤小,不易造成新的感染。和给予经基因工程改造的巨噬细胞相比,给予转载空质粒的巨噬细胞(raw-con细胞,其作用和正常的巨噬细胞基本相似),反而会加重肺纤维化的程度,分析原因可能是因为在纤维化期巨噬细胞更多被诱导分化为m2型,大量m2型巨噬细胞的存在导致肺组织损伤修复失衡,导致组织重塑与胶原形成。因此对巨噬细胞进行改造是十分有必要的。
34.利用工程化巨噬细胞治疗小鼠肺纤维化,可显著降低肺纤维化标志物col1a1、α-sma、vimentin等的表达,此工程化巨噬细胞可有效改善肺纤维化。
35.将巨噬细胞作为递送载体,可以有效将药物输送到肺部,几乎没有系统毒性,较为安全。预计这种方法可以为靶向递送抗纤维化药物提供更好的选择,同时最大限度的减少副作用发生。从临床应用出发,根据肺纤维化形成过程中不同阶段的病理生理特点,采用细胞给药的方式研究对小鼠肺纤维化的影响,获得了较为满意的结果,为临床治疗肺纤维化提供有效参考。
附图说明
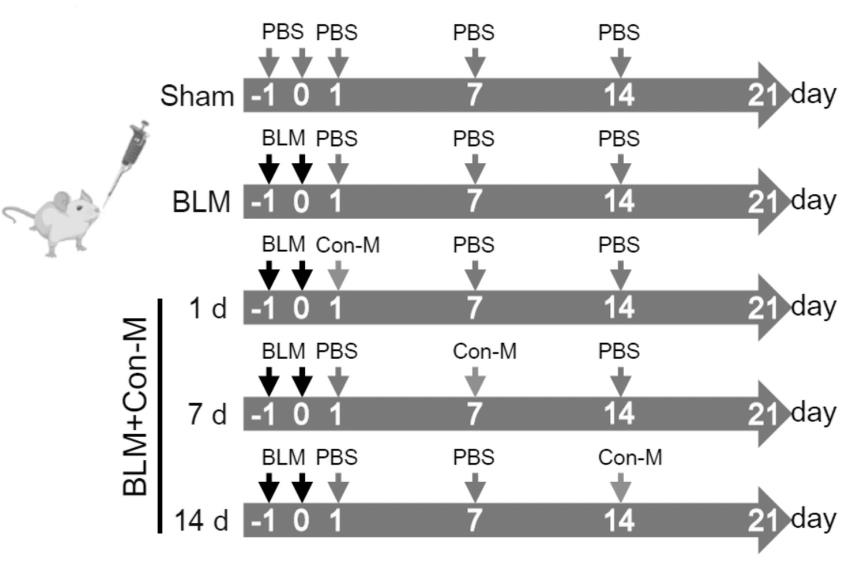
36.图1是con-m治疗blm诱导肺损伤(ipf) 试验设计示意图。
37.图2是小鼠的体重和肺湿重记录。
38.图3是微计算机断层扫描(micro-ct)图像和ct纤维化评分图。
39.图4是con-m治疗ipf的组织学评估,苏木精和伊红(h&e)染色和代表性显微照片; 采用指示性治疗的假对照和blm诱导小鼠肺切片的ashcroft评分,图示10
×
肺叶图像; 肺组织切片masson’s三色染色对胶原沉积的评价,图示10
×
肺叶图像。
40.图5是肺组织中表达的hyp含量(n = 5-10)。
41.图6是rt-pcr分析肺组织中col1a1和fsp-1的mrna水平(n = 5-10)。所有实验一式三份,每一份至少重复三次。柱形表示平均值的
±
标准误差。
42.图7是elisa法检测il-10
‑ꢀ
m和con-m上清中il-10的含量。
43.图8是il10-m对blm诱导的肺损伤(ipf)的实验设计示意图。
44.图9是各组小鼠体重记录。
45.图10是各组小鼠右肺湿重记录。
46.图11是微计算机断层扫描(micro-ct)图像和ct纤维化评分图。
47.图12是il10-m治疗对ipf的组织学评估,苏木精和伊红染色的代表性显微照片(h&e)和sham对照组和blm诱导小鼠肺切片的ashcroft评分,图示10
×
肺叶图像;肺组织切片masson’s三色染色对胶原沉积的评价。
48.图13是采用rt-pcr分析肺组织中il-10 mrna水平(n = 5-7)。
49.图14是第7天采用elisa法检测肺组织匀浆中il-10、tgf-β的浓度。
50.图15是肺组织中hyp表达量(n = 5-10)。
51.图16是采用rt-pcr (qpcr)分析肺中col1a1和fsp-1的mrna水平(n = 5-10)。所有实验一式三份,每一份至少重复三次。柱形表示平均值的
±
标准误差。
52.图17是tgfrcfc和对照293t或raw264.7细胞中tgfrcfc蛋白的western blot分析。
53.图18是tgfrcfc-m上清液抑制tgf-β/smad信号通路。按要求处理mle和raw264.7细胞,收集细胞,western blot检测p-smad2/3和smad2/3。
54.图19是tgfrcfc-m对blm诱导肺损伤(ipf)的实验设计示意图。
55.图20是各组小鼠体重记录。
56.图21是各组小鼠右肺湿重记录。
57.图22是微计算机断层扫描(micro-ct)图像和ct纤维化评分。
58.图23是tgfrcfc
ꢀ‑
m治疗对ipf的组织学评估,苏木精和伊红(h&e)染色的代表性显微照片和sham对照和blm诱导小鼠肺切片的ashcroft评分,图示10
×
肺叶图像。
59.图24是肺组织切片masson’s三色染色评价胶原沉积。
60.图25是elisa法测定肺组织匀浆中tgf-β浓度。
61.图26是肺组织中hyp表达量(n = 5-10)。
62.图27是采用rt-pcr (qpcr)分析肺中col1a1和fsp-1的mrna水平(n = 5-10)。所有实验一式三份,每一份至少重复三次。柱形表示平均值的
±
标准误差。
63.图28是rt-pcr分析cd147-m和con-m细胞中cd147或mmps mrna水平。其中a是cd147的 mrna水平,b是mmps的mrna水平。
64.图29是cd147-m对blm诱导的肺损伤(ipf)的实验设计示意图。
65.图30是是各组小鼠体重记录。
66.图31是cd147-m和pbs-blm小鼠组的右肺重量对比。
67.图32是cd147-m小鼠组micro-ct图像和ct纤维化评分。
68.图33是cd147-m治疗ipf的组织学评估,苏木精和伊红染色的代表性显微照片(h&e) ;采用指示性治疗的假对照和blm诱导小鼠肺切片的ashcroft评分,图示10
×
肺叶图像。
69.图34是肺组织切片masson’s三色染色评价胶原沉积。
70.图35是采用rt-pcr分析肺部cd147和肺中mmps的mrna水平的mrna水平(n=5-7)。
71.图36是肺组织中hyp表达量(n = 8-10)。
72.图37是通过qpcr分析肺中col1a1和fsp-1的mrna水平(n = 5-10)。
具体实施方式
73.下面结合附图实施例对本发明的内容进一步说明。以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
74.实施例1 工程化巨噬细胞的制备。
75.本实验利用基因工程的方法构建表达il-10、tβr2-fc或cd147的重组质粒,包装慢病毒,感染raw264.7巨噬细胞,使其能持续稳定表达il-10、tβr2-fc或cd147,将表达il-10、tβr2-fc或cd147的工程化巨噬细胞进行肺内移植,进一步观察其抗纤维化的疗效。
76.一、实验材料。
77.1.主要仪器及设备。
78.电子天平,冷冻离心机,pcr电泳仪,干式恒温器,凝胶成像分析仪,生物安全柜,制冰机,恒温培养震荡箱,电热鼓风干燥箱,紫外分光光度计,二氧化碳培养箱,荧光倒置显微镜,荧光激发模块,细胞计数仪,冰箱,洗板机,酶标仪,化学发光成像分析仪。
79.2.主要试剂。
80.细胞株:293ft(人肾上皮细胞系)和raw264.7细胞(小鼠单核巨噬细胞白血病细胞)、mle细胞(小鼠肺上皮细胞)由本实验室保存。
81.包装质粒:pspak2、pmd2g。
82.主要试剂: ecor i和bamh
ꢀⅰ
限制性核酸内切酶、dna聚合酶、pcr反应试剂及3.1neb缓冲液(美国neb公司)。感受态细菌dh5α、质粒提取试剂盒及dna电泳凝胶回收试剂盒[天根科技生化(北京)有限公司]。脂质体lipofectamine 2000(美国invitrogen公司)。胎牛血清、dmem高糖培养基、1640培养基(美国gibco公司)。鼠gapdh单克隆抗体(美国santa cruz biotechnology )。鼠myc-tag单克隆抗体(日本mbl公司)。兔smad2/3多克隆抗体,兔p-smad2/3多克隆抗体(美国cst公司)。辣根过氧化物酶标记的羊抗鼠igg二抗,辣根过氧化物酶标记的羊抗兔igg二抗(美国jackson公司)。 ripa裂解液和pmsf蛋白酶抑制剂(北京索莱宝科技有限公司)。 ecl发光试剂盒(美国thermo fisher scientific公司)。mouse il-10 、tgf-β elisa检测试剂盒(美国rd公司)。lb培养基,1m tris-hcl(ph=6.8),1.5m tris-hcl(ph=8.8),10
×
tris-glycine (sds-page电泳缓冲液),10
×
电转缓冲液,10
×
tbst。
[0083]
从ncbi网站上获得tβr2-fc、il-10和cd147的基因序列,利用dna重组技术将其与表达绿色荧光蛋白(gfp)或者红色荧光蛋白(mcherry)的载体连接,获得重组质粒,转化大肠杆菌e.coli dh5α感受态细胞,挑取单克隆,经酶切鉴定及测序分析,构建的重组质粒大小符合预期。利用质粒提取试剂盒提取质粒,所获得的质粒浓度和纯度均较高,本实验成功
构建表达tβr2-fc、il-10和cd147的重组质粒pcdh-rp-tβr2-fc、pcdh-mil10-myc和pcdh-mil10-myc。
[0084]
1. 重组质粒pcdh-rp-tβr2-fc的鉴定。
[0085]
构建的重组质粒pcdh-rp-tβr2-fc经xbai和bamhi双酶切后在琼脂糖凝胶电泳中进行分离,pcdh-rp-tβr2-fc重组质粒利用凝胶成像分析仪可观察到大小约1272bp和9000bp左右的条带,与载体pcdh-rp-tβr2-fc和pcdh-mcherryp大小相符。选取酶切鉴定正确的阳性单克隆菌落送公司进行测序分析,测序结果显示与目的序列一致。
[0086]
2.重组质粒浓度与纯度的检测。
[0087]
按照天根生化科技有限公司提供的无内毒素质粒小提中量试剂盒提取的pcdh-rp-tβr2-fc、pcdh-mil10-myc和pcdh-cd147-myc重组质粒在紫外分光光度计上进行检测,od260/od280分别为1.88、1.89、1.87,结果较为理想,符合后续实验需要。
[0088]
3.重组慢病毒感染raw264.7细胞。
[0089]
用浓缩的pcdh-rp-tβr2-fc、pcdh-mil10-myc、pcdh-cd147-myc和pcdh-x-gfp-puro病毒液感染raw264.7细胞,约72 h后,在倒置荧光显微镜下观察到成功感染pcdh-mil10-myc、pcdh-cd147-myc和 pcdh-x-gfp-puro的raw264.7细胞在488 nm激发光照射下表达绿色荧光蛋白(gfp),成功感染pcdh-rp-tβr2-fc的raw264.7细胞表达红色荧光蛋白mcherry。感染成功的细胞分别命名为raw-tβr2-fc、raw-il10、raw-cd147和raw-con细胞。
[0090]
4. western blot检测tβr2-fc的表达。
[0091]
收集瞬转tβr2-fc的293ft细胞的上清液和细胞以及raw-tβr2-fc、raw-con的培养上清液和细胞,制成上样液进行western blot检测,结果显示:过表达tβr2-fc的293ft细胞和raw264.7细胞培养上清液和细胞裂解液中均可检测到带myc标签的特异性条带,条带大小与目标蛋白一致;而转载空载体pcdh-x-gfp-puro的293ft和raw264.7细胞培养上清及细胞裂解液中未能检测到特异性蛋白表达。
[0092]
5. western blot检测tβr2-fc对tgf-β/smad信号转导通路的抑制作用。
[0093]
取适量mle细胞铺于24孔板中,按照表达tβr2-fc的工程化巨噬细胞的构建及鉴定中的实验分组及步骤进行western blot,结果表明:在mle细胞中加入tgf-β刺激后,可检测到p-smad2/3的特异性条带;当mle细胞与raw-tβr
2-fc细胞培养上清液共培养后,再加入tgf-β刺激后,未能检测到p-smad2/3的表达;与raw-con的细胞培养上清液共培养时可检测到p-smad2/3的表达;单独加入raw-con或raw-tβr2-fc不能检测到p-smad2/3的表达,所有细胞中均能检测到smad2/3的表达。
[0094]
6.elisa法检测raw-il-10中 il-10的分泌水平。
[0095]
分别收集raw-il-10在培养6、12、18、24 h时的上清液,利用rd mouse il-10 elisa试剂盒检测上清液中il-10的分泌水平。结果显示在设置的6 h、12 h、18 h、24 h等不同时间点均细胞培养上清液中均可检测到il-10的表达,且随着时间的延长,il-10的分泌水平逐渐升高,而在raw-con细胞中不能检测到il-10的分泌。
[0096]
7. rt-pcr检测raw-cd147中诱导的mmps。
[0097]
rt-pcr结果显示,cd147-m(raw-cd147)表达更高的cd147和mmp-3、mmp-7和mmp-11等mmp 。
[0098]
重组质粒利用三质粒共转染体系在293ft细胞中获得慢病毒,感染raw264.7细胞,
利用倒置荧光显微镜观察到特异荧光蛋白的表达。收集raw-tβr2-fc、raw-il10和raw-cd147细胞培养上清液及细胞裂解液进行wb检测,可观察到特异性蛋白条带,大小与目标蛋白一致,说明成功构建稳定表达tβr2-fc、il-10和cd147的工程化巨噬细胞。 经体外功能验证,tgf-β拮抗蛋白tβr2-fc可抑制tgf-β/smad信号转导通路,起到抑制纤维化的作用。经检测,工程化细胞raw-il10与对照细胞相比,可高水平分泌纤维化抑制因子il-10。cd147-m(raw-cd147)表达更高的cd147和mmp-3、mmp-7和mmp-11等mmp。
[0099]
实施例2小鼠肺纤维化模型的建立。
[0100]
本发明采用滴鼻的方式诱导制备小鼠肺纤维化模型,且采用隔日重复给药的方式分两次给药,相对于一次性给药法,这种重复给药的方式更接近于人类纤维化的发病过程,且减少了操作误差,使纤维化模型更加稳定。
[0101]
一、实验材料。
[0102]
1.实验动物。
[0103]
健康6-8周龄雄性balb/c小鼠,体重18-20g,购自北京华阜康生物科技股份有限公司[动物合格证:scxk(京)2019-0008],均饲养于公司实验动物中心spf级动物实验内。
[0104]
2.实验仪器及设备。
[0105]
电子天平,电热恒温水浴锅,移液器,动物麻醉机,石蜡包埋机,石蜡烤片机。
[0106]
3、主要试剂。
[0107]
硫酸博莱霉素,异氟烷,pbs缓冲液,二甲基亚砜(dmso),二甲苯,无水乙醇,10%中性福尔马林,苏木素,伊红。
[0108]
试剂盒:羟脯氨酸检测试剂盒(碱水解法)a00-2 南京建成生物工程研究所。
[0109]
主要试剂配制:硫酸博莱霉素母液的配制:将10 mg blm溶解于500 ul dmso(使用前放入水浴锅中加热至50℃)中,配成20 g.l-1的blm母液,使用时稀释成所需浓度。
[0110]
二、实验方法。
[0111]
1.实验分组及给药方式。
[0112]
健康雄性balb/c小鼠25只,分成5组,每组5只,分别为正常对照组、pbs对照组及blm 1mg/kg给药组、2mg/kg给药组和5mg/kg给药组。各组小鼠均饲养于公司spf级动物实验室内,实验前一周予以适应性饲养,喂养条件相同。具体实验操作过程为:实验前将blm母液配制成实验所需的剂量浓度,现用现配。采用吸入性麻醉的方式麻醉小鼠,首先打开氧气钢瓶,调节氧流量,打开麻醉机旋钮,倒入异氟烷,调节浓度,诱导麻醉一般使用1.5%-2%左右的浓度,将小鼠放入充满异氟烷的麻醉箱内,待其出现仰卧时呼吸心跳均匀、肌肉松弛、四肢无活动、胡须无触碰反应,视为麻醉起效,分别向左、右鼻腔内均匀滴注50 ul目标剂量的blm或pbs溶液。实验结束后,关闭麻醉机,待小鼠清醒,继续饲养于spf级清洁动物房内,于第三天重复上述操作,因本实验采用的滴鼻给药方式为隔日给药法,即于实验第1天和第3天分别给予等量的blm溶液,两次给药剂量相加为每组的目标剂量。给予不同剂量的blm致伤模型,经研究发现,随着给药剂量的增加,小鼠肺纤维化程度逐渐加重,纤维化病理损伤评分增高,且较为均一、稳定,未出现死亡病例。综合评估本实验研究中小鼠一般行为状态及体重测量、羟脯氨酸检测及病理学评分的结果,本发明采用blm 5 mg/kg的给药浓度建立小鼠肺纤维化模型,为后续实验做准备。
[0113]
实施例3 工程化巨噬细胞对小鼠肺纤维化的治疗作用研究。
[0114]
博莱霉素致小鼠肺纤维化模型动力学研究显示,博莱霉素致小鼠肺纤维化过程大致可以分为前期的炎症期及后期的纤维化期两个时期,给予博莱霉素后的0-7天主要是炎症期,在此期间大量炎症因子分泌引起肺上皮损伤,如果在此期间给予药物治疗,最主要是发挥抗炎作用,起到一个预防纤维化发展的作用。以第9天为转折,炎症期开始向纤维化期过渡,9-14天为纤维增生期,在此期间以tgf-β介导的纤维化作用为主,14-28天已形成的纤维化会出现不同程度的消退,在此期间给予药物治疗主要发挥抗纤维化作用。因此本发明实验选择在博莱霉素致伤后的第1天、第7天、第14天分别给予工程化巨噬细胞治疗,并采用三种细胞联合给药的方式以期达到协同作用的治疗效果,实验以21天为治疗终点,分别从动物、组织、分子等不同水平检测工程化巨噬细胞对肺纤维化的治疗作用。
[0115]
小鼠:雄性,健康,balb/c小鼠(6-8周龄,无特定病原体)购自北京华福康生物科技有限公司(中国北京)。所有涉及动物受试者的实验均按照动物护理与使用委员会(中国北京)批准的指南进行。小鼠经可控异氟醚流麻醉。通过鼻内灌注硫酸blm (nsc125066, selleck chemicals, houston, tx, usa) (5 mg/kg溶于pbs, 50 μl)建立小鼠模型。按照指示,在blm治疗后一天,小鼠经鼻吸入pbs或工程巨噬细胞(2
×
105细胞/只)。
[0116]
细胞培养:在添加10% (v/v)胎牛血清(fbs)、100 μg/ml青霉素和100 μg/ml链霉素的 dulbecco’s 改良的eagle’s培养基中培养raw264.7、mle-12和hek293t细胞。
[0117]
载体构建和慢病毒转染:将表达小鼠il-10、cd147和tgfrcfc的慢病毒构建物克隆到pcdh载体(sbi)中。用填充质粒将慢病毒载体转染到293t细胞中,收集病毒颗粒并用于感染raw264.7细胞。在含5 μg/ml嘌呤霉素的培养基中培养2天进行筛选。
[0118]
免疫印迹:收集细胞并使用ripa缓冲液提取。用适量ripa缓冲液将小鼠肺组织匀浆。总蛋白的定量使用bca蛋白测定试剂盒(tiangen,中国)。用10% sds-page凝胶分离等量的蛋白质,然后转移到pvdf膜上(pall, usa)。抗smad2 /3、抗psmad2 /3 (cell signaling technology, usa)、抗myc (medical & biological laboratories co, japan)、抗-β-actin、抗gapdh (santa cruz biotechnology, usa)在4℃下孵育膜。在1
ꢀ×ꢀ
tbst缓冲液中洗涤三次后,分别与辣根过氧化物酶标记的山羊抗兔抗体或辣根过氧化物酶标记的山羊抗小鼠抗体孵育(1:2000;jackson immunoresearch, usa)在室温下1小时,重新洗涤,然后使用ecl化学发光试剂盒(thermo fisher scientific, usa)开发。
[0119]
定量pcr分析:用tiangen (rnaprep pure cell/bacteria kit)分离总rna,用revertra ace (toyobo)按照说明书进行逆转录。rt-pcr master mix (toyobo)合成cdna片段;在agilent mx3005p qpcr系统(美国agilent)上检测每个基因的荧光。将目的基因表达水平归一化为管家基因β-actin,并使用2
ꢀ‑ꢀ
δδct方法计算fold change。rt-pcr使用的引物如下。
[0120]
col1a1: forward 5
′‑ꢀ
ggagggaacggtccacgat
ꢀ‑3′ꢀ
reverse 5
′‑ꢀ
gagtccgcgtatccacaa
ꢀ‑3′
;fsp-1: forward 5
′‑ꢀ
aggcaacgagggtgacaagttc
ꢀ‑3′
reverse 5
′‑ꢀ
catcatggcaatgcaggacag
ꢀ‑3′
;cd147: forward 5
′‑ꢀ
ggaatgctccaaacgacag
ꢀ‑3′
reverse 5
′‑ꢀ
cccatcaacagagagcga
ꢀ‑3′
;mmp-2: forward 5
′‑
agattgatgccgtgtacgagg-3
′
reverse 5
′‑
tccaggagtctgcgatgagc
ꢀ‑3′
;mmp-3: forward 5
′‑
caggcattggcacaaaggtg-3
′
reverse 5
′‑
gtgggtcactttccctgcat-3
′
;mmp-7: forward 5
′‑
tggtaccataatgtcctgaatg-3
′
reverse 5
′‑
tcgttattggcaggaagcacacaatgaatt-3
′
;mmp-9: forward 5
′‑
gctgactacgataaggacggc-3
′
reverse 5
′‑
aggaagacgaaggggaagacg-3
′
;mmp-11: forward 5
′‑
ccggagagtcaccgtcatc-3
′
reverse 5
′‑
gcaggactagggacccaatg-3
′
;timp-1: forward 5
′‑
gacctggtcataagggctaaa-3
′
reverse 5
′‑
gcccgtgatgagaaactcttgact-3
′
;timp-2: forward 5
′‑
tcagagccaaagcagtgagc-3
′
reverse 5
′‑
gccgtgtagataaactcgatgtc-3
′
。
[0121]
hyp测量:根据制造商的说明,使用hyp测量试剂盒(南京建成生物工程研究所,中国南京)进行hyp的测量。
[0122]
elisa:使用市售小鼠il-10, tgf-β1 elisa试剂盒(r&d systems inc.,minneapolis, mn, usa)测定全肺匀浆上清中细胞因子的水平。实验重复3次,以标准曲线计算细胞因子浓度。
[0123]
组织病理学观察及肺损伤评分:通过micro-ct扫描(quantum fx demo, perkinelmer-caliper ls, ma, usa)和h&e染色对小鼠肺进行形态学分析。全肺左下叶在4%甲醛中性缓冲液中固定48 h,分级乙醇系列脱水,石蜡包埋,切片为5
µ
m切片。这些切片用h&e或masson’s三色染色进行组织病理学分析。使用以下组织学特征来评估肺损伤的严重程度:水肿、充血和充血、中性粒细胞边缘化和组织浸润、肺泡内出血和碎片以及细胞增生。采用评分系统对肺损伤程度进行分级。每个特征被分为缺席、轻度、中度或重度,并被分配从0到8的分数。计算每只小鼠的总得分33。
[0124]
计算机断层扫描:使用micro-ct (quantum fx demo, perkinelmer-caliper ls, ma, usa)对胸部进行放射学评估。小鼠吸入异氟醚进行麻醉,并以俯卧姿势进行数据采集。3名不了解治疗组的呼吸系统疾病专家根据以下标准对胸部ct检查结果进行评分:1分,肺部检查结果正常;2、中间发现;3、轻度肺纤维化;4、中间调查结果;5、中度肺纤维化;6、中间发现;7,晚期肺纤维化。
[0125]
统计分析:所有分析均使用graphpad (graphpad prism 9.0, san diego, ca, us)进行。结果以均数
±
标准差表示。多组均数比较采用单因素方差检验和事后tukey’s检验。所有检验均以p 《 0.05为统计显著性。
[0126]
一、未修饰的巨噬细胞对blm诱导的pf的影响。
[0127]
研究未修饰的巨噬细胞输注对blm诱导的pf的影响。选择raw264.7小鼠巨噬细胞细胞系,因为它在小鼠巨噬细胞治疗中被广泛用作载体。通过慢病毒导入建立了一个平行的gfp+ raw264.7细胞系(con-m),该细胞系不表达治疗因子作为后续基因修饰raw264.7细胞的控制。为提高鼻吸入模型的稳定性,连续2天给药2次,最后1天标记为第0天。为研究blm诱导的纤维化不同阶段细胞输注的影响,建立了5组小鼠模型。blm组小鼠于blm给药后第1、
7、14天灌胃pbs。blm-con-m 1d组小鼠第1天鼻内注射con-m,第7天和第14天注射pbs。blm-con-m 7d组第7天灌注con-m,第1天和第14天灌注pbs, blm-con-m 14d组第14天灌注con-m,第1天和第7天灌注pbs。对照组在第-1,0,1,7,14天给药,不给药blm,如图1所示。各组小鼠每7天测量一次体重。第20天,使用微型计算机断层扫描(ct)设备扫描所有小鼠。与pbs组不同,blm组小鼠的micro-ct图像具有典型的pf成像特征,提示blm诱导小鼠pf的建立。第21天处死各组小鼠,分离肺并进行后续检测。
[0128]
首先发现con-m 1d和7d组小鼠的体重减轻和肺重量明显高于blm组小鼠,如图2所示。con-m注入小鼠第1天和第7天的肺部micro-ct图像和相应评分与pbs-blm组相比,pf更严重,如图3所示。苏木精和伊红(h&e)染色和相应的ashcroft评分以及con-m 1d和7d组小鼠肺切片的masson’s三色染色,如图4所示也表明纤维化病变增加。值得注意的是,blm-con-m 1d和7d组小鼠出现了过量的胶原沉积,羟脯氨酸(hyp)水平升高证明了这一点,如图5所示。为了进一步定量地确定输注con-m是否能促进纤维化标志物的表达,通过实时聚合酶链反应(rt-pcr)评估了blm处理小鼠肺中纤维化基因mrna的表达水平。如图所示,纤维化标志物col1a1和fsp1 mrna的表达在blm-con-m 1d和7d组小鼠中较高,而在14d组小鼠中不高,如图6所示 。这些结果表明,未修饰raw264.7细胞的输注加速了blm诱导的pf,特别是在早期。早期灌注未修饰的raw264.7巨噬细胞可加速blm诱导的pf 这一观察结果可以部分归因于未修饰巨噬细胞的启动器和放大器在blm诱导纤维化的早期炎症阶段的作用。因此,抗炎工程巨噬细胞应在此时使用。
[0129]
二、 il
ꢀ‑
10过表达巨噬细胞对blm诱导的pf的影响。
[0130]
建立通过慢病毒感染组成性分泌抗纤维化蛋白的工程巨噬细胞。首先构建小鼠il-10分泌raw264.7细胞系,简称il10-m。随着培养时间的推移,il10-m上清中的il-10水平逐渐升高,12小时后达到2000 pg/ml。同时,con-m上清中的il-10水平在三个时间点几乎检测不到,如图7所示。通过鼻内途径注入il10-m细胞,并评估治疗效果,如图8所示。首先发现输注il10-m,特别是在第1天,改善了blm给药小鼠的体重下降,如图9所示, il10-m小鼠组的右肺重量显著低于pbs-blm小鼠组,如图10所示。与pbs-blm组小鼠相比,第1天和第7天输注il10-m后,肺的micro-ct图像及相应的评分(图11)、h&e和masson’s三色染色(图12)显示,il10-m更明显地减少了肺损伤和肺纤维化。然后分离小鼠的肺,并测试生物分子水平。与预期的一样,il10-m组小鼠肺中il-10 mrna水平显著高于sham组和blm-pbs组,如图13所示。酶联免疫吸附试验(elisa)也表面,与sham组和blm-pbs组相比,il10-m 1d组小鼠肺中il-10蛋白水平升高。相反,给药il10-m可降低1d组小鼠肺部tgfβ水平,如图14所示。此外,1d和7d组pf的严重程度明显低于sham组和blm-pbs组,表现为hyp含量较低,如图15所示。同时,肺匀浆的rt-pcr分析显示il-10-m 1d组小鼠col1a1和fsp1的表达显著降低,如图16所示。但与1d和7d组不同,第14天输注il10-m无明显疗效。这些结果表明,在早期而不是后期注入分泌il
ꢀ‑
10的巨噬细胞可以改善blm诱导的pf。
[0131]
三、tgfr2fc(tgfrcfc)过表达的巨噬细胞在给药时间对blm诱导的pf的影响。
[0132]
为了直接靶向tgfβ抑制blm诱导的pf,构建了一个带有myc标记的融合蛋白,该融合蛋白由tgfβ
ꢀ‑
受体2的胞外截短结构域融合到igg fc结构域,并在raw264.7细胞中稳定表达,命名为tgfrcfc-m。western blotting结果显示myc-tgfrcfc被表达并分泌到细胞上清中,如图17所示,这在体外可有效抑制tgfβ诱导的smad2/3磷酸化,如图18所示。由于tgfβ
的表达始于blm诱导的pf的中间阶段,因此在第1天取消了tgfrcfc-m的输注,并评估了治疗效果,如图19所示。 虽然输注tgfrcfc-m并没有改善blm给药小鼠的体重下降,如图20所示,但tgfrcfc-m组小鼠的右肺重量明显低于pbs-blm组小鼠,如图21所示。正如预期的那样,tgfrcfc-m小鼠组的micro-ct图像(图22)、h&e(图23)和masson’s三色染色(图24)显示,肺损伤和肺纤维化减弱。与pbs-blm组相比,tgfrcfc-m组7d小鼠肺组织中tgfβ蛋白水平明显下降,如图25所示。特别是pf的严重程度大大降低,图26显示较低的hyp含量。此外,对tgfrcfc-m注入小鼠的肺匀浆分析显示col1a1和fsp1 mrna表达显著降低,图27所示。总之,数据表明,在中间阶段输注tgfrcfc-m可以缓解blm诱导的肺损伤和纤维化。
[0133]
四、cd147过表达的巨噬细胞对blm诱导的pf的影响鉴于cd147在pf的胶原沉积过程中发挥作用,设计过表达cd147的巨噬细胞,并检测了诱导的mmps。rt-pcr结果显示,cd147
‑ꢀ
m表达更高的cd147,和mmps(mmp-3、mmp-7和mmp-11等),如图28所示。由于胶原沉积发生在后期,因此在第14天将cd147-m单独给药blm诱导的纤维化小鼠的肺,并评估治疗效果,如图29所示。
[0134]
虽然输注cd147-m并没有改善blm给药小鼠的体重下降,如图30所示,但cd147-m小鼠组的右肺重量低于pbs-blm小鼠组,如图31所示。micro-ct图像h&e(图32)和masson’s三色染色(图33)显示cd147-m小鼠组肺损伤和pf减弱。相对于pbs-blm组的肺组织,cd147
‑ꢀ
m组小鼠的肺组织中cd147、mmp-3、mmp-7、mmp-9和mmp-11的mrna水平升高,如图34所示。相反,mmps抑制剂timp-1和timp-2的表达降低,如图35所示。特别是pf的严重程度大大降低,图36可以看出hyp含量较低。rt-pcr结果显示cd147组与pbs组col1a1 mrna水平略有差异,fsp1无差异,如图37所示。总之这些结果表明,给药 cd147-m通过加速胶原降解来减少blm诱导的pf。
[0135]
在blm诱导小鼠肺纤维化的模型中,给予工程化巨噬细胞raw-il10、raw-tβr2-fc或raw-cd147治疗,可有效减轻小鼠肺纤维化损伤,且无系统毒性,较为安全。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1