一种含有苯环结构双环碳酸酯的制备方法与流程
1.本发明涉及一种可制备热塑性非异氰酸酯聚氨酯原料双环碳酸酯的方法,具体地说是涉及一种含有苯环结构双环碳酸酯的制备方法。
背景技术:
2.传统的聚氨酯是一种具有优异性能、应用极为广泛的高分子材料,但因其制备工艺中使用了危害环境与人类健康的异氰酸酯而不符合安全、环保等社会发展趋势的要求。欧美国家在上世纪九十年代,便致力于发展非异氰酸酯的聚氨酯(nipu),并取得了些积极成果(w c crawford,e t marquis,h p klein.usp:5340889,1994;l rappoport,rd brown.usp:5175891,1992;b tamami,s sohn,gl wilkes.j.appl.polym.sci.,2004,92(2):883~891)。非异氰酸酯聚氨酯内部其羟基与羰基氧原子可形成分子内氢键,大大提高了传统聚氨酯耐化学品性、耐水解性、抗渗透性的性能。
3.双环碳酸酯与多元胺是制备非异氰酸酯聚氨酯的原料,而两原料的结构可对终产品nipu的力学性能、分子量及用途起到决定性作用。文献中报道的nipu双环碳酸酯,通常以链烃碳氧或碳硫醚的方式连接两端的双环结构(polym.chem.2011,2,2661-2667;eur.polym.j.2015,70,125-135.),比较容易出现终产品nipu的分子量偏小、力学性能弱的情况出现。为了有效改善nipu终产品分子量偏小、力学性能弱的情况,通过在双环碳酸酯的结构中引入苯环,可有效提高分子量、力学性能。
技术实现要素:
4.本发明提供了一种含有苯环结构双环碳酸酯的制备方法,反应工艺操作简单,产品收率高,工艺具有可放大性。
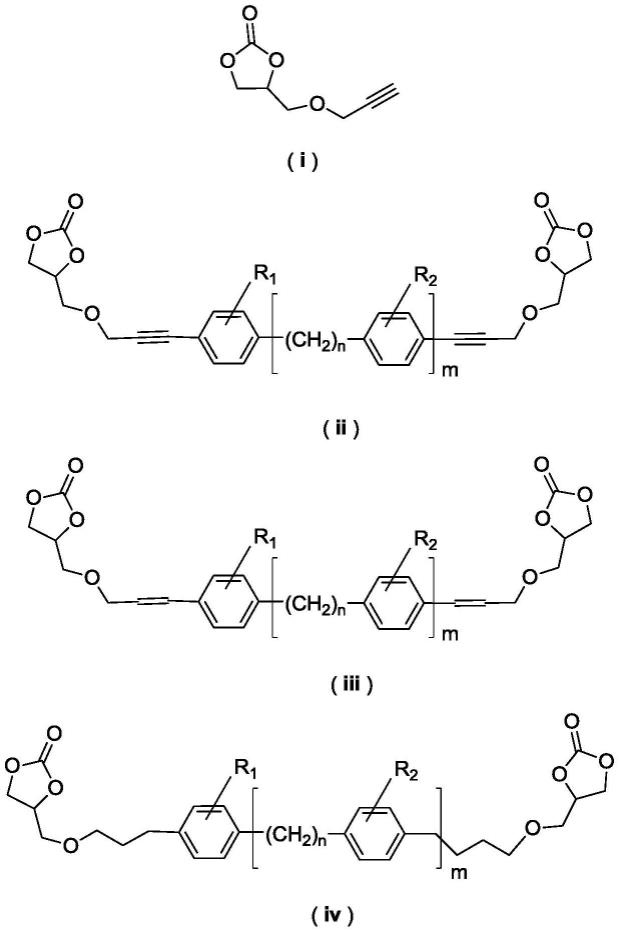
5.一种含有苯环结构双环碳酸酯的制备方法,包括以下步骤:4-(羟甲基)-1,3-二氧杂戊环-2-酮先与炔丙醇通过mitsunobu反应生成结构式如(i)所示的三键单环碳酸酯,然后三键单环碳酸酯与对位双卤代苯环化合物发生sonogashira生成结构式如(ii)三键双环碳酸酯,在催化剂a的作用下,双环碳酸酯(ii)三键氢化成结构式如(iii)双键双环碳酸酯,在催化剂b的作用下,双键双环碳酸酯(iii)进一步氢化生成单键双环碳酸酯(iv);
[0006][0007]
其中,r1、r2代表苯环上的取代基团,r1、r2为氢、甲基、乙基、丙基、丁基、叔丁基、甲氧基、乙氧基、丙氧基、丁氧基、叔丁氧基、硝基、氨基、羟基、甲酸甲酯基、甲酸乙酯基、甲酸丙酯基、甲酸丁酯基、乙酸甲酯基、乙酸乙酯基、乙酸丙酯基、乙酸丁酯基中的一种,r1、r2基团可相同也可不同;对位双卤代苯环化合物中x1,x2代表卤素,为氯、溴、碘中的一种,x1,x2基团可相同也可不同;
[0008]
n代表相同单元碳的个数,n=0~15,m代表重复单元数,m=0~15。
[0009]
所述含有苯环结构双环碳酸酯(ii)、(iii)、(iv)的制备路线如式1所示:
[0010][0011]
作为优选,所述三键单环碳酸酯(i)通过下述方法制备得到:将4-(羟甲基)-1,3-二氧杂戊环-2-酮先与炔醇、磷试剂、偶氮试剂、无水溶剂加入到反应容器中,反应温度在-20~80℃,反应时间为1~24h。
[0012]
作为优选,所述磷试剂为:三苯基磷、三丁基磷、三甲基磷中的一种或二种以上任意组合;所述偶氮试剂为偶氮二羧酸二乙酯、偶氮二羧酸二异丙酯、偶氮二羧酸二叔丁酯中的一种或二种以上任意组合;所述无水溶剂为四氢呋喃、甲基叔丁基醚、乙酸乙酯、乙腈、二氯甲烷中的一种或二种以上任一组合;所述4-(羟甲基)-1,3-二氧杂戊环-2-酮、炔醇、磷试剂、偶氮试剂的物质的量比为1:1~1.2:1~2:1~2。
[0013]
作为优选,所述三键双环碳酸酯(ii)通过下述方法制备得到:将三键单环碳酸酯(i)、对位双卤代苯环化合物、催化剂、碱进行反应,反应温度100~160℃,反应时间1~15h。
[0014]
作为优选,所述催化剂为cui2、cubr2、cucl2、cu(oac)2中的一种或二种以上任意组合;所述碱为三乙胺、二甲基乙基胺、二异丙基乙基胺中的一种或二种以上任意组合;所述三键单环碳酸酯(i)、对位双卤苯环化合物、催化剂、碱的物质的量比为1:0.45~0.55:0.1~0.5:3~10。
[0015]
作为优选,所述双键双环碳酸酯(iii)通过下述方法制备得到:将三键双环碳酸酯(ii)与氢气、催化剂a、溶剂进行反应,反应温度0~50℃,反应时间1~24h。
[0016]
作为优选,所述催化剂a为lindlar catalyst/喹啉或lindlar catalyst/吡啶;所述溶剂为乙酸乙酯、四氢呋喃、甲基叔丁基醚、二氯甲烷中的一种或二种以上任意组合;所述三键双环碳酸酯(ii)、催化剂a的质量比为1:0.001~0.2;反应压力为0.1~1mpa。
[0017]
作为优选,所述单键双环碳酸酯(iv)通过下述方法制备得到:将双键双环碳酸酯(iii)与氢气、催化剂b、溶剂进行反应,反应温度0~70℃,反应时间1~15h。
[0018]
作为优选,所述催化剂b为pd/c或rany-ni;所述溶剂为四氢呋喃、甲基叔丁基醚、
乙酸乙酯、水中的一种或二种以上任意组合;所述双键双环碳酸酯(iii)、催化剂b的质量比为1:0.001~0.1;反应压力为0.1~1mpa。
[0019]
作为优选,对位双卤代苯环化合物中x1,x2选择溴或碘,n代表相同单元碳的个数,优选n=0~5,m代表重复单元数,优选m=0~5。
[0020]
本发明制备含有苯环双环碳酸酯的方法具有每步骤反应条件较温和,原料价格低廉且易得,操作简单,分离方便,收率高优点,具有可放大的工业前景,可为制备高性能的非异氰酸酯聚氨酯(nipu)提供原料。
具体实施方式
[0021]
下面结合具体实施例对本发明作进一步说明,但本发明所要保护的范围并不限于此。本领域的普通技术人员可以且应当知晓任何基于本发明实质精神的简单变化或者替换均应属于本发明所要求的保护范围。
[0022]
实施例1
[0023]
将丙炔醇(59.05g,0.5mol)、4-(羟甲基)-1,3-二氧杂戊环-2-酮(28.03g,0.5mol)、三苯基磷(144.3g,0.55mol)、无水四氢呋喃200g室温依次加入到氮气氛的烧瓶中,搅拌10min。偶氮二甲酸二乙酯(95.8g,0.55mol)的无水四氢呋喃50g溶液缓慢滴加入体系中,滴完再继续反应4h。反应结束后,脱溶后再加入环己烷进行打浆,过滤得到4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮69.5g,收率89.0%,纯度98.1%。[ms+h]
+
:157.2。
[0024]
4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮(50.0g,0.32mol)、4,4'-二碘-1,1'-联二苯(58.5g,0.144mol)、三乙胺(162.0g,1.6mol)、cui2(20.3g,0.064mol)在氮气氛下控制温度130℃反应10h,反应完毕,经过萃取、水洗,二氯甲烷重结晶得到产物
[0025]
4,4'-((([1,1'-联二苯]-4,4'-二基双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)55.3g,收率83%,纯度95%。[ms+h]
+
:463.5.
[0026]
4,4'-((([1,1'-联二苯]-4,4'-二基双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(50.0g,0.108mol)、lindlar catalyst 0.05g、喹啉0.05g、乙酸乙酯50g,抽真空后保持反应容器氢气压力与常压一致,室温搅拌4h,反应完毕,除去催化剂,加入水洗涤,萃取重结晶得到产物4,4'-((([1,1'-联二苯]-4,4'-二基双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)47.9g,收率95%,纯度98.1%。[ms+h]
+
:467.5
[0027]
将4,4'-((([1,1'-联二苯]-4,4'-二基双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(30.0g,0.061mol)、pd/c 0.03g、四氢呋喃30g投入反应烧瓶中,抽真空后容器氢气压力与常压一致,室温搅拌5h,反应完毕,过滤除去催化剂,重结晶得到产物4,4'-((([1,1'-联二苯]-4,4'-二基双(丙烷-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)29.05g,收率96%,纯度98.5%。[ms+h]
+
:471.5.
[0028]
实施例2
[0029]
将丙炔醇(59.05g,0.5mol)、4-(羟甲基)-1,3-二氧杂戊环-2-酮(28.03g,0.5mol)、三丁基磷(26.1g,0.466mol)、无水甲基叔丁基醚200g于30℃依次加入到氮气氛的烧瓶中,搅拌10min。偶氮二甲酸二异丙酯(171.2g,0.847mol)的无水甲基叔丁基醚50g溶液缓慢滴加入体系中,滴完再继续反应4h。反应结束后,脱溶后再加入环己烷进行打浆,过滤
得到4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮55.5g,收率84.0%,纯度98.0%。[ms+h]
+
:157.2
[0030]
4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮(50.0g,0.32mol)、双(4-溴苯基)甲烷(52.2g,0.144mol)、二甲基乙基胺(187.4g,2.56mol)、cubr2(21.5g,0.096mol)在氮气氛下控制温度110℃反应12h,反应完毕,经过萃取、水洗,二氯甲烷重结晶得到产物4,4'-((((亚甲基双(4,1-亚苯基))双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)57.9g,收率76%,纯度96.1%。[ms+h]
+
:477.5
[0031]
4,4'-((((亚甲基双(4,1-亚苯基))双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(50.0g,0.105mol)、lindlar catalyst 0.01g、喹啉0.01g、四氢呋喃50g,抽真空后保持反应容器氢气压力与常压一致,室温搅拌6h,反应完毕,除去催化剂,加入水洗涤,萃取重结晶得到产物4,4'-((((亚甲基双(4,1-亚苯基))双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)46.9g,收率93.0%,纯度97.8%。[ms+h]
+
:481.5.
[0032]
将4,4'-((((亚甲基双(4,1-亚苯基))双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(30.0g,0.062mol)、pd/c 0.03g、甲基叔丁基醚30g投入反应烧瓶中,抽真空后容器氢气压力与常压一致,室温搅拌8h,反应完毕,过滤除去催化剂,重结晶得到产物4,4'-((((亚甲基双(4,1-亚苯基))双(丙基烷-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)29.4g,收率97.1%,纯度98.2%。[ms+h]
+
:485.5.
[0033]
实施例3
[0034]
将丙炔醇(59.05g,0.5mol)、4-(羟甲基)-1,3-二氧杂戊环-2-酮(28.03g,0.5mol)、三甲基磷(45.6g,0.60mol)、无水乙酸乙酯200g于-20℃依次加入到氮气氛的烧瓶中,搅拌10min。偶氮二甲酸二叔丁酯(138.2g,0.60mol)的无水乙酸乙酯50g溶液缓慢滴加入体系中,滴完再继续反应8h。反应结束后,脱溶后再加入环己烷进行打浆,过滤得到4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮62.5g,收率80.1%,纯度98.2%。[ms+h]
+
:157.2.
[0035]
4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮(50.0g,0.32mol)、4,4
”‑
二溴-1,1':4',1
”‑
三联苯(55.9g,0.144mol)、二异丙基乙基胺(248.3g,1.92mol)、cucl2(21.5g,0.16mol)在氮气氛下控制温度130℃反应10h,反应完毕,经过萃取、水洗,二氯甲烷重结晶得到产物4,4'-((([1,1':4',1
”‑
三联苯]-4,4
”‑
二基双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)58.2g,收率75.0%,纯度96.8%。[ms+h]
+
:539.5。
[0036]
4,4'-((([1,1':4',1
”‑
三联苯]-4,4
”‑
二基双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(50.0g,0.093mol)、lindlar catalyst 0.03g、吡啶0.03g、四甲基叔丁基醚50g,抽真空后保持反应容器氢气0.13mpa,室温搅拌3h,反应完毕,除去催化剂,加入水洗涤,萃取重结晶得到产物4,4'-((([1,1':4',1
”‑
三联苯]-4,4
”‑
二基双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)47.4g,收率94.2%,纯度98.0%。[ms+h]
+
:543.6。
[0037]
将4,4'-((([1,1':4',1
”‑
三联苯]-4,4
”‑
二基双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(30.0g,0.055mol)、rany-ni 3.0g(净含量)、水30g、
乙酸乙酯50g投入反应烧瓶中,抽真空后容器氢气压力0.5mpa,50℃搅拌2h,反应完毕,过滤除去催化剂,重结晶得到产物4,4'-((([1,1':4',1
”‑
三联苯]-4,4
”‑
二基双(丙烷-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)29.1g,收率96.4%,纯度98.5%,[ms+h]
+
:547.6.
[0038]
实施例4
[0039]
将丙炔醇(59.05g,0.5mol)、4-(羟甲基)-1,3-二氧杂戊环-2-酮(32.2g,0.575mol)、三苯基磷(262.3g,1.0mol)、无水乙酸乙酯300g于25℃依次加入到氮气氛的烧瓶中,搅拌10min。偶氮二甲酸二叔丁酯(230.3g,1.0mol)的无水乙酸乙酯100g溶液缓慢滴加入体系中,滴完再继续反应7h。反应结束后,脱溶后再加入环己烷进行打浆,过滤得到4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮64.65g,收率82.8%,纯度98.4%,[ms+h]
+
:157.2。
[0040]
4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮(50.0g,0.32mol)、1,4-双(4-溴苄基)苯(60.0g,0.144mol)、二异丙基乙基胺(248.3g,1.92mol)、cu(oac)2(8.72g,0.048mol)在氮气氛下控制温度120℃反应15h,反应完毕,经过萃取、水洗,二氯甲烷重结晶得到产物4,4'-(((((1,4-亚苯基双(亚甲基))双(4,1-亚苯基))双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)62.8g,收率77.0%,纯度95.6%。[ms+h]
+
:567.6.
[0041]
4,4'-(((((1,4-亚苯基双(亚甲基))双(4,1-亚苯基))双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(30.0g,0.053mol)、lindlar catalyst 0.3g、吡啶0.3g、二氯甲烷50g,抽真空后保持反应容器氢气0.2mpa,室温搅拌2h,反应完毕,除去催化剂,加入水洗涤,萃取重结晶得到产物4,4'-(((((1,4-亚苯基双(亚甲基))双(4,1-亚苯基))双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)48.7g,收率92.0%,纯度97.6%,[ms+h]
+
:571.6。
[0042]
将4,4'-(((((1,4-亚苯基双(亚甲基))双(4,1-亚苯基))双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(30.0g,0.053mol)、rany-ni 3.0g(净含量)、水30g、四氢呋喃50g投入反应烧瓶中,抽真空后容器氢气压力0.3mpa,40℃搅拌3h,反应完毕,过滤除去催化剂,重结晶得到产物4,4'-(((((1,4-亚苯基双(亚甲基))双(4,1-亚苯基))双(丙烷-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)28.8g,收率95.3%,纯度98.7%,[ms+h]
+
:575.6。
[0043]
实施例5
[0044]
将丙炔醇(59.05g,0.5mol)、4-(羟甲基)-1,3-二氧杂戊环-2-酮(30.8g,0.55mol)、三丁基磷(151.7g,0.75mol)、无水乙腈200g于35℃依次加入到氮气氛的烧瓶中,搅拌10min。偶氮二甲酸二叔乙酯(130.6g,0.75mol)的无水乙腈100g溶液缓慢滴加入体系中,滴完再继续反应9h。反应结束后,脱溶后再加入环己烷进行打浆,过滤得到4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮62.5g,收率80.0%,纯度98.6%,[ms+h]
+
:157.2。
[0045]
4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮(50.0g,0.32mol)、1,4-二氯-2-甲氧基苯(25.5g,0.144mol)、二异丙基乙基胺(331.1g,2.56mol)、cui2(20.3g,0.064mol)在氮气氛下控制温度150℃反应15h,反应完毕,经过萃取、水洗,二氯甲烷重结晶得到产物4,4'-((((2-甲氧基-1,4-亚苯基)双(丙-2-炔-3,1-二基))双(氧))双(亚甲基))
双(1,3-二氧五环-2-酮)31.8g,收率53.0%,纯度95.1%,[ms+h]
+
:417.4。
[0046]
4,4'-((((2-甲氧基-1,4-亚苯基)双(丙-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(50.0g,0.12mol)、lindlar catalyst 0.5g、吡啶0.5g、二氯甲烷50g,抽真空后保持反应容器氢气0.1mpa,室温搅拌3h,反应完毕,除去催化剂,加入水洗涤,萃取重结晶得到产物4,4'-((((2-甲氧基-1,4-亚苯基)双(丙-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)47.6g,收率94.2%,纯度97.1%,[ms+h]
+
:421.4。
[0047]
将4,4'-((((2-甲氧基-1,4-亚苯基)双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(30.0g,0.071mol)、pd/c 0.5g(净含量)、乙酸乙酯50g投入反应烧瓶中,抽真空后容器氢气压力0.1mpa,40℃搅拌4h,反应完毕,过滤除去催化剂,重结晶得到产物4,4'-((((2-甲氧基-1,4-亚苯基)双(丙烷-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)28.3g,收率93.8%,纯度98.2%,[ms+h]
+
:425.4。
[0048]
实施例6
[0049]
将丙炔醇(59.05g,0.5mol)、4-(羟甲基)-1,3-二氧杂戊环-2-酮(32.2g,0.575mol)、三甲基磷(49.5g,0.65mol)、无水二氯甲烷200g于30℃依次加入到氮气氛的烧瓶中,搅拌10min。偶氮二甲酸二叔异丙酯(131.5g,0.65mol)的无水二氯甲烷100g溶液缓慢滴加入体系中,滴完再继续反应10h。反应结束后,脱溶后再加入环己烷进行打浆,过滤得到4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮63.4g,收率81.2%,纯度97.8%,[ms+h]
+
:157.2。
[0050]
4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮(50.0g,0.32mol)、1,3-双(4-碘苯基)丙烷(64.6g,0.144mol)、二异丙基乙基胺(194.4g,1.92mol)、cubr2(7.15g,0.032mol)在氮气氛下控制温度120℃反应8h,反应完毕,经过萃取、水洗,二氯甲烷重结晶得到产物4,4'-((((丙烷-1,3-二基双(4,1-亚苯基))双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)62.0g,收率85.4%,纯度96.2%,[ms+h]
+
:505.5。
[0051]
4,4'-((((丙烷-1,3-二基双(4,1-亚苯基))双(丙基-2-炔-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(50.0g,0.099mol)、lindlar catalyst 0.8g、喹啉0.8g、乙酸乙酯50g,抽真空后保持反应容器氢气0.15mpa,室温搅拌2h,反应完毕,除去催化剂,加入水洗涤,萃取重结晶得到产物4,4'-((((丙烷-1,3-二基双(4,1-亚苯基))双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)47.5g,收率94.3%,纯度97.0%,[ms+h]
+
:509.6。
[0052]
将4,4'-((((丙烷-1,3-二基双(4,1-亚苯基))双(丙基-2-烯-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)(30.0g,0.059mol)、pd/c 0.2g(净含量)、甲基叔丁基醚50g投入反应烧瓶中,抽真空后容器氢气压力0.13mpa,35℃搅拌4h,反应完毕,过滤除去催化剂,重结晶得到产物4,4'-((((丙烷-1,3-二基双(4,1-亚苯基))双(丙烷-3,1-二基))双(氧))双(亚甲基))双(1,3-二氧五环-2-酮)29.6g,收率95.3%,纯度98.4%,[ms+h]
+
:513.6。
[0053]
实施例7
[0054]
将丙炔醇(59.05g,0.5mol)、4-(羟甲基)-1,3-二氧杂戊环-2-酮(32.2g,0.575mol)、三苯基磷(157.4g,0.60mol)、无水乙腈200g于-10℃依次加入到氮气氛的烧瓶中,搅拌10min。偶氮二甲酸二叔叔丁酯(138.2g,0.60mol)的无水乙腈100g溶液缓慢滴加入
体系中,滴完再继续反应15h。反应结束后,脱溶后再加入环己烷进行打浆,过滤得到4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮62.0g,收率79.4%,纯度97.1%,[ms+h]
+
:157.2。
[0055]
4-((丙基-2-炔-1-基氧)甲基)-1,3-二氧五环-2-酮(50.0g,0.32mol)、5,5'-(戊烷-1,3-二基)双(2-碘苯甲酸)二甲酯(81.3g,0.144mol)、二异丙基乙基胺(194.4g,1.92mol)、cui2(10.16g,0.032mol)在氮气氛下控制温度100℃反应7h,反应完毕,经过萃取、水洗,二氯甲烷重结晶得到产物5,5'-(戊烷-1,3-二基)双(2-(3-((2-氧代-1,3-二氧五环-4-基)甲氧基)丙基-1-炔-1-基)苯甲酸二甲酯)71.3g,收率81.6%,纯度95.8%,[ms+h]
+
:621.6。
[0056]
5,5'-(戊烷-1,3-二基)双(2-(3-((2-氧代-1,3-二氧五环-4-基)甲氧基)丙基-1-炔-1-基)苯甲酸二甲酯)(50.0g,0.082mol)、lindlar catalyst 0.6g、喹啉0.6g、四氢呋喃50g,抽真空后保持反应容器氢气0.14mpa,室温搅拌3h,反应完毕,除去催化剂,加入水洗涤,萃取重结晶得到产物5,5'-(戊烷-1,3-二基)双(2-(3-((2-氧代-1,3-二氧五环-4-基)甲氧基)丙基-1-烯-1-基)苯甲酸二甲酯)47.3g,收率93.9%,纯度97.3%,[ms+h]
+
:625.6。
[0057]
将5,5'-(戊烷-1,3-二基)双(2-(3-((2-氧代-1,3-二氧五环-4-基)甲氧基)丙基-1-烯-1-基)苯甲酸二甲酯)(30.0g,0.049mol)、pd/c 0.4g(净含量)、甲基叔丁基醚50g投入反应烧瓶中,抽真空后容器氢气压力0.13mpa,35℃搅拌4h,反应完毕,过滤除去催化剂,重结晶得到产物5,5'-(戊烷-1,3-二基)双(2-(3-((2-氧代-1,3-二氧五环-4-基)甲氧基)丙基)苯甲酸二甲酯)28.5g,收率94.4%,纯度98.6%,[ms+h]
+
:629.7。
[0058]
实施例8
[0059]
nipu合成实验及物理性能
[0060]
将实施例1中合成的五元环碳酸酯100g、己二胺23.5g、碘化钾0.2g进行常温充分搅拌混合3h,然后将温度升至100℃反应12h,脱泡后在模具上浇片,成片温度150℃,在成片时间8h后室温放置1天得到非异氰酸酯聚氨酯,转化率98%,gpc测试数均分子量28200,分子量分布2.1,测试其物理机械性能。
[0061]
试片物性如下:硬度(shore a),73;永久拉伸形变,24%;断裂伸长率,500%;拉伸强度,7.6mpa;100%拉伸形变模量,120mpa;撕裂强度,32.6kn/m。
[0062]
将实施例2制备得到的五元环碳酸酯100g、ipda二胺34.56g、溴化钾0.2g进行常温充分搅拌混合3h,然后将温度升至100℃反应12h,脱泡后在模具上浇片,成片温度150℃,在成片时间8h后室温放置1天得到非异氰酸酯聚氨酯,转化率98%,gpc测试数均分子量33600,分子量分布2.7,测试其物理机械性能。
[0063]
试片物性如下:硬度(shore a),79;永久拉伸形变,15%;断裂伸长率,200%;拉伸强度,18.0mpa;100%拉伸形变模量,360mpa;撕裂强度,51.6kn/m。
[0064]
将实施例3制备得到的五元环碳酸酯100g、癸二胺36.9g、溴化钾0.2g进行常温充分搅拌混合3h,然后将温度升至100℃反应12h,脱泡后在模具上浇片,成片温度150℃,在成片时间8h后室温放置1天得到非异氰酸酯聚氨酯,转化率98%,gpc测试数均分子量34100,分子量分布3.3,测试其物理机械性能。
[0065]
试片物性如下:硬度(shore a),68;永久拉伸形变,25%;断裂伸长率,680%;拉伸强度,2.3mpa;100%拉伸形变模量,40mpa;撕裂强度,51.6kn/m。
[0066]
本发明成功制备了具有力学性能可调控的nipu树脂。通过调控树脂的软、硬段分子结构,nipu树脂的拉伸强度、断裂伸长率、拉伸模量均可大幅调整。由于nipu分子链含有丰富的羟基基团,该材料的湿态粘附性、自修复性相比较常规热塑性聚氨酯均有显著提高。有望在胶黏剂、涂料、特种涂层材料等领域应用。
[0067]
最后所应说明的是:以上实施例仅用以说明而非限制本发明的技术方案,尽管参照上述实施例对本发明进行了详细说明,本领域的普通技术人员应当理解:依然可以对本发明进行修改或者等同替换,而不脱离本发明的精神和范围的任何修改或局部替换,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1