神经干细胞和原代神经元体外共培养的方法及模型
1.本发明涉及生物技术领域中,神经干细胞和原代神经元体外共培养的方法及模型。
背景技术:
2.神经发生是包括从神经干细胞增殖并经历均衡和不均衡性分裂成为定向祖细胞,并逐渐向功能区域迁移、不断发生可塑性变化并与其他神经元建立突触联系从而产生神经功能的完整过程。突触可塑性作为学习记忆的神经生物学基础,是指突触的形态和功能发生较为持久变化的特性或现象,包括现有神经元之间连接强度的可调节变化以及新生神经元与现有神经元之间连接的建立。在整个成年期,在哺乳动物的中枢神经系统中成体神经发生主要位于海马的齿状回和侧脑室壁的室下区。齿状回中的成体神经干细胞主要存在于颗粒细胞下层,新产生的细胞迁移入颗粒细胞层,其中大多数发育分化成颗粒细胞;而svz区的新生细胞,则通过喙侧迁移流到达嗅球然后在嗅球中发育分化成几种中间神经元亚型。成体干细胞通常在组织中发挥稳态维持作用,并可通过直接和间接机制为大脑提供额外的可塑性层。这些神经元高度兴奋,在关键时期表现出较低的长时程增强诱导阈值,并通过与成熟神经元形成新的突触连接来促进现有回路的可塑性。例如海马齿状回的新生神经元,大部分会在3周内整合到现有的齿状回回路中,沿着苔藓纤维束将轴突延伸到ca3区并且从穿孔通路传入兴奋性突触。随着新生颗粒细胞成熟,它们越来越倾向于被纳入到支持空间记忆的环路中。行为学研究表明,成体神经干细胞发生对于海马/嗅球依赖的学习记忆功能具有重要意义。此外,大脑内各种神经细胞间存在相互作用,神经干细胞和神经元可分泌各种神经营养因子,对自身或其它细胞生长产生不同程度的影响。然而,目前大多数关于成体神经干细胞增殖、迁移、分化以及神经元突触可塑性的研究都是建立在单个类型细胞模型的基础上,并未考虑神经干细胞与神经元之间的相互作用,这在一定程度上限制了生物体脑内神经干细胞相关的基础和应用研究的深入挖掘;基于上述原因,迫切需要建立一种神经干细胞和神经元的体外共培养模型。同时,原代提取的神经元和神经干细胞在性状和功能方面更接近于在体状态,因此,选取原代培养的神经元和神经干细胞进行共培养能够较好的还原成年哺乳动物脑内两类细胞相互作用相互影响的真实情况,对于后续的研究大有裨益。
技术实现要素:
3.本发明所要解决的技术问题是如何体外共培养神经干细胞和原代神经元。
4.为解决上述技术问题,本发明首先提供了一种体外共培养神经干细胞和神经元的方法,所述方法包括:1)将神经元接种于共培养小室(transwell小室)的上室或下室中培养(1-2天)使神经元应贴壁生长且有突起长出,将培养液替换为共培养培养液;2)将神经干细胞接种于共培养小室的另一室(下室或上室)中,所述神经干细胞处于所述共培养培养液中,进行共培养,即实现神经干细胞和神经元的体外共培养;
5.所述共培养培养液由neurobasal培养基、b-27(去除维生素a)、200mm谷氨酰胺补充剂、青链霉素储备液、egf和bfgf组成,其中,neurobasal培养基的体积含量为95-97%,b-27(去除维生素a)的体积含量为1.5-2.5%,200mm谷氨酰胺补充剂的体积含量为0.5-1.5%,青链霉素储备液的体积含量为1-2%,egf(表皮细胞生长因子)的浓度为5-20ng/ml,bfgf(碱性成纤维细胞生长因子)的浓度为5-20ng/ml;
6.所述200mm谷氨酰胺补充剂由溶剂和溶质组成,所述溶剂为85%(质量百分比)nacl溶液,所述溶质为l-丙氨酰-l-谷氨酰胺二肽,其在所述谷氨酰胺补充剂中的浓度为200mm;
7.所述青链霉素储备液中青霉素的浓度为100-200u/ml,链霉素的浓度为100-200μg/ml。
8.其中,neurobasal培养基可为gibco产品(货号21103049)。
9.b-27(去除维生素a)可为gibco产品(货号a3353501)。
10.200mm谷氨酰胺补充剂可为gibco产品(货号35050061)。
11.青链霉素储备液可为gibco产品(货号15140163)。
12.egf可为peprotech产品(货号315-09-100)。
13.bfgf可为peprotech产品(货号为450-33-50)。
14.上述方法中,所述共培养培养液中egf的浓度可为10-15ng/ml,bfgf的浓度可为10-15ng/ml。
15.进一步,所述共培养培养液中egf的浓度可为10ng/ml,bfgf的浓度可为10ng/ml。
16.上述方法中,所述神经元可为原代神经元。
17.上述方法中,所述神经干细胞可为第3-5代的神经干细胞。
18.上述方法步骤1)中,所述神经元的培养包括:将所述神经元在神经元种植液培养后再在神经元单独培养饲养液中培养;
19.所述神经元种植液中各物质及其在所述神经元种植液中的体积百分比分别为:bme培养基86.55%,胎牛血清10%,20%葡萄糖溶液0.45%,200mm谷氨酰胺补充剂1%,100mm丙酮酸钠溶液1%,青链霉素储备液1%;其中,20%葡萄糖溶液,溶剂为水,溶质为葡萄糖,葡萄糖的质量百分比浓度为20%;100mm丙酮酸钠溶液(gibco产品,货号11360070),溶剂为水,溶质为丙酮酸钠,丙酮酸钠的浓度为100mm;
20.所述神经元单独培养饲养液中各物质及其在所述神经元单独培养饲养液中的体积百分比分别为:neurobasal培养基96%,b-27(gibco产品,货号17504044)2%,200mm谷氨酰胺补充剂1%,青链霉素储备液1%。
21.利用所述神经元种植液培养的时间可为2小时。利用所述神经元单独培养饲养液培养的时间可为1-2天。在利用所述神经元单独培养饲养液培养时还可向培养体系中添加阿糖胞苷。阿糖胞苷与神经元的作用时间可为24小时。
22.所述神经元的接种密度可为1
×
106/ml。
23.上述方法步骤2)中,所述神经干细胞的接种密度可为1
×
106/ml。
24.上述方法中,所述共培养可在温度36-37℃,co2浓度4.5%-5.5%,湿度50%-85%的无菌环境中进行。
25.上述方法中,所述共培养小室的上室与下室间的膜为聚碳酸酯膜,孔径为0.4μm。
26.利用所述体外共培养神经干细胞和神经元的方法得到的神经干细胞和神经元的共培养模型,也属于本发明的保护范围。
27.所述共培养培养液,也属于本发明的保护范围。
28.本发明还提供一种成套产品,所述成套产品包括所述共培养培养液与共培养小室。
29.所述成套产品可由所述共培养培养液与共培养小室组成。
30.所述共培养培养液在体外共培养神经干细胞和神经元中的应用;
31.或,所述成套产品在体外共培养神经干细胞和神经元中的应用;
32.或,所述共培养培养液在制备神经干细胞和神经元共培养模型中的应用;
33.或,所述成套产品在制备神经干细胞和神经元共培养模型中的应用,也属于本发明的保护范围。
34.实验证明,本发明体外共培养神经干细胞和原代神经元的方法可以成功实现神经干细胞和原代神经元的体外共培养。所得共培养模型能够很好的保留两种细胞类型的生物学特性,可以很好的模拟体内生长微环境,使之更接近细胞在体性状,为体外研究神经干细胞与成熟神经元共同参与的神经结构、功能和机制研究提供更好的体外实验模型;所得共培养模型的两类细胞不直接接触,适用于研究两种细胞共同生长条件下的相互作用,便于观察细胞与细胞以及细胞与胞外环境之间的相互影响,特别适合两种细胞共存状态下的生物学过程研究及其分子生物学机制的深入挖掘。
35.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
附图说明
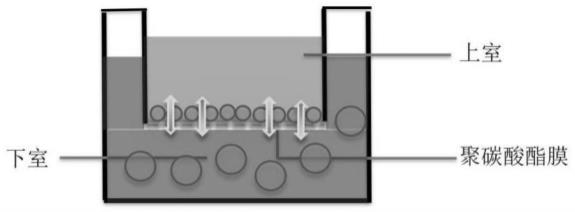
36.图1神经干细胞和原代海马神经元共培养示意图。
37.图2共培养1-5d时神经干细胞生长情况,虚线箭头示神经球边缘突起生长,实线箭头示神经球中央空洞坏死区域(scale bar=100μm)。
38.图3神经干细胞免疫荧光染色结果(scale bar=50μm)。
39.图4共培养5d时神经元免疫荧光染色结果(scale bar=50μm)。
40.图5不同共培养液条件下神经球直径分布情况。
41.图6不同共培养液条件下神经球内部神经干细胞分化情况(scale bar=100μm)。
42.图7不同共培养液条件下神经球内部神经干细胞分化定量分析结果。
具体实施方式
43.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
44.实施例1、
45.选用新生12h内wistar大鼠,分离海马组织并消化,进行神经干细胞原代培养,当
神经球直径约150μm左右时进行传代;同时将原代海马神经元培养于共培养小室(transwell小室)上层或下层,1-2d后,将传至第3-5代的神经干细胞接种至另一层进行共培养(如图1所示)。
46.一、原代海马神经元培养方法
47.(一)神经元种植液:各物质及其在神经元种植液中的体积百分比分别为:bme培养基86.55%,胎牛血清10%,20%葡萄糖溶液0.45%,200mm谷氨酰胺补充剂1%,100mm丙酮酸钠溶液1%,青链霉素储备液1%。
48.其中,20%葡萄糖溶液,溶剂为水,溶质为葡萄糖,葡萄糖的质量百分比浓度为20%;
49.200mm谷氨酰胺补充剂(gibco产品,货号35050061),溶剂为85%(质量百分比)nacl溶液,溶质为l-丙氨酰-l-谷氨酰胺二肽,l-丙氨酰-l-谷氨酰胺二肽的浓度为200mm;
50.100mm丙酮酸钠溶液(gibco产品,货号11360070),溶剂为水,溶质为丙酮酸钠,丙酮酸钠的浓度为100mm;
51.bme培养基为gibco产品,货号21010046;
52.青链霉素储备液为gibco产品,货号为15140163。
53.(二)神经元单独培养饲养液:各物质及其在神经元单独培养饲养液中的体积百分比分别为:neurobasal培养基96%,b-27 2%,200mm谷氨酰胺补充剂1%,青链霉素储备液1%。
54.其中,neurobasal培养基为gibco产品,货号21103049;
55.b-27为gibco产品,货号17504044。
56.(三)操作步骤:
57.1.高压灭菌:使用前1d,选取若干玻璃离心管,90mm玻璃皿6个,50ml烧杯3个及200目不锈钢滤网2个,刻度吸管及细玻璃滴管若干分别装入不锈钢盒内。选取规格为1000ml、200μl和10μl的移液器吸头盒各1盒,放入高压蒸汽灭菌器内。120℃高压灭菌2h,后放入烤箱,80℃烘干2h。
58.2.培养皿包被:使用前2d,在无菌条件下取35mm塑料培养皿,加多聚赖氨酸1ml/皿,放置过夜,吸去多余多聚赖氨酸,自然干燥即得到多聚赖氨酸包被的培养皿,备用。
59.3.组织剥离:取12h内新生的wistar乳鼠,置于75%乙醇水溶液中浸泡消毒。在无菌条件下断头,沿正中剪开皮肤及颅骨,暴露出大脑,用弯镊小心取出全脑,用预冷的解剖液冲洗以去除血液,后浸于盛有预冷解剖液的玻璃平皿中。在解剖显微镜下,用眼科直镊和弯镊配合,取出海马组织。具体方法为沿正中夹断双侧半球,用弯镊将一侧皮层掀开,两镊配合,剥离出完整的海马组织,并去除海马周围粘附的皮层及血管。另一侧进行相同的操作,待双侧海马均取出后置于预冷的解剖液内。
60.4.消化与分散:待所有乳鼠的海马均取出后,吸出大部分解剖液,用小剪刀剪碎海马组织成1-2mm3的组织块。加入浓度为0.25%的胰蛋白酶在37℃温箱内消化20min,后加入等量的胎牛血清终止消化。用剖光过的细玻璃滴管吹打细胞悬液(慢吸快吹),每吹打10次后吸取上层悬液,用200目的不锈钢滤网过滤至烧杯内,后加入适量神经元种植液继续吹打,此步骤重复约3次。将烧杯内滤过的细胞悬液倒入玻璃离心管中,1000rpm/min离心2-5min后弃上清,后加入适量种植液吹打洗涤,再离心一次并弃去上清。将适量种植液加入离
心管内,吹打制备成细胞悬液。
61.5.计数和接种:用神经元种植液对少量细胞悬液稀释,采用细胞计数板计数。将细胞悬液稀释为1
×
106/ml的密度,接种在多聚赖氨酸包被的培养皿中,再按照前后、左右的方向晃动培养皿,使细胞均匀贴服在培养皿内,切忌顺时针或逆时针方向晃动。后置于37℃,5%co2培养箱内培养。
62.6.换液:培养24h后更换培养基,将种植液全部吸掉,加入约2ml神经元单独培养饲养液继续培养,并于培养的第2天向其中加入终浓度为3-5μg/ml阿糖胞苷,作用24h后更换为新鲜的饲养液,之后每周半量换液2次,得到原代海马神经元。
63.二、神经干细胞培养方法
64.(一)大鼠海马神经干细胞单独培养培养基(神经干细胞培养液):各物质及其在该神经干细胞培养液中的浓度分别为:dmem/f-12培养基96%(体积百分比),n2 1%(体积百分比),b-27(去除维生素a)2%(体积百分比),青链霉素储备液1%(体积百分比),egf 20ng/ml,bfgf 20ng/ml;或neurobasal培养基97%(体积百分比),b-27(去除维生素a)2%(体积百分比),青链霉素储备液1%(体积百分比),egf 20ng/ml,bfgf 20ng/ml。
65.其中,dmem/f-12培养基为gibco产品,货号为11320033;n2为gibco产品,货号为17502001;b-27(去除维生素a)为gibco产品,货号为a3353501;neurobasal培养基为gibco产品,货号21103049;青链霉素储备液为gibco产品,货号为15140163;egf为peprotech产品,货号为315-09-100;bfgf为peprotech产品,货号为450-33-50。
66.(二)大鼠海马神经干细胞原代培养步骤
67.1.实验准备:实验中解剖器械、枪头、大玻璃皿等均经高压灭菌、干燥处理;
68.2.超净台消毒:将解剖显微镜、枪头、0.70μm细胞滤网、一次性滴管、移液枪、50ml离心管等放入超净台内紫外消毒30min;
69.3.分离海马:取新生12h内的wistar乳鼠,用75%乙醇水溶液浸泡消毒,大剪刀剪下头部,一只手用小镊子夹住鼻子处,另一只手剪开头皮,再从枕骨大孔处沿正中线剪开头骨,用小镊子将头骨分离至两边,充分暴露大脑,用预冷的dmem高糖培养基冲去血水后,用小弯镊小心将大脑分离下来,放入大玻璃皿中,滴入几滴dmem高糖培养基,在解剖显微镜下分离出海马组织,将海马组织放入置于冰上的加有预冷的dmem高糖培养基的35mm培养皿中;
70.4.胰蛋白酶消化:将35mm培养皿中的dmem高糖培养基吸弃,用小弯剪将海马组织剪碎,加入2ml的0.25%胰蛋白酶,放入培养箱中,消化20min。
71.5.离心:加入2ml胎牛血清终止消化,用吸管吹打细胞10-20次,经过0.70μm细胞滤网过滤至50ml的离心管中,放入离心机中1000rpm离心5min;
72.6.接种:离心后倒掉上清,加入2ml的神经干细胞培养液,吹打混匀,用细胞计数仪测量细胞密度,以1
×
106/ml的密度接种至t25的培养瓶中,放入co2培养箱培养。
73.7.换液:接种后第2天全量换液,将细胞吸至15ml离心管中,1000rpm离心5min,倒掉全部上清,加入2ml神经干细胞培养液重悬细胞,并将细胞悬液吸至新的培养瓶中;之后每隔1d半量换液,每隔5-6d左右可传代。
74.(三)大鼠海马神经干细胞传代培养步骤
75.1.显微镜下观察神经球直径约150μm时可进行第一次传代,将细胞吸至15ml离心
管,37℃下1000rpm离心1min,以区别神经球和其它不成球的单个细胞;
76.2.离心后倒掉上清,加入2ml的accutase酶,放入培养箱中消化15-20min;
77.3.消化结束后轻柔吹打细胞15次左右,加入4ml的神经干细胞培养液终止消化,37℃下1000rpm离心5min;
78.4.离心结束后加入2ml神经干细胞培养液重悬细胞,细胞计数仪测量细胞密度,以1
×
106/ml的密度接种至t25的培养瓶中,即得到下一代的神经干细胞。之后约5-6d(神经球再次增大至直径约150μm左右时)可进行下一次传代。
79.三、神经干细胞与原代海马神经元共培养方案
80.(一)培养基配方的摸索
81.由于原代海马神经元和神经干细胞单独培养的难度比较大,发明人在共培养过程中对于培养基配方的组成进行了反复的尝试、摸索和优化。
82.共培养培养基配方1:共培养小室上室用神经元单独培养饲养液,下室用与上室等体积的以dmem/f-12为基础培养基的神经干细胞培养液进行两种细胞的共培养,共培养结果:上室原代海马神经元逐渐漂浮不再贴壁,而下室神经干细胞逐渐贴壁分化,不能继续维持干性成球生长。
83.共培养培养基配方2:共培养小室上层和下层的培养基配方均为neurobasal培养基+b-27(去除维生素a)+谷氨酰胺补充剂+青链霉素的组分,但共培养后神经干细胞很快贴壁、分化,无法维持成球生长。同时设置谷氨酰胺补充剂浓度为0.5%组和不含谷氨酰胺补充剂的培养液,但神经干细胞的分化情况并无明显改善。
84.共培养培养基配方3-5:采用3种组成为neurobasal+b-27(去除维生素a)+谷氨酰胺补充剂+青链霉素+egf+bfgf(其中egf和bfgf的浓度分别为5ng/ml、10ng/ml和20ng/ml)的细胞共培养培养液,发现神经干细胞聚集成团悬浮生长,且原代海马神经元的生长未受到影响,培养过程中需隔天补充egf和bfgf以确保神经干细胞的持续增殖。
85.具体的,共培养培养液3的各物质及其在共培养培养液3中的浓度分别为:neurobasal培养基96%(体积百分比),b-27(去除维生素a)2%(体积百分比),200mm谷氨酰胺补充剂1%(体积百分比),青链霉素储备液1%(体积百分比),egf 5ng/ml,bfgf 5ng/ml。
86.共培养培养液4的各物质及其在共培养培养液4中的浓度分别为:neurobasal培养基96%(体积百分比),b-27(去除维生素a)2%(体积百分比),200mm谷氨酰胺补充剂1%(体积百分比),青链霉素储备液1%(体积百分比),egf 10ng/ml,bfgf 10ng/ml。
87.共培养培养液5的各物质及其在共培养培养液5中的浓度分别为:neurobasal培养基96%(体积百分比),b-27(去除维生素a)2%(体积百分比),200mm谷氨酰胺补充剂1%(体积百分比),青链霉素储备液1%(体积百分比),egf 20ng/ml,bfgf 20ng/ml。
88.(二)神经干细胞与原代海马神经元共培养方法
89.分别利用共培养培养液1-3进行神经干细胞与原代海马神经元共培养,具体步骤如下:
90.1.首先获得原代海马神经元的单细胞悬液:将步骤一原代海马神经元培养方法中(三)的1-5获得的原代海马神经元以1
×
106/ml的密度接种至transwell培养小室上室或下室,并放入恒温细胞培养箱中培养(温度36.5℃
±
0.5℃,co2浓度4.5%-5.5%,湿度50%-85%);
91.2.共培养模型所需原代海马神经元换液:培养2h小时左右,吸尽transwell嵌套小室中的种植液,加入2ml神经元单独培养饲养液;在培养至第1-2d时向其中加入终浓度为3-5μg/ml阿糖胞苷,抑制其他类型细胞的增殖,待作用24h后更换为新鲜的共培养培养液1或共培养培养液2或共培养培养液3,并将步骤二神经干细胞培养方法中获得的第三代神经干细胞接种至transwell小室另一层。
92.3.第三代的神经干细胞的获得:将步骤二神经干细胞培养方法中获得的第三代神经干细胞(此时所用神经干细胞培养液组成与步骤二中以neurobasal为基础培养基的神经干细胞培养液保持一致)重悬于共培养培养液1或共培养培养液2或共培养培养液3中得到第三代神经干细胞悬液(细胞浓度为1
×
106/ml);将上述第三代神经干细胞悬液接种至已接种有原代海马神经元的transwell嵌套小室的另一层中(原代海马神经元接种至上层,则神经干细胞接种至下层,具体接种至哪层由实验目的决定),放入恒温细胞培养箱中培养(温度36.5℃
±
0.5℃,co2浓度4.5%-5.5%,湿度50%-85%),每隔1天对对共培养体系进行半量换液,神经干细胞视增殖情况定期传代并继续同上述原代海马神经元共同培养。
93.共培养结束后原代海马神经元仍然保持海马神经元自身的形态,并维持良好的存活状态:神经元胞体饱满,突起发达,形成密集的神经纤维网络;神经干细胞聚集成团,悬浮生长,边界清楚,形态规整如桑葚,折光性好,可维持自身的增殖活力即干性。此共培养模型的构建实现的是在同一液体体系中两种不同细胞的伴行生长,二者既可维持自身固有的良好性状,同时二者所分泌的细胞因子又可以通过半透膜相互渗透,影响另一种细胞的生理状态;这更接近于体内两种细胞相互影响作用的真实情况。此外,两种细胞是非直接接触式共培养,因此对于任一细胞中蛋白和基因表达的检测都可以实现有针对性的提取和获得,不受另一种细胞的干扰。
94.(三)神经干细胞和原代海马神经元鉴定及形态学观察
95.通过免疫荧光标记原代海马神经元β-tubulinⅲ蛋白(微管蛋白β,可特异性标记神经元细胞骨架)对神经元进行鉴定及形态观察;通过免疫荧光标记神经干细胞nestin蛋白(神经巢蛋白,可特异性标记神经干细胞)对其进行鉴定。通过测量分布于神经球直径各区间的神经球数量百分比,对神经干细胞增殖能力和干性维持情况进行评价;并用gfap(胶质纤维酸性蛋白,星形胶质细胞特异性标志物)标记星形胶质细胞,neun(神经元核蛋白,成熟神经元特异性标志物)标记成熟神经元,用以表征神经球内部细胞分化程度。综合以上指标用以评价细胞共培养状态,最终确定共培养液中egf和bfgf的最佳浓度。
96.其中,免疫荧光实验步骤如下:
97.1.细胞爬片制作:
①
针对共培养模型中原代海马神经元的细胞爬片,将细胞爬片放入transwell小室中,上面滴加0.1mg/ml的多聚赖氨酸,过夜后吸弃,用1
×
pbs冲洗两遍后在超净台中晾干,将原代海马神经元接种至爬片之上继续培养待原代海马神经元生长成熟;
②
针对神经干细胞神经球的爬片制作,观察共培养小室中神经球的生长情况,待多数神经球直径介于50-150μm时,将经多聚赖氨酸包被的爬片置于共培养小室中培养神经干细胞的一侧,待神经球粘附至爬片后,将培养液小心吸弃。
98.2.将上述细胞爬片采用1
×
pbs清洗一遍后加入2ml的4%多聚甲醛固定15min,固定完成后,在载玻片上滴加一滴中性树脂,并将细胞爬片用镊子小心覆于其上,放入4℃冰箱中保存,待中性树脂干燥后进行后续免疫荧光染色实验;
99.3.将细胞爬片取出,在室温下复温30min,滴加0.3%pbs-t溶液至爬片上,室温放置35min;
100.4.1
×
pbs洗3次,每次5min;
101.5.用免疫组化笔在爬片周围画一个圈,在圈中滴加封闭液,室温下放置1h;
102.6.将封闭液倒掉,轻轻甩干后滴加nestin抗体(abcam,ab18102)用于神经干细胞鉴定,β-tubulinⅲ抗体(abcam,ab78078)用于原代海马神经元鉴定和神经元形态观察,放入4℃冰箱中过夜;当用于检测神经球内组成细胞的分化情况时,使用gfap抗体(sigma-aldrich,g3893-2ml)与neun抗体(abcam,ab177487)的混合溶液共同孵育神经球细胞爬片,放入4℃冰箱中过夜;
103.7.将爬片从冰箱取出室温放置20min后,1
×
pbs洗3次,每次5min;
104.8.滴加150μlfitc标记的山羊抗小鼠二抗(中杉金桥,zf-0312)(用于原代神经元和神经干细胞鉴定),或滴加150μlfitc标记的山羊抗小鼠二抗和tritc标记的山羊抗兔二抗(中杉金桥,zf-0316)混合溶液(用于神经球内部细胞分化检测),室温下孵育1h;
105.9.1
×
pbs洗3次,每次5min;
106.10.用滤纸将载玻片擦干,滴加dapi封片剂,盖玻片封片,避免产生气泡,荧光显微镜下拍照观察。
107.(四)实验结果
108.图1所示为神经干细胞和原代海马神经元共培养示意图,选择嵌入式共培养小室(corning,3412),其中间为一层半透明的聚碳酸酯膜,孔径0.4μm,可以阻止细胞通过,而培养液中的成分可以自由通过。
109.采用上述共培养培养液3培养时,光镜下可见原代海马神经元胞体饱满,突起发达,形成密集的神经纤维网络;神经球随共培养时间的延长增殖速度较慢,且部分神经球贴壁生长,边缘有突起长出,提示存在分化现象(如图2所示)。
110.采用上述共培养培养液4培养时,光镜下可见原代海马神经元形态与上采用述共培养培养液3培养时无异;神经干细胞聚集成团,悬浮生长,边界清楚,部分神经球形态规整如桑葚,折光性好增殖速度适中,鲜见大直径神经球黏连成块或边缘长起突起情况(如图2所示);
111.采用上述共培养培养液5培养时,对原代海马神经元和神经干细胞形态进行光学显微镜观察,可见原代海马神经元胞体饱满,突起发达,形成密集的神经纤维网络;神经干细胞聚集成团,悬浮生长,边界清楚,部分神经球形态规整如桑葚,折光性好,但随着共培养时间的延长,出现大量因增殖过快而产生的大直径神经球,且黏连成块,其折光性差,中央出现空洞和坏死的现象(如图2所示)。
112.之后针对共培养液4,采用神经干细胞特异性标志物nestin对神经干细胞进行鉴定(如图3所示),可见神经球内nestin表达丰富,基本与dapi重合;采用神经元特异性标志物β-tubulinⅲ对原代海马神经元进行鉴定和形态学检测观察,结果可见形成密集的神经纤维网络的神经元均为β-tubulinⅲ阳性(如图4所示)。
113.有文献报道,传代后神经干细胞分裂速度明显加快,传至第三代时,第1,2天细胞增殖较慢,第3天开始细胞进入快速增殖期,第6天进入平台期;当神经球直径大于150μm时,培养基中的营养成分无法进入球心内部,开始出现大量坏死细胞,因此,在不同共培养培养
液共培养实验中,采用分布于各直径区间的神经球所占百分比作为神经干细胞增殖能力的评价指标。发明人把神经球的直径分为小于50μm、50-150μm和大于150μm,分别检测不同共培养培养液组成对神经干细胞的干性维持情况,结果如图5所示。在利用共培养培养液3(egf+bfgf 5ng/ml)共培养时,以直径大于150μm的神经球为例,随培养时间的延长,其百分比逐渐增大,在共培养7天时理应达到平台期,各区间分布比例趋于平稳,但在实际培养过程中仍有所增长,同时直径区间分布于小于50μm和50-150μm的神经球数量百分比波动异常,提示神经干细胞增殖异常。在利用共培养培养液4(egf+bfgf 10ng/ml)共培养时,以直径大于150μm的神经球为例,其百分比于共培养第5-7天趋于平稳,且其他直径区间的神经球数量百分比的变化亦符合神经干细胞的增殖规律;而在利用共培养培养液5(egf+bfgf 20ng/ml)共培养时,共培养期间各区间神经球数量百分比出现异常波动,提示其增殖能力或成球能力异常,状态亦不甚稳定。
114.基于上述结果,发明人进一步采用免疫荧光染色共标记技术,在三种共培养培养液条件下标记神经球中已分化为星形胶质细胞和成熟神经元的细胞,对其荧光强度进行半定量分析,分别用以下公式表示神经球内神经干细胞向成熟神经元/星形胶质细胞分化的倾向:
[0115][0116][0117]
根据以上分化指数表征和评价神经球中神经干细胞的纯度和细胞所处状态。结果如图6和7:神经球内neun阳性表达结果显示共培养培养液3共培养后的neun阳性信号面积和荧光强度(用来表征神经球内成熟神经元的数量)明显大于/强于共培养培养液4和共培养培养液5中neun的表达情况,且神经球周围可见突起生长,定量结果可见其相对荧光强度显著高于共培养培养液4(*p《0.05),且共培养培养液4中的neun相对荧光强度在三组中最低;gfap在神经球内的总荧光强度在三种共培养液培养条件下无显著差异。以上结果均提示利用共培养培养液3共培养时神经球内神经干细胞更倾向于向成熟神经元分化,无法较好的维持神经干细胞的干性和增殖能力。
[0118]
综上,综合考虑神经球增殖状态、神经球内神经干细胞干性维持及其分化情况,共培养培养液3难以维持神经干细胞的增殖能力,其所形成的神经球有突起生长,趋于向成熟神经元分化;共培养培养液5中神经干细胞增殖速度过快,后期易形成直径过大的神经球,且互相黏连成块,中央区域空洞坏死;而共培养培养液4中神经球增殖情况良好,神经球内神经干细胞可维持其自身干性,且向成熟神经元的倾向性均低于共培养培养液3和共培养培养液5,而向星形胶质细胞分化的倾向性与共培养培养液3和共培养培养液5无显著差异。因此,共培养培养液4(egf+bfgf 10ng/ml)最适合用于神经干细胞与原代海马神经元的共培养。
[0119]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本申
请中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1