一种检测甲型H7N9禽流感病毒的方法与流程
一种检测甲型h7n9禽流感病毒的方法
技术领域
1.本发明属于生物检测技术领域,具体涉及一种检测甲型h7n9禽流感病毒的方法。
背景技术:
2.甲型h7n9禽流感病毒(avian influenza a(h7n9)virus)基于两种表面蛋白,即血凝素(hemagglutinin,ha)和神经氨酸酶(neuraminidase,na)进行亚型分类,该病毒是一种新的重组病毒,具有与人类受体结合的能力,可侵入人下呼吸道和肺细胞的上皮细胞,并在哺乳动物中复制。h7n9病毒导致的流感具有潜伏期短和高死亡率等特点,严重威胁人类生命安全。早期诊断对控制疾病传播、改善患者的预后以及降低医疗费用至关重要。因此,建立可靠、灵敏、快速的h7n9病毒检测系统是十分有必要。
3.目前检测h7n9病毒主要包括三种方法:(1)病毒分离和培养;(2)血清中相关抗原的检测(比如利用酶联免疫吸附试验检测抗原);(3)病毒核酸的检测。近年来,临床中主要通过核酸检测h7n9病毒,传统的检测方法为定量逆转录聚合酶链反应(quantitative reverse transcript polymerase chain reaction,qrt-pcr)。但因需要特定的检测设备、耗时较长、需要经专业培训操作人员以及特殊规划的实验室,基层医院很难满足条件。最近,有一些关于h7n9检测的新方法的研究报道,如侧流式试纸重组酶聚合酶扩增(lateral flow dipstick recombinase polymerase amplification,lfd-rpa)需要特殊载体,技术优化门槛较高。逆转录-环介导的等温扩增(reverse transcription loop-mediated isothermal amplification,rt-lamp)引物设计比较繁琐,筛选到合适的引物比较困难。逆转录-液滴数字pcr(reverse-transcription droplet digital pcr,rt-ddpcr)虽然灵敏度高,但需用到昂贵的设备,不利于现场检测。
4.化学发光(chemiluminescence,cl)检测技术完全避免了高荧光信号的背景和容易淬灭的特性,成为生物分析研究与开发最重要的领域。此外,抗体的cl信号与典型的辣根过氧化物酶(hrp)、碱性磷酸酶(alp)和磁珠(mbs)平台已被完美地应用于商品化的免疫分析诊断试剂盒,有效的解决了临床问题。
5.目前,使用crispr-cas13a系统与cl和mbs联用尚未见报道,更未见将其应用于h7n9病毒的检测。
技术实现要素:
6.发明目的:本发明目的在于针对现有技术的不足,提供一种检测甲型h7n9禽流感病毒的方法,通过crispr-cas13a系统与cl和mbs联用,来提高检测的灵敏度,并降低荧光信号背景。
7.本发明针对h7n9 ha/na rna的特征,提供了一种检测甲型h7n9禽流感病毒的特殊检测方法,通过逆转录-重组酶介导扩增(rt-raa),常温扩增靶标rna,结合cas13a-mb-cl进行信号放大和检测,无需对病毒rna进行预处理,大大节约时间和成本,仪器依赖性低,恒温即可扩增,同时特异性强,操作简便,增加了临床适用性。
8.技术方案:本发明的目的通过下述技术方案实现:
9.本发明提供了一种检测甲型h7n9禽流感病毒的方法,利用rt-raa-cas13a-mb-cl放大碱性磷酸酶的化学发光信号检测核酸。
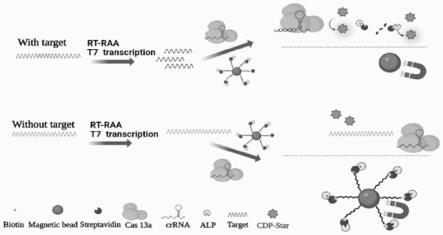
10.本发明通过逆转录-重组酶介导扩增rt-raa,常温扩增靶标rna,结合cas13a-mb-cl进行信号放大和检测。图1为用于核酸检测的rt-taa-cas13a-mb-cl平台示意图:用逆转录-raa法扩增目标rna,氨基化的rna探针通过生物素标记的sa-alp与mbs-cooh偶联,cas13a在crrna降解rna探针的指导下与靶rna结合,释放alp,加入cdp-star后产生cl信号。
11.具体地,本发明检测方法包括以下步骤:
12.(1)iptg诱导lwcas13a蛋白的表达和纯化;
13.(2)rna标准品和crrna的制备;
14.(3)mb-rna-ap复合物的制备;
15.(4)用crispr-cas13a mbs系统检测ha或na基因的rna;
16.(5)通过外部磁场分离溶液,加入alp底物cdp-star;当靶rna存在时,cas13a的crispr rna结合与之互补的靶rna,激活cas13a的侧链切割活性,以切割mb-rna-alp复合物并释放alp,在上清液中产生化学发光信号。化学发光信号的强弱,与h7n9病毒rna浓度成正相关。
17.步骤(2)中,使用premix taq进行pcr以扩增含有h7n9病毒的ha和na基因的质粒;使用pcr产物纯化试剂盒进行扩增双链dna产物纯化并通过onedrop定量;使用转录试剂盒将纯化的双链dna与t7聚合酶于37℃温育过夜;通过rna快速浓缩和纯化试剂盒纯化rna,并通过onedrop定量以制备梯度rna标准溶液;根据靶rna的序列设计crrna;将crrna对应的互补dna单链(包含t7启动子序列,终浓度10μm)进行退火,形成杂交双链。
18.步骤(3)中,5
’‑
末端氨基修饰和3
’‑
末端生物素修饰的rna探针通过缩合化学反应在羧基官能化的mb(mbs-cooh)上进行标记,并与碱性磷酸酶标记的链霉亲和素alp-sa偶联形成mb-rna-alp复合体。
19.步骤(4)中,逆转录-重组酶介导的等温扩增(reverse transcription-recombinase aides amplification,rt-raa)扩增靶rna,用t7rna聚合酶转录出靶rna;当靶rna存在时,cas13a的crispr rna结合与之互补的靶rna,激活cas13a的侧链切割活性,切割mb-rna-alp复合物,并释放alp,检测h7n9病毒。
20.有益效果:
21.本发明将crispr-cas13a系统与cl和mbs三者联用,用于检测甲型h7n9禽流感病毒,是一项方法的创新。本发明利用rt-raa-cas13a-mb-cl放大碱性磷酸酶的化学发光信号检测核酸,克服了crispr结合中荧光检测背景高的问题;可以制备出mb-rna-alp复合物提前存储,整个检测过程可缩短至30min;被证明适用于流感病毒rna检测;尽管具有不兼容的反应系统,仍可进行复杂的生物样品的检测。在病毒检测和诊断方面有很大的应用前景,可以适应临床大规模筛选。因此,本发明检测方法有望扩大临床应用,实现临床应用自动化检测。
附图说明
22.图1为用于核酸检测的rt-taa-cas13a-mb-cl平台示意图;
23.图2为lwcas13a蛋白的表达和纯化;图2a为lwcas13a蛋白的表达;图2b为lwcas13a蛋白的纯化。
24.图3为rt-raa-cas13a-mb-cl检测各浓度h7n9病毒ha rna的化学发光强度拟合曲线。
25.图4为h7n9病毒特异性验证结果。
具体实施方式
26.下面通过具体实施例对本发明技术方案进行详细说明,但是本发明的保护范围不局限于所述实施例。
27.实施例1iptg诱导lwcas13a蛋白的表达和纯化
28.(1)使用plasmid mini kit(omega)试剂盒,根据试剂盒说明书内容,提取pc013pet his6-twinstrep-sumo-lwcas13a细菌(购自张锋实验室)的质粒,并使用one drop(美国热电公司)定量。
29.(2)取100μl冷冻保存的大肠杆菌感受态细胞lb21(cwbiotech),加入50ng pc013pet his6-twinstrep-sumo-lwcas13a细菌的质粒轻轻混匀后(体积不超过10μl),冰上静置30min后,42℃孵育90s,迅速冰上冷却5min;
30.(3)向上步的培养管中加入100μl lb液体培养基(按每升去离子水中加入10gnacl、10g蛋白胨、5g酵母粉的比例进行液体培养基的配制,并经121℃高压蒸汽灭菌20min。取配好的液体培养基按照1.2%的比例,加入琼脂粉配制lb固体培养基,高压蒸汽灭菌后,待lb固体培养基冷却至50℃左右时,加入氨苄(amp)至终浓度为100μg/ml,混匀后铺平板。无抗生素),总体积200μl,37℃孵育45min;
31.(4)取100μl转化后的感受态细胞,均匀涂布于含氨苄(100μg/ml)的lb平板上,37℃温育过夜;
32.(5)挑取转化平板上的单克隆接种于含50μg/ml含氨苄的3ml lb液体培养基的试管中,37℃220r/min振摇过夜;
33.(6)次日按体积比1:50接种于50μg/ml含氨苄的lb液体培养基中,37℃220r/min振摇至菌体od 600为0.6-0.8;
34.(7)取出1ml上步培养物,10000r/min室温离心2min,弃上清,用100μl 1
×
上样缓冲液(20mm na3po4,0.5m nacl,30mm异咪唑,ph7.4)重悬菌体沉淀;
35.(8)向剩余的培养物中加入异丙基硫代半乳糖苷(iptg,sigma公司)至终浓度为0.5mm,16℃220r/min振摇过夜,诱导lwcas13a蛋白表达;
36.(9)继续16℃培养16小时后,取出1ml上步培养物,10000r/min室温离心2min,弃上清,用100μl 1
×
上样缓冲液重悬菌体沉淀。剩余培养物4000r/min,离心10min,弃上清,用pbs(上海生工)重悬菌体沉淀;重悬液进行超声波破碎后,分别取上清液与沉淀液加入1
×
上样缓冲液重悬。
37.(10)进行12% sds-page检测分析,考马斯亮蓝染色显带。
38.(11)5000
×
g离心10min后,取细胞沉淀并重悬于溶菌buffer(20mm tris-hcl,500mm nacl,1mm dtt,ph 7.4)中,加入蛋白酶抑制剂(mce)和溶菌酶(thermofisher);
39.(12)超声破碎:细胞破碎仪(上海净信公司)设置程序功率200w功率,超声2.5s,间
隔10s,超声破碎30min。
40.(13)4℃下以10,000g离心60min后,将上清液用220nm滤器过滤。
41.(14)取上清用镍柱(ge公司)纯化,镍离子亲和柱连接蠕动泵(longer pump),超纯水清洗镍柱后,用结合缓冲液(20mm na3po4,0.5m nacl,30mm异咪唑,ph7.4)平衡镍柱,上清液过柱,再用结合缓冲液洗涤蛋白质结合柱(ge公司)三次,以洗掉杂蛋白。
42.(15)根据lwcas13a蛋白的结构特点,用250u约5ml的sumo蛋白酶溶菌缓冲液(20mm tris-hcl,500mm nacl,1mm dtt,ph 7.4)上柱,4℃旋转孵育过夜,用sumo酶(thermofisher)纯化lwcas13a蛋白。
43.(16)用溶菌buffer冲液洗涤柱子,用sds-page分析收集的溶液。
44.(17)将所有含lwcas13a的溶液用10000d超滤管去异咪唑后于储存缓冲液(600mm nacl,50mm tris-hcl,ph7.5,5%甘油,2mm dtt)中,-80℃冷冻存储。
45.图2为lwcas13a蛋白的表达和纯化。图2a为lwcas13a蛋白的表达。m,marker;泳道1,大肠杆菌未被iptg诱导;泳道2,iptg诱导大肠杆菌过夜;泳道3,沉淀破碎细胞;泳道4,破碎细胞的上清液。图2b为lwcas13a蛋白的纯化。m,marker;泳道1,破碎细胞的上清液;泳道2,用sumo酶处理;泳道3,洗脱液。从图中可以看出:含有sumo位点和标记蛋白的lwcas13a的分子量为155.2kd,但用sumo酶消化后为138.5kd。通过sds-page分析大肠杆菌中表达的lwcas13a,考马斯蓝染色凝胶结果显示,iptg显著诱导大肠杆菌中cas13a蛋白的产生(图2a,泳道2)。收集iptg诱导后的细菌溶液,离心,通过超声破碎细胞沉淀并再次离心。对破碎的细胞上清液和细胞沉淀进行sds-page分析。发现lwcas13a主要存在于上清液中(图2a,泳道3和4)。由于lwcas13a蛋白含有一个his-tag,本发明使用镍离子亲和层析来吸附水溶性蛋白。使用洗涤缓冲液从柱中洗脱出不含多个连续组氨酸的蛋白质,同时lwcas 13a仍在柱上,然后用sumo酶消化lwcas 13a中的sumo位点,lwcas 13a损失6
×
his,用裂解缓冲液很容易从柱中洗脱出来,用黑色箭头标出(图2b,泳道3)。通过这种纯化方法,可以获得高纯度的lwcas13a蛋白。
46.实施例2rna标准品和crrna的制备
47.(1)使用premix taq试剂盒(takara公司),根据试剂盒说明书内容进行pcr,以扩增含有h7n9病毒的ha和na基因的质粒,h7n9质粒pcr扩增体系见表1:
48.ha-f:cctggtattcgctctgattgc;
49.ha-r:taatacgactcactatagggaggcaccgcatgtttccattct。
50.na-f:gaaacaaccaacacaagcca;
51.na-r:taatacgactcactatagggcatccgagctttctccaattctt。
52.上述引物购自生工生物。
53.表1h7n9质粒扩增体系
[0054][0055]
(2)使用pcr产物纯化试剂盒(上海生工),根据试剂盒说明书内容,进行扩增双链dna产物的纯化,并通过one drop定量,获得双链dna产物。
[0056]
(3)使用转录试剂盒(neb)将纯化的双链dna与t7聚合酶(neb)于37℃孵育过夜。通过rna快速浓缩和纯化试剂盒(上海生工)纯化rna,并通过one drop定量,以制备梯度rna标准溶液(10fm,100fm,1pm,10pm,100pm,1nm,10nm)。
[0057]
(4)根据靶rna的序列设计crrna。将crrna对应的互补dna单链(包含t7启动子序列,终浓度10μm)进行退火(pcr 95℃变性2min。缓慢降至25℃,降温过程至少用时45min,短期保存于4℃,长期保存于-20℃),形成杂交双链。
[0058]
ha-crrna-dnaf:
[0059]
taatacgactcactataggggatttagactaccccaaaaacgaaggggact aaaacgattgacccagtcaaactaagcagcggc;
[0060]
ha-crrna-dnar:
[0061]
taatacgactcactataggggatttagactaccccaaaaacgaaggggact aaaacgattgacccagtcaaactaagcagcggc;
[0062]
ha-crrna:
[0063]
rgrgrgrgrarurururargrarcrurarcrcrcrcrarararararcrgrarargrgrgrgrarcru rararararcrgrarururgrarcrcrcrargrurcrarararcrurarargrcrargrcrgrgrc;
[0064]
na-crrna-dnaf
[0065]
taatacgactcactataggggatttagactaccccaaaaacgaaggggactaaaactcca aatagaagaaagaacaagcaggaa;
[0066]
na-crrna-dnar
[0067]
ttcctgcttgttctttcttctatttggagttttagtccccttcgtttttggggtagtctaaat cccctatagtgagtcgtatta;
[0068]
na-crrna
[0069]
grgrgrgrarurururargrarcrurarcrcrcrcrarararararcrgrarargrgrgrgrarcrurararararcr urcrcrarararurargrarargrararargrararcrarargrcrargrgrara。
[0070]
实施例3mb-rna-ap复合物的制备
[0071]
取4℃冰箱保存的10mg/ml的羧基化mbs(life technologies),在涡旋振荡器上涡旋5min混匀mbs,将100μl混匀后mbs转移到新的离心(ep)管中,用1ml 100mm mes缓冲液(大连美仑生物技术有限公司)洗涤mbs两次,并重悬于800μl相同的mes缓冲液中,接着加入1.25m的edc和rna探针补充至总体积1ml,涡旋混匀10s。旋转混合4℃孵育过夜。第二天用1ml tt缓冲液(取12.114g tris溶于90ml ddh2o中,然后加100μl 10% tween-20,定容至100ml,调ph为8.0。每轮孵育30min)封闭mbs 2次后,用1ml nab缓冲液(取12.114g tris溶于90ml ddh2o中,然后加100μl 10% tween-20,定容至100ml,调ph为8.0)重悬mbs,加入alp(大连美仑生物技术有限公司,按照体积比alp:mbs=1:10)后旋转混合1小时。用1ml tt缓冲液洗涤mbs 2次,4℃下储存于tt缓冲液。
[0072]
rna探针序列:
[0073]
/5’aminoc6/rurcrgrgrurururgrurarargrcrcrargrurururururcrgrurcrararurc rargrurururururcrurararurcrgrgrcrcrargru/3’biotin。
[0074]
实施例4用crispr-cas13a mbs系统检测ha或na基因的rna
[0075]
使用rt-raa核酸扩增试剂盒(qitian gene biotechnology)和hiscribe t7快速高产rna合成试剂盒(neb)进行改进的检测分析,如下所示:
[0076]
0.48μm正向引物(cctggtattcgctctgattgc)、0.48μm反向引物(taatacgactcactatagggaggcaccgcatgtttccattct)、14mm无水乙酸镁(大连美仑生物技术有限公司)、12.5μl mm rntp(neb)、2.5μm lt7 mix(neb)、各种浓度的目标rna、2μl鼠rna酶抑制剂(neb)和25μl酶混合液(qitian gene biotechnology)至50μl最终体积。
[0077]
每次反应按2μl初始mbs(life technologies)量加入反应溶液(11.25nm纯化的lwcas13a,22.5nm crrna,1μl rnase抑制剂(neb),100ng背景rna(从人外周血单个核细胞纯化))和各浓度梯度的靶rna(10fm,100fm,1pm,10pm,100pm,1nm,10nm)与mbs复合物(mb-rna-ap)混合,用nab缓冲液补足50μl,用于ha rna和na rna检测。
[0078]
通过磁分离器(thermofisher公司)分离上述溶液,加入alp底物cdp-star(希森美康公司)。当靶rna存在时,cas13a的crispr rna结合与之互补的靶rna,激活cas13a的侧链切割活性,切割mb-rna-alp复合物,并释放alp,在上清液中产生化学发光信号。
[0079]
图3为rt-raa-cas13a-mb-cl检测h7n9病毒ha rna的各个浓度的化学发光强度,拟合的曲线(简单线性回归)线性范围为100fm-1nm,最低检测限为19.7fm。
[0080]
图4为h7n9病毒特异性验证结果。h7n9病毒样本和其他病毒样本,包括季节性流感病毒(a/h1n1和a/h3n2)、2009年猪源性流感病毒a/h1n1和禽流感病毒(a/h5n1和a/h9n1),均可以使用rt-raa-cas13a-mb-cl法检测。
[0081]
本发明利用rt-raa-cas13a-mb-cl,克服了crispr结合中荧光检测背景高的问题;可以制备mb-rna-alp复合物提前存储,整个检测过程可缩短至30min;被证明适用于流感病毒rna检测;尽管具有不兼容的反应系统,仍可进行复杂的生物样品的检测,最低检测限19.7fm。在病毒检测和诊断方面有很大的应用前景,可以适应临床大规模筛选。因此,本发明检测方法有望扩大临床应用,实现临床应用自动化检测。
[0082]
如上所述,尽管参照特定的优选实施例已经表示和表述了本发明,但其不得解释为对本发明自身的限制。在不脱离所附权利要求定义的本发明的精神和范围前提下,可对其在形式上和细节上作出各种变化。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1