由景深扩展技术优化的数字微流控单细胞分选系统
1.本发明涉及数字微流控技术,同时融合了一种光学显微镜景深扩展技术,结合对相关的生物医学数字图像处理。
背景技术:
2.在当前的制药颗粒物分析以及生物医学实验的单细胞分选中,传统技术如激光捕获显微解剖、光镊、光阻法往往带有劳动密集、高损耗、效率较低的缺点。作为一种解决方案,以flowcam为代表的流式分析技术能够有效避免上述缺点,依靠流道内液体的高速成像,并结合特殊微流道设计如原位阻抗阵列等,能够在一定程度上固定住单个细胞或颗粒,对其进行形态学和生长特征的分析。但这种技术中液体的流动依靠压强等因素,无法自由控制,且对单细胞或颗粒的定位也往往局限于特定的尺寸,易造成流道的堵塞;受固定的单细胞仅限于亲代,无法完整地进一步观察菌株群落的生长及分析其性质,且无法自由地废弃杂质。
3.因此利用数字微流控(dmf)系统代替上述传统技术,可以在集成设计配方的单个微流控芯片上对所需的单细胞或颗粒进行筛选、培养。但现有以ahmadi等提出的id2m为代表的dmf系统设计中由于工艺原因,系统流道高度一般远高于光学显微镜景深大小,造成了“goast-well”问题,即因为成像深度不足导致系统计数时忽略此深度之外的悬浮细胞或颗粒,导致计数值及荧光统计值偏小的问题。
4.针对景深的不足,传统做法是拍摄多个轴向图像形成立体全局图像,但光学重聚焦耗费了大量时间,不符合高通量分析的要求。为解决景深扩展问题而新提出的诸多技术中,快速电重聚焦、使用光场测量的数字重聚焦等同样带有上述问题,而使用独立光学器件如菲涅耳透镜、立体相位掩模等扩展景深的方法较为适合高通量成像系统,但这些设备的成本和所造成的图像畸变同样需要被纳入考虑。
技术实现要素:
5.针对现有技术的不足,本发明的目的在于提供一种基于光学相位调制器件优化成像深度的dmf单细胞分选系统,并提供以lr去卷积算法为主的图像去畸变优化算法及单细胞计数、荧光分析算法。本发明提供了一种能够对单细胞液滴进行自主筛选、独立培养并提取的培养与分析集成系统,同时能解决本领域传统器件与显微成像系统景深无法匹配,单次成像无法覆盖整个液滴深度的问题,符合系统的高通量高速成像需求。
6.本发明的技术方案具体介绍如下。
7.一种由景深扩展技术优化的数字微流控单细胞分选系统,其包括基础光学成像系统、光学相位调制器件、数字微流控芯片、控制模块和图像处理模块;其中:
8.基础光学成像系统,包括倒置显微镜、scmos(高科技互补金属氧化物半导体)相机及汞灯系统,其用于获取数字微流控芯片的明场及荧光两模态的显微成像数据;
9.光学相位调制器件,以相位板的形式插入基础光学成像系统中的显微镜物镜和
scmos相机镜头的共同焦点处,对显微镜物镜进行相位调制,扩展系统成像深度;
10.数字微流控平台与芯片,数字微流控平台接收控制模块的微流控控制信号转发给芯片,芯片控制液滴的移动,完成分选、培养、提取的功能;
11.控制模块,发送微流控控制信号给数字微流控平台,接收数字微流控平台的反馈信号控制scmos相机拍摄信号的触发;
12.图像处理模块,对接收到的来自scmos相机的明场及荧光图像数据进行后处理,以数值形式输出所统计的单细胞个数、细胞轮廓内部总荧光强度、单个细胞平均荧光强度。
13.本发明中,汞灯系统包括汞灯光源、激发光滤光片和荧光滤光片;汞灯光源的入射端和激发光滤光片相连,接收端和荧光滤光片相连。
14.本发明中,数字微流控平台放置在电控位移平台之上,数字微流控平台通过usb接口及自带wifi信号与控制模块连接,控制模块调用预先存储的动作配方信息,通过方波信号进行液滴在芯片上的电润湿运动控制;芯片上的电极按照阵列排布,被划分为不同功能区域:
15.进液区以及与其相连的分液区;
16.分选区,用于观察和筛选单细胞液滴、并进行多种溶液混合;
17.培养区,用于筛选出的单细胞或颗粒的观察与培养;
18.取液区,用于提取所需颗粒和细胞;
19.废液区,用于引导分选区中的废液以及阵列中不符合需求的液滴。
20.本发明中,数字微流控平台与芯片实现分选、培养、提取的功能,具体如下:
21.(1)分选
22.在进液区加入经足量液态培养基稀释的菌株混悬液,在分液区获得液滴在分选区观察点经scmos相机拍照分析,如仅识别包含一个单独的细胞颗粒,则经分选区上部电极阵列引导进入培养阵列;如不包含颗粒或包含两个以上颗粒,经分选区下部通道进入废液区;若进液区中液滴被全部分选完毕,则存储于培养阵列中的单细胞进入培养流程;
23.(2)培养
24.培养过程中,引导液滴在培养区观察点电极及其右方电极间来回摇动,使液滴内细胞分布均匀,避免粘附于芯片基底;液滴每隔一段时间被观察拍照一次,进行单细胞数量统计;若满一定时间,在每次明场拍摄完毕后拍摄该液滴的荧光图像,由此进行明场细胞轮廓范围内的荧光产量统计,在培养流程满一定时间后,液滴按逐列左移的形式移出培养阵列进入取液阵列,进入提取流程;
25.(3)提取流程
26.液滴在取液区逐滴下移,若该液滴包含产量最高的克隆,则移出取液口进行下一步培养;若非目标液滴,则将其移入废液区,由此,完成整个流程。
27.本发明中,菌株混悬液为酿酒酵母混悬液;培养过程中,液滴每隔6小时被观察拍照一次,满24小时,在每次明场拍摄完毕后拍摄液滴的荧光图像;在培养流程满48小时后,液滴按逐列左移的形式移出培养阵列
28.本发明中,在分选过程中,数字微流控平台与芯片引导液滴上下摇动并拍摄2-3次,降低单颗粒被忽视的概率。
29.本发明中,图像处理模块对接收到的来自scmos相机的明场及荧光图像数据进行
lr去卷积处理,得到去畸变的液滴明场、荧光图像,再将获得的明场图像与预先获取的背景图像相减,经自适应阈值算法处理提取出细胞大致轮廓范围,经形态学处理填充孔洞后进行轮廓识别与提取,统计单细胞个数;明场获得的细胞轮廓内部保存为mask映射至荧光图像,进行荧光强度分析与计算,统计细胞轮廓内部总荧光强度及单细胞平均荧光强度。
30.本发明中,图像处理模块中,对提取出的面积较小的细胞,为避免粘连情况引起的计算偏差,采用预先统计的细胞平均面积进行数值估算。
31.本发明中,图像处理模块中,对轮廓较大占10*10pixels以上的颗粒在形态学变换后采用watershed方法进行分离,计算其个数。
32.如上所述,本发明的由景深扩展技术优化的数字微流控单细胞分选系统,具有以下有益效果:提供了一套完整的可自由操作液滴动作,不受颗粒尺寸与形状影响,融合单细胞分选、培养、分析与提取的系统,完成了相关高通量分析的集成化;并以较低的成本,解决了现有的dmf分选系统中成像景深不足,计数方式存在缺陷的问题,在单张图像上捕获几乎整个液滴包含的颗粒,提高了相关实验操作分析流程的准确性与稳定性。
附图说明
33.图1:系统基本架构及光路;1)系系统核心部件便携式数字微流控平台外观结构。实施例中该器件配合倒置显微镜及二维电动位移台进行观察;2)系统光路图,相位板置于光路中,荧光成像条件下入射光与激发光均经过滤波。
34.图2:光学相位调制器件作用效果图;1)相位板结构示意图(基底+非球面);2)相位板非球面厚度按与光阑中心分布示意图;3)zemax软件模拟加入景深扩展(edof)系统的光路与普通光路z轴轴向归一化psf强度对比;4)zemax软件模拟加入景深扩展(edof)系统的光路与普通光路的离焦点列图对比,本发明系统相比一般系统,在
±
50μm范围内均保持稳定。
35.图3:数字微流控平台及芯片架构;1):数字微流控平台机械架构,2):数字微流控芯片平面结构及纵向分层结构,3)数字微流控芯片功能分区。
36.图4:图像处理程序实施流程。
37.图5:加入相位调制器件的该系统在510nm波长的荧光条件下工作情况的实际验证实施例。
具体实施方式
38.以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。需说明的是,在不冲突的情况下,以下实施例及实施例中的特征可以相互组合。
39.一种由景深扩展技术优化的数字微流控单细胞分选系统,包括:基础光学成像系统,数字微流控平台与芯片,光学相位调制器件以及加载有控制程序和图像处理程序的后台上位机。上位机程序包括运行配方控制的及相机控制的控制程序(使用labview 2018(32位)编写),以及对相机拍摄的图片进行单细胞颗粒的分割与分析的图像处理程序(使用
python3.7.9及opencv 4.4.0编写)。上位机的控制程序依据图像处理程序的计数反馈液滴进一步运动的信号,并依据微流控平台反馈信号控制相机拍摄信号的触发。数字微流控平台与芯片,数字微流控平台接收上位机的微流控控制信号转发给芯片,芯片控制液滴的移动,完成分选、培养、提取的功能;图像处理模块对接收到的来自scmos相机的明场及荧光图像数据进行后处理,以数值形式输出所统计的单细胞个数、细胞轮廓内部总荧光强度、单个细胞平均荧光强度。
40.本发明中,光学相位调制器件以相位板掩膜的形式,被插入成像系统物镜与荧光系统的滤波器之间,位于物镜和相机镜头的共同焦点处。通过相位板对显微镜物镜进行相位调制,可以扩展系统成像深度,以在单张图像上捕获几乎整个液滴包含的颗粒,提高相关实验分析流程的准确性与稳定性;相位板对光学显微镜系统光学相位传导起调制作用如公式1)所示:
[0041][0042]
其中φ(ρ)代表调制器添加到距中心点ρ处的相位,ρ代表同一个z值所属x-y平面上点到中心的距离即δ为所需设计的相位调制景深,f为物镜焦距,ρ
max
表示相位板光瞳平面上可以传导光线的最大半径,c表示一个用于补偿的常数项,λ表示该系统工作波段的中心波长。
[0043]
下面结合本发明系统在酿酒酵母单细胞分选,选取具备最高产量的克隆体时的实施例对本发明的技术方案进行进一步详细阐述。
[0044]
本发明的系统用于酿酒酵母单细胞分选,选取具备最高产量的克隆体时的工作流程具体如下:
[0045]
在dmf芯片进液口加入约20μl经足量液态培养基稀释的酿酒酵母混悬液,操作系统实施分选流程。在分液区获得的0.1μl液滴在分选区观察点经系统拍照分析,如仅识别包含一个单独的细胞颗粒,则经分选区上部电极阵列引导进入培养阵列;如不包含颗粒或包含两个以上颗粒,经分选区下部通道进入废液区。若进液区中液滴被全部分选完毕,则存储于培养阵列中的单细胞进入培养流程。
[0046]
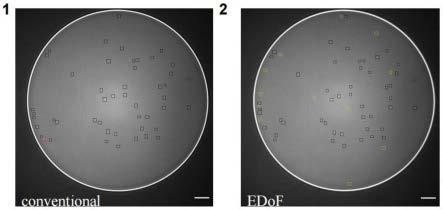
培养过程中,阵列内的液滴每小时经过5分钟2.5hz的晃动,即引导液滴在所在观察点电极及其右方电极间来回摇动,使液滴内细胞分布均匀,避免粘附于芯片基底。液滴每隔6小时被观察拍照一次,进行单细胞数量统计;若满24小时,在每次明场拍摄完毕后拍摄该液滴的荧光图像,由此进行明场细胞轮廓范围内的gfp荧光产量统计。
[0047]
在流程培养满48小时后,液滴按逐列左移的形式移出培养阵列进入取液阵列,在该区逐滴下移。若该液滴包含产量最高的克隆,则移出取液口进行下一步培养;若非目标液滴,则将其移入废液区。由此,完成整个流程。
[0048]
上位机系统包括基于intel(r)core(tm)i5-10300h cpu@2.50ghz cpu的64位windows 10操作系统,rtx 2060gpu,最终输出:液滴明场、荧光图像(可选);将细胞轮廓框选出的明场目标检测图;以数值形式输出所统计的单细胞个数、细胞轮廓内部总荧光强度、单细胞所包含的平均荧光强度,作为液滴筛选与进一步细胞克隆选择的依据。
[0049]
实施例中,系统的结构和光路图如图1-1和1-2所示;以olympusix83倒置显微镜为基本显微镜平台,在显微镜载物台上加装priorpriorscaniii2d电控位移平台。显微镜目镜接口连接滨松orca-flash4.0c11440-22cu相机以获取16位数字图像(2048*2048像素,像素大小6.5μm)。相机和上位机之间通信采用usb接口,也可采用串口通信trigger触发的形式进行,以完成相机拍摄控制的加速。基础光学成像系统采用olympus10倍物镜(na0.3),可进行明场/荧光成像条件转换。荧光成像采用汞灯光源,在入射端采用457-487nm波段带通滤波器过滤,在接收端采用503-538nm带通滤波器过滤,以便检测实例中gfp标注的荧光特征信息。
[0050]
实施例中,根据公式1)设计光学相位调制器件时,所需设计的相位调制景深δ设为130μm。λ在实施例中设为荧光所在的510nm,符合该调制要求的相位板设计以聚甲基丙烯酸甲酯塑料(pmma)为基底材料,基底厚度3mm,按照圆对称加工图案制备非球面,即在基底之上增加厚度z(ρ)如公式2),单位mm。其中ρ与公式1)相同,同样指到光阑平面中心点的距离。
[0051]
z(ρ)=3.1475*10-4
*ρ
2-7.3104*10-6
*ρ4[0052]
0≤ρ≤5.4mm;
[0053]
z(ρ)=4.6036*10-5
mm
[0054]
5.4mm≤ρ≤6.4mm.式2)
[0055]
距圆心5.4至6.4mm处未添加非球面增量,方便安装时不碰到有效区域,也可根据自己的需要留更大的边缘,比如2mm,即5.4mm≤ρ≤7.4mm;该设计的示意图如图2-1所示,非球面高度的具体拟合示意图如图2-2所示。
[0056]
该设计在光学模拟软件zemax中模拟(λ设为荧光所在的510nm,其余参数按照常规设置)所得的归一化psf强度与未添加相位板的普通光路系统对比如图2-3所示,可见在光学相位调制器件的作用下,成像系统的归一化psf在约110μm的深度范围内(此深度范围与δ值理论上保持接近),都维持在了一般显微系统相干光成像景深范围内的psf强度上,即通过去畸变运算后能够以较清晰的形式成像。如图2-4所示:zemax软件模拟加入景深扩展(edof)系统的光路与未添加相位板的普通光路的离焦点列图对比,本发明系统相比普通光路系统,在
±
50μm范围内均保持稳定。
[0057]
实施例中,数字微流控平台如图3-1,放置在电控位移平台之上,通过usb接口及自带wifi信号与后台上位机连接,通过上位机指令调用预先存储的动作配方信息,通过最高95v的方波信号进行液滴的电润湿运动控制,并在接受控制信号后给予反馈。数字微流控芯片的结构可见图3-2至图3-3。深度上,芯片微通道结构具有100-110μm的高度,显微成像系统的景深(110μm)调制恰好能够覆盖芯片通道;芯片通道底部由玻璃基底、电极层、介电疏水层三层构成,随方波信号通电改变其亲水/疏水性引导液滴移动;平面结构排布上,所示芯片的电极按照阵列排布,被划分为不同功能区域。具体的,芯片具有两个进液区以及分别与其相连的分液区;一个用于观察和筛选单细胞液滴、并进行多种溶液混合的分选区,分出液滴体积约0.1μl;一组21*17个电极组成用于筛选出的单细胞或颗粒观察与培养的培养区,一般选择如图所示其中10*8个极点作为培养及观察点以便进行液滴的进一步动作操作;一个用于提取所需颗粒和细胞的取液区;两个废液区,分别用于引导分选区中的废液以及阵列中不符合需求的液滴。
[0058]
实施例中,单细胞检测时,由于不能保证液滴每次都限定于相机视野范围内,可通
过在分选阶段引导液滴上下摇动并拍摄3次,获得3张明场图像。在验证图像中是否仅有一个颗粒时,3张图像上计数的结果相互对照取最大值,使单颗粒被忽视的概率大大降低至几乎可忽略不计。
[0059]
实施例中,系统拍摄全程在光路系统中插入光学相位调制器件,因此造成了图像一定程度的模糊与畸变。因此在获取图像时,上位机中的图像处理程序先依据lucy-richardson(lr)去卷积算法模拟所得系统目镜处psf对图像进行去畸变迭代运算。此后获得的较清晰图像经过图像处理流程如图4所示。图像与预先获取的背景图像相减,经自适应阈值算法处理提取出细胞大致轮廓范围,经形态学处理填充孔洞后进行轮廓识别与提取,并统计个数。明场获得的细胞轮廓内部保存为mask映射至荧光图像,进行荧光强度分析与计算,统计其总荧光强度及单细胞平均荧光强度。
[0060]
实施例中,图像处理程序处理过程中,提取出的面积较小的细胞为避免粘连情况引起的计算偏差,采用预先统计的细胞平均面积进行数值估算。对轮廓较大占10*10pixels以上的颗粒在形态学变换后采用watershed方法进行分离,计算其个数。
[0061]
如图5所示,为加入相位调制器件的该系统在510nm波长的荧光条件下工作情况的实际验证实施例,在同一滴液滴上拍摄而成,时间间隔在5s内,相比颗粒沉降速度可以忽略不计。左图中系统未插入相位板,经统计可识别出49个颗粒。在插入相位板后获得的右图上,则可识别出60个颗粒。该实施例证明了相位调制器件的有效性。
[0062]
此外,本发明的dmf分选系统也可应用于对多种液滴的不同浓度混合操作。芯片的上下两个进液口可加入不同成分溶液,并分别控制分液。所分液滴可在分选区中融合,摇匀并重新拉为两个相同的液滴,并分别存储。据此,系统可完成对两种组分不同浓度梯度的混合工作。当前系统可按照n/8的浓度区间完成此操作。
[0063]
综上所述,本发明旨在提出一种由景深扩展技术优化的数字微流控单细胞分选系统,解决现有单细胞及颗粒分选技术中液滴不可控、损耗率高的问题,同时以较低成本解决高通量拍摄时因芯片微通道高度大于系统成像深度引起的颗粒统计不全的问题。系统实现了在一张芯片上集成单细胞分选、培养、提取功能,并进行对细胞的高通量分析,在生物医学检测领域具有相当的实用价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1