检测17α羟化酶缺乏症相关基因CYP17A1全外显子序列突变的引物、试剂盒及方法与流程
检测17
α
羟化酶缺乏症相关基因cyp17a1全外显子序列突变的引物、试剂盒及方法
技术领域
1.本发明属于分子生物学领域,特别是涉及检测17α羟化酶缺乏症相关基因cyp17a1基因全部8个外显子序列突变的引物、试剂盒以及方法。
背景技术:
2.17α-羟化酶/17,20裂解酶缺乏症是一种罕见的先天性肾上腺增生症,是由细胞色素p450 17a1(cyp17a1)基因突变引起的常染色体隐性遗传病,占所有先天性肾上腺增生症的1/10,其中新生儿的发病率为1/5000-1/10000。
3.cyp17a1基因位于10q24.3,全长6.6kb,包含8个外显子,它编码细胞色素p450超家族的一种酶p450c17,可催化17α-羟化酶反应生成17-羟基类固醇,并通过17,20裂解酶反应将21-碳的17-羟基类固醇裂解成19-碳的17-酮雄激素前体。因此当17α-羟化酶/17,20裂解酶功能缺陷时会导致糖皮质激素和性类固醇的缺乏,垂体会通过负反馈作用分泌促肾上腺皮质激素(acth),使得类固醇前体和acth水平升高,从而导致双侧肾上腺增生,出现高血压、低钾血等表现以及抑制肾素活性,使醛固酮合成下降,临床上主要表现为低肾素、低醛固酮性高血压,低血钾。另外,性激素的不足或缺乏会导致46,xx女性第二性征不发育,表现为性幼稚、原发性闭经,青春期发育不足;在46,xy男性患者,使外生殖器男性化不足,表现为盲端阴道,呈现男性假两性畸形。
4.文献报道的cyp17a1基因突变超过70种,约1/3为替代突变,其次为小的片段缺失(《=20bp)和小片段的重复序列插入,也有少数的复合杂合突变。有研究表明cyp17a1不同突变体的17α-羟化酶/17,20裂解酶活性存在差异;具有相同cyp17a1基因型的个体之间,其表型例如高血压的程度可能存在差异;与完全丧失酶活性的突变相比,保留部分酶活性的突变的临床症状往往较轻,后者个体的表型是高度可变的。临床上对于17α-羟化酶缺乏症的诊断手段的传统方法主要依靠影像学和生化检查,但这些手段都存在很大的缺陷,例如检查过程繁琐,检查的灵敏度以及特异性低,检查结果易受药物、患者精神状况、时间等影响;但基因突变检测不受限制,任何时间均可进行检测,这极大提高了检测时间和效率,这有利于临床上更加快速、高效地结合患者表现症状来研究和判断病情,因此对患者cyp17a1基因进行检测分析是十分有必要的。
5.目前用于cyp17a1基因突变检测的主要方法有taqman法、质谱法、芯片法等。taqman法检测灵敏度高适用于大样本、少位点,价格较高;质谱法准确性也较高但适用于大样本,多位点检测;芯片法准确度较低适用于超多位点检测。质谱法和芯片法都需配备价格昂贵的大型仪器设备,实验条件要求高,导致检测成本提升。
6.因此,本领域需提供一种可以快速、有效且准确的检测基因cyp17a1全外显子序列,sanger测序法对此非常适用,该法原理简单,成本低廉,同时适用于少样本多位点检测且该技术已经相当成熟。
技术实现要素:
7.为解决上述技术问题,本发明提供一组用于检测17α羟化酶缺乏症相关基因cyp17a1外显子序列突变的特异性引物,该组pcr特异性正、反向引物,分别为:
8.用于扩增cyp17a1基因第1外显子的正、反向引物,其核苷酸序列为:
9.cyp17a1-e1-f:ctccaggagaatctttccacaa
10.cyp17a1-e1-r:tctgaagacctgaacaatccca
11.(目的片段长度为510bp)
12.用于扩增cyp17a1基因第2外显子的正、反向引物,其核苷酸序列为:
13.cyp17a1-e2-f:gattcctacagccttgcctgc
14.cyp17a1-e2-r:cattgcgctctagtcctaacc
15.(目的片段长度为272bp)
16.用于扩增cyp17a1基因第3外显子的正、反向引物,其核苷酸序列为:
17.cyp17a1-e3-f:agaggcaactggtacagagag
18.cyp17a1-e3-r:ggaagattggggacaatgtcag
19.(目的片段长度为364bp)
20.用于扩增cyp17a1基因第4外显子的正、反向引物,其核苷酸序列为:
21.cyp17a1-e4-f:agacagaaagctaagatccgcc
22.cyp17a1-e4-r:gaatggactccaccctgctct
23.(目的片段长度为253bp)
24.用于扩增cyp17a1基因第5外显子的正、反向引物,其核苷酸序列为:
25.cyp17a1-e5-f:gtatggcaggagtgtcacagat
26.cyp17a1-e5-r:aactactgcttgggtaaggagc
27.(目的片段长度为416bp)
28.用于扩增cyp17a1基因第6外显子的正、反向引物,其核苷酸序列为:
29.cyp17a1-e6-f:acctccaacctactctggtct
30.cyp17a1-e6-r:tgaatgcatcatggggctagat
31.(目的片段长度为239bp)
32.用于扩增cyp17a1基因第7外显子的正、反向引物,其核苷酸序列为:
33.cyp17a1-e7-f:ggctgagcaaggaagggagt
34.cyp17a1-e7-r:ccgtatagttggagccaagagtt
35.(目的片段长度为288bp)
36.用于扩增cyp17a1基因第8号外显子的正、反向引物,其核苷酸序列为:
37.cyp17a1-e8-f:accagggcagaaccatgc
38.cyp17a1-e8-r:aggtgctcaataaaatcggtg
39.(目的片段长度为595bp)
40.进一步的,所述用于检测17α羟化酶缺乏症相关基因cyp17a1外显子序列突变的引物,还包括1对通用测序正、反向引物m13f和m13r,测序时在cyp17a1基因外显子上游引物的5’端连接有tgtaaaacgacggccagt,在cyp17a1基因外显子下游引物5’端连接有aacagctatgaccatg
41.在检测中,先利用上述正、反向引物对覆盖cyp17a1基因全外显子突变位点的dna片段进行扩增,获得扩增产物,然后利用上述通用测序引物分别对扩增产物进行测序,获得扩增产物的基因序列。
42.本发明还提供一种用于检测17α羟化酶缺乏症相关基因cyp17a1外显子基因突变的试剂盒,所述试剂盒包括:样本dna提取试剂、pcr扩增反应试剂、测序体系反应液、阴性对照,其中pcr扩增反应试剂还包括一组扩增覆盖cyp17a1基因全部8个外显子正、反向引物,其核苷酸序列为:
43.cyp17a1-e1-f:ctccaggagaatctttccacaa
44.cyp17a1-e1-r:tctgaagacctgaacaatccca
45.cyp17a1-e2-f:gattcctacagccttgcctgc
46.cyp17a1-e2-r:cattgcgctctagtcctaacc
47.cyp17a1-e3-f:agaggcaactggtacagagag
48.cyp17a1-e3-r:ggaagattggggacaatgtcag
49.cyp17a1-e4-f:agacagaaagctaagatccgcc
50.cyp17a1-e4-r:gaatggactccaccctgctct
51.cyp17a1-e5-f:gtatggcaggagtgtcacagat
52.cyp17a1-e5-r:aactactgcttgggtaaggagc
53.cyp17a1-e6-f:acctccaacctactctggtct
54.cyp17a1-e6-r:tgaatgcatcatggggctagat
55.cyp17a1-e7-f:ggctgagcaaggaagggagt
56.cyp17a1-e7-r:ccgtatagttggagccaagagtt
57.cyp17a1-e8-f:accagggcagaaccatgc
58.cyp17a1-e8-r:aggtgctcaataaaatcggtg
59.进一步地,所述pcr反应试剂还包括:2*pcr buffer,dntp(2mm),kod fx(1u/μl);
60.进一步地,所述测序体系反应液还包括测序纯化液、edta、无水乙醇、75%乙醇、hidi和big dye terminator v3.1。
61.进一步地,所述测序纯化液包括核酸外切酶ⅰ、牛小肠碱性磷酸酶。
62.进一步地,所述试剂盒的pcr反应体系中,扩增覆盖cyp17a1基因全部8个外显子正、反向引物的工作浓度均为10um;
63.为解决上述技术问题,本发明还提供一种用于检测17α羟化酶缺乏症相关基因cyp17a1全外显子序列突变的方法,包括步骤:
64.(1)利用dna提取试剂提取样本dna;
65.(2)利用扩增覆盖cyp17a1全部8个外显子的pcr特异性引物,对待测dna样本分别进行扩增,获得覆盖检测cyp17a1基因全部8个外显子的扩增产物;所述特异性pcr引物的核苷酸序列为:
66.cyp17a1-e1-f:ctccaggagaatctttccacaa
67.cyp17a1-e1-r:tctgaagacctgaacaatccca
68.cyp17a1-e2-f:gattcctacagccttgcctgc
69.cyp17a1-e2-r:cattgcgctctagtcctaacc
70.cyp17a1-e3-f:agaggcaactggtacagagag
71.cyp17a1-e3-r:ggaagattggggacaatgtcag
72.cyp17a1-e4-f:agacagaaagctaagatccgcc
73.cyp17a1-e4-r:gaatggactccaccctgctct
74.cyp17a1-e5-f:gtatggcaggagtgtcacagat
75.cyp17a1-e5-r:aactactgcttgggtaaggagc
76.cyp17a1-e6-f:acctccaacctactctggtct
77.cyp17a1-e6-r:tgaatgcatcatggggctagat
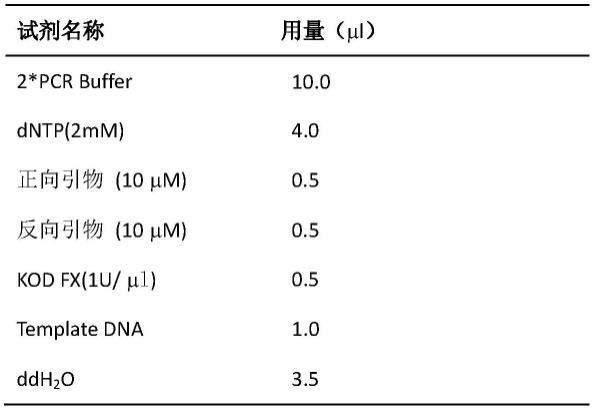
78.cyp17a1-e7-f:ggctgagcaaggaagggagt
79.cyp17a1-e7-r:ccgtatagttggagccaagagtt
80.cyp17a1-e8-f:accagggcagaaccatgc
81.cyp17a1-e8-r:aggtgctcaataaaatcggtg
82.(3)利用测序正、反向引物对步骤(2)获得的扩增产物分别进行正向或反向测序,获得所述扩增产物的基因序列;
83.(4)将步骤(3)获得的基因序列与野生型cyp17a1基因序列进行比较,确定cyp17a1基因外显子序列是否发生突变。
84.具体地,所述步骤(2)是在pcr反应体系中进行扩增,所述pcr扩增反应体系包括2*pcr buffer 10μl,dntp(2mm)4μl,kod fx(1u/μl)0.5μl,模板dna 1μl,正、反向引物(10μm)0.5μl,最后ddh2o补至20μl体系。
85.具体地,所述步骤(2)中,pcr扩增的反应条件为94℃预变性2min;98℃10s,68℃30s,68℃40s,共16个循环;98℃10s,60℃30s,68℃40s,共24个循环;68℃延伸6min,最后置于4℃直至使用。
86.具体地,所述步骤(3)中,进行正向或反向测序是采用sanger测序。
87.优选的,所述步骤(2)中,pcr引物中还加入了通用测序引物对m13f和m13r时,测序时在cyp17a1基因外显子上游引物的5’端连接有tgtaaaacgacggccagt,在cyp17a1基因外显子下游引物5’端连接有aacagctatgaccatg
88.该通用测序引物对m13f和m13r用于sanger测序。在后续sanger测试不需额外设计或提供测序引物,大大简化了操作流程。
89.本发明的有益效果:
90.与传统的诊断17α羟化酶缺乏症方法(化学检验和影像学检验)相比,本发明中的基因检测方法更加安全、快速、方便,大大节省诊断时间;同时基因检测不受患者身体状况,检测时间等影响,在临床上具有重要意义。另一方面本发明采用sanger测序法对17α羟化酶缺乏症相关基因cyp17a1进行检测,可以扩展cyp17a1整个基因全部外显子,覆盖待检测的所有突变位点,具有很高的特异性和准确性;采用pcr方法扩增目的片段并测序,对实验室以及实验人员技术要求不高,具有操作简单、灵敏度高等优点。这将极大地提升17α羟化酶缺乏症的诊断效率,可有效监控此病的发生和发展情况。
附图说明
91.图1为4号样本cyp17a1基因外显子1c.-34t》c突变位置演示图。
92.图2为4号样本cyp17a1基因外显子1c.138c》t突变位置演示图。
93.图3为4号样本cyp17a1基因外显子1c.195g》t突变位置演示图。
94.具体实施实例
95.下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。
96.实施实例1
97.一种用于检测17α羟化酶缺乏症相关基因cyp17a1外显子突变的引物序列,包括扩增覆盖cyp17a1基因全部8个外显子正、反向引物,其核苷酸序列为:
98.cyp17a1-e1-f:ctccaggagaatctttccacaa
99.cyp17a1-e1-r:tctgaagacctgaacaatccca
100.cyp17a1-e2-f:gattcctacagccttgcctgc
101.cyp17a1-e2-r:cattgcgctctagtcctaacc
102.cyp17a1-e3-f:agaggcaactggtacagagag
103.cyp17a1-e3-r:ggaagattggggacaatgtcag
104.cyp17a1-e4-f:agacagaaagctaagatccgcc
105.cyp17a1-e4-r:gaatggactccaccctgctct
106.cyp17a1-e5-f:gtatggcaggagtgtcacagat
107.cyp17a1-e5-r:aactactgcttgggtaaggagc
108.cyp17a1-e6-f:acctccaacctactctggtct
109.cyp17a1-e6-r:tgaatgcatcatggggctagat
110.cyp17a1-e7-f:ggctgagcaaggaagggagt
111.cyp17a1-e7-r:ccgtatagttggagccaagagtt
112.cyp17a1-e8-f:accagggcagaaccatgc
113.cyp17a1-e8-r:aggtgctcaataaaatcggtg
114.当测序引物采用m13f和m13r时,在上述上游引物的5’端连接有tgtaaaacgacggccagt,在上述下游引物5’端连接有aacagctatgaccatg
115.实施实例2
116.该实施例提供了一种用于检测17α羟化酶缺乏症相关基因cyp17a1外显子序列突变的试剂盒,其包括样本dna提取试剂、pcr扩增反应试剂、测序体系反应液、阴性对照,其中pcr扩增反应试剂还包括一组扩增覆盖cyp17a1基因全部8个外显子正、反向引物,其核苷酸序列为:
117.cyp17a1-e1-f:ctccaggagaatctttccacaa
118.cyp17a1-e1-r:tctgaagacctgaacaatccca
119.cyp17a1-e2-f:gattcctacagccttgcctgc
120.cyp17a1-e2-r:cattgcgctctagtcctaacc
121.cyp17a1-e3-f:agaggcaactggtacagagag
122.cyp17a1-e3-r:ggaagattggggacaatgtcag
123.cyp17a1-e4-f:agacagaaagctaagatccgcc
124.cyp17a1-e4-r:gaatggactccaccctgctct
125.cyp17a1-e5-f:gtatggcaggagtgtcacagat
126.cyp17a1-e5-r:aactactgcttgggtaaggagc
127.cyp17a1-e6-f:acctccaacctactctggtct
128.cyp17a1-e6-r:tgaatgcatcatggggctagat
129.cyp17a1-e7-f:ggctgagcaaggaagggagt
130.cyp17a1-e7-r:ccgtatagttggagccaagagtt
131.cyp17a1-e8-f:accagggcagaaccatgc
132.cyp17a1-e8-r:aggtgctcaataaaatcggtg
133.pcr扩增反应试剂还包括:2*pcr buffer,dntp(2mm),kod fx(1u/μl);
134.测序体系反应液包括:测序纯化液(核酸外切酶i:0.6u,牛小肠碱性磷酸酶:1.2u);edta(125mm);无水乙醇;75%乙醇;hidi(高度去离子甲酰胺);覆盖cyp17a1基因全外显子的正、反向扩增特异性引物;一对测序引物m13f(3.2μm)、m13r(3.2μm);bigdye terminator v3.1(购买自美国applied biosystems公司)。
135.该试剂盒还包括dna提取试剂(例如天根生物的dna提取试剂盒)。
136.该试剂盒还包括阴性对照为ddh2o。
137.实施实例3
138.检测17α羟化酶缺乏症相关基因cyp17a1外显子突变的方法,包括以下步骤:
139.(1)提取血液中的基因组dna
140.1)提取200μl血液样本,加入200μl缓冲液gb和20μl proteinase k的预混溶液至上述处理获得的200μl样品中,充分颠倒混匀,56℃放置10min,其间颠倒混匀数次,溶液应变清亮(如溶液未彻底变清亮,请延长裂解时间至溶液清亮为止)。
141.2)室温放置2-5min后加入350μl缓冲液bd,充分颠倒混匀,此时可能会出现絮状沉淀。将上一步所得溶液和絮状沉淀都加入一个吸附柱cg2中(吸附柱cg2放入收集管中),12,000rpm(~13,400
×
g)离心30sec,倒掉收集管中的废液,将吸附柱cg2放入收集管中。
142.3)向吸附柱cg2中加入500μl缓冲液gdb,12,000rpm(~13,400
×
g)离心30sec,倒掉收集管中的废液,将吸附柱cg2放入收集管中。
143.4)向吸附柱cg2中加入600μl漂洗液pwb(使用前请先检查是否已加入无水乙醇),12,000
144.rpm(~13,400
×
g)离心30sec,倒掉收集管中的废液,将吸附柱cg2放入收集管中;
145.5)重复操作步骤4。
146.6)12,000rpm(~13,400
×
g)离心2min,倒掉废液。将吸附柱cg2置于室温放置2min,以彻底晾干吸附材料中残余的漂洗液。
147.7)将吸附柱cg2转入1.5ml离心管中,向吸附膜中间位置悬空滴加50-200μl洗脱缓冲液tb,室温放置2min,12,000rpm(~13,400
×
g)离心2min,将溶液收集到离心管中,即为dna溶液。
148.8)测定dna的浓度和纯度,若不及时使用置于-20℃保存。
149.(2)试剂配置
150.pcr扩增反应体系配置如下:
[0151][0152]
其中,扩增覆盖cyp17a1基因各个外显子的正、反向引物核苷酸为:
[0153]
cyp17a1-e1-f:ctccaggagaatctttccacaa
[0154]
cyp17a1-e1-r:tctgaagacctgaacaatccca
[0155]
cyp17a1-e2-f:gattcctacagccttgcctgc
[0156]
cyp17a1-e2-r:cattgcgctctagtcctaacc
[0157]
cyp17a1-e3-f:agaggcaactggtacagagag
[0158]
cyp17a1-e3-r:ggaagattggggacaatgtcag
[0159]
cyp17a1-e4-f:agacagaaagctaagatccgcc
[0160]
cyp17a1-e4-r:gaatggactccaccctgctct
[0161]
cyp17a1-e5-f:gtatggcaggagtgtcacagat
[0162]
cyp17a1-e5-r:aactactgcttgggtaaggagc
[0163]
cyp17a1-e6-f:acctccaacctactctggtct
[0164]
cyp17a1-e6-r:tgaatgcatcatggggctagat
[0165]
cyp17a1-e7-f:ggctgagcaaggaagggagt
[0166]
cyp17a1-e7-r:ccgtatagttggagccaagagtt
[0167]
cyp17a1-e8-f:accagggcagaaccatgc
[0168]
cyp17a1-e8-r:aggtgctcaataaaatcggtg
[0169]
按样品数n(样品数=待测样本数+阴性对照1个)配置pcr扩增反应液,每管19μl分装于反应管中。
[0170]
(3)加样
[0171]
将1μl步骤(1)提取的基因组dna溶液加入反应管中;对于阴性对照实验,加入1μlddh2o于反应管中;分别混匀,低速离心数秒,进行pcr扩增。
[0172]
(4)扩增
[0173]
touch-down pcr扩增:扩增时在常规pcr仪上进行,可用仪器包括abi veriti(美国applied biosystems公司)等。反应条件为94℃预变性2min;98℃10s,68℃30s,68℃40s,共16个循环;98℃10s,60℃30s,68℃40s,共24个循环;68℃延伸6min,最后置于4℃直至使用。
[0174]
(5)sanger测序
[0175]
取9μl扩增产物和2μl测序纯化液按照如下所述程序进行纯化,从而获得纯化产物。
[0176][0177]
将1μl所获得的纯化产物分别与实施例1中的测序引物m13f(3.2μm)、m13r(3.2μm)按照如下所述体系进行混合,然后按照如下所述中的测序反应条件进行测序。
[0178][0179][0180]
沉淀环节:
[0181]
向完成测序反应的产物中加入2μl edta(125mm),静置5min;加入15ml无水乙醇,漩涡混匀;3700rpm离心30min;倒置离心15sec,加入50ml 70%乙醇,漩涡混匀;3700rpm离心15min;倒置离心15sec,置于95℃金属浴上;加入10μl hidi后进行变性试验。变性试验步骤为:95℃,5min;接着在-30℃2min,然后在4℃保存。变性程序结束后,上测序仪(abi3730)测序。
[0182]
(6)结果判断
[0183]
将获得的基因序列与野生型cyp17a1基因序列(ng_007955.1)进行比较,确定cyp17a1基因外显子是否发生突变。
[0184]
实施实例4
[0185]
采用本发明检测试剂盒检测临床样本。取20例临床血液样本先后按照实施实例1、实施实例2和实施实例3,配制试剂、提取样本dna、扩增(获得扩增产物)和测序。
[0186]
(1)利用所获得的扩增产物进行测序,从图1所示测序结果可以看出(此处仅以样
本1作为范例进行展示),本发明所述引物已经覆盖且能扩增cyp17a1基因外显子1序列;与野生型cyp17a1基因相比较,样本1的cyp17a1基因在外显子1序列有三个突变位点,分别是c.-34t》c、c.138c》t、c.195g》t;外显子2-外显子8序列利用所述引物均可扩增成功,但与野生型cyp17a1基因序列相比较,外显子2-外显子8序列均无突变产生。
[0187]
(2)在1-20例样本中,以cyp17a1基因第1外显子的测序结果为例进行详细说明,经测序比对突变情况,对于结果不统一的样本进行再次测序。最后,根据测序结果对于预后进行判断,20例样本检测结果见表1。
[0188][0189]
表1 1-20样本中cyp17a1基因外显子序列突变检测结果
[0190]
注:“+”表示有位点突变,
“‑”
表示无位点突变。
[0191]
检测结果显示,以cyp17a1基因的第1外显子的扩增引物扩增20例临床血液样本,均能扩出cyp17a1基因的第1外显子,测序所得序列与野生型cyp17a1基因比对,结果发现:样本1、2、3和16均无突变产生;样本4,6,8-15,17-20均有且仅有3个变位点产生,分别是c.-34t》c、c.138c》t、c.195g》t;样本5有2个突变位点c.-34t》c和c.195g》t;样本7有2个突变位点c.138c》t和c.195g》t。
[0192]
以上表明本发明的引物、方法和试剂盒能够检测cyp17a1基因外显子突变的情况。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1