一种含杂环橙酮类衍生物及其用途
本发明涉及一种含杂环橙酮类衍生物及其用途,该类化合物经细胞活性筛选结果表明:有21个化合物对hela宫颈癌细胞有抑制活性;有15个化合物对ht-29结肠癌细胞有抑制活性;有5个化合物对a549肺癌细胞有抑制活性;有6个化合物对hepg2肝癌细胞有抑制活性。
背景技术:
1、肿瘤是引起人类死亡的主要疾病之一,由体内组织细胞长期异常增殖所引起。据世界卫生组织统计数据表明,全世界癌症每年发病约1000万人,死亡约700万人;我国的肿瘤死亡率也呈逐年上升趋势,1999年至2018年,我国肿瘤标化死亡率从94.4/10万上升到130.1/10万,位居全球癌症死亡率第12位。肿瘤细胞的特征在于不受正常机体生理调节,大量消耗患者所摄入的营养物质,导致机体功能紊乱,引起患者的多种器官坏死而死亡。肿瘤不仅给患者带来巨大的痛苦,而且为家庭和社会都带来了沉重的负担和严重的危害。
2、橙酮(aurones)是黄酮类化合物的一种亚类,因为具有广泛的活性而受到关注。这类化合物显示出抗肿瘤,抗菌,抗炎,抗氧化,酶抑制,抗寄生虫,治疗丙肝,抗阿尔兹海默症,抗糖尿病等一系列的药理活性。橙酮是作为植物的次生代谢产物被发现的,但橙酮在天然产物中的含量很低,因此大大限制了橙酮类化合物的提取分离与活性研究。
3、有关橙酮类衍生物的抗肿瘤活性的研究远少于其他黄酮亚类,含杂环橙酮的研究则相对更少。为寻找更多具有高效低毒的橙酮衍生物,近年来,一些针对橙酮骨架及其取代基进行改造的尝试,在抗肿瘤研究中取得了较大成功,在丰富橙酮结构的同时取得了较好的药效。橙酮的母核结构为2-亚苄基苯并呋喃-3-(2h)-酮,根据生物电子等排原理,将橙酮母核的氧原子换位碳原子,即可得到2-苄叉-1-茚酮结构。在上述骨架中引入不同的取代基,可极大地影响化合物的靶点亲和力、脂溶性、氢键供受能力、拓扑极性表面积、偶极矩等理化性质,进而影响其抗肿瘤活性。橙酮、茚酮及其含杂环取代衍生物因其突出的抗肿瘤活性而引人注意,主要集中在对结肠癌、宫颈癌、髓性白血病、肺癌、乳腺癌、肝癌、胃癌等肿瘤的抑制活性。
4、因此,本发明对橙酮进行取代基修饰以及利用药物设计原理到一系列橙酮、茚酮及其衍生物,探究其抗肿瘤活性。活性筛选结果表明:有21个化合物对hela宫颈癌细胞有抑制活性;有15个化合物对ht-29结肠癌细胞有抑制活性;有5个化合物对a549肺癌细胞有抑制活性;有6个化合物对hepg2肝癌细胞有抑制活性。
5、寻找和探索橙酮与茚酮类衍生物的合成方法与生物活性对于发现新药与先导化合物具有较大的理论和应用价值。本发明在国内外有关专利、文献的综合分析和本课题组前期研究工作的基础上,对橙酮与茚酮进行结构改造和修饰,将不同种类的杂环和取代基引入到橙酮、茚酮中,提高其抗肿瘤活性与成药性,并研究了这些化合物对hela宫颈癌细胞、ht-29结肠癌细胞、a549肺癌细胞、hepg2肝癌细胞的抑制活性,以发现高效低毒的抗肿瘤候选药物。
6、参考文献
7、[1]bray f,ferlay j,soerjomataram i,et al.global cancer statistics2018:globocan estimates of incidence and mortality worldwide for 36cancers in185countries[j].ca cancer j cli.,2018,68(6),394-424.
8、[2]陈宏达,郑荣寿,王乐,吕章艳,杜灵彬,魏文强,代敏.2019年中国肿瘤流行病学研究进展[j].中华疾病控制杂志,2020,24(04),373-379.
9、[3]ma q,wei r.chemistry of natural compounds,2021,57(5):828-831.
10、[4]olleik h,yahiaoui s,roulier b,et al.eur j med chem,2019,165:133-141.
11、[5]shrestha a,shrestha r,lee s,et al.bulletin of the korean chemicalsociety,2021,42(3):372-375.
12、[6]du r,zhou x,yang d,et al.hum exp toxicol,2020,39(11):1507-1517.
13、[7]pan g,li x,zhao l,et al.eur j med chem,2017,138:577-589.
14、[8]lee c y,chew e h,go m l.eur j med chem,2010,45(7):2957-2971.
15、[9]takao k,u s,kamauchi h,et al.bioorg chem,2019,87:594-600.
16、[10]meguellati a,ahmed-belkacem a,nurisso a,et al.eur j med chem,2016,115:217-229.
17、[11]meguellati a,ahmed-belkacem a,yi w,et al.eur j med chem,2014,80:579-592.
18、[12]liew k-f,lee e h-c,chan k-l,et al.biomedicine&pharmacotherapy,2019,110:118-128.
19、[13]li y,qiang x,luo l,et al.eur j med chem,2017,126:762-775.
20、[14]wang s,xu l,lu y t,et al.eur j med chem,2017,130:195-208.
21、[15]zwergel,c.;valente,s.;salvato,a.;xu,z.;talhi,o.;mai,a.;silva,a.;altucci,l.;kirsch,g.,novel benzofuran–chromone and–coumarin derivatives:synthesis and biological activity in k562 human leukemia cells.medchemcomm2013,4(12),1571-1579.
22、[16]zheng,x.;wang,h.;liu,y.-m.;yao,x.;tong,m.;wang,y.-h.;liao,d.-f.,synthesis,characterization,and anticancer effect of trifluoromethylatedaurone derivatives.journal of heterocyclic chemistry 2015,52(1),296-301.
23、[17]zwergel,c.;valente,s.;salvato,a.;xu,z.;talhi,o.;mai,a.;silva,a.;altucci,l.;kirsch,g.,novel benzofuran–chromone and–coumarin derivatives:synthesis and biological activity in k562 human leukemia cells.medchemcomm2013,4(12).
24、[18]zheng,x.;wang,h.;liu,y.-m.;yao,x.;tong,m.;wang,y.-h.;liao,d.-f.,synthesis,characterization,and anticancer effect of trifluoromethylatedaurone derivatives.journal of heterocyclic chemistry 2015,52(1),296-301.
25、[19]xie,f.;zhu,h.;zhang,h.;lang,q.;tang,l.;huang,q.;yu,l.,in vitroand in vivo characterization of a benzofuran derivative,a potentialanticancer agent,as a novel aurora b kinase inhibitor.eur j med chem 2015,89,310-9.
26、[20]velagapudi,u.k.;langelier,m.f.;delgado-martin,c.;diolaiti,m.e.;bakker,s.;ashworth,a.;patel,b.a.;shao,x.;pascal,j.m.;talele,t.t.,design andsynthesis of poly(adp-ribose)polymerase inhibitors:impact of adenosinepocket-binding motif appendage to the3-oxo-2,3-dihydrobenzofuran-7-carboxamide on potency and selectivity.j med chem 2019,62(11),5330-5357.
27、[21]vaclavikova,r.;kondrova,e.;ehrlichova,m.;boumendjel,a.;kovar,j.;stopka,p.;soucek,p.;gut,i.,the effect of flavonoid derivatives on doxorubicintransport and metabolism.bioorg med chem 2008,16(4),2034-42.
28、[22]uesawa,y.;sakagami,h.;ikezoe,n.;takao,k.;kagaya,h.;sugita,y.,quantitative structure-cytotoxicity relationship of aurones.anticancer res2017,37(11),6169-6176.
技术实现思路
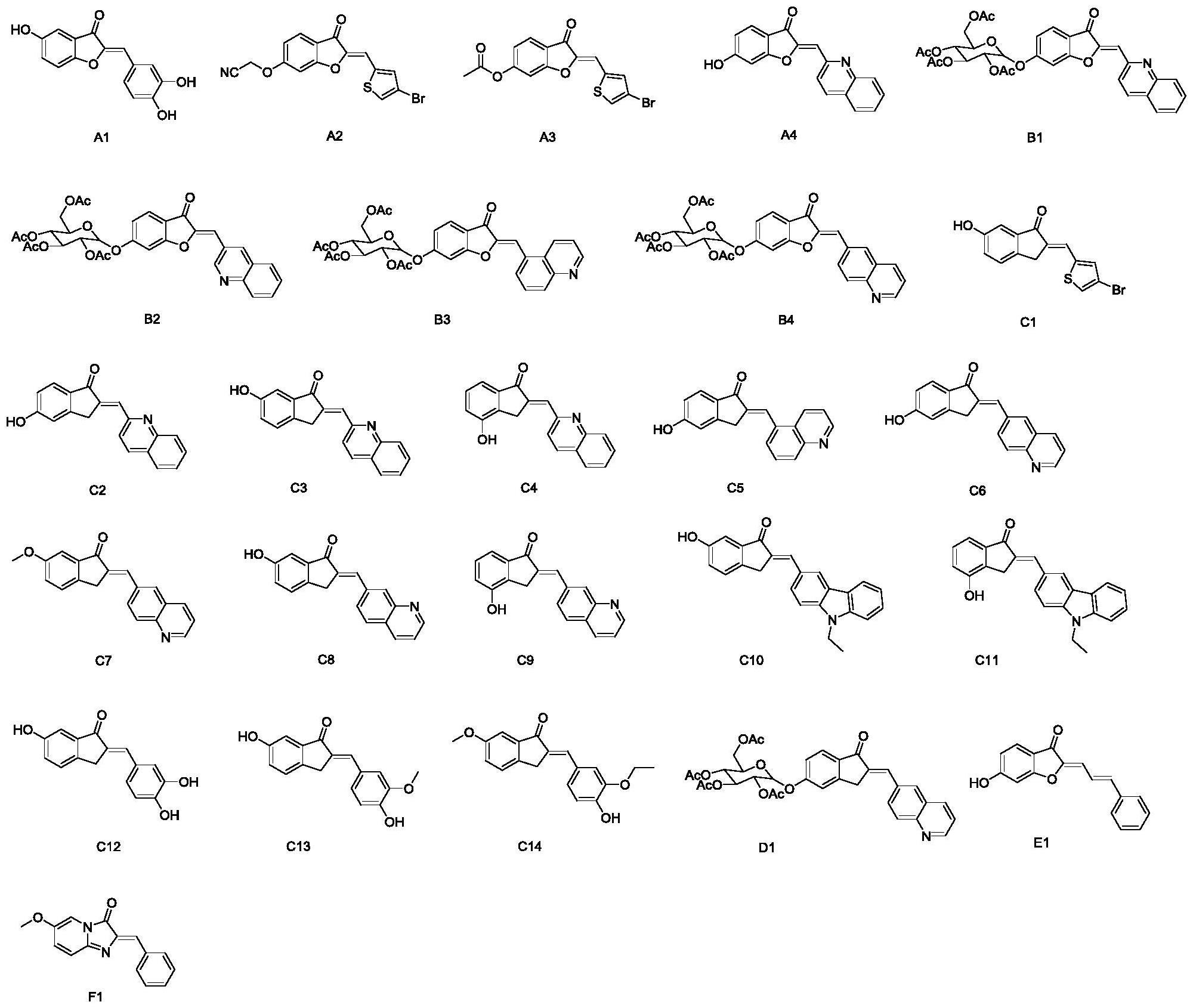
1、本发明的目的在于,提供一种含杂环橙酮类衍生物及其用途,所述的化合物以6-羟基苯并呋喃-3(2h)-酮为或取代的2,3-二氢-1h-茚-1-酮起始原料,与芳醛或芳杂醛在碱性条件下经羟醛缩合反应,得到橙酮及杂环取代的橙酮骨架,再与2,3,4,6-四乙酰氧基-α-d-吡喃葡萄糖溴化物、酰氯类化合物或卤代烃在碱性下发生亲核取代反应,生成橙酮与茚酮及其衍生物。并继续研究了这25个橙酮和茚酮类衍生物对hela宫颈癌细胞、ht-29结肠癌细胞、a549肺癌细胞、hepg2肝癌细胞的抑制作用,结果显示:有21个化合物对hela宫颈癌细胞有抑制活性;有15个化合物对ht-29结肠癌细胞有抑制活性;有5个化合物对a549肺癌细胞有抑制活性;有6个化合物对hepg2肝癌细胞有抑制活性。
2、本发明所述的一种含杂环橙酮类衍生物,该类衍生物结构式为:
3、
4、其中:
5、化合物a1为(z)-2-(3,4-二羟基亚苄基)-5-羟基苯并呋喃-3(2h)-酮;
6、化合物a2为(z)-2-((2-((4-溴噻吩-2-基)亚甲基)-3-氧代-2,3-二氢苯并呋喃-6-基)氧基)乙腈;
7、化合物a3为(z)-2-((4-溴噻吩-2-基)亚甲基)-3-氧代-2,3-二氢苯并呋喃-6-基乙酸酯;
8、化合物a4为(z)-6-羟基-2-(喹啉-2-亚甲基)苯并呋喃-3(2h)-酮;
9、化合物b1为(2r,3r,4s,5r)-2-(乙酰氧基甲基)-6-(((z)-3-氧代-2-(喹啉-2-亚甲基)-2,3-二氢苯并呋喃-6-基)氧基)四氢-2h-吡喃-3,4,5-三酰基三乙酸酯;
10、化合物b2为(2r,3r,4s,5r)-2-(乙酰氧基甲基)-6-(((z)-3-氧代-2-(喹啉-3-亚甲基)-2,3-二氢苯并呋喃-6-基)氧基)四氢-2h-吡喃-3,4,5-三酰基三乙酸酯;
11、化合物b3为(2r,3r,4s,5r)-2-(乙酰氧基甲基)-6-(((z)-3-氧代-2-(喹啉-5-亚甲基)-2,3-二氢苯并呋喃-6-基)氧基)四氢-2h-吡喃-3,4,5-三酰基三乙酸酯;
12、化合物b4为(2r,3r,4s,5r)-2-(乙酰氧基甲基)-6-(((z)-3-氧代-2-(喹啉-6-亚甲基)-2,3-二氢苯并呋喃-6-基)氧基)四氢-2h-吡喃-3,4,5-三酰基三乙酸酯;
13、化合物c1为(e)-2-((4-溴噻吩-2-基)亚甲基)-6-羟基-2,3-二氢-1h-茚-1-酮;
14、化合物c2为(e)-5-羟基-2-(喹啉-2-基亚甲基)-2,3-二氢-1h-茚-1-酮;
15、化合物c3为(e)-6-羟基-2-(喹啉-2-基亚甲基)-2,3-二氢-1h-茚-1-酮;
16、化合物c4为(e)-4-羟基-2-(喹啉-2-基亚甲基)-2,3-二氢-1h-茚-1-酮;
17、化合物c5为(e)-5-羟基-2-(喹啉-5-亚甲基)-2,3-二氢-1h-茚-1-酮;
18、化合物c6为(e)-5-羟基-2-(喹啉-6-亚甲基)-2,3-二氢-1h-茚-1-酮;
19、化合物c7为(e)-6-甲氧基-2-(喹啉-6-亚甲基)-2,3-二氢-1h-茚-1-酮;
20、化合物c8为(e)-6-羟基-2-(喹啉-7-亚甲基)-2,3-二氢-1h-茚-1-酮;
21、化合物c9为(e)-4-羟基-2-(喹啉-7-基亚甲基)-2,3-二氢-1h-茚-1-酮;
22、化合物c10为(e)-2-((9-乙基-9h-咔唑-3-基)亚甲基)-6-羟基-2,3-二氢-1h-茚-1-酮;
23、化合物c11为(e)-2-((9-乙基-9h-咔唑-3-基)亚甲基)-4-羟基-2,3-二氢-1h-茚-1-酮;
24、化合物c12为(e)-2-(3,4-二羟基苯亚甲基)-6-羟基-2,3-二氢-1h-茚-1酮;
25、化合物c13为(e)-2-(4-羟基-3-甲氧基苯亚甲基)-6-羟基-2,3-二氢-1h-茚-1酮;
26、化合物c14为(e)-2-(3-乙氧基-4-羟基苯亚甲基)-6-甲氧基-2,3-二氢-1h-茚-1酮;
27、化合物d1为(2r,3r,4s,5r)-2-(乙酰氧甲基)-6-(((e)-1-氧代-2-(喹啉-6-亚甲基)-2,3-二氢-1h-茚-5-基)氧基)四氢-2h-吡喃-3,4,5-三基三醋酸酯;
28、化合物e1为(z)-6-羟基-2-((e)-3-苯基烯丙基)苯并呋喃-3(2h)-酮;
29、化合物f1为(z)-2-亚苄基-6-甲氧基咪唑并[1,2-a]吡啶-3(2h)-酮;
30、所述含杂环橙酮类衍生物中的化合物a1-a3,b1-b2,b4,c1-c10,c12-c13,d1,e1,f1在制备治疗hela宫颈癌药物中的用途。
31、所述含杂环橙酮类衍生物中的化合物a2,a4,b1-b4,c1,c3,c5-c6,c9-c11,c14,d1在制备治疗ht-29结肠癌药物中的用途。
32、所述含杂环橙酮类衍生物中的化合物b1-b2,b4,c5,d1在制备治疗a549肺癌药物中的用途。
33、所述含杂环橙酮类衍生物中的化合物a2-a3,c3-c4,c10,e1在制备治疗hepg2肝癌药物中的用途。
34、本发明所述的一种含杂环橙酮类衍生物及其用途,其中制备含杂环橙酮类衍生物按下列步骤进行:
35、化合物a1的制备:
36、将1mmol的5-羟基苯并呋喃-3(2h)-酮分散在5ml的甲醇中,加入1ml 50%的koh溶液,在室温下搅拌10min中后,加入1.2mmol的3,4-二甲氧基苯甲醛衍生物,在室温下搅拌过夜,tlc显示反应结束后,减压除去甲醇,再加入10ml的热水稀释,用稀盐酸调节ph至5-6,得到固体沉淀,过滤并洗涤沉淀,沉淀在甲醇中重结晶后即可得到中间体,中间体自然晾干,取中间体0.5mmol,溶于5ml的二氯甲烷中,在无水、氩气氛围中加入2mmol的bbr3,反应温度从0℃-室温,反应过夜,tlc监测反应结束后,加入30ml冰水,用乙酸乙酯萃取,有机相经水洗,无水硫酸钠干燥,抽滤,旋干,硅胶柱层析纯化,得到化合物a1。
37、化合物a2-a3的制备:
38、将1mmol的6-羟基苯并呋喃-3(2h)-酮分散在5ml的甲醇中,加入1ml 50%的koh溶液,在室温下搅拌10min中后,加入1.2mmol的4-溴噻吩-2-甲醛,在室温下搅拌过夜,tlc显示反应结束后,减压除去甲醇,再加入10ml的热水稀释,用稀盐酸调节ph至5-6,得到固体沉淀,过滤并洗涤沉淀,沉淀在甲醇中重结晶后即可得到中间体,取中间体0.5mmol溶于10ml乙腈,再加入1.5mmol碳酸钾,升温至60℃后,加入1mmol氯乙腈或乙酰氯,搅拌6-8h,tlc显示反应结束后,减压除去溶剂,加入30ml水,得沉淀,过滤,水洗,沉淀在乙醇中重结晶后即得到a2-a3。
39、化合物a4的制备:
40、将1mmol的6-羟基苯并呋喃-3(2h)-酮分散在5ml的甲醇中,加入1ml 50%的koh溶液,在室温下搅拌10min中后,加入1.2mmol的2-喹啉甲醛,在室温下搅拌过夜,tlc显示反应结束后,减压除去甲醇,再加入10ml的热水稀释,用稀盐酸调节ph至5-6,得到固体沉淀,过滤并洗涤沉淀,沉淀在甲醇中重结晶后即得到化合物a4。
41、化合物b1-b4的制备:
42、将1mmol的6-羟基苯并呋喃-3(2h)-酮分散在5ml的甲醇中,加入1ml 50%的koh溶液,在室温下搅拌10min中后,加入1.2mmol的喹啉甲醛衍生物,在室温下搅拌过夜,tlc显示反应结束后,减压除去甲醇,再加入10ml的热水稀释,用稀盐酸调节ph至5-6,得到固体沉淀,过滤并洗涤沉淀,在甲醇中重结晶后即可得到中间体,取0.5mmol的中间体溶于10ml二氯甲烷中,加入1mmol的2,3,4,6-四乙酰氧基-α-d-吡喃葡萄糖溴化物,搅拌5min后,加入3mmol碳酸钾和0.1mmol四丁基碘化铵,再加入7.5ml水,用铝箔包裹反应瓶,在室温下搅拌72h,tlc显示反应结束后,加入30ml水,用二氯甲烷萃取,有机相经水洗,无水硫酸钠干燥,抽滤,旋干,硅胶柱层析纯化得到化合物b1-b4。
43、化合物c1-c14的制备:
44、将1mmol的4-羟基-羟基-2,3-二氢-1h-茚酮,5-羟基-羟基-2,3-二氢-1h-茚酮或6-羟基-2,3-二氢-1h-茚酮分散在5ml的甲醇中,加入1ml浓度为50%的koh溶液,在室温下搅拌10min中后,加入1.2mmol的苯甲醛衍生物或杂环甲醛混合,在室温下搅拌过夜,tlc显示反应结束后,减压除去甲醇,再加入10ml的热水稀释,用稀盐酸调节ph至5-6,得到固体沉淀,过滤,洗涤沉淀,沉淀在甲醇中重结晶后,即得到目标化合物c1-c14。
45、化合物d1的制备:
46、将1mmol的5-羟基-羟基-2,3-二氢-1h-茚酮分散在5ml的甲醇中,加入1ml浓度为50%的koh溶液,在室温下搅拌10min中后,加入1.2mmol的6-喹啉甲醛混合,在室温下搅拌过夜,tlc显示反应结束后,减压除去甲醇,再加入10ml的热水稀释,用稀盐酸调节ph至5-6,得到固体沉淀,过滤,洗涤沉淀,沉淀在甲醇中重结晶后,即得到中间体,取0.5mmol的中间体溶于10ml二氯甲烷中,加入1mmol的2,3,4,6-四乙酰氧基-α-d-吡喃葡萄糖溴化物,搅拌5min后,加入3mmol碳酸钾和0.1mmol四丁基碘化铵,再加入7.5ml水,用铝箔包裹反应瓶,在室温下搅拌72h,tlc显示反应结束后,在反应瓶中加入30ml水,用二氯甲烷萃取,有机相经水洗,无水硫酸钠干燥,抽滤,旋干,硅胶柱层析纯化得到化合物d1。
47、化合物e1的制备:
48、将1mmol的6-羟基苯并呋喃-3(2h)-酮分散在5ml的甲醇中,加入1ml浓度50%的koh溶液,在室温下搅拌10min中后,加入1.2mmol的肉桂醛混合,在室温下搅拌过夜,tlc显示反应结束后,减压除去甲醇,再加入10ml的热水稀释,用稀盐酸调节ph至5-6,得到固体沉淀,过滤,洗涤沉淀,沉淀在甲醇中重结晶后,得到化合物e1。
49、化合物f1的制备:
50、将2mmol的5-甲氧基-2-胺基吡啶加入6ml的多聚磷酸中,升温至80℃后,在搅拌下加入2mmol的3-苯基环氧乙烷甲酸乙酯,升温至110℃,反应2h,tlc显示反应完全后,加入30ml冰水,用koh溶液调节ph到6-7,用二氯甲烷萃取,有机相经水洗,无水硫酸钠干燥,抽滤,旋干,硅胶柱层析纯化得到化合物f1。
51、本发明所述的含杂环橙酮类衍生物,其合成路线如下:
52、
- 还没有人留言评论。精彩留言会获得点赞!