一种钙调素结合蛋白MxIQM3及其编码基因与应用
一种钙调素结合蛋白mxiqm3及其编码基因与应用
技术领域
1.本发明涉及生物技术领域,涉及一种钙调素结合蛋白mxiqm3及其编码基因与应用。
背景技术:
2.铁元素是植物生长发育的必需微量元素之一。虽然土壤中富含铁元素,但当植物在中性或碱性土壤中生长时,二价铁离子极容易被氧化成不能被植物直接吸收和利用的三价铁离子,进而造成植物铁缺乏。
3.缺铁胁迫是植物常见的营养胁迫之一。缺铁会引起叶片黄化、早衰等现象,严重者直接造成产量和品质受损。全世界碱性土壤大约占陆地面积的30%,在我国,南起四川盆地北至内蒙古草原地区,东至淮北平原西到黄土高原和甘肃、青海以及新疆等一带的广大区域都存在大面积缺铁土壤,部分沿海地区的盐碱地也普遍存在缺铁现象,由缺铁导致粮食、蔬菜和果树产量大幅下降,造成较大的经济损失。
技术实现要素:
4.本发明的一个目的是提供一种蛋白质。
5.本发明提供的蛋白质来源于小金海棠,名称为mxiqm3,所述mxiqm3蛋白质为如下(a1)-(a4)任一所述的蛋白质:
6.(a1)序列表中序列2所示的蛋白质;
7.(a2)在(a1)所述蛋白质的n端或/和c端连接标签得到的融合蛋白;
8.(a3)将(a1)经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与植物缺铁耐性相关的蛋白质;
9.(a4)与(a1)具有98%以上同一性且与植物缺铁耐性相关的蛋白质。
10.上述(a2)所述蛋白质中,所述标签(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪或纯化。具体可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
11.上述(a3)所述蛋白质中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加具体可为不超过10个氨基酸残基的取代和/或缺失和/或添加,或不超过9个氨基酸残基的取代和/或缺失和/或添加,或不超过8个氨基酸残基的取代和/或缺失和/或添加,或不超过7个氨基酸残基的取代和/或缺失和/或添加,或不超过6个氨基酸残基的取代和/或缺失和/或添加,或不超过5个氨基酸残基的取代和/或缺失和/或添加,或不超过4个氨基酸残基的取代和/或缺失和/或添加,或不超过3个氨基酸残基的取代和/或缺失和/或添加,或不超过2个氨基酸残基的取代和/或缺失和/或添加,或不超过1个氨基酸残基的取代和/或缺失和/或添加。
12.上述(a4)蛋白质中,所述同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高
级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
13.上述(a1)-(a4)任一所述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
14.本发明的另一个目的是提供编码上述mxiqm3蛋白质的核酸分子。
15.本发明提供的编码上述mxiqm3蛋白质的核酸分子为如下(b1)或(b2)任一所述的dna分子:
16.(b1)序列表中序列1所示的dna分子;
17.(b2)与(b1)具有75%以上同一性且编码所述mxiqm3蛋白质的dna分子。
18.上述(b1)所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
19.上述(b2)所述核酸分子中,所述同一性是指与天然核酸序列的序列相似性。同一性包括与本发明的编码序列2所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
20.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码mxiqm3蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的mxiqm3核苷酸序列75%或者更高同一性的核苷酸,只要编码mxiqm3蛋白质且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
21.含有上述核酸分子的表达盒、重组载体或重组微生物也属于本发明的保护范围。
22.所述表达盒可为能够在宿主细胞中表达mxiqm3蛋白质的dna,该dna不但可包括启动mxiqm3基因转录的启动子,还可包括终止mxiqm3基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
23.所述重组载体可为含有序列1所示的用于编码mxiqm3蛋白质的dna分子的载体。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(gus基因、荧光素酶基因等)、具有抗性的抗生素标记物(庆大霉素标记物、卡那霉素标记物等)或是抗化学试剂标记基因(如抗除莠剂基因)等。
24.所述重组微生物可为含有上述核酸分子或上述表达盒或上述重组载体的酵母、细菌、藻和真菌。所述细菌具体可为农杆菌。
25.本发明还有一个目的是提供上述mxiqm3蛋白质或上述核酸分子或上述含有所述核酸分子的表达盒、重组载体或重组微生物的新用途。
26.本发明提供了上述mxiqm3蛋白质或上述核酸分子或上述含有所述核酸分子的表达盒、重组载体或重组微生物在如下(c1)或(c2)任一种中的应用:
27.(c1)调控植物缺铁耐性;
28.(c2)培育缺铁耐性提高的转基因植物。
29.本发明还提供了抑制上述mxiqm3蛋白质的物质的新用途。
30.本发明提供了抑制上述mxiqm3蛋白质的物质在如下(d1)或(d2)任一种中的应用:
31.(d1)降低植物缺铁耐性;
32.(d2)培育缺铁耐性降低的转基因植物。
33.上述应用中,所述抑制上述mxiqm3蛋白质的物质可为抑制上述mxiqm3蛋白质合成或促进上述mxiqm3蛋白质降解或敲低或敲除上述mxiqm3蛋白质编码基因的物质。进一步的,所述抑制上述mxiqm3蛋白质的物质可为干扰mxiqm3蛋白质编码基因表达的质粒。更进一步的,所述干扰mxiqm3蛋白质编码基因表达的质粒为将序列1第828-1043位所示的dna分子插入rnai载体的nde1和sal1酶切位点间,且将序列1第828-1043位所示的dna分子的反义链插入rnai载体的kpn1和ecor1酶切位点间后得到的质粒。
34.本发明还有一个目的是提供上述mxiqm3蛋白质和mxmpk4-1蛋白质的新用途。
35.本发明提供了上述mxiqm3蛋白质和mxmpk4-1蛋白质在如下(c1)或(c2)任一种中的应用:
36.(c1)调控植物缺铁耐性;
37.(c2)培育缺铁耐性提高的转基因植物。
38.本发明还有一个目的是提供一种培育缺铁耐性提高的转基因植物的方法。
39.本发明提供的培育缺铁耐性提高的转基因植物的方法为如下x1)或x2):
40.x1)包括提高受体植物中mxiqm3蛋白质的活性和/或含量,得到转基因植物的步骤;所述转基因植物的缺铁耐性高于所述受体植物;
41.x2)包括提高受体植物中mxiqm3蛋白质和mxmpk4-1蛋白质的活性和/或含量,得到转基因植物的步骤;所述转基因植物的缺铁耐性高于所述受体植物。
42.进一步的,所述提高受体植物中mxiqm3蛋白质的活性和/或含量的方法为将mxiqm3蛋白质的编码基因导入受体植物中。
43.所述提高受体植物中mxiqm3蛋白质和mxmpk4-1蛋白质的活性和/或含量的方法为将mxiqm3蛋白质的编码基因和mxmpk4-1蛋白质的编码基因导入受体植物中。
44.更进一步的,所述mxiqm3蛋白质的编码基因通过重组质粒pri101::mxiqm3导入受体植物中。
45.所述mxiqm3蛋白质的编码基因和所述mxmpk4-1蛋白质的编码基因通过重组质粒pri101::mxiqm3和重组质粒pri101::mxmpk4-1导入受体植物中。
46.所述重组质粒pri101::mxiqm3为将序列1所示的mxiqm3基因插入pri101::myc载体的bamhi酶切位点处后得到的质粒。
47.所述重组质粒pri101::mxmpk4-1为将序列3所示的mxmpk4-1基因插入pri101::gfp载体的bamhi酶切位点处后得到的质粒。
48.本发明最后一个目的是提供一种培育缺铁耐性降低的转基因植物的方法。
49.本发明提供的培育缺铁耐性降低的转基因植物的方法为如下y1)或y2):
50.y1)包括降低受体植物中mxiqm3蛋白质的活性和/或含量,得到转基因植物的步骤;所述转基因植物的缺铁耐性低于所述受体植物;
51.y2)包括降低受体植物中mxiqm3蛋白质和mxmpk4-1蛋白质的活性和/或含量,得到转基因植物的步骤;所述转基因植物的缺铁耐性低于所述受体植物。
repressor of fe acquisition in malus xiaojinensis.scientific reports 8.”中。
70.下述实施例中的rnai表达载体记载于文献“宋梦如,陈可钦,郭运娜,等.一种用于植物基因沉默的新rnai载体的构建[j].2022(6).”中。
[0071]
下述实施例中涉及的培养基及配方如下:
[0072]
lb液体培养基的溶剂为水,溶质及其浓度分别为胰蛋白胨10g/l、酵母提取物5g/l、nacl 10g/l,ph 7.0,121℃灭菌20min。
[0073]
lb固体培养基的溶剂为水,溶质及其浓度分别为胰蛋白胨10g/l、酵母提取物5g/l、nacl 10g/l、琼脂粉15g/l,ph 7.0,121℃灭菌20min。
[0074]
共培养基的溶剂为水,溶质及其浓度分别为ms4.43g/l、2.4-d1.5mg/l、6-ba0.4mg/l、蔗糖30g/l、琼脂7g/l,121℃灭菌20min。
[0075]
筛选培养基的溶剂为水,溶质及其浓度分别为ms 4.43g/l、2.4-d 1.5mg/l、6-ba0.4mg/l、cef 250mg/l、kana 15mg/l、蔗糖30g/l、琼脂7g/l,121℃灭菌20min。
[0076]
继代培养基的溶剂为水,溶质及其浓度分别为ms 4.43g/l、2,4-d 1.5mg/l、6-ba0.4mg/l。
[0077]
ty液体培养基的溶剂为水,溶质及其浓度分别为酵母提取物3g/l、蛋白胨5g/l、1m cacl
2 10ml/l,121℃灭菌20min。
[0078]
ty固体培养基的溶剂为水,溶质及其浓度分别为酵母提取物3g/l、蛋白胨5g/l、1m cacl
2 10ml/l、琼脂15g/l,121℃灭菌20min。
[0079]
mma液体培养基的溶剂为水,溶质及其浓度分别为mgcl
2 10mm、mes 10mm、as 100μm。
[0080]
霍格兰营养液的溶剂为水,溶质及其浓度分别为kno
3 0.5mm、fe
3+-edta 40μm、nh4h2po
4 0.5mm、ca(no3)
2 1mm、cacl
2 0.5mm、mgso4·
7h2o 0.5mm、mg(no3)2·
6h2o 0.3mm、h3bo
3 23μm、znso4·
7h2o 0.4μm、h2moo4·
h2o 0.05μm、cuso4·
5h2o 0.15μm、mncl
2 3μm,用1m naoh调整营养液ph值为6.0。
[0081]
实施例1、mxiqm3及其编码基因的获得
[0082]
对小金海棠的根部进行rna提取,反转录成cdna后用actin基因进行检验,确认cdna质量合格后采用mxiqm3-f和mxiqm3-r引物进行pcr扩增,得到pcr产物。引物序列如下:
[0083]
mxiqm3-f:atggaggtggaaactcagac;
[0084]
mxiqm3-r:ctaatcaacgttattgacatccgtg。
[0085]
对pcr产物进行测序,测序结果表明:pcr扩增得到大小为1500bp的片段,其核苷酸序列如序列1所示,将序列1所示的基因命名为mxiqm3基因,mxiqm3基因编码的蛋白的氨基酸序列如序列2所示,将序列2所示的氨基酸序列命名为mxiqm3蛋白。
[0086]
实施例2、mxiqm3的表达分析与亚细胞定位分析
[0087]
一、mxiqm3的表达分析
[0088]
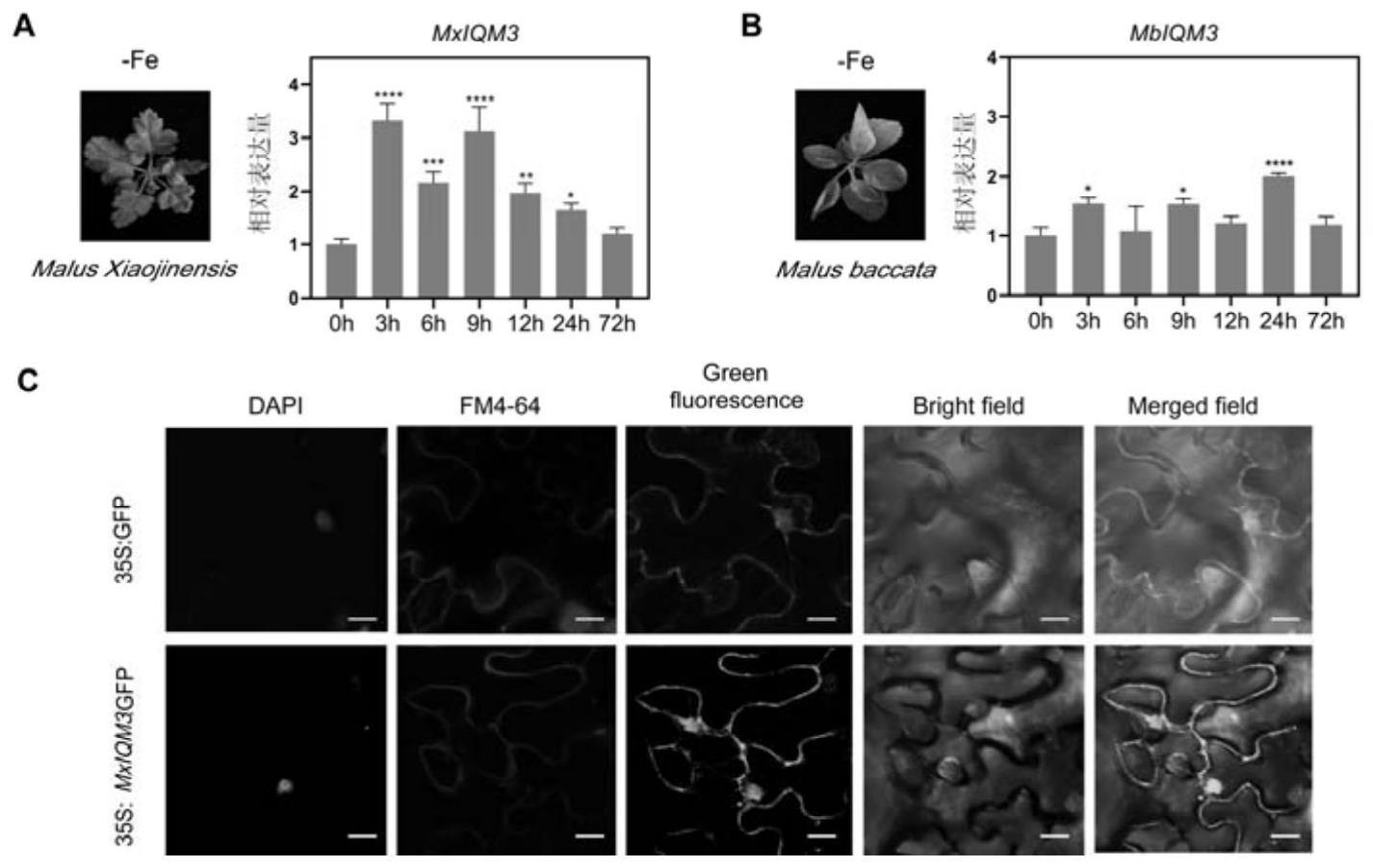
将不同铁敏感基因型苹果材料(耐缺铁型苹果砧木小金海棠、铁敏感型苹果砧木山定子)在不加铁盐的ms培养基(fe-)中进行缺铁胁迫,并于缺铁胁迫后不同时间检测mxiqm3的转录水平。具体检测步骤:
[0089]
①
提取不同铁敏感基因型苹果材料的rna。
[0090]
②
将rna反转录成cdna。
[0091]
③
设计mxiqm3的定量引物,检测mxiqm3在两份材料中的表达水平差异。引物序列如下:
[0092]
f:ctgagaatgcaggccttagag;
[0093]
r:caacgttattgacatccgtgg。
[0094]
结果显示:在小金海棠根系中,mxiqm3的基因表达量在缺铁3h-9h有明显的上调,而在山定子中则整体变化不显著(图1a和图1b)。说明mxiqm3在小金海棠根系中能够受到缺铁信号的诱导,可能会在苹果的缺铁适应性反应中发挥作用。
[0095]
二、mxiqm3的亚细胞定位分析
[0096]
1、将序列1所示的mxiqm3基因插入pri101::gfp载体的bamhi酶切位点处,得到重组质粒pri101::mxiqm3::gfp。
[0097]
2、将步骤1构建的重组质粒利用农杆菌注射烟草叶片。
[0098]
3、用激光共聚焦显微镜进行观察。
[0099]
结果显示:转入pri101::gfp的烟草叶片在细胞膜和细胞核中具有较强的绿色荧光,转入pri101::mxiqm3::gfp的烟草叶片也在细胞膜和细胞核上有绿色荧光,因此mxiqm3定位在细胞膜和细胞核上(图1c)。
[0100]
实施例3、mxiqm3在苹果愈伤中的功能鉴定
[0101]
一、mxiqm3过表达的转基因苹果愈伤组织(mxiqm3-oe)的制备
[0102]
1、重组质粒的构建
[0103]
将序列1所示的mxiqm3基因插入pri101::myc载体的bamhi酶切位点处,得到重组质粒pri101::mxiqm3。重组质粒表达带有myc标签的mxiqm3蛋白。
[0104]
2、稳定转化苹果愈伤组织
[0105]
(1)将重组质粒转入农杆菌感受态细胞gv3101,并进行菌落pcr鉴定。
[0106]
(2)将鉴定正确的农杆菌单菌落,接种到1ml加有相应抗生素的lb液体培养基中,28℃、220rpm培养过夜。
[0107]
(3)将1ml过夜培养后的菌液接种到50ml加有相应抗生素的lb液体培养基,同样的条件培养至od
600nm
为1.0。
[0108]
(4)25℃、5000rpm离心8min,收集菌体,ms液体培养基将菌体重悬至od
600nm
为0.5。
[0109]
(5)选取适量且长势良好、新鲜紧实的苹果“王林”愈伤组织加入悬浮液中,然后再加入as(25mg/l),28℃摇床震荡培养30min。
[0110]
(6)用灭菌的纱布过滤愈伤,滤纸吸干水分,将愈伤平铺到共培养板上,黑暗条件下共培养1天。
[0111]
(7)愈伤均匀地薄薄地铺在筛选培养板,暗培养大约30-40天,直到长出新的愈伤。
[0112]
(8)将新的愈伤置于继代培养基中生长10天后,得到oe-mxiqm3愈伤组织,并对其进行表达量检测。oe-mxiqm3愈伤组织中mxiqm3表达量检测结果如图2a所示。
[0113]
二、mxiqm3干扰的转基因苹果愈伤组织(mxiqm3-rnai)的制备
[0114]
1、干扰质粒的构建
[0115]
将序列1第828-1043位所示的dna分子插入rnai载体的nde1和sal1酶切位点间,且将序列1第828-1043位所示的dna分子的反义链插入rnai载体的kpn1和ecor1酶切位点间,得到干扰质粒。
bpds,避光保存。
[0137]
(2)新鲜的植物愈伤组织和根部样品在黑暗中转移到显色溶液中,避光反应60min。
[0138]
(3)利用分光光度计测定535nm的吸光值,以未加入植物组织的反应液为对照。称取样品鲜重,并计算根fcr活性,fcr(nmol
·
g-1
·
h-1
)=v
×
v535
×
109/8650/m/t,其中反应液的体积是v,单位l,m是愈伤重量,单位g;反应时间是t,单位h,每个实验三次重复。
[0139]
fcr活性定性检测具体检测步骤如下:
[0140]
(1)显色反应板配置:0.5mm caso4、10mm mes、0.25mm fe(iii)-edta、0.2mm bpds、0.75%(w/v)琼脂,ph 5.8,避光保存。
[0141]
(2)将植物根部水分吸干,平铺在一次性培养皿上,在显色培养基快要凝固之时倒进培养皿里;避光处理,每隔30min观察一次,大约10-12h后拍照保存。
[0142]
结果表明:在缺铁胁迫下,oe-mxiqm3愈伤组织的fcr活性比wt愈伤组织高约3.0倍(图3d)。
[0143]
以上结果说明在苹果愈伤组织中过表达mxiqm3可以增强耐缺铁性,提高其抵御缺铁胁迫的能力。
[0144]
实施例4、mxiqm3在苹果根系中的功能鉴定
[0145]
一、mxiqm3过表达的转基因苹果(mxiqm3-oe)的制备
[0146]
1、重组质粒的构建
[0147]
将序列1所示的mxiqm3基因插入pri101::myc载体的bamhi酶切位点处,得到重组质粒pri101::mxiqm3。重组质粒表达带有myc标签的mxiqm3蛋白。
[0148]
2、发根农杆菌稳定转化苹果根系
[0149]
1)山定子种子苗准备
[0150]
山定子种子低温层积,获得种子苗,待种子苗出土后10-15天即可注射菌液。
[0151]
2)菌液准备
[0152]
2-1)将重组质粒转入农杆菌感受态细胞k599,并进行菌落pcr鉴定。
[0153]
2-2)将鉴定正确的农杆菌单菌落,接种到1ml加有相应抗生素的ty液体培养基,28℃、220rpm培养过夜;将1ml过夜培养的菌液按1:50的比例接种到含有相应抗生素的ty液体培养基,同样的条件培养至od
600nm
为1.0。
[0154]
2-3)25℃、5000rpm离心8min,收集菌体;mma液体培养基将菌体重悬至od
600nm
为0.6-0.8,暗处静置4h,得到注射菌液。
[0155]
3)侵染
[0156]
在靠近种子苗根部处,用带有针头的1ml注射器,将菌液注射到植株中至根茎处呈水渍状,注射完毕之后,将植株置于正常光照条件下培养。
[0157]
4)鉴定
[0158]
注射15-20天后,在注射伤口处发出新根,剪去种子苗的原发根,培养一周后,将种子苗进行水培,并用手持的紫外灯(luyor-3415)照射观察是否有gfp荧光,有gfp荧光的转基因植株即为阳性转基因植株,并在rna水平进行鉴定,得到mxiqm3过表达的转基因苹果株系oe-mxiqm3#1、oe-mxiqm3#2和oe-mxiqm3#3。具体步骤如下:
[0159]
①
提取不同植株的rna。
[0160]
②
将rna反转录成cdna。
[0161]
③
设计mxiqm3的定量引物,检测mxiqm3在两份材料中的表达水平差异。引物序列如下:
[0162]
f:ctgagaatgcaggccttagag;
[0163]
r:caacgttattgacatccgtgg。
[0164]
结果如图4所示。选取mxiqm3过表达的转基因苹果株系oe-mxiqm3#1、oe-mxiqm3#2和oe-mxiqm3#3用于下述功能验证实验。
[0165]
同时以pri101空载质粒作为对照,得到转空载体苹果株系oe-ev。
[0166]
二、mxiqm3在缺铁胁迫下的功能验证
[0167]
1、oe-mxiqm3和oe-ev在缺铁胁迫后的叶片表型比较
[0168]
将oe-mxiqm3和oe-ev于不加铁盐的霍格兰营养液(fe-)中进行缺铁胁迫,处理14天后观察植物叶片生长情况。同时以霍格兰营养液(fe+)作为对照。
[0169]
结果表明:在缺铁胁迫下,与对照植物oe-ev相比,过表达mxiqm3的转基因苹果(oe-mxiqm3)叶片出现轻度叶黄化。其中,oe-mxiqm3#1叶片表型如图5a所示。
[0170]
2、oe-mxiqm3和oe-ev在缺铁胁迫后的叶绿素含量比较
[0171]
oe-mxiqm3和oe-ev于不加铁盐的霍格兰营养液(fe-)中进行缺铁胁迫,处理14天后采用叶绿色测定仪检测叶片中的叶绿素含量。同时以霍格兰营养液(fe+)作为对照。
[0172]
结果表明:在缺铁胁迫下,oe-mxiqm3叶片中的叶绿素含量显著高于oe-ev(图5b)。
[0173]
3、oe-mxiqm3和oe-ev在缺铁胁迫后的fcr活性比较
[0174]
oe-mxiqm3和oe-ev于不加铁盐的霍格兰营养液(fe-)中进行缺铁胁迫,处理14天后检测根系部位的fcr活性和根系h
+
外泌量(h
+
流速)。
[0175]
采用非损伤微测技术设备(nmt美国扬格公司;旭月(北京)科技有限公司),测定h
+
进出苹果根部的实时速率,即h
+
流速。具体步骤如下:选取一株缺铁处理的苹果幼苗,使用滤纸条和树脂块,将样品根部固定在培养皿底部,露出根尖部位。向培养皿中加入测试液(0.1mm cacl2,ph6.0),浸没根部,静置20分钟左右。然后弃去测试液,加入5ml新鲜测试液,上样检测。在显微镜下找到苹果根尖成熟区的待测位点,将h
+
流速传感器置于距根表面检测位点约10μm处,开始检测。每个位点检测5分钟,每一组检测3个重复。通过imfluxes v2.0软件(youngerusa llc,amherst,ma01002,usa)直接读取h
+
流速数据,流速单位是pico mol
·
cm-2
·
s-1
,正值代表外排,负值代表吸收。记录读数,每组数据三个重复,比较oe-mxiqm3和oe-ev的h
+
流速差异。
[0176]
结果表明:在缺铁胁迫下,与oe-ev相比,过表达mxiqm3的转基因苹果oe-mxiqm3的根系h
+
外泌量(图5c)和fcr活性(图5d)均有所增加,mxiqm3显著增强了缺铁胁迫反应。
[0177]
4、oe-mxiqm3和oe-ev在缺铁胁迫后的铁含量比较
[0178]
oe-mxiqm3和oe-ev于不加铁盐的霍格兰营养液(fe-)中进行缺铁胁迫,处理14天后对根和叶进行perls染色试验。
[0179]
perls染色实验具体步骤如下:
[0180]
(1)不同处理下的苹果根和叶样品取样后用去离子水冲洗三遍后,用滤纸吸干表面去离子水。随后转移至75%乙醇中,37℃恒温摇床脱色3h。
[0181]
(2)用perls染色液染色1h,perls染色液由4%(v/v)hcl和4%(w/v)亚铁氰化钾等
体积混合而成。
[0182]
(3)待样品染色完成后取出用去离子水洗涤,在sex16(奥林巴斯)体式显微镜下进行成像。
[0183]
结果表明:在缺铁胁迫下,与oe-ev相比,oe-mxiqm3的根和叶中的铁含量明显增加(图5e和图5f),表明mxiqm3是苹果砧木缺铁反应的正调节因子。
[0184]
实施例5、mxmpk4-1与mxiqm3蛋白互作
[0185]
一、酵母双杂交试验验证mxmpk4-1与mxiqm3蛋白互作
[0186]
为了确认mxmpk4-1与mxiqm3的互作关系,分别构建pgadt7-mxiqm3与pgbkt7-mxmpk4-1双杂载体,进行mxmpk4-1与mxiqm3的酵母双杂交试验。具体步骤如下:
[0187]
将mxiqm3蛋白的编码基因序列构建到ad(pgadt7)载体上,得到pgadt7-mxiqm3;将mxmpk4-1蛋白的编码基因序列构建到bd(pgbkt7)载体上,得到pgbkt7-mxmpk4-1。将阴性对照与pgadt7-mxiqm3、pgbkt7-mxmpk4-1组合分别转入酵母感受态y2h gold,涂布于酵母二缺板,置于30℃培养箱内生长2-3天,待二缺板上长出菌斑后,将酵母菌斑在四缺板上进行四个浓度梯度的稀释,置于30℃培养箱内生长3-5天。
[0188]
结果表明:pgadt7-mxiqm3与pgbkt7-mxmpk4-1的组合在四缺板中的四个浓度梯度菌液均能够生长,但是空载pgadt7与bd-mxmpk4-1的组合在四缺的酵母板上不生长(图6a)。因此说明mxiqm3与mxmpk4-1在酵母中存在互作。
[0189]
二、pull-down试验验证mxiqm3与mxmpk4-1蛋白互作
[0190]
利用成功诱导的带gst标签的mxiqm3蛋白与带his标签的mxmpk4-1蛋白进行了体外pull-down试验,以进一步验证mxiqm3与mxmpk4-1蛋白互作。具体步骤如下:
[0191]
1、体外原核表达诱导mxiqm3蛋白
[0192]
1)重组载体的获得
[0193]
将序列1所示的dna分子(mxiqm3基因全长)插入pgex-4t-1-gst载体的bamhi和sali酶切位点间,得到重组载体。重组载体表达带gst标签的mxiqm3蛋白(mxiqm3-gst蛋白)。
[0194]
2)重组菌的获得
[0195]
用热激法将步骤1)中得到的重组载体转化至大肠杆菌bl21(de3)中,得到重组菌,用含有氨苄霉素(100μg/ml)的lb培养基对重组菌进行筛选培养,挑取单菌落,提取质粒并进行菌落pcr验证。
[0196]
3)mxiqm3蛋白的获得
[0197]
挑取单菌落接入含有氨苄霉素(100μg/ml)的lb培养基中,于37℃过夜培养。将过夜培养物接种于50ml含有氨苄霉素(100μg/ml)的lb培养基,37℃、220rpm摇床振荡培养至od
600nm
值达到0.6-0.8左右,再向培养体系中加入iptg(终浓度0.5mm),16℃、110rpm条件下再培养15小时,得到诱导后菌液。取诱导后菌液1ml留存,将剩余菌液4℃、7000rpm离心4min,弃上清;加适量buffer重悬菌体沉淀,然后加10μl/ml的pmsf,涡旋震荡混匀,再超声波破碎(超声2s,间歇3s,60-90个循环),破碎完成后4℃、7000rpm离心25min,收集上清,即为蛋白样品,-80℃保存。
[0198]
蛋白样品经sds-page凝胶电泳验证表明:上清样品中均含有mxiqm3-gst蛋白。
[0199]
2、体外原核表达诱导mxmpk4-1蛋白
[0200]
1)重组载体的获得
[0201]
将序列3所示的dna分子(mxmpk4-1基因全长)插入pet32a-his载体的bamhi和sali酶切位点间,得到重组载体。重组载体表达带his标签的mxmpk4-1蛋白(mxmpk4-1-his蛋白)。
[0202]
2)重组菌的获得
[0203]
用热激法将步骤1)中得到的重组载体转化至大肠杆菌bl21(de3)中,得到重组菌,用含有氨苄霉素(100μg/ml)的lb培养基对重组菌进行筛选培养,挑取单菌落,提取质粒并进行菌落pcr验证。
[0204]
3)mxmpk4-1蛋白的获得
[0205]
挑取单菌落接入含有氨苄霉素(100μg/ml)的lb培养基中,于37℃过夜培养。将过夜培养物接种于50ml含有氨苄霉素(100μg/ml)的lb培养基,37℃、220rpm摇床振荡培养至od
600nm
值达到0.6-0.8左右,再向培养体系中加入iptg(终浓度0.5mm),16℃、110rpm条件下再培养15小时,得到诱导后菌液。取诱导后菌液1ml留存,将剩余菌液4℃、7000rpm离心4min,弃上清;加适量buffer重悬菌体沉淀,然后加10μl/ml的pmsf,涡旋震荡混匀,再超声波破碎(超声2s,间歇3s,60-90个循环),破碎完成后4℃、7000rpm离心25min,收集上清,即为蛋白样品,-80℃保存。
[0206]
蛋白样品经sds-page凝胶电泳验证表明:上清样品中均含有mxmpk4-1-his蛋白。
[0207]
3、利用体外诱导的蛋白进行pull-down试验
[0208]
利用pull-down试验验证上述原核表达诱导得到的mxmpk4-1蛋白和mxiqm3蛋白的相互作用。具体步骤如下:
[0209]
(1)将原核诱导的两种蛋白溶液(mxiqm3-gst蛋白和mxmpk4-1-his蛋白)混匀,4℃摇床中赋予5小时。
[0210]
(2)将蛋白混养转入his纯化柱内,4℃孵育5小时。
[0211]
(3)样品上柱,用吊瓶针头控制流速,10倍柱体积/小时。
[0212]
(4)使用15倍柱体积的binding buffer冲洗柱子,去除杂蛋白。
[0213]
(5)使用elution buffer洗脱,收集洗脱液。
[0214]
(6)加上样缓冲液,western blot检测。
[0215]
结果证明:mxiqm3蛋白确实能与mxmpk4-1蛋白在体外互作(图6b)。
[0216]
三、bifc试验验证mxiqm3与mxmpk4-1蛋白互作
[0217]
为了进一步确认互作结果,分别构建了pspyce-mxiqm3(将mxiqm3编码基因插入pspyce载体后得到的载体)与pspyne-mxmpk4-1载体(将mxmpk4-1编码基因插入pspyne载体后得到的载体),分别将pspyne-mxiqm3与pspyne-mxmpk4-1载体转入农杆菌gv3103菌株,菌落pcr验证无误后,集菌后用配置好的mma缓冲液重悬,在烟草中注射进行bifc试验。
[0218]
结果表明:在激光共聚焦显微镜下可见到明显荧光(图6c和图6d),验证了mxiqm3与mxmpk4-1在体内也存在互作。
[0219]
综上所述,体内外试验结果证明了mxiqm3蛋白与mxmpk4-1蛋白的互作关系。
[0220]
实施例6、mxiqm3和mxmpk4-1在苹果愈伤中的功能鉴定
[0221]
一、过表达mxiqm3和mxmpk4-1的转基因苹果愈伤组织的制备
[0222]
1、重组质粒的构建
[0223]
将序列1所示的mxiqm3基因插入pri101::myc载体的bamhi酶切位点处,得到重组质粒pri101::mxiqm3。重组质粒表达带有myc标签的mxiqm3蛋白。
[0224]
将序列3所示的mxmpk4-1基因插入pri101::gfp载体的bamhi酶切位点处,得到重组质粒pri101::mxmpk4-1。重组质粒表达带有gfp标签的mxmpk4-1蛋白。
[0225]
2、稳定转化苹果愈伤组织
[0226]
将重组质粒pri101::mxiqm3和重组质粒pri101::mxmpk4-1共同转化于苹果“王林”愈伤组织,得到oe-mxmpk4-1-gfp+oe-mxiqm3-myc共转愈伤。具体步骤同实施例3步骤一的2。
[0227]
过表达mxiqm3蛋白和mxmpk4-1蛋白的共转愈伤oe-mxmpk4-1-gfp+oe-mxiqm3-myc的鉴定结果如图7所示。选取oe-mxmpk4-1-gfp+oe-mxiqm3-myc(下文简称oe-mxmpk4-1+oe-mxiqm3)共转愈伤#2、#3和#4用于下述功能验证实验。
[0228]
二、mxiqm3和mxmpk4-1在缺铁胁迫下的功能验证
[0229]
1、缺铁胁迫后的fcr活性比较
[0230]
将wt愈伤组织、实施例3中的oe-mxiqm3愈伤组织和oe-mxmpk4-1+oe-mxiqm3共转愈伤在不加铁盐的ms培养基(fe-)中进行缺铁胁迫,处理14天后检测愈伤组织的三价铁还原酶活性(fcr活性)
[0231]
结果表明:与单转愈伤oe-mxiqm3相比,共转愈伤oe-mxmpk4-1+oe-mxiqm3#4的fcr活性显著增强(图8a、b)
[0232]
2、铁吸收相关基因表达量检测
[0233]
检测wt愈伤组织、实施例3中的oe-mxiqm3愈伤组织和oe-mxmpk4-1+oe-mxiqm3共转愈伤中铁吸收相关基因fro2、ha2和nramp1的表达量。
[0234]
结果表明:与单转愈伤oe-mxiqm3相比,共转愈伤oe-mxmpk4-1+oe-mxiqm3中铁吸收相关基因fro2、ha2和nramp1的表达量均显著性上调(图8c-e)。
[0235]
实施例7、mxiqm3和mxmpk4-1在苹果根系中的功能鉴定
[0236]
一、过表达mxiqm3和mxmpk4-1的转基因苹果的制备
[0237]
1、重组质粒的构建
[0238]
将序列1所示的mxiqm3基因插入pri101::myc载体的bamhi酶切位点处,得到重组质粒pri101::mxiqm3。重组质粒表达带有myc标签的mxiqm3蛋白。
[0239]
将序列3所示的mxmpk4-1基因插入pri101::gfp载体的bamhi酶切位点处,得到重组质粒pri101::mxmpk4-1。重组质粒表达带有gfp标签的mxmpk4-1蛋白。
[0240]
2、发根农杆菌稳定转化苹果根系
[0241]
将重组质粒pri101::mxiqm3和重组质粒pri101::mxmpk4-1共同转化于苹果山定子种子苗,得到oe-mxmpk4-1+oe-mxiqm3共转株系。具体步骤同实施例4步骤一的2。
[0242]
同时以pri101空载质粒作为对照,得到转空载体苹果株系oe-ev。
[0243]
过表达mxiqm3和mxmpk4-1共转根系oe-mxmpk4-1+oe-mxiqm3的鉴定结果如图9所示。
[0244]
二、mxiqm3和mxmpk4-1在缺铁胁迫下的功能验证
[0245]
将oe-ev转基因根系、oe-mxiqm3转基因根系和oe-mxmpk4-1+oe-mxiqm3共转根系在不加铁盐的ms培养基(fe-)中进行缺铁胁迫,处理14天后检测愈伤组织的三价铁还原酶
活性(fcr活性)。
[0246]
结果表明:与空载对照(oe-ev)相比,oe-mxiqm3转基因根系表现出较强的fcr活性,同时oe-mxmpk4-1+oe-mxiqm3共转根系fcr活性进一步增强(图10a)。此外,h
+-atp酶活性与三价铁还原酶fcr活性表现一致,且oe-mxmpk4-1+oe-mxiqm3的根际ph值显著低于oe-mxiqm3(图10b)。
[0247]
上述结果说明,mxmpk4-1和mxiqm3可以正向调控小金海棠的缺铁适应性反应。
[0248]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1