一种利用葡萄糖生产乳酸单体的菌株及其应用
:本发明涉及发酵工程和基因工程,具体涉及一种可利用葡萄糖高转化率合成乳酸单体的生产菌株及其获得方法,具体为细胞生长相关关键调控基因的克隆、表达、删除和以葡萄糖为原料的乳酸单体的发酵生产。
背景技术
0、
背景技术:
1、乳酸(又称为α-羟基丙酸,分子式为c2h5ocooh)是一种天然存在的有机酸,广泛存在于人、动物、植物和微生物中。乳酸是世界上公认的三大有机酸之一,乳酸及其衍生物被广泛应用于酿造、食品、农业、医药、化工、纺织、皮革、烟草、印染等行业中。乳酸是自然界最小的手性分子,其羧基α位碳原子为不对称碳原子,具有l(+)和d(-)两种光学构型。极高光学纯度极高化学纯度的l-乳酸或d-乳酸单体是重要的手性中间体和聚乳酸合成的原料。随着人们环保意识的提高,生物可降解聚乳酸材料的市场需求量剧增,也推动了对其单体l-乳酸和d-乳酸的需求,同时促进了对以高产量、高转化率和高生产强度生产极高光学纯度和极高化学纯度l-乳酸和d-乳酸合成方法的需求。
2、大肠杆菌生长速度快、营养需求简单,作为基因操作的工具菌,大肠杆菌遗传背景清楚、易于进行基因操作。通过定向遗传改良,可以使大肠杆菌在合成乳酸时的光学纯度和化学纯度皆能达到理想的程度。作为生产菌株,重组大肠杆菌通过合理搭建或改造l-乳酸或d-乳酸合成途径,并针对性阻断其他副产物合成途径后,其发酵产酸阶段的理论糖酸转化率可达到100%。
3、前期研究已有许多通过删除乳酸竞争途径来增加乳酸合成的报道(zhou l.etal.,current microbiology,2011,62:981~989;zhu y.et al.,applied environmentalmicrobiology,2007,73:456~464;zhou s.et al.,applied environmentalmicrobiology,2003,69:399~407;zhu j.et al.,applied microbiology andbiotechnology,2004,64:367~375;zhu j.et al.,metabolic engineering,2005,7:104~115)。进一步在重组大肠杆菌中增加乳酸合成关键途径-乳酸脱氢酶基因(ldha)的拷贝数或将其启动子替换为强启动子有可能会增加乳酸合成的速率。此外,生产实践中常常会遇到菌体生长阶段产生乳酸消耗碳源,使得好氧阶段不能得到高菌体浓度和高活性细胞,进而影响发酵产酸阶段生产强度的问题。如,我们前期报道的菌株b0013-070(zhou l.etal.,current microbiology,2011,62:981~989)在菌体生长阶段合成7g/l乳酸,与细胞合成竞争底物,由于在大规模发酵过程中供氧能力会显著下降,好氧阶段乳酸的积累会进一步增加,从而影响菌体量的积累,使得在乳酸积累阶段乳酸的体积生产强度降低。
4、此外,发酵产酸阶段菌体的继续生长同样会带来碳源的消耗使得发酵产酸阶段糖酸转化率通常不高于96%。为了实现乳酸单体的高转化率下的合成,已有研究通过基因工程直接删除菌体生长关键基因,然后通过添加乙酸等替代碳源的方式实现细胞生长过程的恢复(zhu y.et al.,applied environmental microbiology,2007,73:456~464),同时通过通入氮气等维持绝对厌氧条件获得发酵产酸阶段糖酸转化率接近99%的乳酸单体生产过程(zhu y.et al.,applied environmental microbiology,2007,73:456~464)。而从工业化规模生产角度来讲,乙酸等物质的流加控制实现难度大,绝对厌氧体系则需要维持发酵体系的密闭性,从而增加了设备成本和维护成本。
5、丙酮酸脱氢酶(pdh)多酶复合体,是一种可催化丙酮酸不可逆的转化为乙酰-coa的多酶复合物,主要包括丙酮酸脱氢酶(e1p)、二氢硫辛酰胺转乙酰基酶(e2p)和二氢硫辛酰胺脱氢酶(e3),acee、acef和lpda基因分别编码这3种蛋白。pdh多酶复合体作为一组限速酶,连接emp通路(糖酵解通路)和tca循环,糖酵解通路降解细胞外糖并氧化其他有机化合物生成丙酮酸,tca循环产生atp和中间体来支持细胞的整体生长。丙酮酸在硫胺焦磷酸盐依赖的反应中被e1p(acee基因编码)脱羧后,与e2p(acef基因编码)的ld基结合的硫基乙酰化,然后ld的乙酰化脂基部分与位于c端的e2催化位点(cat)相互作用,乙酰基转移到辅酶a上,剩余还原的ld基部分被e3(lpda基因编码)氧化,重置脱氢酶,进行另一轮乙酰辅酶a的合成。pdh复合体的三种酶均属于细胞生长必需型关键酶,直接对其染色体上的编码基因进行敲除会导致细胞无法生长,或生长极其缓慢。
6、定点删除或敲除目标基因是研究特定基因及其编码蛋白以及相关代谢途径的重要手段之一。代谢工程改造和合成途径重构中,常需要对宿主菌生长代谢所必需的基因进行敲除或删除。由于该类型基因的敲除或删除会直接导致细胞不生长或生长极为微弱,而无法直接获得需要的转化子。
7、本发明建立了一种高效删除细胞生长必需型基因的方法。先借助具有同源重组辅助功能的温敏型质粒游离表达选定的细胞生长必需型基因,再通过选择选定基因上下游序列作为同源臂,删除染色体上原有的选定基因。获得的重组菌可通过调整培养温度,控制表达温敏型质粒中的选定细胞生长必需型基因。在原有乳酸单体高产菌种cgmcc 11059和cgmcc11060(zl201580000781.7)的基础上,借助上述策略选育了新型乳酸单体高产菌种。较低培养温度下,该菌种在好氧菌体生长阶段可以正常生长,发酵产酸阶段通过升高培养温度,可以显著限制菌体生长情况,实现发酵原料最大限度的流向乳酸单体的合成,且这一过程可以在无需严格厌氧的大规模发酵生产体系下完成。发酵产酸阶段的糖酸转化率超过99%,接近理论转化率。
技术实现思路
0、
技术实现要素:
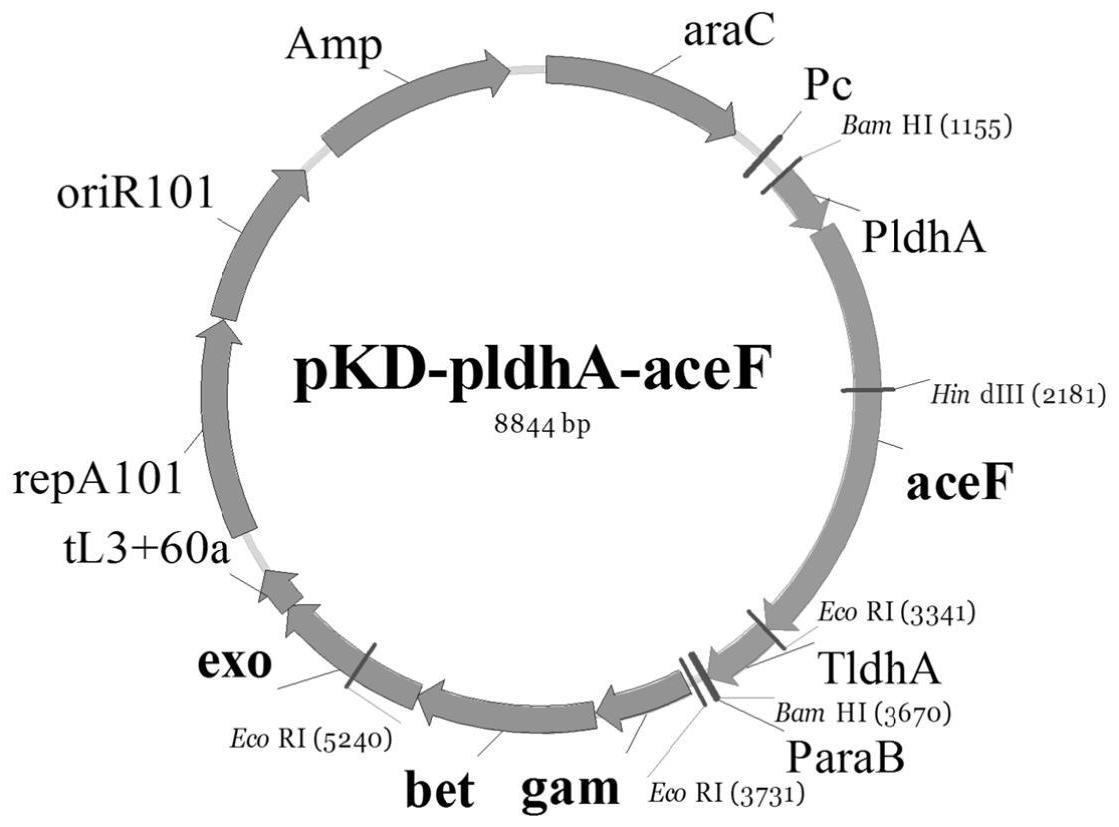
1、本发明目的是通过基因克隆与基因重组技术在乳酸单体生产菌株中实现细胞生长过程与发酵生产体系的培养温度形成关联,通过培养温度改变实现对细胞生长过程的开关控制,进而在发酵产乳酸阶段使葡萄糖等原料最大限度的流向乳酸单体的合成,获得利用葡萄糖高转化率发酵生产乳酸单体的生产菌种,以及高效合成乳酸单体的发酵生产技术。
2、本发明提供的技术方案之一,是一株生产乳酸的基因工程菌,所述工程菌以具有乳酸生产能力的菌株为宿主,通过温敏型质粒在宿主内游离表达pdh复合体中的关键酶的编码基因,然后再缺失宿主染色体上的上述关键酶的编码基因,获得细胞生长和增殖可以通过培养温度进行调控的乳酸单体生产新菌种,该菌种糖酸转化率提高到99%以上;
3、进一步地,所述pdh复合体中的关键酶,是催化丙酮酸为乙酰辅酶a过程中的酶,包括丙酮酸脱氢酶(e1p)、二氢硫辛酰胺转乙酰基酶(e2p)、二氢硫辛酰胺脱氢酶(e3),acee、acef和lpda基因分别编码这3种蛋白;
4、优选地,所述pdh复合体中的关键酶是二氢硫辛酰胺转乙酰基酶e2p,其氨基酸序列如seq id no.2所示;e2p由acef基因编码,核苷酸序列如seq idno.1所示;
5、进一步地,所述e2p的编码基因acef通过克隆入温敏型质粒在宿主中进行游离表达,所述温敏型质粒具备编码exo、beta、gam三种蛋白质的功能;
6、更进一步地,所述温敏型质粒选自pkd3,pkd4,pkd46,pkd20或pkd13;
7、优选地,所述温敏型质粒为pkd46;
8、进一步地,温敏型质粒上还包含来源于大肠杆菌的启动子和终止子序列,用于控制pdh复合体中的关键酶的表达;所述启动子和终止子的来源包括但不限于乳酸脱氢酶(ldha),乙醇脱氢酶(adhe),甲酸裂解酶(pflb),琥珀酸还原酶(frda);
9、优选地,所述温敏型质粒上,含有来源于大肠杆菌的乳酸脱氢酶(ldha)的启动子pldha和终止子tldha,pldha的核苷酸序列如seq id no.11所示,tldha的核苷酸序列如seqid no.12所示;
10、进一步地,所述缺失pdh复合体中的关键酶的编码基因的表达的方式包括但不限于基因敲除、基因失活等方式,所述基因失活包括通过删除、敲除或插入片段使其功能失活的方式;
11、优选地,所述缺失pdh复合体中的关键酶的编码基因的表达的方式为基因敲除;
12、更优选地,借助温敏型质粒辅助同源重组的功能对宿主染色体上pdh复合体中的关键酶的编码基因进行敲除;
13、进一步地,所述具有乳酸单体生产能力的宿主菌株包括但不限于大肠杆菌、酿酒酵母、热带假丝酵母、凝结芽胞杆菌、枯草芽胞杆菌、巨大芽胞杆菌、谷氨酸棒杆菌、地衣芽胞杆菌等;
14、优选地,所述宿主菌为大肠杆菌cgmcc no.11059或cgmcc no.11060。
15、更优选地,所述生产乳酸单体的基因工程菌,是以大肠杆菌cgmccno.11059或cgmcc no.11060为宿主,将二氢硫辛酰胺转乙酰基酶的编码基因acef、启动子pldha和终止子tldha克隆至温敏型质粒pkd46中,获得重组质粒pkd-pldha-acef,并将重组质粒pkd-pldha-acef转化至上述宿主中,之后敲除宿主菌中染色体上的acef基因,获得重组大肠杆菌;
16、进一步地,以大肠杆菌cgmcc no.11060为宿主,获得可代谢利用葡萄糖高转化率合成l-乳酸单体的大肠杆菌gsfl;
17、进一步地,以大肠杆菌cgmcc no.11059为宿主获得可代谢利用葡萄糖高转化率合成d-乳酸单体的大肠杆菌gsfd;
18、大肠杆菌gsfl、gsfd均具有细胞生长过程可通过温度改变精确调控的特征。
19、本发明提供的技术方案之二,是技术方案一所述基因工程菌在生产乳酸中的应用;
20、进一步地,采用上述基因工程菌通过发酵罐发酵生产乳酸的方法如下:
21、在无机盐培养基中添加2~5wt.%的葡萄糖,以0.1%~10%的接种量接入生产菌株,在25~35℃、通风0.1~3vvm和200~1000r/min下控制溶解氧浓度不低于20%培养4~16h,过程中通过流加5~25wt.%氨水维持发酵液ph 6.0~7.5,当菌体od600达到10~50后关闭通风并降低转速到0~200r/min,提高发酵温度到35~55℃进入乳酸合成阶段,期间补加葡萄糖,葡萄糖补加总量为200~270g/l发酵液(以起始发酵体积计算);乳酸合成阶段通过流加5~30wt.%氢氧化钙悬浊液维持发酵液ph 6.0~7.5;当残糖浓度低于0.5g/l时,或耗糖速率低于1g/(l·h)时,或发酵液固形物含量过高难以搅拌时,结束发酵,发酵周期26~36h,乳酸浓度160g/l以上,产酸速率5.6g/(l·h)以上,发酵产酸阶段糖酸转化率99%以上;
22、更进一步地,通过分批补加浓度为3~70wt.%的葡萄糖溶液或以3~30g/(l·h)的流加速度流加10~70wt.%葡萄糖溶液来补加葡萄糖;
23、更进一步地,所述无机盐培养基组成为(w/v):十二水磷酸氢二钠0.5%~2.5%,氯化钠0.02%~0.1%,磷酸二氢钾0.1%~1.0%,氯化铵0.01%~0.5%,其余为水;
24、优选地,在无机盐培养基中添加3~4wt.%的葡萄糖,以5%~8%的接种量接入生产菌株,在30~35℃、通风0.3~2vvm和200~1000r/min下培养6~8h,过程中通过流加15~25wt.%氨水维持发酵液ph 6.5~7.0,然后关闭通风并降低转速到100~200r/min,提高发酵温度到40~50℃,然后分批补加浓度为50~60wt.%的葡萄糖溶液或以8~20g/(l·h)的流加速度流加50~60wt.%葡萄糖溶液使得葡萄糖补加总量为230~240g/l发酵液(以起始发酵计算),这一过程中通过流加20~25wt.%氢氧化钙悬浊液维持发酵液ph 6.5~7.0。
25、进一步地,采用上述基因工程菌通过摇瓶发酵生产乳酸的方法如下:
26、在摇瓶发酵培养基中,按初始od600为0.05~0.2接入种子液,先好氧阶段25~37℃、100~250r/min培养8~16h,使菌体生长起来,再转入厌氧产乳酸阶段,厌氧产乳酸阶段,加入终浓度为10~80g/l的葡萄糖和终浓度2%~8%的caco3,37~50℃静置培养12~50h;发酵产酸阶段糖酸转化率99%以上。
27、进一步地,摇瓶发酵培养基如下:十二水磷酸氢二钠0.5%~2.5%,氯化钠0.02%~0.1%,磷酸二氢钾0.1%~1.0%,氯化铵0.01%~0.5%,葡萄糖0.1%~1.0%;ph 7.0。
28、有益效果:
29、本发明提供的重组菌具有明显的利用葡萄糖高转化率合成乳酸单体的能力。大规模发酵生产体系下(发酵罐培养),乳酸单体发酵水平达到160g/l以上,光学纯度99.9%以上,化学纯度98%以上,发酵产酸阶段糖酸转化率99%以上(原始菌为96%),葡萄糖到乳酸的整体转化率92%以上(原始菌为90%),本发明中发酵产酸阶段糖酸转化率=发酵产酸阶段乳酸积累量除以发酵产酸阶段的葡萄糖消耗量乘以100%;整体转化率=发酵全程的乳酸积累量除以发酵全程的葡萄糖消耗量乘以100%。本发明提供的技术在乳酸单体发酵生产过程中,有助于提高原料到乳酸单体的转化率和降低副产物合成水平,有效降低了发酵生产成本和产品提取精制成本。同时,本发明技术实现了以发酵温度为调控手段,精确控制乳酸单体生产过程中的细胞生长和增殖情况,无需外源限制性添加营养物。简洁控制工艺有助于实现乳酸单体发酵生产体系的智能化控制和无人工厂的建立。本发明也可直接应用于蔗糖、淀粉以及糖蜜、菊芋、牛蒡、甘蔗汁、甜菜汁等其他原料的乳酸单体发酵生产。
- 还没有人留言评论。精彩留言会获得点赞!