一种含酰胺键脂质的合成方法与流程
1.本发明属于有机合成技术领域,特别涉及一种含酰胺键脂质的合成方法。
背景技术:
2.脂质纳米颗粒(lipid nano particles,简称lnps)递送系统是当下最先进和主流的mrna疫苗递送系统。lnps一般由可离子化或阳离子脂质、膦脂、胆固醇和聚乙二醇化的脂质组成。结构上均为具有自组装性能的两亲性分子,lnps各成分结构确定,重现性好,利于质量监管。同时因其具有较长的体内循环时间、良好的生物相容性等优点而受到广泛关注。
3.由于天然脂质通常为混合物,品质不稳定且安全性难以保证,目前的lnps递送系统均使用合成脂质构建。但合成脂质的步骤复杂、提纯困难,往往难以大规模生产。
4.酰胺键是构建合成脂质的一种重要母核。尽管以醇、醛、酮、酯、腈和肟为原料合成酰胺的方法很多,但羧酸和胺的脱水缩合仍然是最直接和最主要的方法(参见文献:tetrahedron lett.2013,54,4922
–
4925;organomet.chem.2014,28,900
–
907;j.am.chem.soc.2006,128,13064
–
13065;j.am.chem.soc.2012,134,15233
–
15236;tetrahedron lett.2002,43,7221
–
7223;tetrahedron 2014,70,4420
–
4424)。传统的直接脱水缩合通常发生在相对恶劣的条件下(温度》200℃),不能容忍敏感的官能团,因此难以用于合成脂质(参见文献:synth.commun.1993,23,2761
–
2770;tetrahedron lett.1989,30,2771
–
2774)。为了克服这些缺点,人们开发了许多经典的偶联剂,如碳酰二亚胺、膦、脲、铵盐等,以在温和的条件下原位活化羧酸,然而,现有的这些方法大多数都存在成本高、原子经济性差和纯化过程繁琐等问题(参见文献:j.am.chem.soc.1955,77,1067
–
1068;j.am.chem.soc.1969,91,5669
–
5671;j.org.chem.2001,66,5245
–
5247)。因此,仍然迫切需要开发更经济、更简便的方法来构建酰胺键。
5.现有技术中有通过硫酰氟介导酰胺化的方法,然而,硫酰氟价格昂贵且作为气体并不适用于工业化生产。现有技术还有利用溴甲基磺酰氟和氢氧化钾组合作为水去除体系,从羧酸和胺中合成酰胺和多肽,但该方法用于合成长链的脂质产率不佳(产率难超过50%)并且反应温度较高,容易使脂质水解失活。
6.因此,亟需提供一种新的含酰胺键脂质的合成方法,该合成方法不仅可在低温下进行,而且经济高效,产物产率高。
技术实现要素:
7.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种含酰胺键脂质的合成方法。所述合成方法的反应条件温和、操作简单、安全环保、经济高效、产物易纯化,产率高。所述合成方法用于解决目前合成方法的缺点与不足,高效经济地合成多种含酰胺键脂质,应用于有机合成,医药技术等领域。
8.本发明的发明构思为:本发明制得的产物是一类含酰胺键脂质,是通过简单的硫氟交换活化羧基,在辅助碱的作用下,脱去一分子磺酸进行酰胺化得到的。本发明基于硫氟
交换点击化学创新性地开发了一种羧酸/胺直接酰胺化方法,该方法反应条件温和、操作简单、安全环保、经济高效、产物易于纯化、产率高(产率不低于80%),可以应用于一系列含酰胺键脂质的合成,满足实验室大量制备和工业生产放大的条件。
9.本发明提供一种含酰胺键脂质的合成方法。
10.具体的,一种含酰胺键脂质的合成方法,包括以下步骤:
11.将羧酸、胺、碱催化剂、氯甲基磺酰氟混合,反应,制得所述含酰胺键脂质。
12.即上述合成方法以羧酸、胺为原料,在碱催化剂存在的条件下,以氯甲基磺酰氟原位活化羧酸反应生成含酰胺键脂质。
13.优选的,所述羧酸的结构式为其中,r1为取代或未取代的c
1-c
25
烷基、c
2-c
25
烯基、c
2-c
25
炔基、c
3-c
25
环烷基、芳香环、聚乙二醇或聚乙二醇单甲醚。
14.进一步优选的,所述聚乙二醇、聚乙二醇单甲醚的重均分子量为200-50000。
15.进一步优选的,所述取代的c
1-c
25
烷基、c
2-c
25
烯基、c
2-c
25
炔基、c
3-c
25
环烷基的取代基为c
1-c
10
烃基、c
1-c
10
环烷基、甲氧基或氟中的至少一种。
16.进一步优选的,所述取代的聚乙二醇、聚乙二醇单甲醚的取代基为保护或未保护的羧基、巯基、羟基、氨基、c
1-c6烷基。所述保护为预先连接上保护基团。
17.优选的,所述c
1-c
25
烷基、c
2-c
25
烯基、c
2-c
25
炔基、c
3-c
25
环烷基中包含或不包含其他官能团,其他官能团包括醚键、酯基、羰基、羟基、羧基、磷酸酯中的至少一种。
18.优选的,所述胺的结构式为其中,r2和r3各自独立地为取代或未取代的c
1-c
25
烷基、c
2-c
25
烯基、c
2-c
25
炔基、c
3-c
25
环烷基、聚乙二醇、聚乙二醇单甲醚、芳香环、氢。
19.优选的,所述聚乙二醇、聚乙二醇单甲醚的重均分子量为200-50000。
20.优选的,所述取代的c
1-c
25
烷基、c
2-c
25
烯基、c
2-c
25
炔基、c
3-c
25
环烷基的取代基为c
1-c
10
烃基、c
3-c
10
环烷基、甲氧基、氟、取代或未取代的磷酸酯。
21.优选的,所述取代的聚乙二醇、聚乙二醇单甲醚的取代基为保护或未保护的羧基、巯基、羟基、氨基、c
1-c6烷基。所述保护为预先连接上保护基团。保护基团为酰基类、醚类、苄基类、缩醛类、缩酮类、硅醚类、氧羰基类、三苯甲基、磺酸类,或与上述保护基团作用相同,用于提高反应选择性并且能够通过化学手段脱去且不对分子其它结构造成影响的基团。
22.优选的,所述c
1-c
25
烷基、c
2-c
25
烯基、c
2-c
25
炔基、c
3-c
25
环烷基中包含或不包含其他官能团,官能团包括醚键、酯基、羰基、羟基、羧基、磷酸酯中的至少一种。
23.优选的,所述碱催化剂选自n,n-二异丙基乙胺、三乙胺、碳酸氢钠、碳酸氢钾、碳酸钠、碳酸钾、氢氧化钠、氢氧化钾、醋酸钾中的至少一种;优选碳酸钠。
24.优选的,所述含酰胺键脂质的结构式为其中的r1、r2、r3与羧酸中的r1、胺中的r2和r3保持一致。
25.优选的,所述含酰胺键脂质选自n-十四烷基十四酰胺、n-辛基十二酰胺、
[0026][0027]
中的至少一种。
[0028]
上述合成方法的合成路径如下所示:
[0029][0030]
优选的,所述反应的温度为20-80℃;进一步优选的,所述反应的温度为40-50℃。
[0031]
优选的,所述反应的时间为2-48小时,优选12-24小时。根据反应的原料种类不同,反应时间有所不同。
[0032]
优选的,所述羧酸、胺、氯甲基磺酰氟、碱催化剂的摩尔比为1:(0.1-6):(0.1-11):(0.05-12);进一步优选的,所述羧酸、胺、氯甲基磺酰氟、碱催化剂的摩尔比为1:(0.2-5):(0.2-10):(0.1-10);更优选的,所述所述羧酸、胺、氯甲基磺酰氟、碱催化剂的摩尔比为1:1.1:1:1.1。
[0033]
优选的,所述反应是在溶剂条件下进行,即将各原料加入到溶剂中进行反应。
[0034]
优选的,所述溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、1,4-二氧六环、苯、甲苯、乙腈、丙酮、乙酸乙酯、氯苯、四氢呋喃、四氢吡咯、二氯甲烷、氯仿、水中的至少一种;优选乙腈或氯仿。
[0035]
优选的,所述反应结束后,过滤,取滤液,蒸馏回收溶剂,取蒸馏所剩固体,重结晶得到纯度高的产物(含酰胺键脂质)。
[0036]
优选的,所述重结晶所用的溶剂为水、n,n-二甲基甲酰胺、氯苯、二甲苯、甲苯、乙腈、乙醇、四氢呋喃、氯仿、乙酸乙酯、冰醋酸、四氯化碳、苯、环己烷、丁酮、丙酮、石油醚、乙醚、二甲基亚砜、六甲基磷酰胺、n-甲基吡咯烷酮、1,4-二氧六环、乙二醇单甲醚中的至少一种;优选甲苯。
[0037]
相对于现有技术,本发明的有益效果如下:
[0038]
与传统的直接酰胺化方法相比,本发明所述合成方法将羧酸、胺、碱催化剂、氯甲基磺酰氟混合,反应,制得所述含酰胺键脂质,条件温和,低于绝大多数脂质体的相变温度与水解温度,并且产率显著提高,更适用于脂质的合成。与传统的偶联试剂催化酰胺化方法相比,本发明所述合成方法更加经济高效、易于纯化,产率高,所用氯甲基磺酰氟催化剂可使用二氯甲烷轻松合成,并且反应结束后通过简单的过滤、重结晶即可得到高纯度产物,所用溶剂均可回收套用,所用重结晶母液均可循环利用。而与传统的酰氯法制备酰胺方法相比,本发明所述合成方法操作简单、安全环保、经济高效、易于纯化,无须经过单独的酰氯化步骤即可一步得到产物,并且避免生成脂质不耐受的氯化氢气体,更适用于脂质的合成。
具体实施方式
[0039]
为了让本领域技术人员更加清楚明白本发明所述技术方案,现列举以下实施例进行说明。需要指出的是,以下实施例对本发明要求的保护范围不构成限制作用。
[0040]
以下实施例中所用的原料、试剂或装置如无特殊说明,均可从常规商业途径得到,或者可以通过现有已知方法得到。
[0041]
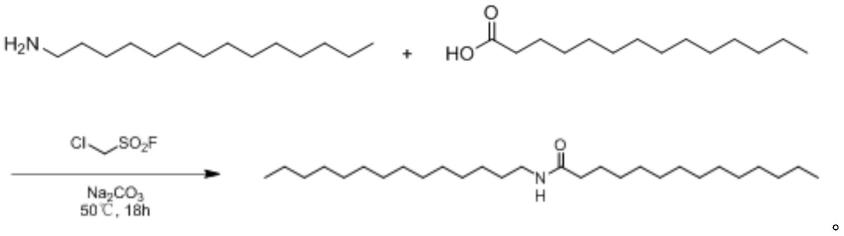
实施例1:n-十四烷基十四酰胺的制备
[0042]
n-十四烷基十四酰胺的反应方程式(方程式中只记录目标产物)如下所示:
[0043][0044]
一种含酰胺键脂质(n-十四烷基十四酰胺)的合成方法,包括以下步骤:
[0045]
在室温25℃下,向500ml圆底烧瓶中依次加入碳酸钠(110.0mmol)、乙腈(200ml)、十四酸(100.0mmol)、十四胺(110.0mmol)和氯甲基磺酰氟(100mmol),50℃下反应18h后,减压抽滤,使用乙腈润洗滤饼两次,收集滤液并减压蒸馏回收乙腈,取蒸馏所剩固体,加入甲苯结晶得到固体产物,收集固体产物并在真空中干燥至恒重38.49g,产物的纯度为99.5%(质量分数),产物的产率为91%。
[0046]
本实施例制得的产物含酰胺键脂质(n-十四烷基十四酰胺)的核磁共振氢谱表征结果为:1hnmr(500mhz,cdcl3)δ(ppm)5.37(s,1h),3.22(q,j=7.0hz,2h),2.14(t,j=8.0hz,2h),1.47-1.44(m,2h),1.28-1.24(m,44h),0.88(t,j=7.0hz,6h)。
[0047]
实施例2:n-辛基十二酰胺的制备
[0048]
n-辛基十二酰胺的反应方程式(方程式中只记录目标产物)如下所示:
[0049][0050][0051]
一种含酰胺键脂质(n-辛基十二酰胺)的合成方法,包括以下步骤:
[0052]
在室温25℃下,向500ml圆底烧瓶中依次加入碳酸钠(110.0mmol)、乙腈(200ml)、十二酸(100.0mmol)、辛胺(110.0mmol)和氯甲基磺酰氟(100mmol),50℃下反应12h后,减压抽滤,使用乙腈润洗滤饼两次,收集滤液并使用减压蒸馏回收乙腈,取蒸馏所剩固体,加入甲苯结晶得到固体产物,收集固体产物并在真空中干燥至恒重29.6g,产物的纯度为99.5%(质量分数),产物的产率为95%。
[0053]
本实施例制得的产物含酰胺键脂质(n-辛基十二酰胺)的核磁共振氢谱表征结果为:1hnmr(500mhz,cdcl3)δ(ppm)5.36(s,1h),3.25(td,j=7.0,5.8hz,2h),2.15(t,j=
8.0hz,2h),1.57-1.67(m,2h),1.43-1.52(m,2h),1.20-1.41(m,26h),0.92(t,j=7.5hz,3h),0.88(t,j=7.0hz,3h)。
[0054]
实施例3
[0055]
结构式为的含酰胺键脂质的制备,反应的方程式(方程式中只记录目标产物)如下所示:
[0056][0057]
上述含酰胺键脂质的合成方法,包括以下步骤:
[0058]
在室温25℃下,向250ml圆底烧瓶中依次加入碳酸钠(11.0mmol)、乙腈(100ml)、peg-cooh(peg表示聚乙二醇,重均分子量为2000,10.0mmol)、2-磷酸酯乙胺衍生物(11.0mmol)和氯甲基磺酰氟(10mmol),50℃下反应18h后,减压抽滤,收集滤液并使用减压蒸馏回收乙腈,取蒸馏所剩固体,使用水洗涤两次后加入甲苯结晶得到固体产物,收集固体产物并在真空中干燥至恒重24.10g,产物的纯度为98%(质量分数),产物的产率85%。
[0059]
本实施例制得的产物含酰胺键脂质的核磁共振氢谱表征结果为:1hnmr(500mhz,cdcl3)δ(ppm)5.57(s,1h),4.77(t,j=5.0hz,1h),4.33(s,2h),3.83-3.47(m,92h),2.29(t,j=7.5hz,4h),1.63-1.57(m,4h),1.40-1.22(m,56h),0.86(t,j=7.0hz,6h)。
[0060]
实施例4
[0061]
结构式为的含酰胺键脂质的制备,反应的方程式(方程式中只记录目标产物)如下所示:
[0062][0063]
上述含酰胺键脂质的合成方法,包括以下步骤:
[0064]
在室温25℃下,向250ml圆底烧瓶中依次加入碳酸钠(11.0mmol)、氯仿(100ml)、peg-cooh(重均分子量为2000,10.0mmol)、双十四烷基胺(11.0mmol)和氯甲基磺酰氟(10mmol),50℃下反应24h后,减压抽滤,收集滤液并使用减压蒸馏回收氯仿,取蒸馏所剩固体,使用水洗涤两次后加入甲苯结晶得到固体产物,收集固体产物并在真空中干燥至恒重21.12g,产物的纯度为95%(质量分数),产物的产率为84%。
[0065]
本实施例制得的产物含酰胺键脂质的核磁共振氢谱表征结果为:1hnmr(500mhz,cdcl3)δ(ppm)4.09(s,2h),3.56(s,187h),3.28(s,3h),3.19(t,j=8.0hz,2h),3.10(t,j=7.5hz,2h),1.46-1.43(m,4h),1.21-1.16(m,44h),0.78(t,j=7.0hz,6h)。
[0066]
实施例5
[0067]
结构式为的含酰胺键脂质的制备,反应的方程式(方程式中只记录目标产物)如下所示:
[0068][0069]
上述含酰胺键脂质的合成方法,包括以下步骤:
[0070]
在室温25℃下,向250ml圆底烧瓶中依次加入碳酸钠(11.0mmol)、乙腈(100ml)、peg-cooh(重均分子量为2000,10.0mmol)、2-膦酰酯基乙胺(11.0mmol)和氯甲基磺酰氟(10mmol),40℃下反应12h后,减压抽滤,收集滤液并使用减压蒸馏回收乙腈,取蒸馏所剩固体,使用水洗涤两次后加入甲苯结晶得到固体产物,收集固体产物并在真空中干燥至恒重20.00g,产物的纯度为99%(质量分数),产物的产率为92%。
[0071]
本实施例制得的产物含酰胺键脂质的核磁共振氢谱表征结果为:1hnmr(500mhz,cdcl3)δ(ppm)5.57(s,1h),4.61(t,j=5.5hz,1h),4.33(s,2h),3.83-3.47(m,88h)。
[0072]
对比例1
[0073]
使用现有技术中的溴甲基磺酰氟制备n-十四烷基十四酰胺,反应的方程式(方程式中只记录目标产物)如下所示:
[0074][0075]
在室温下,向100ml圆底烧瓶中依次加入碳酸钠(11.0mmol)、乙腈(30ml)、十四酸(10.0mmol)、十四胺(11.0mmol)和溴甲基磺酰氟(10mmol),50℃下反应18h后,减压抽滤,使用乙腈润洗滤饼两次,收集滤液,浓缩滤液并加入硅胶拌样后,使用快速柱色谱分离得到产物,在真空中干燥至恒重1.73g,产物的产率为41%。
[0076]
对比例1制得的产物的核磁共振氢谱表征结果为:1hnmr(500mhz,cdcl3)δ(ppm)5.37(s,1h),3.22(q,j=7.5hz,2h),2.14(t,j=8.0hz,2h),1.47-1.44(m,2h),1.28-1.24(m,44h),0.88(t,j=7.0hz,6h)。
[0077]
从上述实施例结果可以看出,在本发明的合成条件下制得的含酰胺键脂质的产率显著高于对比例条件下的含酰胺键脂质产率。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1