一种马铃薯疮痂病拮抗细菌的分离鉴定及发酵工艺
本发明属于微生物,具体涉及一种马铃薯疮痂病拮抗细菌的分离鉴定及发酵工艺。
背景技术:
1、中国已经成为世界上最大的马铃薯生产国,年产量为9950万吨,产量份额为25.02%,随着种植面积增大,病害发生严重程度也在加重。近年来,马铃薯疮痂病已经日益危害马铃薯产业,在部分地区的发病率已达30%~60%,据报道宁夏马铃薯产业中疮痂病发病率普遍达到1/3以上,在连作地、盐碱地及栽培管理不当地块的发病率达80%以上,该病被认为是马铃薯的“癌症”病害,其防治成为世界性难题。
2、马铃薯疮痂病是由腐生性丝状革兰氏阳性链霉菌疥疮链霉菌streptomycesscabies和其他多种植物致病性链霉菌streptomyces spp.引起的土传兼种传病害,目前已报道的病原有二十多种。该病原菌能通过皮孔、伤口或幼嫩的块茎侵染植物组织,通过产生环二肽导致疮痂病的发生,主要引起部分薯块病斑中央凹陷、四周凸起,形成褐色结痂。化学药剂虽然能短时间控制病害的发生但同时对环境造成高度污染,成本高昂,容易引起植物本身的抗药性。
3、利用生物防治控制马铃薯疮痂病的发生已经成为一种主要手段。其中芽孢杆菌属的细菌具有生长迅速、抑菌广谱,绿色环保、制剂稳定、施用方便等优点。从生态安全考虑,利用微生物防治马铃薯疮痂病是实现马铃薯绿色可持续控制的有效方法,对马铃薯产业健康发展具有重要的意义,本发明旨在提供一种从马铃薯疮痂病发病土壤中进行分离获得的对马铃薯疮痂病具有拮抗性的生防菌,并确定其发酵工艺。
4、从生态安全考虑,利用微生物防治马铃薯疮痂病是实现马铃薯绿色可持续控制的有效方法,对马铃薯产业健康发展具有重要的意义,本发明旨在提供一种从马铃薯疮痂病发病土壤中进行分离获得的对马铃薯疮痂病具有拮抗性的生防菌,并确定其发酵工艺。
技术实现思路
1、基于以上现有技术,本发明从马铃薯疮痂病发病土壤中进行分离,获得对疮痂链霉菌streptomyces scabies x-1具有良好拮抗效果的生防细菌,采用形态学、生理生化以及分子生物学鉴定方法确定菌株的分类地位;通过单因素及正交实验筛选菌株的发酵培养基,优化其发酵条件;借助盆栽实验明确其生防效果,为抑菌机理的研究和生防菌剂的开发奠定基础。
2、为了实现以上目的,本发明采用的技术方案为:
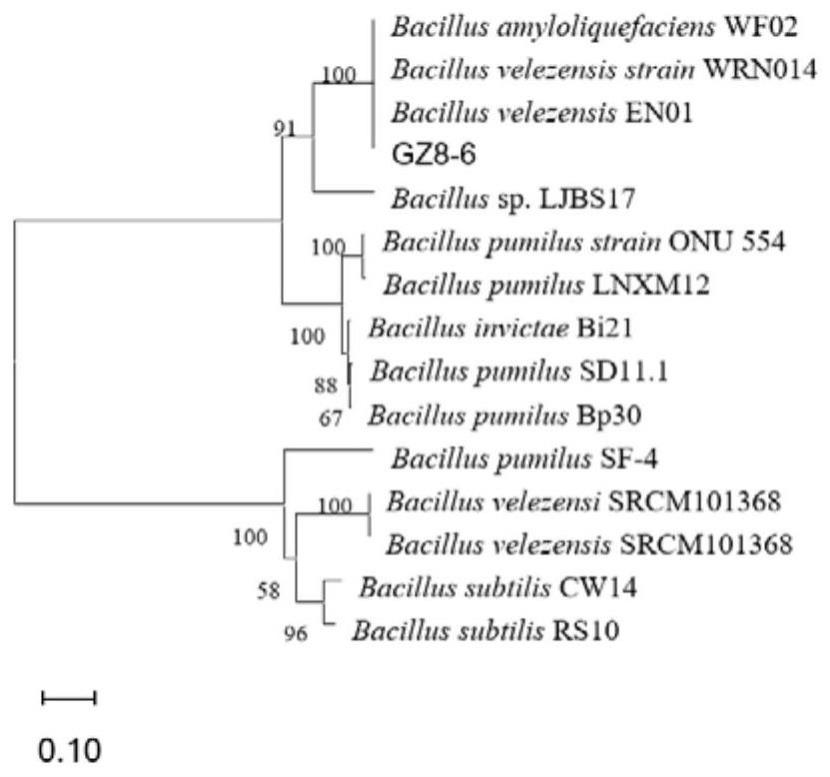
3、一种马铃薯疮痂病拮抗细菌,所述的拮抗细菌为贝莱斯芽孢杆菌gz8-6菌株,分类命名为贝莱斯芽孢杆菌,baciilus velezensis、由中国微生物菌种保藏管理委员会普通微生物中心简称cgmcc、保藏地址是北京市朝阳区北辰西路1号院3号中国科学院微生物研究所、保藏日期2022年9月13日,保藏编号为cgmcc no.25699。
4、一种马铃薯疮痂病拮抗细菌的分离鉴定,包括以下步骤:
5、步骤1、马铃薯疮痂病发病土壤的采集与准备;
6、步骤2、拮抗细菌的分离和筛选;
7、步骤3、拮抗细菌形态学观察;
8、步骤4、拮抗细菌分子生物学鉴定;
9、步骤5、扫描电镜观察拮抗细菌对疮痂链霉菌x-1形态的影响。
10、为了更好的实现本发明,进一步的,步骤1中所述马铃薯疮痂病发病土壤采集自宁夏西吉县、原州区马铃薯疮痂病发病田地,分别标明编号、采地点、采集时间,病样用纸袋分装带回备用。
11、为了更好的实现本发明,进一步的,步骤2中拮抗细菌的分离时使用燕麦琼脂培养基(oma),具体操作为将土样烘干后称取1g,加入9ml灭菌水配成10-4、10-5、10-6、10-7倍稀释液,分别取100μl涂布于oma固体培养基上,每个梯度3次重复,30℃,培养18~24h后挑取不同形态的单菌落进行多次划线培养,得到的纯培养进行斜面保存。
12、为了更好的实现本发明,进一步的,步骤2中拮抗细菌的筛选分为初筛和复筛,其具体步骤为:初筛时使用高氏一号培养基,首先将病原菌疮痂链霉菌x-i菌悬液调至1×108cfu/ml取100μl涂布于高氏一号培养基上,后将分离保存的拮抗菌株活化好后打直径5mm的菌饼接种在上述涂布好的培养基中间,以不接种拮抗细菌为对照,每个处理3次重复,30℃培养5~7d,比对抑菌圈的大小;
13、复筛时使用lb培养基,将初筛有抑菌效果的菌株落置于lb液体培养基30℃,180r/min振荡培养24h后,所得发酵液经10000r/min离心1~2min后取上清液,将无菌牛津杯放置于涂病原菌x-1的高氏一号培养基中,取200μl上清液于牛津杯中,以不接种上清液的培养基作为对照,每个处理3次重复,30℃培养5-7d,测量抑菌圈大小。
14、为了更好的实现本发明,进一步的,步骤3中拮抗细菌的形态学观察时,将筛选出的拮抗细菌在lb固体培养基上划线接种,观察菌落形态,并参照《伯杰细菌鉴定手册》进行鉴定,采用hbi芽孢杆生物鉴定条(hbig14)进行细菌v-p,硝酸盐还原生理生化进行鉴定。
15、为了更好的实现本发明,进一步的,步骤4中拮抗细菌分子生物学鉴定采用solarbio细菌基因组试剂盒(cat#d1600)进行基因组dna的提取,其16s rdna扩增:采用细菌通用引物27f(5′-agtttgatcmtggctcag-3′)和1492r(5′-ggttaccttgttacgactt-3′)进行基因扩增;gyrb扩增:采用引物gyrb-f(5′-gaagtcatcatgaccgttctgcaygcnggnggnaarttyga-3′)和gyrb-r(5′-agcagggtacggatgtgcgagccrtcnacrtcngcrtcngtcat-3′)进行基因扩增;
16、pcr反应体系为:10×pcr buffer、10mmol/ld ntp、5u/μl taq plus dnapolymerase、50mmol/l mgso4共12.5μl,dna模板1.0μl,引物f(10mmol/l)1.0μl,引物r(10mmol/l)1.0μl,加ddh2o 9.5μl到25μl;
17、pcr反应条件:95℃预变性5min,94℃变性30s,57℃退火30s,72℃延伸90s,共30个循环,72℃延伸10min,12℃保存,扩增产物在1.5%琼脂糖凝胶上电泳40min,在凝胶成像系统中拍照。
18、为了更好的实现本发明,进一步的,步骤5中扫描电镜观察拮抗细菌对疮痂链霉菌x-1形态的影响,其步骤为取拮抗菌株与疮痂病病原菌x-1对峙交界处约5mm,贴于盖玻片上制成爬片,30℃培养12h,后将盖玻片取下放入4℃冰箱中用2.5%戊二醛固定1d,后进行电镜扫描。
19、一种马铃薯疮痂病拮抗细菌的发酵工艺,包括以下步骤:
20、(1)种子液制备:挑取筛选的拮抗细菌单菌落接种至lb液体培养基中,180r/min,30℃培养24h;
21、(2)发酵培养:发酵培养基组成为:葡萄糖1.25%,牛肉膏1.00%,kh2po4 1.25%;发酵条件为:初始ph 6.5~8.0,培养温度为25~31℃,初始接种量为4~6%,培养时间为24~32h,转速为140~180rpm,250ml三角瓶装液量为100~150ml。
22、为了更好的实现本发明,进一步的,发酵培养中发酵条件为:初始ph 7.5,培养温度为31℃,初始接种量为6%,培养时间为32h,转速为160rpm,250ml三角瓶装液量为150ml。
23、有益效果
24、本发明的有益效果如下:
25、(1)马铃薯疮痂病病原菌能通过皮孔、伤口或幼嫩的块茎侵染植物组织,通过产生环二肽导致疮痂病的发生,主要引起部分薯块病斑中央凹陷、四周凸起,形成褐色结痂,化学药剂虽然能短时间控制病害的发生但同时对环境造成高度污染,成本高昂,容易引起植物本身的抗药性,本发明分离的菌株为贝莱斯芽孢杆菌,具有生长迅速、抑菌效果优,绿色环保、制剂稳定、施用方便等优点,对生物防治控制马铃薯疮痂病有很好的效果。
26、(2)本发明筛选了174株细菌菌株,通过平板对峙生长法初步筛选获得34个对马铃薯疮痂病菌x-1有明显拮抗作用的菌株,并通过牛津杯试验法对其进一步复筛,筛选出采自原州区张易镇的菌株gz8-6有显著抑制作用,抑菌直径为57.3mm,抑菌率为71.63%,从而可实现利用微生物防治马铃薯疮痂病的有效方法,对马铃薯产业健康发展具有重要的意义。
27、(3)本发明对马铃薯疮痂病拮抗细菌的分离纯化纯度高,鉴定操作简单,准确性高,简便快速;鉴定结果可靠,并开发了发酵工艺,为实现工业化生产生防菌剂打下了基础,在马铃薯的病害防治具有重要的作用。
- 还没有人留言评论。精彩留言会获得点赞!