SlGA2ox基因在调节番茄有毒生物碱含量上的应用
slga2ox基因在调节番茄有毒生物碱含量上的应用
技术领域
1.本发明属于植物基因工程技术领域。具体涉及番茄slga2ox基因在调节番茄甾体生物碱含量降低番茄毒性方面的应用。
背景技术:
2.番茄(solanum lycopersicum l.)属于茄科、番茄属,是一年生或多年生草本植物,原产南美洲,全世界广泛栽培。番茄的果实营养丰富,具特殊风味。番茄中含有大量的次级代谢物,如类黄酮、类胡萝卜素、萜类和生物碱等,其已成为研究植物次生代谢物的模式植物(li y等,microtom metabolic network:rewiring tomato metabolic regulatory network throughout the growth cycle.molecular plant.2020,13(8):1203-1218)。甾体生物碱及其糖基化形式(steroidal alkaloids and their glycosylated forms,sgas)是番茄等茄科植物中产生的一类特殊化代谢产物,对植物病原体和食草动物具有防御作用。迄今为止,在番茄中已经检测到近100种甾体生物碱,其中α-番茄碱(α-tomatine)是叶片、花蕾和绿色果实组织中的主要sga。食物中高浓度的α-tomatine在食用时会引起苦味和喉咙灼热感,同时在番茄中番茄红素的水平增加,会导致毒性表型,如生长迟缓、茎栓化以及叶和果实形态畸变等。因此在果实驯化和育种过程中,选择苦味较低、口感较好、毒性较低、sgas含量较低的番茄果实具有重要意义。(kazachkova,y.等,the gorky glycoalkaloid transporter is indispensable for preventing tomato bitterness.nature plants.2021,7(4):468-480)。
3.α-tomatine是一种在番茄中天然存在的甾体糖苷生物碱,其中四个糖基连接到糖苷配基番茄碱的3-oh基团上。有研究表明,甾体生物碱在番茄果实成熟期间不断变化,在未成熟的绿色果实中为α-tomatine;果实成熟后,α-tomatine的c-23和c-27位被氧化成为番茄皂苷a(esculeoside a);当番茄果实过熟时,番茄皂苷a又转化为孕甾烷糖苷(pregnane glycoside)(c
á
rdenas,pablo d.等,pathways to defense metabolites and evading fruit bitterness in genus solanum evolved through 2-oxoglutarate-dependent dioxygenases.nature communications.2019,10:5169)。番茄的7号和12号染色体上存在含有10个基因的game基因簇,负责将胆固醇(cholesterol)催化为有毒的tomatidine和α-tomatine,之后进一步转化形成无毒的esculeoside a。slgame9是番茄中ap2/erf家族转录因子,其与slgame1和slgame4共表达效果显著,多项转录调控实验均表明slgame9直接或与slmyc2转录因子协同作用结合game系列基因的启动子影响其转录活性,为了解番茄甾体生物碱类化合物的转录调控提供分子基础(c
á
rdenas,pablo d等,game9 regulates the biosynthesis of steroidal alkaloids and upstream isoprenoids in the plant mevalonate pathway.nature communications.2016,7(10654):1-16)。最近的研究表明,活性ja(jasmonate)降低导致sga产生减少,而低水平的ga(gibberellin)导致sga积累增加。myc1和myc2转录因子通过转录激活sga生物合成和ga分解代谢基因来介导ja/ga串扰。这一结果揭示了植物激素在调节sga生物合成以平衡化学防御与植物生长发育中的作用机
制(sayantan,p.等,steroidal alkaloids defense metabolism and plant growth are modulated by the joint action of gibberellin and jasmonate signaling.new phytologist.2022,233:1220-1237)。
技术实现要素:
4.本发明目的在于提供一个调节番茄有毒甾体生物碱含量的基因slga2ox及其应用。
5.本发明的技术方案为:slga2ox基因在调节番茄有毒生物碱含量上的应用,所述slga2ox基因的核苷酸序列如seq id no.1所示。
6.进一步地,所述应用为下调slga2ox基因的表达来降低番茄有毒生物碱的含量。
7.进一步地,所述下调slga2ox基因的表达的方式为基因敲除或基因沉默。
8.进一步地,所述有毒生物碱是指22,26-dihydoxycholeseol、tomatidenol、tomatidine或α-tomatine。
9.与现有技术相比,本发明具有以下效果:
10.通过反向遗传学手段,克隆得到番茄slga2ox基因。激素处理结果表明slga2ox可以响应乙烯前体acc和ga3。通过转基因技术构建超量表达的slga2ox基因植株和slga2ox敲除植株,发现slga2ox基因敲除可以降低番茄中甾体生物碱代谢物的含量,使番茄中有毒的甾体生物碱转变为无毒的甾体生物碱。本发明证实了该基因的生物学功能及应用途径,为番茄育种过程中促进植株发育和降低毒性方面提供重要的参考依据,对于培育高品质的番茄新品种将具有重要的指导意义。
附图说明
11.图1:slga2ox基因在番茄中的表达模式和激素诱导表达谱。图中a为slga2ox基因在番茄不同发育时期的表达量;图中b为在acc和ga3处理后0、2、6、12小时的表达量;nl表示新叶,ml表示成熟的叶,r表示根,s表示茎,if表示未成熟的花,mf表示成熟的花,f1表示直径为1cm的果实、f2直径为2cm的果实、igf表示未成熟青果,mg表示成熟绿果,br表示破色期;br3、7、10表示破色后天数。rf表示红果。结果基于三次重复,误差线代表标准偏差(sd)。
12.图2:slga2ox基因转基因植株的构建及鉴定。图中a为6周龄slga2ox基因超表达材料;图中b为slga2ox基因超表达材料的鉴定;图c为slga2ox基因材料的敲除鉴定结果。结果基于三次重复,误差线代表标准偏差(sd),***表示p value值小于0.001,****表示p value值小于0.0001,两者均表示差异极显著。
13.图3:slga2ox基因超表达植株中甾体生物碱合成通路相关基因表达量,虚线表示其中有步骤省略,实线表示只有一步。结果基于三次重复,误差线代表标准偏差(sd),**表示p value值小于0.01,***表示p value值小于0.001,****表示p value值小于0.0001,三者均表示差异极显著。
14.图4:slga2ox基因超表达植株中甾体生物碱合成通路相关物质含量。结果基于三次重复,误差线代表标准偏差(sd),**表示p value值小于0.01,***表示p value值小于0.001,****表示p value值小于0.0001,三者均表示差异极显著。
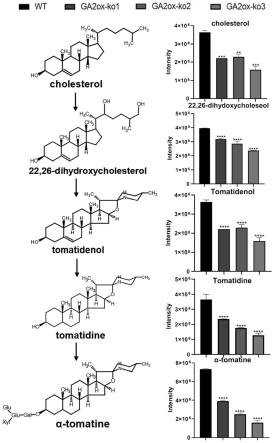
15.图5:slga2ox基因敲除植株中甾体生物碱合成通路相关物质含量。结果基于三次重复,误差线代表标准偏差(sd),**表示p value值小于0.01,***表示p value值小于
0.001,****表示p value值小于0.0001,三者均表示差异极显著。
16.图6:敲除载体ptx41质粒图谱。
具体实施方式
17.以下实施例定义了本发明,并描述了本发明在分离克隆包含有slga2ox基因完整编码区段的dna片段,以及验证slga2ox基因功能的方法。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为从商业渠道购买得到的。
18.所用试剂和培养基的配制:
19.(1)试剂和溶液缩写:本发明中培养基所用到的植物激素的缩写表示如下,kn(kanamycin,卡那霉素);kt(kinetin,激动素);iaa(indole-3-acetic acid,吲哚乙酸);2,4-d(2,4-dichlorophenoxyacetic acid,2,4-二氯苯氧乙酸);as(acetosringone,乙酰丁香酮);dmso(dimethyl sulfoxide,二甲基亚砜);tim(timentin,特美汀);zr(trans-zeatin-riboside,玉米素核苷);iba(3-indolebutyric acid,吲哚丁酸);kh2po4(磷酸二氢钾);ms(murashige&skoog),acc(1-aminocyclopropane-1-carboxylic acid,1-氨基环丙烷-1-羧酸);ga3(gibberellins,赤霉素)。
20.(2)主要溶液配方:
21.1)ms液体培养基的配制
22.ms base salt
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
4.33g;
23.ms vitamin
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0.1031g;
24.蔗糖
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
30g;
25.室温下溶解并用蒸馏水定容至1000ml。
26.2)zr贮存液,iba贮存液为2g/l;iaa贮存液,kh2po4,2,4-d贮存液,kt贮存液为1g/l;tim贮存液为320g/l;kn贮存液为50g/l;as贮存液为200mm/l。均需要过滤灭菌。
27.(3)用于番茄遗传转化的培养基配方
28.1)预/共培养基
[0029][0030]
调节ph值到5.8,定容至1000ml,封口灭菌。
[0031]
2)筛选培养基
[0032][0033]
调节ph值到5.8,定容至1000ml,封口灭菌。
[0034]
3)生根培养基
[0035][0036]
调节ph值到5.8,定容至1000ml,封口灭菌。
[0037]
4)yeb培养基
[0038][0039][0040]
调节ph值到7.4,定容至1000ml,封口灭菌。
[0041]
5)1.5
×
ctab提取液
[0042][0043]
加入ddh2o定容至1000ml。
[0044]
实施例1:分离克隆slga2ox基因鉴定进行表达谱分析
[0045]
为了获得slga2ox基因的编码序列,申请人将已经测序的番茄品种microtom种植一个月后,利用trizol试剂(invitrogen公司)抽提番茄叶片总rna(提取方法根据上述trizol试剂说明书),利用反转录试剂盒supermix(购自北京全式金公司)将rna进行反转录合成cdna,反应条件:42℃30min,80℃5s。以该cdna为模板,用引物slga2ox-f:5
’‑
aaaaagc
aggcttaatgatcaaaatcttaaatctc-3’和slga2ox-r:5
’‑
agaaagctgggtatgtatacgacttttcga-3’进行pcr扩增,得到slga2ox基因的全长编码序列(full length of coding sequence,cds序列)(1140bp,seq id no.1)。pcr反应条件:94℃预变性2min;98℃10sec,60℃30sec,68℃2min,35个循环;68℃延伸5min。
[0046]
取番茄不同发育时期各个组织的rna样和激素处理材料的rna样。激素处理方式为:100μm acc和100μm ga3喷洒6周大的番茄植株,分别在处理0h、2h、6h和12h后取样。按照实施例1中的方法提取rna,进行反转录获得不同样本的cdna,利用sybr定量pcr检测试剂盒(购自vazyme公司)进行检测(使用方法根据上述试剂盒说明书),使用实时荧光定量pcr软件quantstudiotm,以番茄ubiquitin 3基因slubi为内参,检测引物序列为slubi-qrt-f:5
’‑
gccaaagaagatcaagcaca-3’,slubi-qrt-r:5
’‑
tcagcatt agggcactcctt-3’,采用δδct法计算不同样品中slga2ox的相对表达量,使用graphpad prism 8软件处理数据及作图。
[0047]
图1中a图为slga2ox表达谱,表示slga2ox在叶和花中表达较高;图1中b表示slga2ox受acc、ga3诱导,在处理6h内slga2ox表达上升,随后表达下降。
[0048]
实施例2:slga2ox基因转基因材料构建
[0049]
超量表达载体构建方法如下:将扩增获得的pcr产物通过gateway克隆技术的bp反应连入pdonr207入门载体,筛选阳性克隆并测序确认,获得slga2ox基因全长cdna,再通过gateway克隆技术的lr反应连入超量表达载体pbi121,申请人将测序正确的克隆命名为pbi-slga2ox。
[0050]
敲除载体构建方法如下:在slga2ox基因cds序列上设计两个间隔100bp内的敲除靶位点,通过goldengate构建至敲除载体ptx41(sun,cl.等,atranscriptional network promotes anthocyanin biosynthesis in tomato flesh.molecular plant.2020,13(1):42-58),将测序正确的克隆命名为ptx41-slga2ox。
[0051]
将pbi-slga2ox和ptx41-slga2ox用于转化,即通过农杆菌介导的番茄遗传转化体系将其导入到番茄品种microtom中,经过预培养、侵染、共培养、筛选具有卡那霉素抗性的愈伤,分化、生根、移栽、鉴定后得到转基因植株。
[0052]
具体步骤:(1)点种:将番茄品种microtom种子数粒提前泡水中3-4h,再倒掉水加入75%酒精消毒45s,无菌水冲洗五次,加入20% naclo消毒18min(避光),消毒结束用无菌水洗种子五次,每次约浸泡两分钟后倒掉无菌水,稍微吸干水分后转移至萌发培养基1/2ms上进行暗培养;(2)切苗进行预培养:当种子发芽并长到有两片成熟子叶时,用剪刀剪去叶尖和叶基部,将子叶倒扣叶背面朝上铺到预培养基上,避光预培养1-2天左右;(3)农杆菌转化及培养:将构建好的pbi-slga2ox载体加入20μl lba4404感受态细胞(来源于上海唯地生物,商用菌株),置于冰上静置5min,转移至液氮中5min,接着37℃水浴5min,最后冰上静置5min后加入100μl yeb培养基(成分见后),28℃摇床培养1h,菌液涂布至带抗性的yeb平板上,28℃培养1~2天。待出现单菌落后,将菌落转移至yeb液体培养基里,28℃摇床上培养12小时;(4)农杆菌侵染及共培养:使用液体ms培养基调节农杆菌的悬浮液至od600=0.2-0.3,将子叶在农杆菌悬浮液中轻柔振荡培养12-15min,再转移至灭菌好的滤纸上吸干,放置在共培养培养基上暗处培养2天;(5)筛选培养:将共培养基上的子叶转移到筛选培养基上,每两个周更换一次培养基,直至愈伤组织长出不定芽;(6)生根:将长出的不定芽切下,去掉周围所有的愈伤组织,尽量保持完整,转移至生根培养基上(插入培养基)进行生根培
养;(7)移栽:选取长出根的健壮植株,移栽到营养土中,移栽后5天避免水分大量丧失,待植株生长正常后进行鉴定。
[0053]
鉴定具体步骤如下:(1)dna提取:剪下1cm大小左右的叶片,通过ctab法进行dna的提取,首先使用1.5
×
ctab提取液加热提取后,加入氯仿和异戊醇分离有机相,再使用异丙醇沉淀dna后用75%乙醇进行洗涤后即可获得dna溶液;(2)载体转入鉴定:为了验证pbi121超量表达载体和ptx41敲除是否转化进植株,使用载体特异性引物进行pcr扩增鉴定,pcr反应条件:94℃预变性5min;94℃30sec,60℃30sec,72℃1min,35个循环;72℃延伸5min。然后进行琼脂糖凝胶电泳,有相应条带的表示载体转入;
[0054]
有载体转入的材料进一步鉴定,超表达鉴定:rna提取、反转录及实时荧光定量检测:使用实施例2中的rna提取、反转录方法及实时荧光定量检测方法检测转基因植株中slga2ox的相对表达量;敲除鉴定:在靶位点上下游100bp处设计引物,进行pcr扩增,扩增后产物送测序与wt比对鉴定是否有片段缺失、突变。检测结果表明:构建的3株超表达材料表达量均在8~15倍(图2中b),并且转基因成体植株表现矮小表型(图2中a);构建的3株敲除材料均有碱基插入或碱基缺失(图2中c)。
[0055]
实施例3:slga2ox超表达材料中生物碱合成途径相关基因表达量检测
[0056]
以6周龄的t2代超表达材料为样品,取rna样品。rna样品提取和反转录方式同实施例1。以检测转基因材料中已发表的sga生物合成途径的slgames基因的表达量,具体操作同实施例1。图3为番茄中甾体生物碱sgas生物合成途径,其中game7、game6、game11、game4、game12和game25参与了从胆固醇(cholesterol)至具有毒性的番茄碱(tomatidine)的合成,game1、game17、game18、game2以及game5则参与了番茄碱(tomatidine)至番茄中主要的毒性甾体生物碱α-番茄碱(α-tomatine)的过程,而game31和game5负责将α-番茄碱(α-tomatine)转化为无毒七叶皂苷(esculeoside a)。
[0057]
试验结果表明:参与甾体生物碱合成途径的所有基因表达量均有明显上升(图3)。
[0058]
实施例4:slga2ox超表达材料中生物碱合成途径相关物质含量检测
[0059]
同样以6周龄的t2代超表达材料为样品,取代谢样品。代谢样品置于冻干机中冷冻干燥约1周左右,然后使用研磨机研磨成粉末,按照样品:提取液=0.1g:1ml的比例加入70%甲醇,涡旋振荡混匀,放置于冰上,每隔10min涡旋一次,共三次,过夜放置后涡旋,于4℃下以12000rpm离心,吸取上清液进行过滤后即可使用液相色谱-质谱联用仪lc-ms进行检测。试验结果表明,α-tomatine及其上游物质含量明显下升,七叶皂苷含量下降(图4)。
[0060]
实施例5:slga2ox敲除材料中生物碱合成途径相关物质含量检测
[0061]
同样以6周龄的t2代敲除材料为样品,取代谢样品。具体实施同实施例4。检测结果显示,毒性生物碱22,26-dihydoxycholeseol、tomatidenol、tomatidine、α-tomatine含量均明显下降(图5),通过将slga2ox基因敲除可获得低生物碱含量的无毒番茄。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1