一种大鲵水解胶原活性肽的制备方法和应用与流程
1.本发明涉及生物活性肽技术领域,尤其是涉及一种大鲵水解胶原活性肽的制备方法和应用。
背景技术:
2.大鲵(andrias davidianus)属隐鳃鲵科,分布于亚洲,有中国大鲵和日本大鲵两个种。中国大鲵俗称娃娃鱼,取其叫声像婴儿啼哭。大鲵是世界上现存最大的两栖动物。
3.大鲵是一种具有出色再生能力的生物,陕西省动物研究所张红星研究团队发现娃娃鱼“断足再生”现象。这些现象可以为再生医学和组织工程领域提供十分重要的信息,这些生物有助于我们了解组织再生或其他复杂疾病,以便于设计药物用于治疗。
4.截肢后肢体再生的主要阶段可概括为伤口愈合、胚基形成、胚基形成和最终细胞分化以取代所有丢失的细胞类型,成功的无疤痕伤口愈合对于再生的进行是十分必要的。在伤口愈合阶段,细胞从通常称为伤口上皮的远端上皮细胞迁移以闭合伤口。在整个迁移过程中,细胞差异性地调节基因表达并可能开始表达和/或分泌激活周围细胞形成胚基的蛋白质。较早的研究表明,用未受伤的皮肤覆盖伤口会抑制再生过程,这表明响应损伤的基因表达变化对于无疤痕再生过程的进行至关重要。再生过程中形成的伤口上皮被认为是一种特殊结构,因为当角质形成细胞开始迁移时,它们开始产生自己的ecm,主要由层粘连蛋白、iv型胶原蛋白、xii型胶原蛋白、mmp3和mmp9组成(campbell&crews,2008年))。在伤口部位的再上皮化过程中,其他关键过程正在残端组织中推进,例如真皮、肌肉、粘合等残余受伤组织的组织溶解和ecm的重塑。
5.从大鲵组织中挖掘并应有相关的多肽,可发挥组织再生功能具有重要意义。目前,大鲵多肽的制备方法主要包括酸水解、碱水解和酶解法。目前对于大鲵胶原蛋白肽的制备更多的是关注水解产物肽的分子量大小,以期获得分子量更小、利于机体的吸收的胶原蛋白肽,而对于特定功能活性肽则少有关注。例如专利申请cn105018555a公开了一种大鲵皮胶原蛋白肽的制备方法,以大鲵皮为原料,经脱脂、去黑皮和杂蛋白以及高压处理后加入碱性蛋白酶进行酶解,经活性炭脱色,离心、滤膜微滤、超滤膜超滤、纳滤膜纳滤得滤液,将滤液浓缩冻干后得到大鲵皮胶原蛋白肽粉,其制备的胶原蛋白肽分子量小,90%以上分子量小于1000道尔顿,其酶解产物多为混合多肽,具体序列不清楚,且具体功效也不明确。
技术实现要素:
6.本发明的目的在于克服上述现有技术的不足之处而提供一种大鲵水解胶原活性肽的制备方法和应用。
7.为实现上述目的,本发明采取的技术方案为:
8.第一目的,本发明提供了一种大鲵水解胶原活性肽,所述大鲵水解胶原活性肽的氨基酸序列为spprarv(如seq id no:1所示)。
9.本发明分离纯化获得的大鲵水解胶原活性肽可以促进细胞划痕修复和细胞增殖,
将其应用于相关产品,有利于皮肤损伤的修复。
10.第二目的,本发明提供了一种大鲵水解胶原活性肽的制备方法,包括以下步骤:
11.1)将大鲵肽粉用溶剂进行溶解,得到大鲵肽溶液;
12.2)将大鲵肽溶液上样至凝胶层析色谱柱,采用葡聚糖凝胶g15作为分离层析介质,平衡,洗脱,收集样品峰;
13.3)将步骤2)收集的样品进行色谱纯化,分段收集样品;然后进行分子量检测,分析序列,获得大鲵水解胶原活性肽,大鲵水解胶原活性肽的氨基酸序列为spprarv。
14.本发明首次利用凝胶层析色谱柱和制备色谱相结合的方式对大鲵肽粉中的单一多肽进行分离鉴定,成功获得了氨基酸序列为spprarv的大鲵水解胶原活性肽。
15.作为本发明所述大鲵水解胶原活性肽的制备方法的优选实施方式,所述步骤3)中,将步骤2)收集的样品进行色谱纯化,流动相a为水和浓度为0.01%~0.1%的tfa,流动相b为乙腈和浓度为0.01%~0.1%的tfa,流速0.5~1ml/min,检测波长220nm。
16.优选地,所述流动相a为水和浓度为0.05%的tfa,流动相b为乙腈和浓度为0.05%的tfa。
17.作为本发明所述大鲵水解胶原活性肽的制备方法的优选实施方式,所述步骤3)中,使用ab sciex tripletof 5600质谱对样品进行分子量检测,使用岛津全自动蛋白质多肽测序仪(ppsq-33a)对样品进行序列分析。
18.第三目的,本发明提供了一种修饰肽,将上述大鲵水解胶原活性肽经过acssspskhcg、rgdfk、lcle、ctwlky透皮肽中的其中一种修饰获得;所述修饰肽的氨基酸序列为acssspskhcgspprarv(如seq id no:2所示)、rgdfkspprarv(如seq id no:3所示)、lclespprarv(如seq id no:4所示)和ctwlkyspprarv(如seq id no:5所示)中的一种。
19.优选地,所述修饰肽的氨基酸序列为lclespprarv。
20.本发明采用分子模拟对接技术,对该肽进行修饰,修饰得到的多肽具有较好透皮吸收能力和细胞修复能力,可促进细胞划痕修复和细胞增殖,促进ⅰ型胶原蛋白含量增加,适用于皮肤修复和抗衰类医美产品或皮肤损伤修复的药品。
21.第四目的,本发明提供了一种修饰肽的固相合成方法,包括以下步骤:
22.1)以fmoc-l-leu-wang resin为固相合成载体,以fmoc-cys(me)-oh,fmoc-ser(tbu)-oh、fmoc-pro-oh、fmoc-lys(ac)-oh、fmoc-his(bom)-oh、fmoc-glu-oh、fmoc-leu-oh、fmoc-tyr-oh、fmoc-phe-oh、fmoc-arg-oh、fmoc-glu-oh、fmoc-val-oh、fmoc-thr(hpo3bzl)-oh、fmoc-trp(2-me)-oh为合成原料,称取fmoc-l-leu-wang resin浸泡在dmf溶液中,加入含有哌啶的dmf溶液脱保护;加入fmoc-cys(trt)-oh,加入缩合剂dic/hobt反应;
23.2)按照步骤1)依次按照序列c-l-e-s-p-p-r-a-r-v缩合,得到fmoc-缩合肽-l-leu-wang resin;最后用tfa、水、edt、tls配制成混合切割剂,将多肽lclespprarv从fmoc-l-leu-wang resin上切割;
24.3)将步骤2)收集的溶液进行色谱纯化,流动相a为水和浓度为0.01%~0.1%的tfa,流动相b为乙腈和浓度为0.01%~0.1%的tfa,流速0.5~1ml/min,检测波长220nm,收集修饰肽。
25.第五目的,本发明提供了上述修饰肽在制备具有如下任一功能的产品中的应用:
26.(a)促进成纤维细胞增殖;
27.(b)促进成纤维细胞划痕修复活性;
28.(c)促进胶原蛋白合成。
29.作为本发明所述应用的优选实施方式,所述产品为药品或化妆品。
30.第六目的,本发明提供了一种化妆品组合物,所述化妆品组合物包括上述的大鲵水解胶原活性肽或修饰肽,及其化妆品上可接受的载体。
31.所述大鲵水解胶原活性肽或修饰肽与化妆品上可接受的载体的重量比为(1-1000):(1-1000)。例如,重量比为450:1至1:450、400:1至1:400、350:1到1:350、300:1到1:300、250:1到1:250、200:1到1:200、150:1到1:150、100:1到1:100、80:1到1:80、60:1到1:60、40:1到1:40、20:1到1:20、10:1到1:10、8:1到1:8、6:1至1:6、4:1至1:4或2:1至1:2,但不限于此。
32.在上述化妆品中,加入的大鲵水解胶原活性肽或修饰肽的含量为化妆品有效量,术语“化妆品有效量”是指足以实现化妆品组合物的功效的量。
33.所述化妆品组合物可以制备成本领域常规制备的任何剂型,例如溶液、悬浮液、乳液、糊剂、凝胶、霜剂、洗剂、粉剂、肥皂、含有表面活性剂的清洁剂、油、粉底、乳液粉底、蜡粉底和喷雾,但不限于此。例如,可以制备成柔韧乳液、滋养乳液、滋养霜、按摩霜、精华、眼霜、洁面霜、洁面泡沫、洁面水、面膜、喷雾,或冻干粉。
34.第七目的,本发明提供了一种药物组合物,所述药物组合物包括上述的大鲵水解胶原活性肽或修饰肽,及其药学上可接受的载体;所述大鲵水解胶原活性肽或修饰肽与药学上可接受的载体的重量比为(1-1000):(1-1000)。例如,重量比为450:1至1:450、400:1至1:400、350:1到1:350、300:1到1:300、250:1到1:250、200:1到1:200、150:1到1:150、100:1到1:100、80:1到1:80、60:1到1:60、40:1到1:40、20:1到1:20、10:1到1:10、8:1到1:8、6:1至1:6、4:1至1:4或2:1至1:2,但不限于此。
35.所述药学上可接受的载体是制剂中常用的载体,包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露糖醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、明胶、硅酸钙、微晶、性纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆、甲基纤维素、羟基苯甲酸甲酯、羟基苯甲酸丙酯、滑石粉、硬脂酸镁和矿物油中的至少一种。
36.第七目的,本发明提供了上述修饰肽在制备促进透皮吸收制剂中的应用。
37.与现有技术相比,本发明具有以下有益效果:
38.本发明提供了一种大鲵水解胶原活性肽的制备方法和应用,首次利用凝胶层析色谱柱和制备色谱相结合的方式对大鲵肽粉中的单一多肽进行分离鉴定,成功获得了氨基酸序列为spprarv的大鲵水解胶原活性肽。采用分子模拟对接技术,对该多肽进行修饰,获得的修饰肽具有较好透皮能力和的细胞修复能力,可促进细胞划痕修复和细胞增殖,促进ⅰ型胶原蛋白含量增加。适用于皮肤修复和抗衰类医美产品或皮肤损伤修复的药品。
附图说明
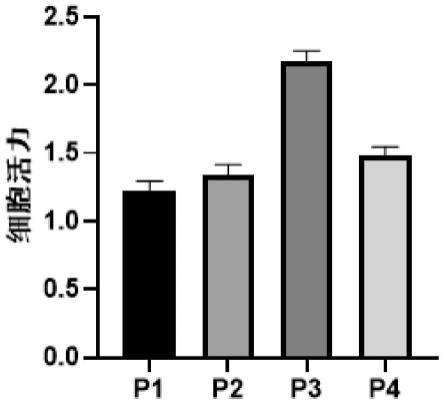
39.图1为p1、p2、p3、p4的细胞活力图;
40.图2为实施例3中不同浓度的修饰肽lv-11对3t3-l1细胞增殖的影响图;
41.图3为实施例3中不同浓度的修饰肽av-18对3t3-l1细胞增殖的影响图;
42.图4为实施例3中不同浓度的修饰肽sv-7对3t3-l1细胞增殖的影响图;
43.图5为实施例3中不同浓度的修饰肽cv-13对3t3-l1细胞增殖的影响图;
44.图6为实施例3中不同浓度的修饰肽rv-12对3t3-l1细胞增殖的影响图;
45.图7为修饰肽lv-11、av-18、sv-7、cv-13和rv-12的体外透皮试验结果图;
46.图8为修饰肽sv-7和修饰肽lv-11对划痕修复的结果图;
47.图9为修饰肽sv-7和修饰肽lv-11的不同基因表达量检测结果图。
具体实施方式
48.为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
49.在以下实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
50.实施例1、一种大鲵水解胶原活性肽的分离筛选
51.具体步骤包括:
52.1、大鲵水解胶原活性肽分离:取新鲜养殖大鲵,取肌肉部位组织,研磨成匀浆,取10g匀浆,加入胰蛋白酶100u、中性蛋白酶100u、碱性蛋白酶100u、胃蛋白酶100u酶解5小时。12000rpm离心30min,取上清。采用unique autoprep高压制备液相色谱仪进行分离纯化,色谱填料unisil 10-120c18,检测波长220nm,流速0.5ml/min,流动相a为乙腈和0.05%三氟乙酸,流动相b为纯化水和0.05%三氟乙酸,采用梯度洗脱。采用0%-100%的流动相a洗脱20min,柱温25℃,自动进样,进样量100ml,根据不同峰收集洗脱液。分别标记为p1、p2、p3、p4。采用超微量分光光度计,检测波长280nm,对不同组分进行定量分析,其中p1 1.51μg/μl、p2 1.75μg/μl、p3 3.25μg/μl、p4 2.57μg/μl。
53.2、多肽筛选:采用小鼠胚胎成纤维细胞3t3-l1细胞,应用cck-8检测受试物的细胞活力,细胞计数后稀释至1
×
105个/ml,在96微孔板中添加细胞悬液进行铺板操作,加样。铺板24
±
1h后,细胞密度达到40-60%使用排枪加入1μg/ml p1、p2、p3、p4,设置溶剂对照,且设置试验孔平行不低于3个。检出加样48h后,去除废液,加入含10% cck-8的dmem,培养1-1.5h后。酶标仪检测。酶标仪设置为∶中速震荡10秒,od450nm进行读数。仪器完成读数后导出文件。计算细胞活力,结果如图1所示,p3组分具有具有较强的促进细胞活力的功效。
54.3、多肽序列鉴定:基于edman降解法的多肽n-端测序分析:采用氨基酸自动测序仪ppsq33a对组分p3进行分析,具体步骤如下:置换buffer,取50μl样品至超滤管中,加入8mol/l urea溶液200μl,于4℃在12000rcf速度下离心10min,并重复操作一次。加入100μl ddh2o,于4℃在12000rcf速度下离心10min,并重复操作一次。上机检测,将置换后的样品溶液滴在膜上,放置到反应器中,组装好反应器后将其放置于仪器固定位置,通过软件ppsq-30analysis设置:样品名称、样品号、测试循环数、选择方法文件,设置完成后开始测试。数据处理,ppsq-33a 产生的原始数据及图谱由ppsq-30dataprocessing软件识别标峰并导出对应图谱。测试品的n端序列为:spprarv(如seq id no:1所示),命名为sv-7(大鲵水解胶原活性肽)。
55.实施例2、大鲵水解胶原活性肽的固相合成方法
56.为了使筛选的大鲵水解胶原活性肽在皮肤中应用中具有较好的透皮吸收性能,使用多种透皮肽对其进行修饰,经多肽疏水性、多肽等电点、结构稳定性等分析,其中
acssspskhcg、rgdfk、lcle、ctwlky等透皮肽与多肽sv-7较为匹配,具有较好的稳定性,与合适的等电点。
57.以下实施例分别合成av-18(acssspskhcgspprarv,如seq id no:2所示),sv-7(spprarv),rv-12(rgdfkspprarv,如seq id no:3所示)、lv-11(lclespprarv,如seq id no:4所示)、cv-13(ctwlkyspprarv,如seq id no:5所示)等修饰肽。
58.具体步骤包括:
59.1、采用x高通量多肽合成仪进行修饰肽合成,根据修饰肽序列在编辑窗口从n端到c端输入氨基酸单字母,所用合成原料为fmoc-ala-wang resin,fmoc-cys(me)-oh,fmoc-ser(tbu)-oh、fmoc-pro-oh、fmoc-lys(ac)-oh、fmoc-his(bom)-oh、fmoc-glu-oh、fmoc-leu-oh、fmoc-tyr-oh、fmoc-phe-oh、fmoc-arg-oh、fmoc-glu-oh、fmoc-val-oh、fmoc-thr(hpo3bzl)-oh、fmoc-trp(2-me)-oh。
60.设置程序如下:dmf溶液中30-60min,充分活化树脂,加入浓度为20%哌啶的dmf溶液脱保护两次(10min、30min)。依次用15ml异丙醇、dmf溶液洗涤树脂fmoc-ala-wang resin三次。在反应体系中加入缩合剂dic/hobt(dic170mmol,hobt 100mmol),按输入序列开始合成。
61.2、合成多肽纯化:合成修饰肽采用unique autoprep高压制备液相色谱仪进行分离纯化,色谱填料unisil 10-120c18,检测波长220nm,流速0.5ml/min,流动相a为乙腈和0.05%三氟乙酸,流动相b为纯化水和0.05%三氟乙酸,采用梯度洗脱。采用浓度为10%-90%的流动相a梯度洗脱20min,柱温25℃,自动进样,收集洗脱峰。
62.纯度检测:
63.高效液相色谱仪(安捷伦1260,配四元泵,自动进样器和vwd检测器);色谱柱为c18色谱柱(4.6mm
×
250mm,5μm);流动相a(0.1%tfa+水),流动相b(乙腈);梯度洗脱,洗脱程序见表1;柱温:30℃;进样量:20μl;流速:1.0ml/min;检测器:vwd检测器,检测波长220nm。
64.表1梯度洗脱程序
[0065][0066][0067]
经检测合成的修饰肽的纯度如下表2所示:
[0068]
表2合成的修饰肽的纯度
[0069]
合成的修饰肽纯度av-18(acssspskhcgspprarv)99.8%sv-7(spprarv)99.5%rv-12(rgdfkspprarv)99.4%lv-11(lclespprarv)99.5%
cv-13(ctwlkyspprarv)98.8%
[0070]
实施例3、细胞毒性测试
[0071]
细胞毒性测试:采用小鼠胚胎成纤维细胞3t3-l1细胞,应用cck-8检测受试物的细胞毒性。
[0072]
体外培养的正常哺乳动物细胞不断地分裂增生,毒性物质不论其作用位点和机制如何,都会干扰细胞的分裂增殖过程,导致细胞生长速率下降和数量减少。cck-8检测试剂中的wst-8被细胞内脱氢酶氧化还原后生成的橙黄色甲能够溶解在培养基中,生成的甲腋物的数量与活细胞数量成正比。最后通过微孔板酶标仪在450nm读取结果后计算细胞存活率。
[0073]
小鼠胚胎成纤维细胞3t3-l1细胞计数后稀释至1
×
105个/ml,在96微孔板中添加小鼠胚胎成纤维细胞3t3-l1细胞的悬液进行铺板操作。铺板24
±
1h后,细胞密度达到40-60%使用排枪加入受试物(lv-11、av-18、sv-7、cv-13、rv-12),使其终浓度为设置浓度,设置溶剂对照,且设置试验孔平行不低于3个。检出加样48h后,去除废液,加入含10% cck-8的dmem,培养1-1.5h后。酶标仪检测。酶标仪设置为∶中速震荡10秒,od450nm进行读数。仪器完成读数后导出文件。计算。受试物的毒性试验中细胞存活率计算∶
[0074][0075]
结果如下:
[0076]
由图2-6可知,修饰肽lv-11在浓度区间为0.10-30μm时对3t3-l1细胞有提升细胞存活率的体现,且与av-18(acssspskhcgspprarv)、sv-7(spprarv)、rv-12(rgdfkspprarv)、cv-13(ctwlkyspprarv)相比,活性更高。
[0077]
实施例4、体外透皮试验
[0078]
具体步骤:
[0079]
透皮实验前,取小鼠,电动剃须刀刮去鼠毛,处死,然后取腹部皮肤,用生理盐水反复冲洗干净,然后将其置于玻璃板,仔细剥下脂肪层,立即进行透皮试验测定。采用改进franz双室渗透扩散装置(扩散面积为3.14cm2,扩散池容积为15ml)。将处理好的离体小鼠皮肤置于水平扩散池结合处,角质层面朝向供给池,并与弹簧夹固定。供给池中加入相应的测试样品。接收池中加入生理盐水,恒速电磁搅拌(200r/min),扩散池夹层水浴温度保持在32℃。在预定的取样时间(2h、4h、6h、8h、10h、12h、24h)从接收池取样1ml,并补充等量的生理盐水,进行hplc含量检测。hplc检测方法如下:
[0080]
高效液相色谱仪(安捷伦1260,配四元泵,自动进样器和vwd检测器);上述制备的修饰肽(纯度≥98%),乙腈(色谱纯,罗恩试剂公司),三氟乙酸/tfa(分析纯,麦克林试剂),实验用水为超纯水。
[0081]
c18色谱柱(4.6mm
×
250mm,5μm);流动相a(0.1%tfa+水),流动相b(乙腈);梯度洗脱,洗脱程序见表3;柱温:30℃;进样量:20μl;流速:1.0ml/min;检测器:vwd检测器,检测波长220nm。
[0082]
表3梯度洗脱程序
[0083][0084]
取上述制备的修饰肽lv-11、av-18、sv-7、cv-13、rv-12按照上述方法进行检测。记录峰面积积分值,计算合成外泌体的含量,带人公式计算累计透过量(qn,μg/cm2)。公式如下:
[0085]
qn=(cn*v+∑ci*vi)/a
[0086]
注:cn第n个时间点吸取液的浓度(mg/l);ci第n-1个时间点吸取液的浓度(mg/l);v接收液的总体积,即15ml;vi每次吸取液体的体积,即1ml;a:接收池的面积,即3.14cm2。
[0087]
参考图7,实验结果表明,与其他修饰肽相比,lv-11具有更好的透皮性能,可促进皮肤吸收。
[0088]
实施例5、细胞划痕实验
[0089]
具体包括以下步骤:通过3t3-l1细胞划痕试验检测了sv-7(spprarv)、lv-11(lclespprarv)对划痕修复的作用,将3t3-l1细胞以2*105个/ml的细胞密度接种于6孔板中,在培养箱中培养24h;用枪头笔直地划一条横线,用pbs洗细胞3次,去掉划下的细胞,加入无血清培养基;分别设立空白对照组和测试组,sv-7(spprarv)、lv-11(lclespprarv)浓度为1μg/ul,放入37℃,5%co2培养箱,培养24h时间点观察拍照。
[0090]
结果如图8所示,lv-11与其他测试组相比具有较好的划痕修复能力。
[0091]
实施例6、基因表达量检测
[0092]
本实施例涉及collagenⅰ(ⅰ型胶原蛋白)、collagenⅲ(ⅲ型胶原蛋白)、elastic(弹性蛋白)、mmp-9(基质金属蛋白酶-9)基因表达量检测。
[0093]
采用rt-pcr法检测hsf细胞中基因转录水平,将对数生长期的3t3-l1细胞以3*105个/孔接种于六孔板,待细胞贴壁24h后,分别将0.39mg/ml sv-7(spprarv)、0.39mg/ml lv-11(lclespprarv)、作用hsf细胞24h。trizol法提取细胞总rna。取1μgrna采用easyscript 5*all-in(100runs)ae341-02试剂盒进行逆转录。以逆转录合成的cdna为模板,进行pcr反应,反应体系如下表4:
[0094]
表4反应体系
[0095]
[0096][0097]
引物序列设计见下表5。反应条件为:94℃预变形30s,94℃变性5s;55℃退火30s;72℃延伸10s,共40个循环。
[0098]
表5引物序列
[0099][0100]
以gapdh为参照基因,采用2^-δδct:进行计算,结果如下图9,lv-11可促进collagenⅰ、collagenⅲ、elastic基因的表达,抑制mmp-9基因的表达。从而促进细胞外基质的生产,抑制胞外基质的降解。
[0101]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1