来源于桦树原料的外泌体及其制备方法与流程
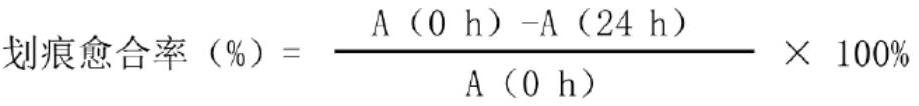
本发明涉及植物外泌体领域,尤其涉及一种来源于桦树原料的外泌体、其制备方法及其用途。
背景技术:
1、桦树为桦木科落叶乔木,由桦树可获得桦树汁、桦树叶、桦树根、桦树皮、桦树干、桦树芽等,其均具有丰富的用途。尤其地,桦树汁为在解冻至早春发叶之间,人工在桦树的树干基部钻孔收集而得的无色透明、无沉淀、无杂质的汁液,其内含糖类、氨基酸、维生素、生物素、微量的矿质元素、芳香油、桦树醇、皂角甙等化合物,具有良好的保湿、抗炎、抗皱、美白等护肤功效。
2、外泌体可以是动物来源的或者植物来源的,这二种来源的外泌体的种属差异很大,且即使同为植物来源的外泌体,不同植物来源的外泌体的功效也完全不同。外泌体具有多种特殊功效。
3、据报道,姜的外泌体样纳米颗粒(gingerexosome-l ike nanopart icles,geln)可被肠道细菌摄取,易被乳杆菌吸收,所含的mirna mirna ath-mir167a下调鼠李糖乳杆菌spac表达,抑制结肠炎。小麦外泌体对内皮细胞、上皮细胞和真皮成纤维细胞具有惊人的促增殖和迁移作用,增加了内皮细胞的管状结构形成,增强伤口愈合相关基因的表达,修饰协调血管的形成,促进伤口愈合。
4、脂质间充质干细胞来源的外泌体可以降低巨噬细胞趋化蛋白(cx3cl1)及肿瘤坏死因子的表达,上调白细胞介素10的表达,降低局部炎症反应,起到免疫调节的作用;骨髓间充质干细胞分泌的外泌体具有保护肾功能的作用,其修复能力与其母体细胞无显著性差异。
5、然而,无论植物来源还是动物来源,获得外泌体的现有技术始终面临组织培养困难、提取成本高、稳定性较差的问题,难以实现最终的产业化和临床应用。例如,在通过免疫亲和捕获法获得外泌体的工艺中,试剂成本高,产率低,且仅适合游离细胞样本。在通过超滤法获得外泌体的工艺中,外泌体损失显著,且需要专门的仪器,提取周期长。
6、目前,桦树原料来源的外泌体及其提取工艺尚未见报道。
技术实现思路
1、一方面,本发明提供一种来源于桦树原料的外泌体,所述外泌体是粒径为约40-400nm、优选约85-350nm、更优选约100-250nm的纳米囊泡。所述纳米囊泡具有不规整的半球形或圆盘形的形貌。
2、另一方面,本发明提供一种从桦树原料制备外泌体的方法,其包括下述步骤:
3、(1)预处理桦树原料,得到预处理液;
4、(2)将所述预处理液进行一次或多次离心处理,得到粗离提取液;
5、(3)将所述粗离提取液进行富集处理,得到外泌体。
6、上述步骤(1)中所述的桦树原料选自桦树汁、桦树叶、桦树根、桦树皮、桦树干、桦树芽、桦树花和桦树愈伤组织,优选地选自桦树汁、桦树叶、桦树根、桦树皮和桦树愈伤组织。
7、所述桦树汁可例如得自芬兰桦树、大兴安岭桦树或小兴安岭桦树等,且所述桦树汁可商购获得,例如可购自大兴安岭超越野生浆果开发有限责任公司。
8、所述桦树叶、桦树皮、桦树根、桦树花、桦树干和桦树芽可例如得自芬兰桦树、大兴安岭桦树或小兴安岭桦树等。
9、所述桦树愈伤组织是指将来源于桦树的细胞和组织等作为外植体进行离体培养,经过诱导、分裂和分化而得的植物培养材料。所述桦树愈伤组织可商购获得,例如购自东北林业大学曾凡锁教授实验室。
10、上述(1)的预处理是常规的,目的是将非液体形式的桦树原料转化为液体混合物,其通常包括:任选地清洗桦树原料以获得干净的桦树原料,破碎桦树原料得到液体破碎混合物,和过滤所述液体破碎混合物以去除其中的不溶物和桦树原料残渣,得到滤液形式的预处理液。当所述桦树原料为桦树汁时,则无需预处理步骤。
11、上述清洗步骤是任选的,当采用桦树汁或桦树愈伤组织时,清洗步骤是不需要的。但当采用桦树叶、桦树皮、桦树根、桦树干、桦树芽和桦树花作为桦树原料时,清洗步骤可能是需要的。清洗步骤是常规的,例如用水和/或超纯水将桦树原料清洗一次或多次,以彻底去除表面的泥土和灰尘等杂质。
12、上述破碎桦树原料的步骤也是常规的,通常采用破碎机进行,例如将清洗过的桦树原料放入破壁机中,向破壁机加入等体积的去离子水和/或者pbs(磷酸盐缓冲液)等缓冲液,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,从而得到液体破碎混合物。
13、上述过滤步骤是常规的,例如使用约9-2000目、优选约9-1000目的膜布将所述液体破碎混合物过滤以除去其中的不溶物和桦树原料残渣等较大固体物质,得到滤液形式的预处理液。
14、上述步骤(2)离心步骤的目的是进一步去除上述预处液中的纤维、细胞和碎屑,其通常包括:首先在400-3000g的离心力和约0-30℃的温度下将所述预处理液离心约5-30分钟;和任选地,将上清液在约10,000-18,000g的离心力和约4-30℃的温度下进一步离心约10-30分钟,得到粗离提取液。任选地,在进行第二次离心之前,可使所述上清液经过约0.2-0.5um的过滤器过滤,以去除较小的污染物。
15、上述步骤(3)富集处理目的是为了得到比较纯净的外泌体,其可采用超速离心法、peg(聚乙二醇)沉淀法、peg/dex(聚乙二醇/葡聚糖)双相沉淀法或密度梯度离心法进行。
16、通过超速离心法进行富集处理的工艺包括:
17、(a)在约0-30℃、优选约4-25℃的温度和100,000-200,000g、优选约100,000-150,000g的离心力下,将所述粗离提取液离心约15-90分钟,然后去除上清液,留下离心沉淀物;
18、(b)任选地,按照约0.1-99%、优选约1-50%的质量/体积比(沉淀物的质量与重悬液的体积之比,下同),将所述沉淀物与重悬液(其通常为水或者诸如pbs的其他缓冲液)混合,在约0-30℃、优选约4-25℃的温度和100,000-200,000g、优选约100,000-15,000g的离心力下进一步离心约15-90分钟,然后去除上清液,得到更加纯净的沉淀物;和
19、(c)按照约0.1-99%、优选约1-50%的质量/体积比,将所述沉淀物与重悬液(其通常为水或者诸如pbs的其他缓冲液)混合,得到外泌体。
20、通过peg沉淀法进行富集处理的工艺包括:
21、(a)按照1:1-10:1、优选约1:1-4:1的体积比,将约10-50%、优选约15-40%的peg溶液与所述粗离提取液混合,和在约0-30℃、优选约0-20℃、最优选2-12℃的温度下沉降过夜,得到沉降液;其中所述peg溶液通常为peg水溶液或peg盐溶液,例如可为peg的氯化钠溶液,例如将约15-40%浓度的peg溶解于约3-30%的氯化钠溶液中获得的peg盐溶液。
22、(b)在约0-30℃、优选约2-25℃、最优选2-12℃的温度和约9,000-20,000g、优选约10,000-15,000g的离心力下,将上述沉降液离心约20-60分钟,然后去除上清液,得到离心沉淀物;
23、(c)任选地,按照约1-70%、优选约5-50%的质量/体积比将离心沉淀物与重悬液(其通常为水或者诸如pbs的其他缓冲液)混合,然后将约10-40%、优选约15-35%的蔗糖溶液加入混合物中,并在约0-30℃、优选约2-25℃、最优选2-12℃的温度和约80,000-150,000g、优选约100,000-120,000g的离心力下离心约30-90分钟;然后去除约70-90%的上清液,用重悬液补足,并在约80,000-150,000g、优选约100,000-120,000g的离心力下进一步离心约30-90分钟,然后去除上清液,得到离心沉淀物;和
24、(d)按照约1-70%、优选约5-50%的质量/体积比,将所述离心沉淀物与重悬液(其通常为水或者诸如pbs的其他缓冲液)混合,得到外泌体。
25、通过peg/dex双相沉淀法进行富集处理的工艺包括:
26、(a)将约2-20%、优选约3-15%的peg与约1-10%、优选约1.5-6%的dex溶于水以得到peg/dex溶液,按约1:1-20:1、优选约1:1-5:1的体积比将peg/dex溶液与所述粗离提取液混合,和在约0-30℃、优选约4-25℃的温度和约400-1,500g、优选约400-1000g的离心力下离心约5-30分钟,以使两相分离;
27、(b)去除上相中约60-95%体积、优选约80-95%体积的液体,然后用peg/dex稀释液(其通过用水将peg/dex溶液稀释至约20-80%、优选20-60%而得到)补足,在约0-30℃、优选约4-25℃的温度和约400-1,500g、优选约800-1000g的离心力下离心约5-30分钟;
28、(c)然后去除75-95%体积的上清液,在约0-30℃、优选约4-25℃的温度,使剩余5-25%体积的液体通过约0.2-0.5um、优选约0.22-0.45um的过滤器以进行过滤,得到外泌体。
29、通过密度梯度离心法进行富集处理的工艺包括:
30、(a)按照约1:1-1:15、优选约1:3-1:10的体积比将约10-50%、优选约15-40%的重水蔗糖与所述粗离提取液混合,和在约0-30℃、优选约4-25℃的温度和约80,000-150,000g、优选约90,000-120,000g的离心力下离心约30-90分钟,然后去除上清液,得到离心沉淀物;
31、(b)按照20-90%的质量/体积比,将所述离心沉淀物和重悬液(其通常为水或者诸如pbs的其他缓冲液)混合,和在约0-30℃、优选约4-25℃的温度和约80,000-150,000g、优选约90,000-120,000g的离心力下离心约30-90分钟,然后去除上清液,留下离心沉淀物;
32、(c)按照20-90%的质量/体积比,将上述离心沉淀物与重悬液(其通常为水或者诸如pbs的其他缓冲液)混合,得到外泌体。
33、通过上述方法获得的外泌体是粒径为约40-400nm、优选约85-350nm、更优选约100-250nm的纳米囊泡。所述纳米囊泡具有不规整的半球形或圆盘形的形貌。
34、所述外泌体具有多种用途,包括例如促进伤口愈合,促进屏障修复,抗衰老,并可调控与神经发育与传导相关的信号通路如突触发生信号通路,调控与炎症相关的信号通路如il-1(白细胞介素1)、1l-6(白细胞介素6)、il-8(白细胞介素8)、tgf-β(转化生长因子-β)信号通路,调控与修复紫外线损伤相关信号通路如mapk(丝裂原活化蛋白激酶)信号通路以及调控脂肪生成相关信号通路。
35、再一方面,本发明涉及一种皮肤外用组合物,其包含上述来源于桦树原料的外泌体。
36、所述外泌体的含量为约0.1-99%,优选为约0.5-98%,更优选为约2-95%,基于所述皮肤外用组合物的总重量。
37、所述皮肤外用组合物包括药物组合物或者化妆品组合物,尤其是化妆品组合物,例如护肤化妆品组合物和抗衰老化妆品组合物。
38、除了所述来源于桦树原料的外泌体外,所述皮肤外用组合物还可以任选地包含(b)皮肤外用组合物中常用的成分,其包括但不限于媒介物、活性成分和辅料等。组分(b)是本领域已知的,本领域技术人员可根据需要选择其类型和用量,例如,组分(b)的含量为约2-82%,基于所述皮肤外用组合物的总重量。
39、所述媒介物包括例如稀释剂、分散剂或载体等,其实例包括但不限于乙醇、双丙甘醇、丁二醇等。所述媒介物在所述皮肤外用组合物中的含量是本领域已知的,例如,其通常占组分(b)总重量的0.5-20%。
40、所述活性成分包括例如润肤剂、保湿剂、美白活性成分、抗衰老活性成分等。
41、所述润肤剂的实例包括但不限于橄榄油、澳洲坚果油、甜杏仁油、葡萄籽油、鳄梨油、玉米油、芝麻油、大豆油、花生油、白池花籽油、红花籽油、狗牙蔷薇果油、刺阿干树仁油、霍霍巴籽油、向日葵籽油、毛瑞榈果油、角鲨烷、棕榈酸乙基己酯、肉豆蔻酸异丙酯、氢化聚异丁烯、异十六烷、异十二烷、碳酸二乙基己酯、碳酸二辛酯、月桂酰肌氨酸异丙酯、异壬酸异壬酯、氢化聚癸烯、甘油三(乙基己酸)酯、鲸蜡醇乙基己酸酯、双-二乙氧基二甘醇环己烷1,4-二羧酸酯、辛酸/癸酸甘油三酯、油醇芥酸酯、辛基十二醇肉豆蔻酸酯、辛基十二醇、聚二甲基硅氧烷、辛基聚甲基硅氧烷、鲸蜡基聚二甲基硅氧烷、环五聚二甲基硅氧烷等的一种或多种。固体润肤剂的实例包括但不限于鲸蜡醇、硬脂醇、鲸蜡硬脂醇、山嵛醇、鲨肝醇、月桂酸、肉豆蔻酸、棕榈酸、硬脂酸、蜂蜡、小烛树蜡、巴西棕榈蜡、羊毛脂、地蜡、霍霍巴籽蜡、石蜡、微晶蜡、氢化米糠蜡、氢化椰油甘油酯类、甘油山嵛酸酯/二十酸酯、肉豆蔻醇肉豆蔻酸酯、双-二甘油多酰基己二酸酯-2、牛油果树果脂、木鲁星果棕籽脂等中的一种或多种。所述润肤剂在所述皮肤外用组合物中的含量是本领域已知的,例如其通常占组分(b)总重量的1-50%。
42、所述保湿剂的实例包括但不限于甘油、双甘油、丁二醇、丙二醇、1,3-丙二醇、双丙甘醇、1,2-戊二醇、聚乙二醇-8、聚乙二醇-32、甲基葡糖醇聚醚-10、甲基葡糖醇聚醚-20、peg/ppg-17/6共聚物、甘油聚醚-7、甘油聚醚-26、甘油葡糖苷、ppg-10甲基葡糖醚、ppg-20甲基葡糖醚、peg/ppg/聚丁二醇-8/5/3甘油、蔗糖、海藻糖、鼠李糖、甘露糖、棉子糖、甜菜碱、赤藓醇、木糖醇、尿素、甘油聚醚-5乳酸酯、透明质酸钠、水解透明质酸钠、乙酰化透明质酸钠、聚谷氨酸钠、水解小核菌胶、出芽短梗酶多糖、银耳多糖、酸豆籽多糖等中的一种或多种。所述保湿剂在所述皮肤外用组合物中的含量是本领域已知的,例如,其通常占组分(b)总重量的1-30%。
43、所述美白活性成分包括但不限于曲酸、抗坏血酸葡糖苷、熊果苷、传明酸、烟酰胺、植物甾醇、植物甾醇/山嵛醇/辛基癸醇月桂酰谷氨酸酯、苯乙基间苯二酚、姜黄根提取物、白桦树皮提取物、神经酰胺2、神经酰胺3、乙酰植物鞘氨醇、白藜芦醇、花榈木树皮提取物、毛喉鞘蕊花根提取物、胡椒籽提取物、泛醌、胆甾醇、胆甾醇硬脂酸酯、抗坏血酸、抗坏血酸二棕榈酸酯、生育酚(维生素e)、生育酚乙酸酯、红没药醇、抗坏血酸四异棕榈酸酯、吡哆素二辛酸酯、吡哆素二棕榈酸酯、视黄醇棕榈酸酯、植物甾醇/辛基十二醇月桂酰谷氨酸酯、双-山嵛醇/异硬脂醇/植物甾醇二聚亚油醇二聚亚油酸酯、植物甾醇澳洲坚果油酸酯、各种肽类、各种植物提取物等中的一种或多种。所述美白活性成分在所述皮肤外用组合物中的含量是本领域已知的,例如,其通常占组分(b)总重量的0.01-30%。
44、所述抗衰老活性成分的实例包括但不限于生育酚(维生素e)、视黄醇、视黄醇棕榈酸酯、水解胶原、水解弹性蛋白、尿囊素、酵母提取物、谷维素、四氢姜黄素、鞣花酸、泛醌、乳清蛋白、多肽、乙酰基六肽-8、棕榈酰五肽-4、水杨酰植物鞘氨醇、浓缩桦树汁、水飞蓟素、蚕丝胶蛋白、生育酚磷酸酯钠、核糖核酸(rna)、二肽二氨基丁酰苄基酰胺二乙酸盐、棕榈酰三肽-5、寡肽-1、六肽-9、棕榈酰寡肽、棕榈酰四肽-7、葡萄(vitis vinifera)籽提取物、花榈木(pterocarpus marsupium)树皮提取物、茶(camellia sinensis)多酚、葡萄酒提取物、苹果籽提取物、欧洲水青冈(fagus sylvatica)芽提取物、水解猴面包树(adansoniadigitata)提取物、卤虫(artemia)提取物、香根鸢尾(iris florentina)根提取物、橙皮苷、人参皂甙、丹参(salvia miltiorrhiza)提取物、烟酰胺、熊果酸、透明质酸钠、乙酰化透明质酸钠、水解透明质酸钠、番茄红素、咖啡(coffea arabica)提取物、二肽-2、乳酸、超氧化物歧化酶(sod)、月见草(oenothera biennis)油、神经酰胺、二棕榈酰羟脯氨酸、羟基硬脂酸、水杨酸、麦角硫因、溶血卵磷脂、肌肽、脱羧肌肽hcl、硫辛酸、腺苷、糖原、白藜芦醇、阿魏酸、二裂酵母发酵产物溶胞物、乳酸菌发酵溶胞产物等中的一种或多种。所述抗衰老活性成分在所述皮肤外用组合物中的含量是本领域已知的,例如,其通常占组分(b)总重量的0.01-10%。
45、所述辅料包括例如乳化剂、增稠剂、防腐剂、香料等。
46、所述乳化剂的实例包括但不限于鲸蜡硬脂醇橄榄油酸酯、山梨坦橄榄油酸酯、聚山梨醇酯-60、聚山梨醇酯-80、甲基葡糖倍半硬脂酸酯、peg-20甲基葡糖倍半硬脂酸酯、peg-40氢化蓖麻油、ppg-26-丁醇聚醚-26、peg-4聚甘油-2硬脂酸酯、peg-60氢化蓖麻油、硬脂醇聚醚-2、硬脂醇聚醚-21、ppg-13-癸基十四醇聚醚-24、鲸蜡硬脂基葡糖苷、peg-100硬脂酸酯、甘油硬脂酸酯、甘油硬脂酸酯se、椰油基葡糖苷、鲸蜡硬脂醇聚醚-25、peg-40硬脂酸酯、聚甘油-3甲基葡糖二硬脂酸酯、甘油硬脂酸酯柠檬酸酯、聚甘油-10硬脂酸酯、聚甘油-10肉豆蔻酸酯、聚甘油-10二油酸酯、聚甘油-10月桂酸酯、聚甘油-10异硬脂酸酯、聚甘油-10油酸酯、聚甘油-10二异硬脂酸酯、聚甘油-6月桂酸酯、聚甘油-6肉豆蔻酸酯、蔗糖硬脂酸酯、蔗糖多硬脂酸酯等中的一种或多种。所述乳化剂在所述皮肤外用组合物中的含量是本领域已知的,例如,其通常占组分(b)总重量的0.5-10%。
47、所述增稠剂的实例包括但不限于卡波姆类、丙烯酸(酯)类及其衍生物、黄原胶、阿拉伯胶、聚乙二醇-14m、聚乙二醇-90m、琥珀酰聚糖、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素等高分子聚合物中的一种或多种。所述增稠剂在所述皮肤外用组合物中的含量是本领域已知的,例如,其通常占组分(b)总重量的0.1-10%。
48、所述防腐剂的实例包括但不限于羟苯甲酯、羟苯丙酯、苯氧乙醇、苯甲醇、苯乙醇、双(羟甲基)咪唑烷基脲、山梨酸钾、苯甲酸钠、氯苯甘醚、脱氢乙酸钠、辛酰羟肟酸、1,2-己二醇、1,2-戊二醇、对羟基苯乙酮、辛甘醇、甘油辛酸酯、十一碳烯酸甘油酯、山梨坦辛酸酯、乙基己基甘油、牡丹根提取物等中的一种或多种。所述防腐剂在所述皮肤外用组合物中的含量是本领域已知的,例如,其通常占组分(b)总重量的0.01-2%。
49、可根据皮肤外用组合物(药物组合物或化妆品组合物)工业中已知的任何方法,将桦树组织外泌体样囊泡与其它药物成分或者化妆品成分混合,得到药物组合物或者化妆品组合物。其中所述其它的药物成分或者化妆品成分如上所述为皮肤外用组合物中常用的成分。
50、根据需要,可以将所述皮肤外用组合物可制成各种剂型,例如溶液、悬浮液、膏、霜、乳液、凝胶、粉末或喷剂等。
51、实施例
52、以下结合实施例,对本发明进行进一步详细说明。但是,应当理解为,这些实施例、对比例仅仅是用于更详细地说明本发明,而不应理解为用于以任何形式限制本发明所附权利要求书的范围。实施例中未注明的具体条件,按照常规条件或制造商建议的条件进行。所用物质未注明制备厂商者,均为可以通过市购获得的常规产品。
53、实施例1:采用超速离心法制备外泌体
54、本实施例中采用芬兰桦树汁作为原料,通过超速离心法制备外泌体,制备步骤如下。
55、(1)预处理桦树原料,得到预处理液
56、将芬兰桦树汁解冻,得到预处理液。
57、(2)将所述预处理液进行离心处理,得到粗离提取液
58、将上述预处理液分装至50ml离心管中,使用离心机(eppendorf,5910r),在25℃和800g的离心力下离心20分钟以去除细胞及碎屑,然后将上清液转移至另一50ml离心管中,配平;
59、使用离心机(eppendorf,5810r),在15000g的离心力和25℃下进一步离心20分钟以进一步去除细胞碎片,然后将上清液转移到另一50ml离心管中,得到粗离提取液。
60、(3)将所述粗离提取液进行富集处理,得到外泌体
61、(a)将上述粗离提取液加入ul tra-clear centr ifuge tubes中,放入吊桶和拧紧吊桶的盖子,在4℃和150,000g的离心下离心60分钟,然后去除上清液以留下离心沉淀物;
62、(b)按照0.1%的质量/体积比,向所述离心沉淀物中加入pbs缓冲液,重复上述超速离心步骤,然后去除上清液,得到更加纯净的离心沉淀物;
63、(c)将0.01g所述离心沉淀物加入1ml的pbs中以进行重悬,并收集至1.5ml的safe-lock tubes中并缠绕封口膜,然后涡旋振荡10分钟以充分混匀并打散聚集状态的外泌体,于-80℃下保存。
64、通过电子显微镜观察到了所得外泌体的形貌,参见附图1。
65、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为151.1nm。
66、实施例2:采用超速离心法制备桦树来源的外泌体
67、本实施例中采用得自东北大兴安岭的桦树叶作为原料,通过超速离心法制备外泌体,制备步骤如下。
68、(1)预处理桦树原料,得到预处理液
69、清洗:将50g桦树叶放入洁净容器中,先用水清洗2遍,再用超纯水清洗1遍以彻底洗净表面的泥土和灰尘。
70、破碎:将清洗过的桦树叶放入破壁机中,再向破壁机加入去离子水和pbs各200ml,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,从而得到液体破碎混合物。
71、过滤:用9目膜布过滤液体破碎混合物,收集滤液至500ml洁净的试剂瓶中,得到预处理液。
72、(2)将所述预处理液进行离心处理,得到粗离提取液
73、与实施例1相同。
74、(3)将所述粗离提取液进行富集处理,得到外泌体
75、与实施例1相同。
76、通过电子显微镜观察了所得外泌体的形貌,参见附图2。
77、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为201.5nm。
78、实施例3:采用超速离心法制备桦树来源的外泌体
79、本实施例中采用得自东北林业大学曾凡锁教授实验室的实验用桦树皮作为原料,通过超速离心法制备外泌体,制备步骤如下。
80、(1)预处理桦树原料,得到预处理液
81、清洗:将10g桦树皮放入洁净容器中,先用水清洗2遍,再用超纯水清洗1遍,以彻底洗净掉表面的泥土和灰尘。
82、破碎:将10g桦树皮放入破壁机中,再向破壁机加入去离子水和pbs各60ml,破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,得到液体破碎混合物。
83、过滤:将溶液用9目膜布过滤,收集滤液至500ml洁净的试剂瓶中,得到预处理液。
84、(2)将所述预处理液进行离心处理,得到粗离提取液
85、与实施例1相同。
86、(3)将所述粗离提取液进行富集处理,得到外泌体
87、与实施例1相同。
88、通过电子显微镜观察了所得外泌体的形貌,参见附图3。
89、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为153.5nm。
90、实施例4:采用超速离心法制备桦树来源的外泌体
91、本实施例中采用得自东北林业大学曾凡锁教授实验室的实验用桦树根作为原料,通过超速离心法制备外泌体,制备步骤如下。
92、(1)预处理桦树原料,得到预处理液
93、清洗:将5g桦树根放入洁净容器中,先用水清洗2遍,再用超纯水清洗1遍,以彻底洗净掉表面的泥土和灰尘。
94、破碎:将5g桦树根放入破壁机中,再向破壁机加入去离子水和pbs各45ml,进行破碎至无明显片状桦树根,而是呈颗粒物和液体的混合物形式,得到液体破碎混合物。
95、过滤:用9目膜布过滤所述液体破碎混合物,收集滤液至500ml洁净的试剂瓶中,得到预处理液。
96、(2)将所述预处理液进行离心处理,得到粗离提取液
97、与实施例1相同。
98、(4)将所述粗离提取液进行富集处理,得到外泌体
99、与实施例1相同。
100、通过电子显微镜观察了所得外泌体的形貌,参见附图4。
101、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为152.2nm。
102、实施例5:采用超速离心法制备桦树来源的外泌体
103、本实施例中采用得自东北林业大学曾凡锁教授实验室的桦树愈伤组织作为原料,通过超速离心法制备外泌体,制备步骤如下。
104、(1)预处理桦树原料,得到预处理液
105、破碎:将8g愈伤组织放入破壁机中,再向破壁机中加入去离子水和pbs各60ml,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,得到液体破碎混合物。
106、过滤:用9目膜布过滤所述液体破碎混合物,收集滤液至500ml洁净的试剂瓶中,得到预处理液。
107、(2)将所述预处理液进行离心处理,得到粗离提取液
108、与实施例1相同。
109、(3)将所述粗离提取液进行富集处理,得到外泌体
110、与实施例1相同。
111、通过电子显微镜观察了所得外泌体的形貌,参见附图5。
112、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为150.4nm。
113、实施例6:采用peg沉淀法制备桦树来源的外泌体
114、本实施例中采用得自东北大兴安岭的桦树汁作为原料,通过peg沉淀法制备外泌体,制备步骤如下。
115、(1)预处理桦树原料,得到预处理液
116、将桦树汁解冻,得到预处理液。
117、(2)将所述预处理液进行离心处理,得到粗离提取液
118、将上述预处理液分装至50ml离心管中,使用离心机(eppendorf,5910r),在25℃和1000g的离心力下离心20分钟以去除细胞及碎屑,然后将上清液转移至另一50ml离心管中,配平。
119、使用离心机(eppendorf,5810r),在10000g的离心力和25℃下离心20分钟以进一步去除细胞碎片,然后将上清液转移到另一50ml离心管中,得到粗离提取液。
120、(3)将所述粗离提取液进行富集处理,得到外泌体
121、(a)将20g的peg6000(s igma 81260)溶于100ml的1m氯化钠溶液中得到peg溶液,将peg溶液与上述粗离提取物按照1:1的体积比混合,和在4℃下沉降过夜,得到沉降液;
122、(b)在4℃和10000g的离心力下离心所述沉降液60分钟,和去除上清液,得到离心沉淀物;
123、(c)按照10%的质量/体积比将所述离心沉淀物与pbs重悬液混合,得到外泌体,于-80℃冰箱中保存。
124、通过电子显微镜观察了所得外泌体的形貌,参见附图6。
125、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为177.1nm。
126、实施例7:采用peg沉淀法制备桦树来源的外泌体
127、本实施例中采用得自东北大兴安岭的桦树叶作为原料,通过peg沉淀法制备外泌体,制备步骤如下。
128、(1)预处理桦树原料,得到预处理液
129、清洗:将20g桦树叶放入洁净容器中,先用水清洗2遍,再用超纯水清洗1遍,以彻底洗净表面的泥土和灰尘。
130、破碎:将清洗过的桦树叶放入破壁机中,再向破壁机加入去离子水和pbs各50ml,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,从而得到液体破碎混合物。
131、过滤:用9目的膜布过滤上述液体破碎混合物,并收集滤液至500ml洁净的试剂瓶中,得到预处理液。
132、(2)将所述预处理液进行离心处理,得到粗离提取液
133、与实施例6相同。
134、(3)将所述粗离提取液进行富集处理,得到外泌体
135、与实施例6相同。
136、通过电子显微镜观察了所得外泌体的形貌,参见附图7。
137、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为338.4nm。
138、实施例8:采用peg沉淀法制备桦树来源的外泌体
139、本实施例中采用得自东北林业大学曾凡锁教授实验室的桦树愈伤组织作为原料,通过peg沉淀法制备外泌体,制备步骤如下。
140、(1)预处理桦树原料,得到预处理液
141、破碎:将8g桦树愈伤组织放入破壁机,再向破壁机中加入去离子水和pbs各60ml,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,得到液体破碎混合物。
142、过滤:用9目的膜布过滤上述液体破碎混合物,并收集滤液至50ml离心管中,得到预处理液。
143、(2)将所述预处理液进行离心处理,得到粗离提取液
144、与实施例6相同。
145、(3)将所述粗离提取液进行富集处理,得到外泌体
146、与实施例6相同。
147、通过电子显微镜观察了所得外泌体的形貌,参见附图8。
148、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为179.0nm。
149、实施例9:采用peg/dex双相沉淀法制备桦树来源的外泌体
150、本实施例中采用购自大兴安岭超越野生浆果开发有限责任公司的桦树汁作为原料,通过peg/dex双相沉淀法制备外泌体,制备步骤如下。
151、(1)预处理桦树原料,得到预处理液
152、将桦树汁解冻,得到预处理液。
153、(2)将所述预处理液进行离心处理,得到粗离提取液
154、将上述预处理液分装至50ml离心管中,使用离心机(eppendorf,5910r),在25℃和800g的离心力下离心20分钟以去除细胞及碎屑,然后将上清液转移至另一50ml离心管中,配平。
155、使用离心机(eppendorf,5810r),在12000g的离心力和4℃下离心20分钟以进一步去除细胞碎片,然后将上清液转移到另一50ml离心管中,得到粗离提取液。
156、(3)将所述粗离提取液进行富集处理,得到外泌体
157、(a)将7%的peg与3%的dex溶于水中得到peg/dex溶液,并按1:1的体积比与所述粗离提取液混合,和在4℃和1000g的离心力下离心10分钟,以使两相分离;
158、(b)去除上相中80%体积的液体,然后用peg/dex稀释液(其通过用水将peg/dex溶液稀释至50%获得)补足,和在4℃和1000g的离心力下离心10分钟;
159、(c)去除90%体积的上清液,使剩余10%体积的液体在25℃下通过0.22um的过滤器以进行过滤,得到外泌体。
160、通过电子显微镜观察了所得外泌体的形貌,参见附图9。
161、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为192.8nm。
162、实施例10:采用peg/dex双相沉淀法制备桦树来源的外泌体
163、本实施例中采用得自东北小兴安岭的桦树叶作为原料,通过peg/dex双相沉淀法制备外泌体,制备步骤如下。
164、(1)预处理桦树原料,得到预处理液
165、清洗:将20g桦树叶放入洁净容器中,先用水清洗2遍,再用超纯水清洗1遍,以彻底洗净表面的泥土和灰尘。
166、破碎:将清洗过的桦树叶放入破壁机中,再向破壁机加入去离子水和pbs各50ml,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,从而得到液体破碎混合物。
167、过滤:用9目的膜布过滤所述液体破碎混合物,并收集滤液至500ml洁净的试剂瓶中,得到预处理液。
168、(2)将所述预处理液进行离心处理,得到粗离提取液
169、与实施例9相同。
170、(3)将所述粗离提取液进行富集处理,得到外泌体
171、与实施例9相同。
172、通过电子显微镜观察了所得外泌体的形貌,参见附图10。
173、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为209.3nm。
174、实施例11:采用peg/dex双相沉淀法制备桦树来源的外泌体
175、本实施例中采用得自东北林业大学曾凡锁教授实验室的桦树愈伤组织作为原料,通过peg/dex双相沉淀法制备外泌体,制备步骤如下。
176、(1)预处理桦树原料,得到预处理液
177、破碎:将5g桦树愈伤组织放入破壁机中,再向破壁机中加入去离子水与pbs各60ml,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,得到液体破碎混合物。
178、过滤:用9目膜布过滤上述液体破碎混合物,并转移至500ml洁净的试剂瓶中,得到预处理液。
179、(2)将所述预处理液进行离心处理,得到粗离提取液
180、与实施例9相同。
181、(3)将所述粗离提取液进行富集处理,得到外泌体
182、与实施例9相同。
183、通过电子显微镜观察了所得外泌体的形貌,参见附图11。
184、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为123.3nm。
185、实施例12:采用密度梯度离心法制备桦树来源的外泌体
186、本实施例中采用得自芬兰的桦树叶作为原料,通过密度梯度离心法制备外泌体,制备步骤如下。
187、(1)预处理桦树原料,得到预处理液
188、清洗:将20g桦树叶放入洁净容器中,先用水清洗2遍,再用超纯水清洗1遍,以彻底洗净表面的泥土和灰尘。
189、破碎:将清洗过的桦树叶放入破壁机中,再向破壁机加入去离子水和pbs各50ml,进行破碎至原料不具有明显形态,而是呈颗粒物和液体的混合物形式,从而得到液体破碎混合物。
190、过滤:用9目的膜布过滤上述液体破碎混合物,并收集滤液至500ml洁净的试剂瓶中,得到预处理液。
191、(2)将所述预处理液进行离心处理,得到粗离提取液
192、将上述预处理液分装至50ml离心管中,使用离心机(eppendorf,5910r),在25℃和800g的离心力下进行离心20分钟以去除细胞及碎屑,然后将上清液转移至另一50ml离心管中,配平。
193、使用离心机(eppendorf,5810r),在12000g的离心力和4℃下离心20分钟以进一步去除细胞碎片,然后将上清液转移到另一50ml离心管中,得到粗离提取液。
194、(3)将所述粗离提取液进行富集处理,得到外泌体
195、(a)按照1:1的体积比将30%的重水蔗糖与所述粗离提取液混合,和在100,000g的离心力和4℃的温度下离心约60分钟,然后去除上清液,留下离心沉淀物;
196、(b)按照20%的质量/体积比,将所述离心沉淀物与pbs混合,和在100,000的离心力和4℃的温度下离心约60分钟,然后去除上清液,留下离心沉淀物;
197、(c)按照20%的质量/体积比,将上述离心沉淀物与pbs混合,得到外泌体。
198、通过电子显微镜观察了所得外泌体的形貌,参见附图12。
199、通过纳米颗粒跟踪分析仪测定,外泌体的平均粒径为185.1nm。
200、实施例13:外泌体在促进伤口愈合和屏障修复中的功效
201、本实施例考察了上述实施例中制备的外泌体在促角质细胞划痕愈合中的作用以评价其促进伤口愈合和皮肤屏障修复功效。
202、检测方法如下。
203、按照以下方法进行分组:
204、模型组:划痕后加入不含血清的dmem(达尔伯克氏改良伊格尔氏培养基)高糖培养基
205、阳性药组:划痕后加入2.5%的fbs(胎牛血清)
206、样品组:划痕后加入各实施例中制备的外泌体样品。
207、细胞种板:将细胞悬液按照1×106个/ml
208、接种于6孔板中,2ml/孔,接种完毕后置于37℃和5%的co2培养箱中培养24小时。
209、划痕及加样:根据预试验的结果,确定试验的受试物浓度范围,试验最高浓度组不得高于最大耐受浓度(mtc)。取出6孔板,弃掉上清液,每孔加入1ml的pbs,用1ml枪头在6孔板底部(细胞贴壁所在面)划二条直线,二条直线间隔约1.5cm,并用pbs洗去悬浮的细胞。模型组加入不含血清的dmem高糖培养基,阳性药组加入2.5%的fbs,样品组加入含不同浓度样品的不含血清的dmem高糖培养基,2ml/孔,加药结束后置于37℃和5%的co2培养箱中培养。
210、拍照:给药后在0和24小时将6孔板中的划痕置于显微镜下拍照,每组选取5个不同的视野,不同时间点选择的视野划痕位置应一致。
211、实验结果与统计:将划痕宽度记为a,划痕愈合率计算公式如下:
212、
213、计算各组试验的平均值(mean)及标准误差(standard deviat ion,sd)。实验数据采用graphpad pr ism 9.0软件进行统计分析,多组间数据使用one-way anova分析,并使用lsd分析进行两两比较,p≤0.05为显著差异,p≤0.01为极显著差异。
214、测定结果如下表1所示。
215、表1
216、 样品名称 划痕愈合率(%) p-value 模型组 40.28±6.625 / 2.5%血清 78.64±7.388 **** 实施例1 56.11±5.360 **** 实施例2 63.38±9.153 **** 实施例3 55.73±5.139 **** 实施例4 53.91±3.394 *** 实施例5 53.99±1.863 *** 实施例6 60.18±2.747 **** 实施例7 65.03±5.071 **** 实施例8 54.63±1.911 *** 实施例9 57.70±2.650 **** 实施例10 60.26±1.837 **** 实施例11 51.81±1.458 **
217、注:*表示与模型组相比,**表示p<0.01,***表示p<0.005,****表示p<0.001。
218、结果表明,与模型组相比,本发明实施例中制备的外泌体能明显提高划痕愈合率,这说明本发明的外泌体具有显著的促进伤口愈合作用及皮肤屏障修复功效。
219、实施例14:外泌体的抗衰老功效
220、本实施例以成纤维细胞为研究模型,采用uva照射建立损伤模型,经外泌体处理后,通过考察胶原和弹性蛋白合成与降解的相关蛋白,从而评价外泌体的紧致抗皱和因此抗衰老的功效。
221、检测方法如下。
222、(1)按照以下方法进行分组:
223、空白对照组:不进行处理。
224、阴性对照组:30j/cm2 uva照射。
225、阳性对照组:30j/cm2 uva照射并加入100ng/ml tgf-β1。
226、样品组:各组对应的实施例中制备的外泌体样品。
227、(2)elas t in、ha、mmp-1、检测
228、接种:按2×105个/孔的接种密度接种细胞至6孔板,在37℃和5%的co2培养箱中孵育过夜。
229、造模:按照分组,待6孔板中细胞铺板率达到40-60%时,进行分组给药,每孔给药量为2ml,每组设3个复孔,在37℃和5%的co2培养箱中孵育24小时。
230、uva辐照:根据试验分组,对有uva照射的组别进行30j/cm2的uva辐照,在37℃和5%的co2培养箱中继续培养24小时。
231、elisa检测:收集细胞培养后的上清液,按照elisa试剂盒说明书进行elisa检测。
232、结果统计分析:应用graphpad pr ism作图,结果表示为mean±sd。
233、(3)胶原检测colⅰ
234、接种:按4×104个/孔的接种密度接种成纤维细胞至24孔板,在37℃和5%的co2培养箱中孵育过夜。
235、造模:根据测试分组,待24孔板中细胞铺板率达到40-60%时,进行分组给药,每组设3个复孔。给药完成后将24孔板放置在37℃和5%的co2培养箱中培养24小时。
236、uva辐照:根据测试分组,对需要辐照的组别进行uva辐照,辐照剂量为30j/cm2。辐照结束后,在37℃和5%的co2培养箱中继续培养24小时。
237、免疫荧光测试:用4%的多聚甲醛对细胞进行固定,固定24小时后,进行col lagenⅰ免疫荧光检测,荧光显微镜拍照并使用image-图像处理软件进行分析。
238、结果统计分析:应用graphpad pr ism作图,结果表示为mean±sd。
239、测定结果如下表2所示。
240、表2
241、
242、
243、注:*表示与模型组相比,*表示p<0.05,**表示p<0.01,***表示p<0.005,****表示p<0.001。
244、结果表明,与模型组相比,本发明实施例中制备的外泌体能显著提高elas t in和ha的表达量,并能够显著降低mmp-1的表达量,这说明本发明的外泌体具有显著的抗衰功效。
245、实施例15:外泌体的mirna测序
246、在该实施例中,对实施例1中制备的外泌体进行microrna(mirna)测序,并对数据进行了分析。
247、查询最主要的已知mirna靶向的mrna,并进行了生物学功能的富集分析。对表达量最高的40个mirna(前40个mirna的总表达量占了样本中已知mirna总表达量的50%)的序列信息进行查询,再用序列信息预测靶向的mrna。top40 mirna对应的靶基因总计2162个,过滤掉出现频率较低(=1次)的靶基因后,分析基因集合的信号通路富集情况。
248、结果如下表3所示。
249、表3
250、
251、
252、基于上述分析结果可以看出,本发明的桦树来源的外泌体显著富集到与神经调控、免疫炎症、细胞生长、细胞衰老、修复紫外线诱导损伤、脂肪生成相关的通路,因此可以预期所述外泌体样囊泡在对应方向具有一定的功效。
253、实施例16:抗衰老面霜组合物
254、所述抗衰老面霜组合物的配方如下表4所示。
255、表4
256、
257、
258、上述抗衰老面霜组合物如下制备:
259、1.油相:将5、7、8、9、10、12、13、14、16号原料加入油相锅,并加热至80℃,溶解,混合均匀;
260、2.将3、17、19号原料在常温下混合均匀;
261、3.将2、11、15、18、21号原料等原料在常温下混合均匀;
262、4.水相:将1、4、6号原料加热到80℃,加入步骤2的混合物,溶解,混合均匀;
263、5.乳化:将水相和油相加入乳化罐中,保温在80℃,在3000rpm速度下均质乳化5分钟,乳化完成后加入20号原料;
264、6.搅拌降温至40℃时加入步骤3的混合物,搅拌均匀后出料,得到所述抗衰老面霜组合物。
265、采用半脸对照的测试方法,在使用产品前和使用产品4周后分别对30名志愿者进行如下测试:
266、1)用primos对志愿者左右两侧外眼角拍照,用软件计算皱纹参数,其中包括皱纹数量、皱纹面积、皱纹深度等;
267、2)用corneometer测试左右两侧眼角的皮肤水分含量。
268、结果表明,30名受试者中有28人眼角皮肤含水量显著增加,其中有25人眼角皱纹明显变浅变淡,皱纹面积和数量均有所减少。
269、实施例17:皮肤屏障/伤口修复乳
270、所述皮肤屏障/伤口修复乳组合物的配方如下表5所示。
271、表5
272、
273、
274、上述皮肤屏障/伤口修复乳组合物如下制备:
275、1.将原料10用原料8分散均匀。
276、2.将原料1、3、4、5、6、7、8、11、12号原料边搅拌边加入乳化罐中,高速均质5分钟,保温在80℃;
277、3.降温至50℃,加入9号原料,慢速均质3分钟。
278、4.搅拌降温至40℃,加入2号原料,搅拌均匀后出料,得到皮肤屏障/伤口修复乳组合物。
279、选择30名肌肤类型为敏感性肌的受试者,采用半脸对照的测试方法,在使用产品前和使用产品4周后分别对30名志愿者进行如下测试:
280、1)用corneometer测试左右脸颊的皮肤水分含量和经表皮失水率(twel)。
281、2)受试者主观评估(干燥、泛红、刺痛)
282、结果表明,上述皮肤屏障/伤口愈合修复乳可以减少敏感肌受试者的经表皮失水,增加皮肤水分含量,减少泛红、刺痛等现象,这表明该修复乳可以促进问题皮肤的修复。
283、以上所述实施例的技术方案是本发明优选实施方式,在不脱离本发明原理的前提下还可以进行若干改进和变换,这些改进和变化也应视为在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!