肿瘤相关抗原DSGb5糖脂的制备方法
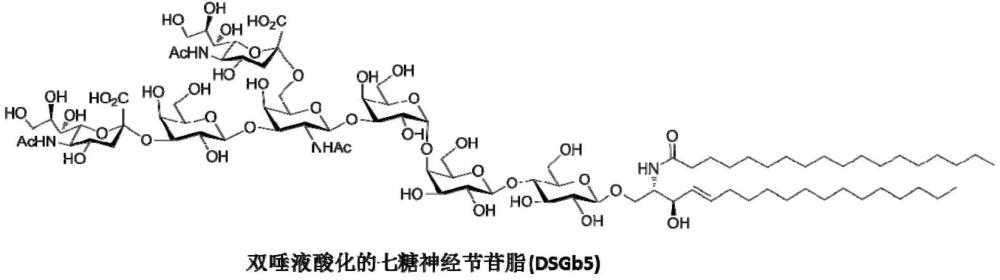
本发明涉及医药领域,具体涉及肿瘤相关抗原dsgb5糖脂的制备方法。作为糖抗原,可应用于肾癌疫苗的开发和肿瘤免疫相关药物的研发。
背景技术:
1、癌症是威胁人类生命健康的重大疾病之一,近年来其发病率和死亡率均呈现渐增的趋势,是当代医学研究的难点。目前癌症的治疗手段主要以减轻患者痛苦、提高患者生存期以及改善患者生活质量为目的,而且抗癌药物的高耐药现象频发。肿瘤疫苗是预防和治疗癌症的有效手段之一,目前已经成为了药物研发的热点。肿瘤相关的糖抗原在肿瘤细胞表面高表达,是开发肿瘤疫苗的有效靶标。双唾液酸化的七糖神经节苷脂(dsgb5)是一种在肾癌细胞组织中过度表达的肿瘤相关抗原,与肾癌细胞的异常增殖和转移有着密切的关系。开发基于dsgb5特异性的抗肿瘤疫苗将有利于恶性肾癌的预防与治疗。由于神经节苷脂的微不均一性和复杂性,直接从癌细胞组织中分离获取组分均一、结构明确、数量充足的dsgb5糖脂非常困难,严重地限制了其在相关疫苗研发方面的应用。
2、
3、dsgb5由亲水的七糖和疏水的神经酰胺脂质连接所组成,其合成极具挑战性。前期的工作多集中在七糖部分的合成,而且相关的生物活性显示,dsgb5的功能是由糖链和脂链部分协同发挥作用的。因为dsgb5糖脂的复杂性,目前仍然没有关于dsgb5糖脂合成的报道。
4、因此,本领域急需提供能够高效合成双唾液酸化的七糖神经节苷脂的制备方法。
技术实现思路
1、本发明的目的是提供一种能够高效合成双唾液酸化的七糖神经节苷脂的制备方法。
2、本发明提供了一种双唾液酸化的七糖神经节苷脂的制备方法,包括步骤:
3、
4、(xii)在α-2,3-唾液酸转移酶cst-i存在下,化合物2和5'-单磷酸腺嘌呤核苷-唾液酸二价盐反应生成化合物3;
5、(xiii)使化合物3与c17h37cor发生酰化反应,生成化合物4,其中,r为cl或-oh;和
6、(xiv)在环糊精和α2,6-唾液酸转移酶st6galnac5存在下,化合物4与5'-单磷酸腺嘌呤核苷-唾液酸二价盐反应得到化合物1双唾液酸化的七糖神经节苷脂dsgb5;
7、
8、在另一优选例中,所述方法还包括步骤:(ix)使化合物5、三氟甲磺酸三甲基硅酯tmsotf和化合物16反应,生成化合物8。
9、在另一优选例中,所述方法还包括步骤:(x)使化合物8部分脱保护,然后与乙酸化试剂反应,得化合物17。
10、在另一优选例中,所述方法还包括步骤:(xi)使化合物17发生脱保护反应得化合物2。
11、
12、在另一优选例中,所述方法还包括步骤:(iv)使化合物12脱保护,然后与苯甲醛二甲基缩醛反应,生成化合物13。
13、在另一优选例中,所述方法还包括步骤:(v)使化合物13与2-(溴甲基)萘napbr反应,生成化合物14。
14、在另一优选例中,所述方法还包括步骤:(vi)使化合物14部分脱保护,然后与苯甲酰氰反应,生成化合物7。
15、在另一优选例中,所述方法还包括步骤:(vii)使化合物6与化合物7反应,生成化合物15。
16、在另一优选例中,所述方法还包括步骤:(viii)使化合物15部分脱保护,生成化合物16。
17、
18、在另一优选例中,所述方法还包括步骤:(i)使化合物9与乙酰化试剂反应,生成化合物10;较佳的,所述乙酰化试剂为乙酸酐或乙酰氯。
19、在另一优选例中,所述方法还包括步骤:(ii)使化合物10与hbr的乙酸溶液反应,生成化合物11。
20、在另一优选例中,所述方法还包括步骤:(iii)在2,6-二甲基吡啶存在下,化合物11发生反应,生成化合物5。
21、
22、在另一优选例中,所述方法还包括步骤:所述环糊精选自α-环糊精、β-环糊精、γ-环糊精、羟丙基-γ-环糊精、羟丙基-β-环糊精、磺丁基-β-环糊精钠、甲基化-β-环糊精,或其组合,优选甲基化-β-环糊精。
23、在另一优选例中,步骤(xii)包括一个或多个下述特征:
24、所述反应在ph7-8的缓冲溶液中进行,优选地,如hepes缓冲液、tris-hcl缓冲液;
25、所述5'-单磷酸腺嘌呤核苷-唾液酸二价盐为钠盐或钾盐;
26、所述反应的温度为37±5℃,较佳的,37±2℃,更佳的37±1℃;
27、α-2,3-唾液酸转移酶cst-i的使用浓度为50-200μg/ml;较佳的80-120μg/ml;和/或
28、化合物2和5'-单磷酸腺嘌呤核苷-唾液酸二钠盐的当量比为1:1-2;较佳的1:1.2-1.5。
29、在另一优选例中,步骤(xiii)包括一个或多个下述特征:
30、所述反应溶剂选自下组:thf、h2o、或其组合;
31、所述酰化反应在缚酸剂存在下反应,如选自下组的缚酸剂:nahco3、khco3、na2co3、k2co3,或其组合;
32、所述反应的温度为25±15℃,较佳的,25±10℃,更佳的25±5℃;和/或
33、化合物3与c17h37cor的当量比为1:1-2;较佳的1:1.2-1.5。
34、在另一优选例中,步骤(xiv)包括一个或多个下述特征:
35、所述反应在ph6.5-8的缓冲溶液中进行,较佳的ph6.8-7.4,如hepes缓冲液、tris-hcl缓冲液;
36、所述反应的温度为37±5℃,较佳的,37±2℃,更佳的37±1℃;
37、α2,6-唾液酸转移酶st6galnac5的使用浓度为5-100μg/ml;较佳的10-50μg/ml;和/或
38、化合物4和5'-单磷酸腺嘌呤核苷-唾液酸二钠盐的当量比为1:1-2;较佳的1:1.2-1.5。
39、在另一优选例中,步骤(ix)包括一个或多个下述特征:
40、所述反应在分子筛存在下反应;如na2o·al2o3·2sio2·9/2h2o;
41、所述反应溶剂选自下组:甲苯、二氯甲烷、三氯甲烷、或其组合;
42、所述反应的温度为0±10℃,较佳的,0±5℃,更佳的0±2℃;和/或
43、化合物16与化合物5的当量比为1:1-2;较佳的1:1.2-1.5;和/或
44、化合物16与tmsotf的当量比为1:0.1-1;较佳的1:0.2-0.5。
45、在另一优选例中,步骤(x)包括如下步骤:
46、(x-1)化合物8在氢氟酸吡啶溶液中反应,得中间体8-1;
47、(x-2)在碱存在下(如naoh、koh,或其组合)中间体8-1反应后并中和生成中间体8-2;和
48、(x-3)使中间体8-2与乙酰化试剂反应,从而得化合物17。
49、在另一优选例中,步骤(xi)包括如下步骤:
50、(xi-1)在2,3-二氯-5,6-二氰对苯醌ddq存在下,化合物17反应得一中间体17-1;和
51、(xi-2)在1,3-丙二硫醇、吡啶和水的存在下,中间体17-1反应得化合物2。
52、在另一优选例中,步骤(iv)包括如下步骤:
53、(iv-1)在碱(如naoh、koh,或其组合)存在下,化合物12脱保护生成中间体12-1;和
54、(iv-1)在樟脑磺酸csa存在下,中间体12-1与苯甲醛二甲基缩醛反应,生成化合物13。
55、在另一优选例中,步骤(v)包括如下步骤:在nah存在下,使化合物13与2-(溴甲基)萘napbr反应,生成化合物14。
56、在另一优选例中,步骤(vi)包括如下步骤:
57、(vi-1)将化合物14溶于dcm、tfa和h2o(体积比(8-12):(0.5-2):1,较佳地10:1:1)的混合溶液中,化合物14脱保护生成中间体14-1;和
58、(vi-1)在碱(如二乙胺、三乙胺、二甲胺、三甲胺,或其组合)存在下,中间体14-1与苯甲酰氰反应,生成化合物7。
59、在另一优选例中,步骤(vii)包括一个或多个下述特征:
60、所述反应在分子筛存在下反应;如na2o·al2o3·2sio2·9/2h2o;
61、所述反应溶剂选自下组:甲苯、二氯甲烷、三氯甲烷、或其组合;
62、所述反应的温度为0±10℃,较佳的,0±5℃,更佳的0±2℃;和/或
63、化合物7与化合物6的当量比为1:1-3;较佳的1:1.5-2.5;和/或
64、化合物7与tmsotf的当量比为1:0.1-0.5;较佳的1:0.2-0.3。
65、在另一优选例中,步骤(viii)包括:(viii)在醋酸肼存在下,化合物15部分脱保护,生成化合物16。
66、在另一优选例中,步骤(i)包括一个或多个下述特征:
67、所述乙酰化试剂为乙酸酐或乙酰氯;
68、所述反应在4-二甲氨基吡啶dmap存在下进行;
69、所述反应溶剂为吡啶;和/或
70、所述反应的温度为25±10℃,较佳的,25±5℃,更佳的25±2℃。
71、在另一优选例中,步骤(ii)包括一个或多个下述特征:
72、溴化氢醋酸溶液中溴化氢浓度为30-35wt%;
73、所述反应溶剂选自下组:甲苯、二氯甲烷、或其组合。
74、在另一优选例中,步骤(iii)包括一个或多个下述特征:
75、所述反应溶剂选自下组:乙腈、乙醇、或其组合;
76、所述反应的温度为25±10℃,较佳的,25±5℃,更佳的25±2℃;和/或
77、化合物11与2,6-二甲基吡啶的当量比为1:1-3;较佳的1:1.5-2。
78、应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
- 还没有人留言评论。精彩留言会获得点赞!