cd164融合蛋白及其应用
1.本技术是2021年11月8日提交的发明名称为“cd164融合蛋白及其应用”的申请号为202180009089.6的中国发明专利申请的分案申请。
2.发明背景
3.细胞表面粘蛋白是大型跨膜糖蛋白,参与保护呼吸道上皮免受病原感染,调节细胞信号转导和转录。与大型粘蛋白不同,cd164包含长度小于60个氨基酸的小粘蛋白结构域。截至目前,cd164中粘液蛋白结构域功能并未明确。缺失cd164基因的小鼠均存活,无明显表型。人cd164是一种具有粘附性的唾液化粘蛋白样的膜蛋白。它是一种i型膜蛋白,在组织中几乎无处不在,主要位于细胞内的核内体和溶酶体内(ihrke 2000,chan 2000)。功能分析表明,cd164可能在cd34+细胞对接骨髓基质组织过程中起辅助作用。cd164包含两个粘蛋白结构域(i和ii),由一个富含半胱氨酸的非粘蛋白结构域连接,接着是一个跨膜结构域和一个胞内结构域(doyonnas 2000)。cd164的粘蛋白结构域i由37个氨基酸组成,理论上可在3个n-链糖基化位点和9个o-链糖基化位点上翻译后修饰。
4.几种抗粘蛋白结构域i的单克隆抗体可结合糖表位,阻止cd34+细胞附着在骨髓基质网织细胞上。cd164去唾液酸后,可减少cd34+细胞的附着,因此,像唾液酸修饰这样的末端糖基化可能对维持cd34+细胞的“干细胞样”特征很重要(doyonnas 2000)。此外,cd164可能参与cxcr4信号相关的迁移反应(f或des 2007)。在另一种检测系统中,转染293t细胞产生的cd164 fc融合蛋白,可抑制响应分化信号的多核肌管的形成(lee等人,2001)。
5.在所有情况下,cd164的功能对唾液酸酶或o-糖肽酶的处理均敏感,表明cd164的糖基化修饰是其介导细胞间信号转导结合所必需。
6.人cd164粘蛋白结构域ii由56个氨基酸组成,理论上可在2个n-链糖基化位点和23个o-链糖基化位点上形成翻译后修饰。没有证据表明cd164粘蛋白结构域ii的表位参与功能结合。相反,cd164转录本分析发现,缺失外显子4或外显子5的剪接变异体,移除了大部分cd164粘蛋白结构域ii,但并未影响cd164的功能(chan 2001)。因此,cd164的粘蛋白结构域ii形成一个刷状茎,支撑由cd164粘蛋白的结构域i和半胱氨酸富集区组成的冠状结构,参与细胞间的相互作用。
7.cd164粘蛋白结构域i和ii之间的半胱氨酸富集区含52个氨基酸,其中8个半胱氨酸残基可形成二硫键桥。该结构域还包含4个假定的n-连接的糖基化位点,以及可能附加的o-糖基化位点。
8.总的来说,如果cd164完全糖基化,其糖基化可以贡献70%的分子质量。从人骨髓细胞、cd34+纯化的脐血细胞、或培养的骨髓基质网状细胞中,可以观察到90kda的糖基化cd164,证实在成熟形态的人cd164的174个氨基酸残基的多肽中具有明显糖基化修饰(doyonnas 2000)。
9.发明概述
10.本发明的一个方面是提供了一种融合蛋白,包括:(1)一种多肽,其包含的氨基酸序列与序列seq id no:1或2至少有90%的一致,(2)异源多肽。
11.在某些实施例中,该多肽由编号为seq id no:1或2的氨基酸序列组成。
12.在某些实施例中,(1)是(2)的c-端。在本案例中,(1)是seq id no:2
13.在某些实施例中,(1)是(2)的-n端。在本案例中,(1)是seq id no:1
14.在某些实施例中,融合蛋白进一步包括(3),一个第二种多肽,包含的氨基酸序列与序列seq id no:1或2至少有90%的一致性,其中(1)和(3)分别包含seq id no:1或2中的不同序列。
15.在某些实施例中,seq id no:1多肽是与异源多肽的n端融合,seq id no:2的多肽与异源多肽的c端融合。
16.在某些实施例中,所述异种多肽是一种治疗多肽。
17.在某些实施例中,治疗性多肽的(人或小鼠)血清或循环半衰期至少比融合蛋白的半衰期短10%、20%、30%、40%、50%、60%、70%、80%、85%、90%或95%。
18.在某些实施例中,异源多肽包括成纤维细胞生长因子21(fgf21)、促卵泡激素(fsh)、髓源性生长因子(mydgf)、成纤维细胞生长因子结合蛋白3(fgfbp3)、利钠肽b、肠促胰酶肽、胰高血糖素样肽1(glp-1)、促性腺激素释放激素、肠促胰液素、亮乳素、恩福维肽、胰高血糖素、双伐卢定、血清激素、促肾上腺皮质激素四肽、胰岛素样生长因子(igf)、甲状旁腺激素或胰淀素。
19.融合蛋白包括o和/或n链糖基化。
20.在某些实施例中,融合蛋白包括唾液化。
21.在某些实施例中,融合蛋白还包括(1)和(2)之间的连接肽。
22.在某些实施例中,融合蛋白中(1)是(2)的c-端,(1)可以是seq id no:2,异源多肽为mydgf或其功能片段。
23.在某些实施例中,融合蛋白的氨基酸序列与seo id nos:3-8的任何一个氨基酸序列至少有90%的一致性。
24.在某些实施例中,融合蛋白的氨基酸序列为seq id no:3。
25.本发明的另一方面提供了编码本发明中融合蛋白的多核苷酸。
26.在某些实施例中,多核苷酸经密码子优化后在目标宿主细胞中表达。
27.在某些实施例中,目标宿主细胞是人类细胞、啮齿动物细胞(如小鼠细胞)或非人类哺乳动物细胞。
28.本发明的另一方面提供了包含本发明中的多核苷酸的载体。
29.在某些实施例中,所述载体为表达载体。
30.在某些实施例中,载体是质粒。
31.本发明的另一方面提供了包含本发明中融合蛋白、本发明中多核苷酸、或本发明中载体的宿主细胞。
32.在某些实施例中,宿主细胞是组织培养细胞。
33.在某些实施例中,宿主细胞是cho k-1细胞(atcc#ccl61)或cho dg44细胞或cho dxb-11细胞、namalwa细胞(e.g.,atcc#crl-1432)、hela细胞(atcc#ccl-2)、hek293细胞(atcc#ccl-1573)、wi-38细胞(atcc#ccl-75)、mrc-5细胞(atcc#ccl-171)、hepg2细胞(atcc#hb-8065)、3t3细胞(atcc#ccl-92)、l-929细胞(atcc#ccl-1),myeloma(e.g.,ns/o)细胞、bhk-21细胞(atcc#ccl-10)、cos-7细胞(atcc#ccl-1651)或vero细胞(atcc#ccl-81)或其衍生物。
34.在某些实施例中,宿主细胞为cho k-1细胞(atcc#ccl61)或其衍生物,或hek293细胞(atcc#ccl-1573)或其衍生物。
35.本发明的另一方面提供了一种药物组合物,包括本发明中的融合蛋白的治疗有效量、本发明中的多核苷酸或本发明中的载体,以及药物上可接受的添加剂或赋形剂。
36.在某些实施例中,配制该药物组合物可用于静脉注射。
37.本发明的另一方面提供了一种延长蛋白质的血清/循环半衰期的方法,包括将蛋白质融合到与seq id no:1或2氨基酸序列至少具有90%同源性的多肽。
38.在某些实施例中,该多肽由seq id no:1或2的氨基酸序列组成。
39.在某些实施例中,该蛋白融合在seq id no:2的n-端。
40.在某些实施例中,蛋白质通过连接肽与多肽融合。
41.本发明的另一方面,提供了一种在有需求的受试者上治疗疾病、紊乱或非健康状态的方法,该方法包括给予受试者有效剂量的本发明的融合蛋白、本发明的多核苷酸或本发明的载体,其中所述疾病、紊乱或非健康状态可通过所述异源多肽治疗。
42.在某些实施例中,疾病、紊乱或非健康状态是从包含组织损伤、心血管疾病、炎症疾病或紊乱和肾脏疾病的疾病组别中选取的。
43.在某些实施例中,组织损伤是一种急性损伤,如心肌梗死或卒中。
44.在某些实施例中,组织损伤是一种慢性损伤,如糖尿病对肾脏的损伤。
45.在某些实施例中,心血管疾病是从心肌梗死、动脉硬化、高血压、心绞痛、高脂血症、心力衰竭的组别中选取的。
46.在某些实施例中,炎症性疾病或紊乱从i型糖尿病、ii型糖尿病、胰腺炎、非酒精性脂肪性肝病(nafld)和非酒精性脂肪性肝炎(nash)中选取。
47.在某些实施例中,疾病或紊乱是一种肾脏疾病。
48.在某些实施例中,受试者是人类。
49.附图简要说明
50.图1为cd164粘蛋白结构域融合蛋白糖基化形式的western blot检测结果。mydgf-164和fgf21-164在293f细胞中表达。收集细胞培养上清,进行sds-page和western blot分析。“r”表示dtt还原性样本。
51.图2是融合到cd164粘蛋白结构域的天然糖基化蛋白的western blot检测结果。164-fsha或fsha,以及fshb-164或fshb),以及它们各自的异源二聚亚基,稳定地转染到cho细胞。非还原(nr)和还原(r)样品均采用sds-page和western blot检测。对293f细胞表达的fgfbp3-164进行了同样的分析。
52.图3a和3b显示了纯化后的mydgf-164融合蛋白经sds-page后的考马斯亮蓝染色分析(图3a)或rp-hplc分析(图3b)。
53.图4显示了在293细胞表达的mydgf-164融合蛋白为酸性形式。纯化的mydgf-164融合蛋白(样本a001)通过等电聚焦(ief),并根据邻近泳道的pi标准品进行分析,mydgf-164融合蛋白主要亚型等电点低于5.1。
54.图5为单糖组成分析,表明mydgf-164融合蛋白中的glcnac:galnac:gal:man:fuc为7:5:11:2:1。mydgf-164融合蛋白中含有大量半乳糖,表明其含有o-聚糖和n-聚糖。
55.图6为β-消除分析,mydgf-164融合蛋白中o-聚糖的含量远高于n-聚糖。
56.图7是经过pngase处理和2-ab标记后,mydgf-164融合蛋白n-链聚糖衍生物的uplc特征峰。不同峰的洗脱时间以分钟表示。与峰相对应的不同糖链用糖的象形符号表示。
57.图8为uplc对mydgf-164融合蛋白中唾液酸含量及种类的分析。mydgf-164融合蛋白中含有6.6%的neu5ac。
58.图9为mydgf-164融合蛋白的maldi-tof质谱。m+:单质子峰。m2+:双质子峰。
59.图10a和10b为纯化的mydgf-164融合蛋白(图10a)和标准蛋白(图10b)的sec-hplc分析。标准蛋白(甲状腺球蛋白:670000;γ球蛋白:150000;卵白蛋白:45000;肌红蛋白:17000;血管紧张素:1000)的分子量(mws)与洗脱时间对应,使用非线性回归模型拟合(r2=0.99898)。mydgf-164融合蛋白的流体动力学半径为98.744kda。
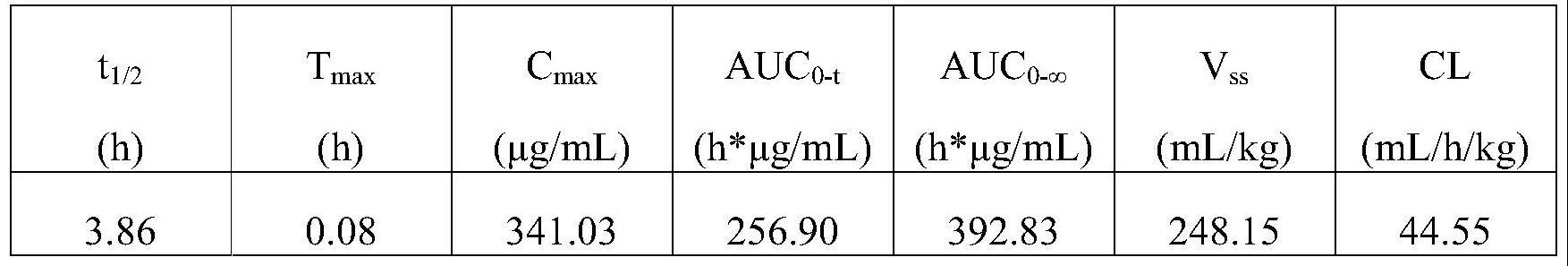
60.图11为纯化的mydgf-164融合蛋白静脉注射到c57bl/6小鼠的药代动力学(pk)分析。采用lc-ms/ms分析血清中mydgf-164融合蛋白的浓度。
61.图12显示,mydgf-164融合蛋白与5%胎牛血清(fbs)共孵育时,促进huvec细胞增殖。在5%胎牛血清中的huvec细胞中添加mydgf-164,huvec细胞的增殖呈现剂量依赖效应。使用单因素方差分析:***p《0.001,**p《0.01,*p《0.05。
62.图13显示mydgf-164融合蛋白促进1%胎牛血清中huvec的细胞周期活性(左)。不同细胞周期的细胞比例如图(右)所示。使用单因素方差分析:***p《0.001,**p《0.01,*p《0.05。
63.图14为划痕修复分析,说明mydgf-164增强了细胞迁移。机械划伤单层huvec细胞,通过细胞迁移修复划痕。在不同浓度的mydgf-164或100ng/ml vegfa的存在下,测试单层内皮细胞划痕修复。分别于0、12和24小时采集单层huvec细胞图像。使用image-pro-plus软件分析迁移速率。迁移速率定义为变化面积/伤口面积。使用单因素方差分析:***p《0.001,**p《0.01,*p《0.05。
64.图15表明mydgf-164或100ng/ml vegfa孵育4小时后,huvec细胞在低生长因子的基质胶中的成管增强。内皮细胞管型被定义为内皮细胞包围的圆形结构,封闭管数为内皮管数量。使用单因素方差分析:***p《0.001,**《0.01,*p《0.05。
65.图16显示mydgf-164降低了过氧化氢诱导的huvec细胞凋亡。以1μg/ml mydgf-164预孵育huvec细胞24小时,再以400μmol/l过氧化氢处理。annexin v-fitc及碘化丙啶染色,流式细胞术检测细胞凋亡或细胞死亡。使用单因素方差分析:***p《0.001,**《0.01,*p《0.05。
66.图17a和图17b描绘了在大鼠心肌缺血模型中测试mydgf-164保护功能的实验计划的示意图。在第一次缺血实验计划(图17a)中,在再灌注5分钟前和4小时后静脉注射mydgf-164,然后连续7天每天两次静脉内注射,之后处死大鼠,评估大鼠的心脏梗塞面积。使用阻止血小板聚集的gp iib/iiia受体的非肽拮抗剂替罗非班作为阳性对照。在第二个缺血实验计划中(图17b),在再灌注同时静脉注射mydgf-164,然后在再灌注6和12小时后两次静脉内注射mydgf-164,并在24小时后分析梗塞面积。在两个实验计划中,分析作为心肌损伤的生物标志物的心肌肌钙蛋白i(ctni)。
67.图18a和图18b可重复地显示在由两个不同研究组织进行的两个独立实验中,mydgf-164减少心肌梗塞标志物心肌钙蛋白i含量。使用的阳性对照是抗血小板药物替罗非班。在mydgf-164处理的大鼠中ctni的释放降低至假手术大鼠的水平。使用双因素方差分
析:***p《0.001模型组vs.假手术组,###p《0.001treatment vs.模型组。
68.图19a-f显示了mydgf-164在大鼠缺血模型中的治疗效果。图19a和19b显示基于氯化三苯基四氮唑(ttc)染色的mydgf-164处理后梗塞面积减少,并且通过排除切片心脏器官的较暗染色确定7天后大鼠心脏的梗塞面积(图19a)。在独立的大鼠缺血模型中,通过三苯基四唑氯化物(ttc)和伊文思蓝(伊文思蓝)排除较暗的染色来确定24小时后大鼠心脏的危险区域和梗塞面积(图19d-e)。危险面积在左心室(lv)的面积的百分比。梗塞面积在危险面积的百分比。单因素方差分析,tukey多重比较检验。****p《0.0001vs.假手术组,***p《0.001vs.假手术组,###p《0.001vs.mi/r模型组,##p《0.01vs mi/r模型组。图19f显示在梗塞区域和梗塞区域边缘的毛细血管。图19g-h显示mydgf-164处理的大鼠的心肌梗塞区边缘毛细血管密度更高。
69.图20显示在心肌梗塞大鼠中,mydgf-164治疗增加心肌梗死后的生存优势。
70.图21描绘了测试mydgf-164保护受试者免受肾功能衰竭的实验计划示意图。
71.图22显示mydgf-164可降低腺嘌呤引起的大鼠肾衰模型中,大鼠血清尿素氮及肌酐水平。使用单因素方差分析:***p《0.001,**《0.01,*p《0.05。
72.图23a-23g显示mydgf-164蛋白抵抗由腺嘌呤诱导的肾脏结构损伤。图23a为肾组织h&e染色的组织学图像,显示管腔内晶体结构的沉积(箭头1),肾小球萎缩(箭头2)、坏死小管(箭头3)、管型(箭头4)和炎症(箭头5)。比例尺为250μm。在图23b中,治疗后测定肾重量与体重的比值,即相对肾重量。n=5。各肾脏组织损伤的5点法病变评分以图表形式显示:肾小管坏死(图23c)、肾小球萎缩(图23d)、炎症(图23e)、肾小管扩张(图23f)、色素沉着(图23g)。5点法:1)轻度,累及范围《10%;2)轻中度,累及范围11-25%;3)中度,累及范围26-50%;4)严重,涉及范围51-75%;5)重度,涉及范围76-100%。使用单因素方差分析:***p《0.001,**《0.01,*p《0.05。
73.图24a-24d显示肾脏组织的免疫组织化学分析,左侧为代表性图像,使用image-pro plus 6.0计算出特征细胞的比例,右侧为条形图。图24a显示肾组织石蜡切片肾小管损伤分子kim-1染色。比例尺为100μm。图24b为肾组织石蜡切片reca-1免疫组化(ihc)分析。黑色箭头表示管周毛细血管(ptcs)的管腔结构维持不变,红色箭头表示ptcs的管腔结构塌陷。比例尺为100μm。图24c显示肾组织石蜡切片ki-67免疫组化的染色。标尺为250μm。图24d显示了肾组织石蜡切片中凋亡细胞的tunel检测。比例尺为50μm。
74.图25a-25c显示向huvec细胞中添加mydgf-164以剂量依赖性方式刺激细胞增殖(图25a)并激活mapk1/3磷酸化(图25b)。此外,mydgf-164融合增强了细胞周期蛋白d1的表达(图25c)
75.图26a-26d显示mydgf-164在划痕试验中促使huvec细胞迁移方面优于尼可地尔。在该测定中,在mydgf-164或尼可地尔处理24小时之前刮擦huvec细胞单层。以100倍放大率拍摄的代表性显微照片(用黑色双箭头表示的划痕修复距离)(图26a和图26c)。用mydgf-164或尼可地尔处理后测定huvec的迁移率(图26b和图26d),采用双因素方差分析和tukey's多重比较检验,n=3,***p《0.001,*p《0.05。
76.图27a-27b显示与用尼可地尔处理相比,用mydgf-164刺激4小时后huvec的管形成增强。vegfa用作阳性对照。以40倍放大拍摄的代表性显微照片(图27a)。mydgf-164、尼可地尔或vegfa处理后huvec每个视野封闭管的数量(图27b),采用单因素方差分析和tukey's多
重比较检验,n=3,***p《0.001,*p《0.05。
77.图28显示了在293f细胞中稳定表达的纯化的fgf21-164融合蛋白。左:纯化的fgf21-164融合体的sds-page后考马斯亮蓝染色。右:蛋白质印迹分析。
78.方法:采用tetra system(bio-rad)进行sds-page,考马斯亮蓝(cbb)染色后进行光密度测定。应用分子量标准品(11-180kda,tanon)进行分析。为了纯度分析,将约10μg融合蛋白溶解在样品缓冲液中并在12%sds-page凝胶中分离,并使用tanon 4600sf凝胶图像分析系统进行光密度测定。
79.图29显示纯化的fgf21-164融合蛋白的maldi-tof分析的数据。在分析中,42751.5da的maldi-tof质量峰是单质子化的fgf21-164蛋白,21601.173da的峰是双质子化的蛋白质。
80.方法:使用bruker autoflex速度仪器(配备1000hz smartbeam-ii激光器)获得质谱,并使用2,5-二羟基苯甲酸作为基质。使用bruker flexanalysis软件3.3.80版分析fgf21-164的质谱。
81.图30a-c显示纯化的fgf21-164蛋白的分析性sec的数据。a、在sec分析中,fgf21-164作为单个对称峰迁移。b、sec分析过程中各种标准蛋白的保留时间。将标准蛋白(甲状腺球蛋白:67000;γ-球蛋白:150000;卵清蛋白:45000;肌红蛋白:17000;血管紧张素:1000)的分子量(mws)与其洗脱时间作图。c、保留时间与标准蛋白质分子量的回归分析和拟合使用非线性回归模型。计算fgf-164融合蛋白的流体动力学半径为87.679kda。
82.图31a.在pngase处理和2-ab标记后,来自fgf21-164的n-连接聚糖形式的uplc表征。以分钟表示各种峰的洗脱时间。对应于峰的聚糖形式用聚糖的象形图表示。图31b是显示fgf21-164融合蛋白中o-聚糖含量的β-消除分析。
83.方法:使用改进的β消除从样品中释放o-聚糖和n-聚糖。使用水平衡后的石墨化碳柱(supelclean
tm
envi
tm-carb spe)除去蛋白质和盐,用20%和40%乙腈洗脱聚糖。通过真空蒸发洗脱液。用2-氨基苯甲酰胺(2-ab)对聚糖进行荧光标记,并在hilic uplc(acquity uplc glycan beh amide column,1.7μm,2.1mm
×
150mm)上分离标记的聚糖。
84.根据制造商的规程(sigma),在pngase f处理后,用2-氨基苯甲酰胺标记n-连接的聚糖。在hilic uplc(acquity uplc glycan beh amide column,1.7μm,2.1mm x 150mm)上分离标记的聚糖,基于2-ab标记的聚糖标准物的比较来确定n-连接聚糖的形式。
85.图32.静脉注射到c57/bl6小鼠后fgf21-164融合体的药代动力学分析。通过lc-ms测定fgf21-164蛋白随时间的血清浓度。
86.方法:使用lc-ms分析fgf21-164特征肽ylytddaqqte ahlei(yly肽),确定fgf21-164融合蛋白的体内半衰期。静脉内注射c57/bl6小鼠fgf21-164蛋白(22.7mg/kg),注射后不同时间点制备血清样品,并用胰蛋白酶处理以释放yly肽。lc-ms定量分析yly肽的浓度以追踪fgf21-164蛋白。
87.图33.fgf21-164融合蛋白刺激脂肪细胞摄取葡萄糖。在将分化成熟的3t3-l1脂肪细胞与各种浓度的fgf21-164一起孵育后,测定条件培养基中的葡萄糖浓度。
88.方法:培养的分化成熟的3t3-l1脂肪细胞,用含有0.1%fbs的高糖dmem预处理24小时,更换培养基,加入不同浓度的fgf21-164。培养24小时后测定培养基中葡萄糖的浓度。
fgf21-164刺激脂肪细胞摄取葡萄糖显著增加(使用单因素方差分析和dunnett的多重比较检验,*p《0.05,***p《0.001,****p《0.0001)。
89.图34.ob/ob小鼠血清葡萄糖的降低
90.图34a.即使在过夜饥饿后,ob/ob小鼠也表现出高基线水平的葡萄糖水平。单次给予小鼠fgf21-164融合蛋白,可降低血清葡萄糖水平。图34b.高剂量治疗组的小鼠葡萄糖水平显示出更高的降低趋势。
91.方法:购买b6/jgpt-lepem1cd25/gpt品系的ob/ob雄性小鼠,并根据中国药科大学的iacuc指南进行处理。除非对小鼠进行测试,否则随意提供食物。将小鼠随机分为对照组(n=4),6mg/kg fgf21-164(低剂量,n=5)治疗组和12mg/kg fgf21-164(高剂量,n=5)治疗组。在过夜禁食后,小鼠皮下注射pbs或fgf21-164融合蛋白。通过尾静脉采血,然后使用血糖仪定量来确定不同时间点的血糖水平。使用单因素方差分析和tukey的多重比较检验对照和fgf21-164之间的差异。
92.图35a.sds-page后考马斯亮蓝染色上分析6微克纯化的fsh164融合蛋白。图35b.使用抗糖蛋白激素α亚基的抗体对纯化的fsh164融合蛋白进行蛋白质印迹分析。
93.图36.fsh164孵育后体外刺激kgn细胞中孕酮的合成。
94.方法:kgn细胞在dmem/f12+10% fbs+1% p/s中生长,接种于96孔板中,每孔2
×
104个细胞。细胞生长24小时,再切换至低血清(1%fbs)培养基24小时。将不同浓度的重组人fsh或fsh164添加到培养基中,最终体积等于150微升。72小时后,收集培养上清液,并通过elisa(drg)测量孕酮的生物合成。
95.图37.与fsh相比,fsh164融合体在体内的半衰期延长
96.方法:雌性,6周龄未成熟sd大鼠(180-190克)用于药代动力学分析。通过皮下给药将rh-fsh(10微克/kg)或fsh164(18.5微克/kg)注射到大鼠腹膜中。通过眼眶采血,制备血清样本,使用drg fsh elisa分析。使用pk solver2.0计算药代动力学参数。应用非隔室模型和线性梯形拟合来分析数据。
97.发明详述
98.1.概述
99.本发明扩展了已知的半衰期延长技术,如fc融合、白蛋白融合或聚乙二醇化。本文所述的方法和组合物是独特的,部分原因是它们改变分子的pka,将带有碱性电荷的蛋白质转化为酸性分子,从而增强溶解性、组织分布和吸收,提高融合蛋白的生物利用度。此外,通过糖基化覆盖降低融合蛋白的免疫原性,这对于需要频繁和/或长期给药的生物治疗药物是有利的。
100.如预期的那样,将蛋白或多肽融合到具有高糖基化和唾液酸化的小粘蛋白结构域也能增强生物治疗药物的药代动力学特性和生物活性。因此,本发明提供了一种新的技术平台,用于提供具有用于临床的所需特征的生物治疗药物。
101.更具体地说,本发明提供的融合蛋白包含(人)cd164粘蛋白结构域i和/或ii和感兴趣的异体蛋白。结果表明,当融合蛋白重组后产生时,粘蛋白结构域的糖基化和唾液化被保留,令人惊讶的是,与文献报道的相比,融合蛋白的半衰期显著延长。因此,本发明提供的主体融合蛋白作为蛋白质工程平台的一部分,有助于优化蛋白质疗法的药代动力学(pk)特性。
102.本发明部分基于认识到粘蛋白结构域的刷状结构(由于o-连接和n-连接的糖基化)可以显著改变具有这种糖基化结构域的融合蛋白的流体动力学行为,且观察到具有高糖基化cd164粘蛋白结构域的新型融合蛋白改善药代动力学特性,例如显著延长了血清半衰期和提高组织分布。
103.虽然不希望被任何特定的理论束缚,但使用本发明的粘蛋白结构域融合蛋白存在几个潜在的优点。首先,融合蛋白被高度糖基化和唾液化,从而降低融合蛋白的免疫原性。其次,融合蛋白的唾液化作用可能有助于融合蛋白良好的药代动力学特性,包括分布和吸收。平板等电聚焦(ief)的结果表明,含有粘蛋白样结构域的融合蛋白具有强酸性,这一特征可以提高融合蛋白的溶解度。例如,已知fgf21是不稳定的,在高浓度时形成聚集物(hecht 2012),这可能导致非预期的免疫反应。另外,fgf21的组织分布也较差,与cd164的粘蛋白结构域的融合改善了组织分布。
104.与延长半衰期的fc融合策略相比,本发明的cd164粘蛋白结构域融合蛋白不具有fc区域的额外效应免疫功能(如抗体依赖的细胞介导的细胞毒性(adcc)和补体依赖的细胞毒性(cdc)),因此,对于结合细胞表面受体的融合蛋白来说,这可能是一种更安全的选择。此外,fc融合是将半衰期延长至数日的有效方法,而cd164粘蛋白结构域融合的半衰期延长则更适合于更短的范围。这对于长期过度刺激可能有害的治疗特别有用。
105.聚乙二醇化策略以前也被用来延长结合蛋白的半衰期。根据本发明,繁琐的聚乙二醇化化学过程被融合至cd164粘蛋白样结构域的天然氨基酸聚合物所取代。因此制造步骤更加简单,且cd164粘蛋白结构域融合在可能更具成本效益。此外,粘蛋白结构域比非纯天然的聚乙烯结构域更天然,后者长时间使用可能导致毒性。
106.因此,在一个方面,本发明提供了一种融合蛋白,包括:(1)包含氨基酸序列的多肽,该氨基酸序列与seq id no:1或2具有至少90%的同源性,以及(2)异种多肽。
107.在本本发明中,“异源多肽”是指或多肽或蛋白质,该多肽或蛋白质不包含源自seq id no:1和/或2的多肽或蛋白质。它可以是来自同一物种(其他人类蛋白质/多肽)或不同物种的蛋白质或多肽。
108.在融合蛋白中,存在所述的异源多肽,该多肽包含与seq id no:1或2至少90%同源性的氨基酸序列,以及选择性的附加序列,如连接肽,该连接肽连接异源多肽和包含与seq id no:1或2至少90%同源性氨基酸序列的多肽。
109.在某些实施例中,异源多肽和与seq id no:1或2至少有90%同源性氨基酸序列的多肽之间没有连接肽。
110.在某些实施例中,包含氨基酸序列与seq id no:1或2至少有90%的同源性的多肽由seq id no:1或2氨基酸序列组成。即,在本实施例中,融合蛋白由异源多肽、seq id no:1或2的氨基酸序列组成的多肽,以及可选择性序列(如可能存在或不存在的连接肽)组成。
111.异源多肽(2)和所包含的氨基酸序列与seq id no:1或2(1)至少具有90%的同源性的多肽的顺序可以是以下任意一种:(1)是(2)的n-端,或(1)是(2)的c-端。
112.在某些实施例中,(1)是(2)的n-端。在本实施例中,(1)可选为seq id no:2。
113.在某些实施例中,(1)是(2)的c-端。在本实施例中,(1)可选为seq id no:1。
114.在某些实施例中,所述融合蛋白可包括两个或多个多肽,每一个多肽包含一个氨基酸序列,该氨基酸序列与seq id no:1或2具有至少90%的同源性。
115.例如,在某些实施例中,所述融合蛋白可包括seq id nos:1和2。在本实施例中,所述异源多肽的两侧可以有两个多肽,其n端多肽包括与seq id no:1氨基酸序列具有至少90%同源性,c端多肽包括与seq id no:2氨基酸序列具有至少90%同源性。在另一实施例中,该异源多肽的两侧可以有3个或更多的多肽,每一个多肽包含一个氨基酸序列,该氨基酸序列与seq id no:1或2至少具有90%的同源性,其中异源多肽的n端包含与seq id no:1氨基酸序列至少具有90%同源性的任一多肽,和/或异源多肽的c端包含与seq id no:2氨基酸序列至少90%同源性的任一多肽。例如,可能有两个(相同或不同)多肽组成的与seq id no:1氨基酸序列至少有90%同源性,两者都是异源多肽的n端,以及一个与seq id no:2氨基酸序列至少有90%的同源性的多台肽,该多肽是异源多肽的c端,以此类推。
116.因此,在某些实施例中,融合蛋白进一步包括(3)第二类多肽,该第二多肽与seq id no:1或2氨基酸序列具有至少90%的同源性,其中(1)和(3)分别包含seq id no:1和2中的不同氨基酸序列。
117.在某些实施例中,seq id no:1多肽融合至异源多肽的n-端,seq id no:2多肽融合至异源多肽的c-端。
118.在某些实施例中,所述融合蛋白可仅包含seq id nos:1或2,并不是两者都包含。例如,融合蛋白可能包含一个或多个(相同或不同)多肽,每个多肽都包含一个氨基酸序列,该序列与seq id no:1具有至少90%同源性,并且所有这些多肽都是异源多肽的n-端。在某些实施例中,融合蛋白可包括一个或多个(相同或不同的)多肽,每个多肽包含一个氨基酸序列,该序列与seq id no:2具有至少90%同源性,并且所有这些多肽都是异种多肽的c-端。
119.某些实施例中,该多肽包括与seq id no:1至少具有90%、91%、92%、93%、94%、95%、96%、97%、98%或99%相同的氨基酸序列。这些序列同源性百分比可能基于查询序列(例如,多肽不同于seq id no:1),seq id no:1,或者查询与seq id no:1并列的序列。
120.某些实施例中,多肽包括与seq id no:2至少具有90%、91%、92%、93%、94%、95%、96%、97%、98%或99%同源性的氨基酸序列。这些序列同源性百分比可能基于查询序列(例如,多肽不同于seq id no:2),seq id no:2,或者查询与seq id no:2并列的序列。
121.在某些实施例中,异源多肽是一种需要延长动物(如人类或非人类哺乳动物)血清半衰期的多肽。在某些实施例中,异源多肽是一种血清半衰期相对较短的多肽(例如约10分钟、15分钟、20分钟、30分钟、45分钟、1小时或2小时)。
122.在某些实施例中,异源多肽是一种治疗性多肽。
123.在此使用“治疗性多肽”包括多肽作为人类和/或兽用于治疗疾病或非健康状态的药物研究和开发(r&d)的主题。在某些实施例中,治疗性多肽是指在临床试验中正在或已经评估的多肽或蛋白质疗法。
124.已完成的或正在进行的药物研发和/或临床开发的治疗性多肽目录可以从公共或专有来源获得。例如,肽治疗基金会(ptf)维护并公开了商业赞助的已进入临床研究的蛋白疗法数据集。其他数据可以从公共来源收集,如clinicaltrials.gov、pubmed、公司和监管机构网站等;以及专有或商业数据库(如thomson reuters partnering、thomson reuters integrity、sagient research systems biomedtracker等)。
125.在某些实施例中,治疗性多肽包括单一多肽链的多肽,如那些长度不超过500个氨
基酸,450个氨基酸,400个氨基酸,350个氨基酸,300个氨基酸,250个氨基酸,200个氨基酸,150个氨基酸,100个氨基酸,80个氨基酸,50个氨基酸,40个氨基酸,30个或20个氨基酸。在某些实施例中,治疗性多肽包括通过一个或多个二硫键连接在一起的两个或两个以上的多肽,如那些总长度不超过1500个氨基酸,1000个氨基酸,800个氨基酸,700个氨基酸,600个氨基酸,500个氨基酸,450个氨基酸,400个氨基酸,350个氨基酸,300个氨基酸,250个氨基酸,200个氨基酸,150个氨基酸,100个氨基酸,80个氨基酸,或50个氨基酸。
126.在某些实施例中,治疗性多肽包括单一多肽链的多肽,如那些长度不超过500个氨基酸,450个氨基酸,400个氨基酸,350个氨基酸,300个氨基酸,250个氨基酸,200个氨基酸,150个氨基酸,100个氨基酸,80个氨基酸,50个氨基酸,40个氨基酸,30个或20个氨基酸。
127.在某些实施例中,典型的但非限制性的异源多肽包括成纤维细胞生长因子21(fgf21)、促卵泡激素(fsh)、髓源性生长因子(mydgf)、成纤维细胞生长因子结合蛋白3(fgfbp3)、利钠肽b、胆囊收缩素、胰高血糖素样肽-1(glp-1)、促性腺激素释放激素、促分泌素、左乳肽、恩福韦肽、胰高血糖素、双缬脲素、舍莫肽、促肾上腺皮质激素四肽、胰岛素样生长因子(igf)、甲状旁腺激素或胰淀素。
128.在某些实施例中,治疗性多肽的(人或小鼠)血清半衰期至少比融合蛋白的半衰期低10%、20%、30%、40%、50%、60%、70%、80%、85%、90%或95%。
129.在某些实施例中,融合蛋白包括o和/或n链糖基化。
130.在某些实施例中,融合蛋白包括唾液化。
131.在某些实施例中,融合蛋白进一步包括位于(1)(包含与seq id no:1或2的氨基酸序列具有至少90%的同源性的的多肽)和(2)(异种多肽)之间的连接肽。
132.在某些实施例中,融合蛋白中(1)是(2)的c-端,(1)可以是seq id no:2,异源多肽为mydgf或其功能片段。
133.在某些实施例中,所述融合蛋白氨基酸序列与seq id no:3至少90%同源性,如seq id no:3。
134.本发明的另一个方面还提供了编码本发明所述融合蛋白中的任何一个的多核苷酸。
135.在某些实施例中,多核苷酸经密码子优化后在目标宿主细胞中表达。
136.在某些实施例中,目标宿主细胞是人类细胞、啮齿动物细胞(如:小鼠细胞),或者非人类哺乳动物细胞。
137.本发明的另一方面提供了包含本发明的多核苷酸的载体。
138.在某些实施例中,载体是表达载体,例如质粒。
139.本发明的另一方面提供了包含本发明融合蛋白、本发明多核苷酸或本发明载体的宿主细胞。
140.在某些实施例中,宿主细胞是组织培养细胞。
141.在某些实施例中,宿主细胞为cho细胞或hek293细胞或其衍生物。
142.本发明的另一方面提供了一种延长蛋白质的血清半衰期的方法,包括将蛋白质融合成包含与seq id no:1或2氨基酸序列具有至少90%同源性的多肽。
143.在某些实施例中,该多肽由seq id no:1或2的氨基酸序列组成。
144.在某些实施例中,蛋白融合在seq id no:2的-n端。
145.在某些实施例中,蛋白质通过连接肽与多肽融合。
146.本发明的另一方面,提供了一种在有需求的受试者上治疗疾病、紊乱或非健康状态的方法,该方法包括给受试者使用治疗有效剂量的本发明的融合蛋白、本发明的多核苷酸或本发明的载体,其中疾病、紊乱或非健康状态可以用所述的异源多肽治疗。
147.在某些实施例中,疾病、紊乱或非健康状态是从包含组织损伤、心血管疾病、炎症疾病或紊乱和肾脏疾病的疾病组别中选取的。
148.在某些实施例中,组织损伤是一种急性损伤,如心肌梗死或卒中。
149.在某些实施例中,组织损伤是一种慢性损伤,如糖尿病对肾脏的损伤。
150.在某些病例中,心血管疾病是从心肌梗死、动脉硬化、高血压、心绞痛、高脂血症、心力衰竭的组别中选取的。
151.在某些病例中,炎症性疾病或紊乱从i型糖尿病、ii型糖尿病、胰腺炎、非酒精性脂肪性肝病(nafld)和非酒精性脂肪性肝炎(nash)的组别中选取。
152.在某些实施例中,疾病或紊乱是一种肾脏疾病。
153.在某些实施例中,受试者是人类。
154.简要描述了本发明的一般方面之后,以下提供了本发明某些方面的具体实施例。应当知道:任何一个实施例,包括仅在示例、权利要求书或说明书的一个部分中公开的实施例,都可以与发明的任何一个或多个其他实施例组合,除非明确否认或有其他不当之处。
155.2.cd164
156.cd164也被称为涎粘蛋白或内啡肽。其197个残基的人源亚型1前体序列为refseq np_006007,包括n端23位残基信号肽(粗体),粘蛋白结构域i和ii(seq id nos:1和2,均双下划线):
157.msrlsrsllwaatclgvlcvlsadknttqhpnvttlapisnvtsapvtslplvttpapetcegrnscvscfnvsvvnttcfwieckdesycshnstvsdcqvgnttdfcsvstatpvptanstakptvqpspsttsktvttsgttnntvtptsqpvrkstfdaasfiggivlvlgvqavifflykfckskernyhtl
158.上述没有信号肽的人类序列在ncbi nr数据库中使用blastp检索,从其他物种搜索到大量同系物(包括同源序列和旁系同源基因)。aotus nancymaae中同源性最少的灵长类同源物与查询的序列同源性为88%,前100个搜索结果中同源性最少的是啮齿动物(cast或canadensis),同源性为69%。
159.类似地,seq id no:2使用blastp检索,确定了99个结果,高级灵长类同源物一般具有》98%的序列一致性,低级灵长类(如m和rillus leucophaeus)同源物一般具有约90-94%的序列一致性。啮齿类动物,如大鼠和小鼠通常在这一区域具有约70%的序列一致性。
160.因此,在某些实施例中,本发明的融合蛋白包括与人类cd164粘蛋白结构域i或ii至少具有约70%、80%、90%、95%、97%或99%的序列一致(seq id nos:1或2)的哺乳动物cd164粘蛋白结构域i或ii。
161.在某些实施例中,哺乳动物cd164粘蛋白结构域i或ii是seq id no:1或2。
162.在某些实施例中,本发明的融合蛋白包括变体型、突变型,或与人类cd164粘蛋白结构域i或ii至少具有约90%、95%、97%或99%的序列一致性(seq id nos:1或2)的合成型cd164粘蛋白结构域i或ii。在某些实施例中,变体型、突变型或合成型cd164粘蛋白结构域i或ii分别具有与野生型人类cd164粘蛋白结构域i或ii相同的n和/或o-糖基化位点。
163.3.治疗性多肽和可治疗的疾病
164.在某些实施例中,本发明的融合蛋白包括有治疗性作用多肽的异源多肽,比如kaspar和reichert所揭露的“肽疗法发展的未来方向”(drug discov.today,18:807-817,2013;和fosgerau和hoffmann,drug discov.today,20(1):122-128,2015)(此处均为参考)。
165.天然产生的肽通常不适合直接作为便利治疗手段,因为它们有固有的弱点,包括化学和物理稳定性差,以及循环血浆半衰期短。它们为药物在这些方面必须作加以处理。
166.治疗性多肽通常也有较短的半衰期,这严重限制了治疗效用,并且需要频繁给药(通常通过静脉注射或其他注射方式,或需要住院,或需要经过训练的患者自我给药)。因此,能够延长药物在循环中的半衰期对于患者的方便性、依从性、成本和最终的治疗效果都是一个重大的改善。
167.截至2015年,有超过60个经美国食品药品监督管理局(fda)批准的多肽药物已上市,约140个多肽药物进行临床试验,超过500个治疗性多肽在临床前试验阶段。这些数据在今后显著增长。因此,本发明的融合蛋白提供了一种延长现有和正在开发的治疗性多肽的治疗半衰期的通用方法,包括那些已经获得fda和ema批准的治疗性多肽。
168.在某些实施例中,所述治疗性多肽用于治疗代谢性疾病、癌症、炎症、或作为疫苗。
169.在某些实施例中,治疗性多肽对多种疾病治疗有效:内分泌科疾病、呼吸系统疾病、骨骼疾病、泌尿科疾病、眼科疾病、皮肤疾病、中枢神经系统疾病、疼痛、消化内科疾病、过敏/免疫疾病、传染病、心血管疾病、肿瘤疾病或代谢疾病。
170.在某些实施例中,治疗性多肽用于治疗胃肠道疾病,如短肠综合征(如利那洛肽和替度鲁肽)。
171.在某些实施例中,治疗性多肽对治疗呼吸窘迫综合征很有用,如高危早产儿、早产儿(例如芦西纳坦)。
172.在某些实施例中,该治疗多肽用于治疗贫血,如患有慢性肾病的成人透析患者的贫血(如聚乙二醇肽)。
173.在某些实施例中,治疗性多肽对治疗库欣病是有用的,如成人患者的库欣病,他们不能进行垂体手术或不能治愈(如帕瑞肽)。
174.在某些实施例中,治疗性多肽用于治疗癌症,如血液癌(如卡非佐米)。
175.在某些实施例中,治疗性多肽用于治疗红细胞生成性原卟啉症(epp),这是一种罕见的遗传性疾病,其特征是对阳光的严重反应(例如,光保护剂阿法诺肽,一种黑素皮质素1受体激动剂)。
176.在某些实施例中,治疗性多肽用于治疗epp和日光性荨麻疹(例如,阿法诺肽)。
177.在某些实施例中,治疗性多肽对治疗多发性硬化症有用,如醋酸格拉替雷。
178.在某些实施例中,治疗性多肽为丙亮瑞林、奥曲肽(用于治疗癌症患者的肢端肥大症和症状)或戈舍瑞林(用于治疗子宫内膜异位症和晚期前列腺癌和乳腺癌的姑息治疗)。
179.在某些实施例中,治疗性多肽是其抗体或抗原结合片段,如scfv、fab、fab'、f(ab')2、fd、disulfide linked fv、v-nar domain、ignar、intrabody、igg
△
ch2、minibody、f(ab')3、tetrabody、triabody、diabody、single-domain antibody、dvd-lg、fcab、mab2、(scfv)2或scfv-fc。
180.在某些实施例中,治疗性多肽是天然多肽,如蛋白质片段、降解产物或源自肠道微生物群的信号分子。
181.在某些实施例中,治疗性多肽是抗体-药物偶联物(adc;gemtuzumab-ozogamicin,brentuximab-vedotin,trastuzumab-emtansine)。
182.在某些实施例中,治疗多肽是一种肽-药物结合物(pdc;如zoptarelin dox或ubicin,ep100),用于治疗尿路上皮癌、子宫内膜癌、前列腺癌、乳腺癌和卵巢癌。
183.在某些实施例中,治疗性多肽针对glp受体、cxcr4、阿片受体、ghrelin受体、gnrh-r、加压素、催产素受体、黑素皮质激素受体或甲状旁腺激素受体。
184.在某些实施例中,治疗性多肽用于治疗2型糖尿病或肥胖,如glp-1r激动剂多肽(例如,利西拉肽;艾塞那肽/byetta1/bydureonl;利拉鲁肽;阿必鲁泰(白蛋白融合);度拉糖肽(fc融合);司美格鲁肽(酰化glp-1类似物);pb 1023(重组glp-1类似物与生物聚合物融合;cpd86;zpgg-72;zp3022;mod-6030;zp2929;hm12525a;vsr859;nn9926;ttp273/ttp054;zyog1;mar709;tt401;hm11260c;itca);ro6811135;zp2929;tt401).这些治疗性多肽还可用于治疗心血管疾病、神经退行性疾病和体重管理,如心肌梗死、阿尔茨海默病、帕金森氏病和轻度认知障碍。
185.在某些实施例中,治疗多肽是一种多功能多肽,如glp-1-gip和glp-1-gcg双重激动剂。例如,glp-1-gcg双激动剂与单纯的glp-1激动剂相比,通过gcg引起的能量消耗增加,对超重的t2dm患者有更多的减重效果。同时,glp-1-cckb双激动剂中,cckb(胃泌素)激动作用叠加glp-1的作用,增强胰腺β细胞的功能,这反过来有助于减少/预防t2dm进展。
186.在临床研究中,最常见的肽治疗靶点是glp-1r。在2000-2012年期间进入临床研究的265种肽疗法中,32种(12.1%)是glp-1r激动剂。与此同时,所有其他靶点的占比都低于3%。glp-1r作为2型糖尿病药物的靶点已得到充分验证。自从艾塞那肽在2005年获批以来,设计、制定或交付多肽成为这类产品一个显著的发展趋势,能使它们的用药频率少于每日两次的艾塞那肽。内源性配体glp-1在1-2分钟内被二肽基肽酶4(dpp4)降解。艾塞那肽的半衰期约为2.4小时,利西拉肽的半衰期也为2-4小时,是特别设计抵抗dpp4的。利拉鲁肽的肽主干通过添加一种脂质(即棕榈酸)来修饰,从而将其半衰期增加到13小时,利拉鲁肽可以每天给药一次。阿必鲁泰由一个串联重复序列的抗ddp4的glp-1(7-36)酰胺类似物融合到has。它的半衰期是6-7天。度拉糖肽包括一个抗ddp4的glp-1(7-36)酰胺类似物融合到igg4的fc区域,该区域被设计为减少与fcg受体的结合及潜在免疫原性,并消除半抗体的形成。它的半衰期大约为四天。司美格鲁肽是一种酰基化glp-1类似物,半衰期为6-7天。
187.在某些实施例中,治疗多肽是mydgf。髓源性生长因子(mydgf,又称c19或f10)是一种由骨髓来源的单核细胞和巨噬细胞产生的旁分泌作用细胞因子,已被证明能够促进缺血心肌梗死(mi)后的心脏恢复。mydgf还通过诱导胰高血糖素样肽-1(glp-1)的产生和分泌来维持葡萄糖稳态,从而改善糖耐量和脂质代谢。在糖尿病肾病(dkd)中,mydgf通过保留狭缝膈蛋白表达和减少足细胞凋亡来保护足细胞免受损伤。
188.尽管在动物模型中,mydgf通过持续静脉给药或腺病毒超表达给药可以抑制器官和组织的损伤,但由于mydgf在血液中的半衰期较短(约15.3分钟),临床应用受到限制。为了降低肾滤过率,我们开发了具有更长血清半衰期的mydgf。
189.因此,带有cd164粘蛋白结构域的mydgf融合蛋白可用于治疗组织损伤、心血管疾
病、炎症性疾病或紊乱和肾脏疾病。
190.在某些实施例中,治疗性多肽是fgf21。成纤维细胞生长因子21(fgf21)是一种属于fgf超家族的内分泌分子,在维持脂质代谢和能量稳态中发挥作用(hecht 2012)。fgf21是一种治疗糖尿病、胰腺炎、非酒精性脂肪性肝病(nafld)和非酒精性脂肪性肝炎(nash)的药物。
191.在某些实施例中,治疗性多肽是促卵泡激素。促卵泡激素(fsh)是一种促性腺激素,是一种糖蛋白多肽激素,由垂体前叶促性腺细胞合成和分泌。
192.在某些实施例中,治疗性多肽是fgfbp3。成纤维细胞生长因子结合蛋白3(fgfbp3)是调节脂肪和葡萄糖代谢的分泌伴侣。fgfbp3是一种治疗非酒精性脂肪肝和2型糖尿病的潜在疗法(tassi等人2018)。
193.需要注意的是,上述治疗性多肽仅用于说明用途,许多其他治疗性多肽,特别是那些为静脉注射而配制的但循环半衰期相对较短的多肽,都在本发明的范围内。
194.4.多核苷酸与载体
195.本发明另一方面提供了编码本文所述发明的融合蛋白的多核苷酸。在一个实施例中,该多核苷酸编码seq id nos:1-8中的任何一个,例如seq id nos:3-8中的任何一个。
196.在一些实施例中,多核苷酸是合成核酸。在一些实施例中,多核苷酸是dna分子。在一些实施例中,多核苷酸是rna分子(例如,一种mrna分子)。在一些实施例中,mrna被封端、聚腺苷酸化、用5-甲基胞苷取代、用假尿苷取代或其组合。
197.在一些实施例中,该多核苷酸(例如,dna)可操作连接到调控元件(例如,启动子)以控制多核苷酸的表达。在一些实施例中,启动子是组成型启动子。在一些实施例中,启动子是诱导型启动子。在一些实施例中,启动子是细胞特异性启动子。在一些实施例中,启动子是生物体特异性启动子。
198.合适的启动子是本领域已知的,包括例如polⅰ启动子、polⅱ启动子、polⅲ启动子、t7启动子、u6启动子、h1启动子、逆转录劳斯肉瘤病毒ltr启动子、巨细胞病毒(cmv)启动子、sv40启动子、二氢叶酸还原酶启动子和β-肌动蛋白启动子。
199.在一方面,本发明提供与本文所述的多核苷酸序列至少50%、55%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%同源性的多核苷酸序列,即,编码本文所述的任何融合片段的核酸序列。
200.为了确定两个氨基酸序列或两个核酸序列的同源性,这些序列以最佳比对目的进行比对(例如,可在第一和第二氨基酸或核酸序列中的一个或两者中引入间隙以实现最佳比对,并且可忽略非同源序列以便于比对)。一般而言,为比对目的而进行比对的参考序列的长度应至少为参考序列长度的80%,在一些实施例中,应至少为参考序列长度的90%、95%或100%。然后比较相应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当第一个序列中的一个位置与第二个序列中的相应位置是被相同的氨基酸残基或核苷酸占据时,则这些分子在该位置是相同的。两个序列之间的同源性是一种序列共享的相同位置的功能,考虑到空位的数量和每个空位的长度,这需要引入两个序列的最佳比对。为了本次公开的目的,可以使用空位处罚为12、空位扩展处罚为4和移码空位处罚为5的blossum 62记分矩阵来完成序列的比对和两个序列之间的同源性的确定。
201.在某些实施例中,编码融合蛋白、其衍生物或功能片段的核酸分子是密码子优化
的,以便于在宿主细胞或生物体中表达。宿主细胞可包括已建立的细胞系或分离的原代细胞。所述多核苷酸可被密码子优化以用于任何感兴趣的生物体,尤其是人类免疫细胞。密码子使用表是现成可获取的,例如,在www.kazusa.或jp/codon/可获取的“codon usage database”,并且这些表可以通过多种方式进行调整。参见nakamura等人,nucl.acids res.28:292,2000(纳入本文参考)。通过计算机算法进行密码子优化特定序列以在特定的宿主细胞中表达也同样可取,如gene f或ge(aptagen;jacobus,pa.)。
202.密码子优化序列的一个实例,在此实例中是优化多核苷酸编码序列以用于在真核生物(例如,人类)中表达(即,优化多核苷酸编码序列以用于在人类中表达),或优化多核苷酸编码序列以用于本文所述其他真核生物、动物或哺乳动物中表达。虽然这是优选的,但应理解为其他示例是可能的,并且对于人类以外的宿主物种的密码子优化,或者对于已知的特定器官的密码子优化。一般而言,密码子优化是指通过将原有序列的至少一个密码子(例如,约1、2、3、4、5、10、15、20、25、50或更多密码子)替换为在目的宿主细胞中更频繁或最频繁使用的密码子来修饰核酸序列,以增强其表达的过程,同时保持天然氨基酸序列。不同物种对特定氨基酸的特定密码子表现出特殊的偏向。密码子偏好性(生物体间密码子使用的差异)通常与信使rna(mrna)的翻译效率相关,而信使rna(mrna)的翻译效率又取决于被翻译的密码子的性质和特定的转移rna(trna)分子的可用性。在细胞中所选择的trnas的优势通常反映了肽合成中最常用的密码子。因此,基于密码子优化,基因可以被定制为在给定生物体中的最佳基因表达。密码子使用表是现成可获取的,例如,在www.kazusa.或jp/codon/可获取的“codon usage database”,并且这些表可以通过多种方式进行调整。参见nakamura,y.,等人"codon usage tabulated from the international dna sequence databases:status f或the year 2000"nucl.acids res.28:292(2000)。通过计算机算法进行密码子优化特定序列以在特定的宿主细胞中表达也同样可取,如gene f或ge(aptagen;jacobus,pa.)。在一些实施例中,编码融合片段的序列中的一个或多个密码子(例如,1、2、3、4、5、10、15、20、25、50、或更多的、或所有的密码子)对应于特定残基的最常用密码子。
203.在一些实施例中,本发明的多核苷酸或核酸存在于载体(例如,病毒载体)中。
204.本文所使用的术语“载体”通常指能够运输与其连接的另一核酸的核酸分子。载体包括但不限于单链、双链或部分双链的核酸分子;核酸分子包含一个或多个自由端、无自由端(例如,环状)的核酸分子;核酸分子包含dna、rna或两者都有;以及本领域已知的其他种类的多核苷酸。
205.在某些实施例中,载体可以是克隆载体,或表达载体。载体可以是质粒、噬菌体、黏性质粒等。载体可包含一个或多个调控元件以允许该载体在目的细胞中的复制(例如,哺乳动物细胞,如cho细胞、hek293细胞等)。
206.在某些实施例中,载体是“质粒”,指可插入额外的dna片段的环状双链dna,例如通过标准的分子克隆技术操作。
207.在某些实施例中,载体是病毒载体,其中病毒衍生的dna或rna序列存在于载体中以包装成病毒(例如,逆转录病毒、慢病毒、复制缺陷逆转录病毒、腺病毒、复制缺陷腺病毒、hsv和腺相关病毒(aav))。病毒载体还包括由病毒携带的用于转染到宿主细胞的多核苷酸。
208.在某些实施例中,载体是慢病毒载体。在某些实施例中,慢病毒载体是自灭活慢病
毒载体。参见,例如,zufferey等人,"self-inactivating lentivirus vect或f或safe和efficient in vivo gene delivery."j virol.72(12):9873-9880,1998.(纳入本文参考)。
209.在某些实施例中,载体基于睡美人(sb)转座子,其已被用作将基因导入脊椎动物基因组并用于基因治疗的非病毒载体。由于sb系统完全由dna组成,与病毒载体相比其生产和传递的成本大大降低。sb转座子已被用于人类临床试验中的t细胞基因修饰。
210.在某些实施例中,载体能够在它们被引入的宿主细胞中自主复制。在某些实施例中,载体(例如,非游离基因的哺乳动物载体)在被引入宿主细胞时被整合到宿主细胞的基因组中,并且与宿主基因组一起复制。在某些实施例中,本文称为“表达载体”的载体能够引导与之连接的基因的表达。用于完成在真核细胞中表达的载体是“真核表达载体”。
211.在某些实施例中,所述载体是重组表达载体,包含本发明的核酸,其形式适于在宿主细胞中表达该核酸。所述重组表达载体可包括一个或多个调控元件,该调控元件可根据要表达的宿主细胞进行选择,并与要表达的核酸序列进行操作连接。在此,“可操作连接”是指目的核苷酸序列以允许核苷酸序列表达的方式连接到调控元件(例如,在体外转录/翻译系统中载体引入宿主细胞时的宿主细胞中)。
212.术语“调控元件”包括启动子、增强子、内部核糖体进入位点(ires)和其他表达控制元件(例如,转录终止信号,如多聚腺苷酸化信号和poly-u序列)。例如参见,goeddel,gene expression technology:methods in enzymology 185,academic press,san diego,calif.(1990).描述了这些调控元件。调控元件包括在多种类型的宿主细胞中直接组成性表达核苷酸序列的元件,以及仅在某些宿主细胞中直接表达核苷酸序列的元件(例如,组织特异性调控序列)。组织特异性启动子可主要在所需组织中直接表达,例如肌肉、神经元、骨、皮肤、血液、特定器官(例如,肝脏、胰腺)或特定细胞类型(例如,诸如t细胞或nk细胞的淋巴细胞)。调控元件也可以时间依赖性的方式直接表达,例如以细胞周期依赖性或发育阶段依赖性的方式,其也可是或不是组织或细胞类型特异性的。
213.在一些实施例中,载体包含一个或多个polⅲ启动子(例如,1、2、3、4、5或多个polⅲ启动子),一个或多个polⅱ启动子(例如,1、2、3、4、5或多个polⅱ启动子),一个或多个polⅰ启动子(例如,1、2、3、4、5或多个polⅰ启动子)或其组合。polⅲ启动子的实例包括但不限于u6和h1启动子。polⅱ启动子的实例包括但不限于逆转录病毒肉瘤病毒(rsv)ltr启动子(rsv增强子任选)、巨细胞病毒(cmv)启动子(cmv增强子任选)[参见,例如,boshart et al,cell,41:521-530(1985)]、sv40启动子、二氢叶酸还原酶启动子、β-肌动蛋白启动子、磷酸甘油激酶(pgk)启动子和ef1a启动子。
[0214]
术语“调控元件”还包括增强子元件,例如wpre;cmv增强子;htlv
‑ⅰ
的ltr中的r-u5'片段(mol.cell.biol.,vol 8(1),p.466-472,1988);sv40增强子;兔b-globin的外显子2和3之间的内含子序列(proc.natl.acad.sci.usa.,vol.78(3),p.1527-31,1981)。
[0215]
本领域技术人员将理解,表达载体的设计可取决于诸如待转化的宿主细胞的选择、所需的表达水平等因素。载体可引入宿主细胞以由此产生转录物、蛋白质或肽,包括如本文所述由核酸编码的融合蛋白或肽。
[0216]
在某些实施例中,载体是慢病毒或aav载体,其可被选择用于靶向特定类型的细胞(例如,具有组织和/或细胞类型特异性取向)。
[0217]
本发明的载体可通过现有技术认可方法中的任何一种引入靶细胞或宿主细胞,例如转染、脂质载体、感染、电穿孔、微注射、肠外注射、气雾剂、基因枪或使用弹道粒子等。
[0218]
在某些实施例中,本文所述融合蛋白可在原核细胞中表达,例如细菌细胞;或在真核细胞中表达,例如真菌细胞(例如酵母)、植物细胞、昆虫细胞和哺乳动物细胞。这类表达可被执行,例如可以根据本领域已知的程序。可用于表达多肽的示例性真核细胞包括但不限,cos细胞,包括cos 7细胞;293细胞,包括293-6e细胞;cho细胞,包括cho-s和dg44细胞;per.细胞(crucell);和nso细胞。在一些实施例中,本文所述的融合蛋白可在酵母中表达。参见,例如,u.s.publication no.us 2006/0270045 a1。在一些实施例中,根据其对粘蛋白结构域进行所需翻译后修饰的能力来选择特定的真核宿主细胞。例如,在一些实施例中,cho细胞产生的多肽具有比在293细胞中产生的相同多肽更高水平的唾液酸化。
[0219]
将一种或多种核酸引入所需宿主细胞可通过任何方法来完成,包括但不限于,磷酸钙转染、deae-葡聚糖介导的转染、阳离子脂质介导的转染、电穿孔、转导、感染等。非限制性示例性方法在,例如,sambrook等人,molecular cloning,a lab或at或y manual,3rd ed.cold spring harb或lab或at或y press(2001)中有描述。根据任何合适的方法,核酸可瞬时或稳定地转染到所需的宿主细胞中。
[0220]
在一些实施例中,根据任何合适的方法,一种或多种多肽可在已编码本发明的融合蛋白的一种或多种载体或多核苷酸进行工程或转染的动物体内产生。
[0221]
在某些实施例中,转染包括通过例如通过磷酸钙、脂质或蛋白质复合物引入载体的化学转染。磷酸钙、deae-葡聚糖、脂质体和脂质复合物(用于基因的口服递送)表面活性剂和用于基因的气溶胶递送的全氟化学液体。
[0222]
在某些实施例中,脂质载体由质粒dna和脂质溶液组合产生,其导致脂质体的形成,脂质体可与多种细胞类型的细胞膜融合,从而将载体dna引入细胞质和细胞核中,以在其中表达编码基因。在某些实施例中,叶酸连接到dna或dna脂质复合物以更有效地将载体引入表达高水平叶酸受体的细胞中。其他靶向部分可类似地用于靶向载体到靶向部分靶向的特定细胞类型的递送。
[0223]
在某些实施例中,载体dna通过受体介导的内吞作用被内化。
[0224]
在某些实施例中,所述载体是慢病毒载体,并且通过用载体的包装细胞系(pcl)中另一个病毒基因组的基因替换表面糖蛋白的基因,来扩展所述载体的靶细胞感染谱。
[0225]
5.药物组合
[0226]
本发明的另一方面提供用于治疗疾病或状况(例如癌症或炎症性疾病),或本文所述治疗性多肽治疗的任何其他疾病或适应症的药物组合物。药物组合物包含治疗有效量的本发明融合蛋白、本发明多核苷酸或本发明载体。所述药物组合物还包括药学上可接受的载体或赋形剂。
[0227]
如本文所用,“医药上可接受的载体或赋形剂”包括任何及所有溶剂、分散介质、涂层、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等生理上相容的载体或赋形剂。在某些实施例中,载体适于静脉注射、肌肉注射、皮下注射、肠外注射、脊髓或表皮给药(例如,通过注射或输液)。在某些实施例中,药物组合物包含与本发明融合蛋白的载体或赋形剂,以用于静脉(i.v.)、皮下(s.c.)、吸入或口服(例如,直接在胃肠道中表达的肽的口服递送)。
[0228]
在另一实施例中,药物组合物包含本发明融合蛋白的用载体或赋形剂,用于经鼻、
经皮、经口给药。(例如,通过金纳米颗粒(midtech)和pharmfilm
tm
(monosol rx技术)的组合进行输送)
[0229]
如本文所用,“治疗有效量”或“治疗有效剂量”或“有效量”意指投与足量的物质、化合物、材料或细胞以产生期望的治疗效果。因此,给药量足以预防、治疗或改善疾病或状况的至少一种症状,或完全或部分阻断疾病或状况的进展/恶化。给药量也低于阈值毒性水平,高于阈值可能/会导致受试者终止或中止治疗。
[0230]
本发明药物组合物中融合蛋白的数量和剂量水平取决于特定患者需要、给药方式、受试者的疾病类型和/或程度、期望的治疗反应、对患者的可耐受毒性而变化,以及主治医师认为相关的其他因素。即所选剂量水平可取决于多种药代动力学因素,包括所使用的特定组合物、给药途径、患者年龄、联合使用的其他药物组合物、给药持续时间和给药时间、排泄率或消除率、性别、体重、状况、一般健康状况病人的病情和病史等因素,这在医学界是众所周知的。本领域的普通技术人员可经验上确定本发明的有效量,而无需进行不必要的实验。结合本文所提供的指导,通过在本发明的各种融合蛋白中选择并权衡诸如效价、相对生物利用度、患者体重、不良副作用的严重程度和优选给药方式等因素,可以计划一种有效的预防或治疗方案,其本身不会造成实质性毒性,但对治疗特定的受试者是完全有效的。
[0231]
本发明方案的毒性和有效性可通过细胞培养物或实验动物中的标准药物程序来确定,例如,用于确定ld50(半数致死量)和ed50(半数有效量)。毒副作用与治疗作用的剂量比是治疗指标,可表示为ld50/ed50之比。首选具有较大治疗指数的预防和/或治疗剂。虽然可以使用具有毒副作用的预防性和/或治疗性药物,但应注意设计一种将此类药物靶向受影响组织部位的输送系统,以尽量减少对未受感染细胞的潜在损害,从而减少副作用。
[0232]
在某些实施例中,从细胞培养分析、动物研究和人类研究获得的数据可用于配制用于人类的预防剂和/或治疗剂的剂量范围。此类药剂的剂量优选地在循环浓度范围内,该循环浓度包括毒性很小或没有毒性的ed50。根据所使用的剂型和所使用的给药途径,剂量可在此范围内变化。对于本发明方法中使用的任何药剂,可从细胞培养分析初步估计治疗有效剂量。可在动物模型中配制剂量,以达到循环血浆浓度范围,包括细胞培养中测定的ic50(即,达到半数最大症状抑制的试验化合物浓度)。这些信息可用于更准确地确定人体的有效剂量。例如血浆中的水平可通过高效液相色谱法来测量。
[0233]
在某些实施例中,所述药物组合物被配制成用于诸如人类、非人灵长类动物、牛、马、猪、羊、山羊、狗、猫或啮齿动物等个体。在某些实施例中,受试者是人类。
实施例
[0234]
实施例1:cd164粘蛋白结构域融合蛋白及其表征方法
[0235]
对含有cd164粘蛋白结构域ⅰ(aa24-60)和粘蛋白结构域ⅱ(aa110-162)的基因密码子进行优化重组表达。通常,粘蛋白结构域ⅰ与所选蛋白质的n-末端融合,而粘蛋白结构域ⅱ与c-末端融合。
[0236]
至少构建了以下融合蛋白:成纤维细胞生长因子21(fgf21)、卵泡刺激素(fsh)、髓源性生长因子(mydgf)和成纤维细胞生长因子结合蛋白3(fgfbp3),它们都是当前或潜在的蛋白质治疗学。粘蛋白结构域的序列及其几种代表性融合如下:
[0237]
cd164粘蛋白结构域ⅰ:
[0238]
dknttqhpnvttlapisnvtsapvtslplvttpapet(seq id no:1).
[0239]
cd164粘蛋白结构域ⅱ:
[0240]
svstatpvptanstakptvqpspsttsktvttsgttnntvtptsqpvrks tfd(seq id no:2).
[0241]
mydgf-164:
[0242]
vsepttvafdvrpggvvhsfshnvgpgdkytcmetyasqggtneqwqmslgtsedhqhftctiwrpqgksylyftqfkaevrgaeieyamayskaaferesdvplkteefevtktavahrpgafkaelsklvivakasrtelsvstatpvptanstakptvqpspsttsktvttsgttnntvtptsqpvrkstfd(seq id no:3)
[0243]
cd164-mydgf融合蛋白:
[0244]
dknttqhpnvttlapisnvtsapvtslplvttpapetvsepttvafdvrpggvvhsfshnvgpgdkytcmftyasqggtneqwqmslgtsedhqhftctiwrpqgksylyftqfkaevrgaeieyamayskaaferesdvplkteefevtktavahrpgafkaelsklvivakasrte(seo id no:4)
[0245]
fgf21-164融合蛋白:
[0246]
dsspllqfggqvrqrylytddaqqteahleiredgtvggaadqspesllqlkalkpgviqilgvktsrflcqrpdgalygslhfdpeacsfrellledgynvyqseahglplhcpgnksphrdpaprgpcrflplpglppalpeppgilapqppdvgssdplsmvgpsqgrspsyassvstatpvptanstakptvqpspsttsktvttsgttnntvtptsqpvrkstfd(seq id no:5)
[0247]
在某些实施例中,164融合中的fgf21是野生型fgf21序列。在某些实施例中,164中的fgf21包含l146c和/或a162c突变。
[0248]
fgfbp3-164融合蛋白:
[0249]
rrekgaasnvaepvpgptggssgrflspeqhacswqlllpapeaaagselalrcqspdgarhqcayrghpercaayaarrahfwkqvlgglrkkrrpch dpaplqarlcagkkghgaelrlvpraspparptvagfageskprarnrgrtrerasgpaagtpppqsappkenpserktnegkrkaalvpneerpmgtgpdpdgldgnaeltetycaekwhslcnffvnfwngsvstatpvptanstakptvqpspsttsktvttsgttnntvtptsqpvrkstfd(seq id no:6)
[0250]
164-fsha融合蛋白:
[0251]
dknttqhpnvttlapisnvtsapvtslplvttpapetapdvqdcpectlq enpffsqpgapilqcmgccfsrayptplrskktmvtsestccvaksynvaks ynrvtvmggfkvenhtachcstcyyhks(seq id no:7)
[0252]
fshb-164融合蛋白:
[0253]
mktloffflfccwkaiccnsceltnitiaiekeecrfcisinttwcagycytrdlvykdparpkiqktctfkelvyetvrvpgcahhadslytypvatqchcgkcdsdstdctvrglgpsycsfgemkesvstatpvptanstakptvqpspsttsktvttsgttnntvtptsqpvrkstfd(seq id no:8)
[0254]
将所有基因片段克隆到pd2531表达载体(atum)中,稳定转染至已适应无血清生长的中国仓鼠卵巢(cho)细胞或293f细胞进行融合蛋白的重组表达。在缺乏谷氨酰胺的培养基中筛选重组细胞系,并通过有限稀释法在96孔组织培养板中进行亚克隆挑选。利用多克隆抗体(sinobiologicals或abcam)进行蛋白印迹分析(western blot analysis)以初步鉴定重组蛋白的表达,然后进行蛋白纯化和分析鉴定。
[0255]
蛋白用tetra system(bio-rad)通过sds-page分离后,用考马斯亮蓝(cbb)染色并进行密度测定,分析蛋白纯度。采用分子量标准(11-180kda,tanon)进行分析。
flexanalysis通过光谱分析得出的。
[0266]
12只c57bl/6小鼠尾静脉注射17.5mg/kg的mydgf-164蛋白,进行药代动力学分析。将小鼠随机分为3组,分别于注射后0、30、240min,5、60、360min和15、120、480min采集血样。用11000转/分低温离心5分钟获得血清。用lc-ms/ms分析血清中的mydgf-164融合蛋白,通过masshunter软件((agilent,usa))定量血浆中融合蛋白的浓度。通过phoenix winnonlin 7.0软件(pharsight,usa)基于非房室模型计算药代动力学参数。通过lc-ms/ms测定cmax和tmax。
[0267]
实施例2:粘蛋白结构域的糖基化在融合蛋白中不受影响
[0268]
cd164粘蛋白域ⅰ(seq id no:1)和ⅱ(seq id no:2)分别由37或53个氨基酸组成,未糖基化形式的分子量分别为3.8kda和5.4kda。
[0269]
为了了解与非糖基化蛋白融合是否会影响cd164粘蛋白结构域的糖基化,构建粘蛋白与非糖基化蛋白mydgf和fgf21融合的嵌合蛋白,产生mydgf-164(seq id no:3)和fgf21-164(seq id no:5)。融合蛋白在cho或293f细胞中稳定表达,通过sds-page和western blot分析在条件培养基中的分泌蛋白(图1)。未经糖基化的成熟多肽mydgf-164的预测分子量为21.1kda,fgf21-164的预测分子量为24.3kda。sds-page和western分析表明,mydgf-164在电泳过程中有48kda迁移,fgf21-164有52kda迁移,表明与cd164粘蛋白结构域的融合产生20-30kda的额外质量。
[0270]
此外,还生成了与fsh alpha、fsh beta和fgfbp3蛋白嵌合的cd164粘蛋白融合蛋白,这些蛋白都是天然糖基化的(图2)。根据比较非融合蛋白,fsh融合蛋白也获得了20到30kda的更多质量。所有案例均可检测到融合cd164粘蛋白区域的糖基化。
[0271]
这些数据令人信服地表明,粘蛋白结构域与其他异源蛋白的融合对糖基化没有显著影响。
[0272]
实施例3:cd164粘蛋白融合蛋白的表征
[0273]
为了鉴定含有粘蛋白结构域的嵌合/融合蛋白,采用常规色谱法纯化mydgf-164融合蛋白。纯化的mydgf-164融合蛋白使用sds-page分离后,经考马斯亮蓝染色,进行分析(图3a)。
[0274]
纯化后mydgf-164蛋白迁移为48kda蛋白,和western分析类似(图1)。对纯化的蛋白进行n端测序,确定了5个氨基酸的n端序列。反相高效液相色谱分析也证实了蛋白质的均一性(图3b)。
[0275]
在rp-hplc洗脱中,mydgf-164图谱是一个单一的吸收峰,表明cd164粘蛋白结构域ii的两个n-连接的糖基化位点被统一利用,即要么完全糖基化,要么两者都没有。此外,纯化蛋白的考马斯亮蓝染色显示出相对简单的条带模式。这些观察结果表明,mydgf-164的多糖形式主要是均一结构。
[0276]
等电聚焦(ief)分析表明,纯化的mydgf-164融合物是含有多种酸性异构体的混合物,其pi为5.22-3.31(图4)。未经翻译后修饰的mydgf-164是一个pi值为7.93的碱性蛋白。ief数据强烈提示融合蛋白可能通过聚糖的唾液酸化而转化为酸性形式。唾液酸可以添加到o-和n-连接的聚糖中。
[0277]
通过pngase处理和2-ab标记对n-连接聚糖进行进一步分析,然后进行uplc分析(图7)。聚糖的主要形式是双触角聚糖,而在34.078和35.181分钟处发现的三触角聚糖可以
忽略不计。因此,发现的相对均一的双触角聚糖结构与考马斯亮蓝染色和rp-hplc数据一致(图3),再次表明cd164粘蛋白结构域的n-连接糖基化高度均一。
[0278]
因此,n-连接聚糖的存在得到证实。2-ab标记的处理程序去除了唾液酸,因此没有一个洗脱峰具有唾液酸的结构。
[0279]
例如,在29.668分钟的洗脱峰对应于岩藻糖基化双天线聚糖含半乳糖,但没有唾液酸。如前所述,cd164的粘蛋白ii结构域包含两个假定的n-连接糖基化位点(doyonnas)。基于对n-连接的聚糖的分析,表明my64融合在所有n-糖基化位点上都被完全修饰。
[0280]
为了确定纯化的mydgf-164融合蛋白的质量,对纯化的蛋白进行maldi-tof质谱分析。在质谱图中,纯化的mydgf-164融合蛋白在42370.668道尔顿处呈现一单电荷峰,以及一双电荷峰(图9)。双荷电峰预测的质量为42432道尔顿,比单荷电峰的42370.668道尔顿高。这种差异可能是由质谱中激光诱导质子化的各种糖形式的融合蛋白和随后释放质子化的蛋白质的异质性造成的。然而,与未糖基化的mydgf-164的预测分子量21182.6道尔顿相比,单电荷峰的质量高出约20kda,表明融合蛋白是高度糖基化的。
[0281]
用sec色谱分析法对mydgf-164水动力性质进行表征。蛋白质洗脱为单个对称峰(图10a),与标准蛋白质比较(图10b)时,mydgf-164融合蛋白的流体动力学半径对应98.744kda球状蛋白质。由于粘蛋白结构域的刷状构象,mydgf-164融合蛋白不太可能折叠成球状结构。然而,可认为与fc融合蛋白或聚乙二醇化蛋白类似,mydgf-164流体动力学半径的增加会降低肾小球滤过率,从而增加融合蛋白在体内的半衰期。
[0282]
实施例4:增强cd164粘蛋白融合蛋白的血清半衰期
[0283]
早期数据表明,由于半衰期极短,mydgf在体内的生物利用度有限,在心脏修复模型中的活性需要持续的和静脉滴注(k或f-klingebiel 2015)。
[0284]
本实验利用小鼠模型来确定mydgf-164融合的半衰期是否延长。
[0285]
通过静脉注射纯化蛋白,然后进行lc-ms/ms分析来研究药代动力学,并量化不同时间点血清中mydgf-164融合蛋白的浓度(图11)。基于非房室模型计算mydgf-164融合蛋白的药代动力学参数(表1)。
[0286]
表1.mydgf-164pk数据汇总
[0287][0288]
*采用lc-ms/ms法测定t
max
和c
max
。
[0289]
基于对终末药代动力学数据的分析,mydgf-164融合蛋白在小鼠体内可被清除,半衰期为3.86小时。
[0290]
与此形成鲜明对比的是,没有粘蛋白结构域融合的mydgf在体内清除半衰期仅为15.3分钟(k或f klingebiel 2015)。融合产生的mydgf-164蛋白半衰期的增加有望极大地减轻该蛋白作为治疗药物在疾病治疗中的使用频率,并改善治疗效果。
[0291]
此外,稳态分布容积为248.15ml/kg,远高于小鼠血容量(70ml/kg),表明mydgf-164大部分进入组织,粘蛋白结构域融合不影响组织分布。
[0292]
总之,药代动力学参数强烈表明cd164粘蛋白结构域可用于蛋白质工程,以提高半
衰期而不影响组织分布。
[0293]
参考文献
[0294]
chan等人,cd164/endolyn的新亚型、重要功能域和亚细胞分布之间的关系(relationship between novel isoforms,functionally important domains,and subcellular distribution of cd164/endolyn).jbc 276(3):2139-52,2001.
[0295]
doyonnas等人,阻断造血祖细胞或细胞粘附和增殖的cd164单克隆抗体与cd164受体的第一个粘蛋白结构域相互作用(cd164 monoclonal antibodies that block hemopoietic progenit or cell adhesion and proliferation interact with the first mucin domain of the cd164 receptor).the journal of immunology 165(2):840-51,2000.
[0296]
fares等人,通过将绒毛膜促性腺激素β亚基的c端序列与促卵泡素β亚基融合设计长效促卵泡激素激动剂(design of a long-acting follitropin agonist by fusing the c-terminal sequence of the chorionic gonadotropin beta subunit to the follitropin beta subunit).pnas usa 89(10):4304-8,1992.
[0297]
fares等人,通过将人绒毛膜促性腺激素β亚基的羧基末端肽与人促红细胞生成素的编码序列融合开发长效促红细胞生成素(development of a long-acting erythropoietin by fusing the carboxyl-terminal peptide of human chorionic gonadotropinβ-subunit to the coding sequence of human erythropoietin).endocrinology 148(10):5081-7,2007.
[0298]
forde等人,endolyn(cd164)调节cxcl12介导的脐带血cd133+细胞迁移(endolyn(cd164)modulates the cxcl12-mediated migration of umbilical cord blood cd133+cells).blood 109(5):1825-33,2007.
[0299]
hecht等人,基于原理的强效长效fgf21类似物工程或治疗2型糖尿病(rationale-based engineering of a potent long-acting fgf21 analog f或the treatment of type 2diabetes).plos one 7(11):e49345,2012.
[0300]
ihrke等人,endolyn是一种粘蛋白样ⅰ型膜蛋白,通过其细胞质尾部靶向溶酶体(endolyn is a mucin-like typeⅰmembrane protein targeted to lysosomes by its cytoplasmic tail).biochemical journal.345(2):287-96,2000.
[0301]
korf-klingebiel等人,髓源性生长因子(c19或f10)介导心肌梗死后的心脏修复(myeloid-derived growth factor(c19 or f10)mediates cardiac repair following myocardial infarction).nature medicine 21(2):140,2015.
[0302]
lee等人,通过酵母中的信号序列捕获鉴定唾液酸粘蛋白cd164在肌原性分化中的作用(identification of a role for the sialomucin cd164 in myogenic differentiation by signal sequence trapping in yeast).mcb 21(22):7696-706,2001.
[0303]
tassi等人,成纤维细胞生长因子结合蛋白3(fgfbp3)影响碳水化合物和脂质代谢(fibroblast growth factor binding protein 3(fgfbp3)impacts carbohydrate and lipid metabolism).scienctific reports 8:15973,2018.
[0304]
所有参考文献都被插入引用的地方。
[0305]
实施例5:mydgf-164融合蛋白促进人脐静脉内皮细胞增殖、迁移和形成小管、抗凋亡
[0306]
为了表征huvec细胞的增殖活性,将mydgf-164添加到接种在96孔板中的huvec细胞中,并在5%或1%fbs存在下由不同浓度的mydgf-164刺激(图12)。结果发现,mydgf-164在5%fbs中以剂量依赖性的方式促进huvec细胞增殖。在1%fbs中,mydgf-164对细胞增殖有影响,但不随剂量的增加而增加,表明血清中附加的生长因子与mydgf-164有协同作用。
[0307]
为了证实mydgf-164能够促进huvec细胞的增殖,进行流式细胞术来确定细胞周期不同阶段的细胞比例(图13)。在1%fbs培养基中,24小时后g0/g1期的huvecs约占79%,而另添加1μg/ml mydgf-164中g0/g1期的huvecs约占65%。同时约14%的细胞进入g2期,而未经处理的细胞进入g2期约5%。处理后s期的细胞数约为21%,也高于未处理样品的16%。这些结果证实mydgf-164对细胞周期活性有显著影响。
[0308]
内皮细胞的特征之一是对血管生成刺激的迁移反应。测定在mydgf-164存在下huvec细胞的迁移行为(图14)。在划痕修复实验中,内皮细胞单层通过迁移而闭合。mydgf-164促进huvec细胞的迁移,因为迁移引起的划痕闭合随着mydgf-164浓度的增加而增加(图14)。
[0309]
由内皮细胞形成的导管是血管生成的关键部分,本文对其进行体外测试(图15)。传统上,huvec细胞附着在低生长因子的基质凝胶(bd,bioscience)上,形成管状结构的能力,是衡量内皮细胞血管生成潜能的指标。与100ng/ml的vegfa相比,不同浓度的mydgf-164均能促进管状结构的形成。值得注意的是,与相同浓度的vegfa相比,mydgf-164刺激下的环形结构的封闭管似乎更紧密、更规则。
[0310]
数据进一步证明mydgf-164融合蛋白能够减少各种刺激引起的细胞凋亡。在该试验中,huvec细胞与1μg/ml mydgf-164预孵育24小时,然后用过氧化氢(400μmol/l)再处理24小时(图16)。在有mydgf-164存在的情况下,pi和annexin-v双重染色的细胞减少到20.54%,而未处理样品的细胞减少到27.85%,表明过氧化氢引发的细胞凋亡显著减少(图16)。
[0311]
方法:
[0312]
细胞系。人脐静脉内皮细胞购自promocell(heidelberg,germany,原代细胞),在添加内皮细胞生长补充剂(补充剂混合物,promocell)和5%(v/v)fbs和1%(vol/vol)链霉素的内皮细胞生长培养基中,并且在37℃的5%co2气氛中培养。实验前,将人脐静脉内皮细胞(huvecs)在t75瓶中至少传代三次(每3天传代一次)。
[0313]
细胞增殖分析。人脐静脉内皮细胞以3000个细胞/孔的速度接种于96孔培养板中培养24小时,用含不同浓度mydgf-164的5%或1%fbs刺激24小时。细胞增殖用cck-8法(yeasen)定量。
[0314]
流式细胞术分析。为了进行细胞周期分析,将人脐静脉内皮细胞以每孔2
×
105的密度接种在6孔板中。细胞置于1%fbs中,然后添加溶剂或1μg/ml mydgf-164。处理24小时后,收集细胞,固定,用细胞周期分析试剂盒(solarbio)染色。用novocyte(agilent bio)采集信号,用novoexpress软件进行数据分析。细胞凋亡分析:用1μg/ml mydgf-164孵育24小时。然后,再加入h2o2(400μmol/l)或顺铂(ddp,5μg/ml)刺激24小时。收集细胞,用pbs洗涤,用细胞凋亡检测试剂盒(yeasen)染色,用novocyte(agilent bio)检测凋亡和坏死细胞,用
novoexpress软件进行数据分析。
[0315]
划痕试验。为了进行划痕恢复分析,将人脐静脉内皮细胞以每孔1
×
105的密度接种在12孔板中。去除上清液,然后用200μl的枪头在每个孔的中间绘制一条穿过细胞单层的直线。加入不同浓度mydgf-164或100ng/ml vegfa的内皮细胞生长培养基。在0、12和24小时拍摄图像。用image-pro-plus软件分析迁移率。迁移率=变化面积/伤口面积。
[0316]
小管形成实验。低生长因子基质胶(bd,bioscience)与细胞培养基按1:2混合,并按照100μl/孔置于48孔板中,然后在37℃下聚合1h,每孔加入用不同浓度mydgf-164或100ng/ml vegfa孵育的2
×
104人脐静脉内皮细胞。培养4小时后,对小管进行拍照。封闭管为环形结构,完全被huvec细胞包围,计数封闭管数。
[0317]
实施例6:mydgf-164融合蛋白减少心肌梗死后心肌梗死面积
[0318]
在大鼠心肌缺血模型中测试mydgf-164的潜在保护功能(图17a和图17b)。在第一个模型中,将32只6周龄雄性sd大鼠随机分为开胸假手术组(假手术组组)和模型组,模型组进行45min心肌缺血再灌注。mydgf-164治疗组于再灌注前5min尾静脉注射mydgf-164。再灌注后4小时后给予mydgf-164,然后在接下来的一周内每天两次,间隔6小时。阳性对照组给予tirofiban(血小板糖蛋白(gp)ⅱb/ⅲa受体的非肽可逆拮抗剂,和血小板聚集的抑制剂)。在第二个模型中,mydgf-164治疗是相似的,除了心脏在缺血事件后24小时进行评估,以确定危险区面积。
[0319]
心肌肌钙蛋白i(ctni)是心肌梗死时由心肌释放特异性蛋白,心肌肌钙蛋白的测定被广泛用作心肌梗死和急性冠脉综合征的诊断指标。分别于术前,术后24小时、72小时和8天采集血清ctnⅰ。mydgf-164和tirofiban治疗显著降低血清ctnⅰ水平,说明实验性心肌梗死期间mydgf-164的心脏保护作用(图18a和图18b)。
[0320]
图19a-19h显示mydgf-164能够减少由缺血再灌注引起的心脏组织损伤并促进血管生成。氯化三苯基四氮唑(ttc)染色是死后心肌缺血测定的首选方法。非梗死的活组织染红,而梗死区未染色(图19a和19b)。将大鼠心脏切成1mm切片,用ttc染色(图19a)。结果显示,与模型组相比,tirofiban和mydgf-164组的梗死面积有减少的趋势(图19b)。
[0321]
在第二个大鼠缺血模型中,加入伊文思蓝染色进行分析。伊文思蓝未染色的缺血组织是永久性组织损伤的区域。缺血事件后24小时,mydgf-164治疗后危险区域和梗死面积均显着减少(图19c,图19d,图19e)
[0322]
图19f-19h显示mydgf-164增强梗塞组织和非梗塞组织之间边界区域的血管生成。在缺血和治疗后7天,用h&e染色切片的心脏组织,分析梗塞区域和梗塞区边缘毛细血管(图19f,红色箭头)。mydgf-164组和替罗非班(阳性对照)组,梗死区毛细血管密度相似(图19g)。mydgf-164治疗后梗塞边缘区毛细血管密度显着增高(图19h)。采用单因素方差分析和tukey's多重比较检验,***p《0.001vs.假手术组;#p《0.05vs.模型组。
[0323]
在第8天还计算了不同组的存活率(图20)。与模型组和阳性对照组相比,mydgf-164组的存活率最高。这一结果与总体梗死面积数据一致,其中mydgf-164组的心肌梗塞面积也最低。结果表明,mydgf-164可显著降低心肌梗死患者的死亡率。
[0324]
实施例7:mydgf-164融合蛋白减少腺嘌呤所致肾损伤
[0325]
为探讨mydgf-164对肾损伤的保护作用,将wistar大鼠随机分为实验组,分别口服200mg/kg/d的腺嘌呤4周,然后灌胃pbs或675mg/kg的黄葵,或皮下注射0.7mg/kg/d的
mydgf-164为期1周,接着是持续两周的0.7mg/kg/2d。作为阴性对照,一组大鼠在整个实验过程中喂食pbs。在治疗期间,根据制造商协议(nanjing jiancheng bioengineering institute),每周采集血清样本以测定肌酐和尿素水平。实验方案如图21所示。
[0326]
治疗结束后,处死动物,称量肾脏重量。肾组织用4%多聚甲醛固定24小时后,用石蜡包埋。苏木精-伊红(h&e)染色按照标准程序(bio-year tech)进行。5点法测定肾脏病变程度。免疫组化(ihc)染色中,切片用抗ki-67(gb14102:servicebio),抗kim-1(ba3537;baster),抗大鼠内皮细胞抗原-1(ab9774;abcam)孵育过夜,相应的hrp标记二抗体与支结合,然后与dab溶液孵育,并用苏木精进行核染。根据制造商的说明(beyotime,beijing,china)对tunel信号进行染色。
[0327]
血清尿素氮和肌酐都是肾功能的血清标志物,它们在血清中的累积表明肾脏功能受到影响,例如腺嘌呤诱导的组织损伤(图22)。各组于4~7周测定血清尿素氮和肌酐。与只喂养pbs(4周)对照组相比,腺嘌呤给药4周后,模型组出现了严重的肾功能不全,表现为血清肌酐和尿素氮水平显著升高(p《0.001),。
[0328]
同时,皮下注射mydgf-164蛋白1周后,血清肌酐和尿素氮水平(5周)显著降低,与对照组无显著性差异。mydgf-164治疗组的疗效与黄葵灌胃组(5、6、7周)相当。治疗一周后,mydgf-164显著降低血清尿素氮水平,而黄葵则无明显降低,提示mydgf-164治疗肾损伤的疗效优于黄葵。用药后2周,血清肌酐(6周)和尿素(7周)下降至与对照组无差异的水平。
[0329]
治疗方案完成后,处死所有动物。组织病理学检查显示模型组肾脏苍白,相对肾重(mg/g体重)分析显示肾脏严重肥大(图23a)。与模型组相比,经mydgif-164或黄葵治疗后,相对肾脏重量显著降低(图23b),表明mydgif-164蛋白和黄葵保护肾脏免受腺嘌呤的损伤。采用五点法评估肾组织损伤程度。资料显示,经mydgf-164治疗后,肾小管坏死(图23c)、肾小球萎缩(图23d)、炎症(图23e)均较模型组减轻,减轻程度与黄葵治疗组相似。
[0330]
值得注意的是,在mydgf-164治疗后,肾小球萎缩评分恢复到与对照组相同的水平(图23d)。然而,mydgf-164和黄葵治疗并没有改善腺嘌呤诱导的肾损伤后的肾小管扩张(图23f)和色素沉着(图23g)。
[0331]
在腺嘌呤诱导的肾损伤模型中,持续的上皮细胞死亡和随后的增殖是损伤和修复的细胞过程。作为慢性肾脏疾病组织修复过程的一部分,肾小管间质纤维化与管周围毛细血管(ptcs)减少有关。
[0332]
观察mydgf-164对ptcs凋亡和增殖的影响。mydgf-164和黄葵治疗组肾损伤分子-1(kim-1)的生物标记物水平显著降低(图24a),表明mydgf-164和黄葵治疗后肾小管损伤得到有效修复。
[0333]
为了评估mydgf-164对ptcs的影响,通过reca-1染色来评估ptcs的状态,reca-1是一种大鼠内皮细胞标记物,在组织学分析中可以显示血管结构。在模型组中,许多ptcs显示异常的血管系统(即管腔结构塌陷)(图24b)。相比之下,mydgf-164组的reca-1染色面积占检查组织总面积的2.46%,明显高于模型组和黄葵组(图24b)。这一结果表明,mydgf-164能有效地恢复或预防肾脏损伤模型中腺嘌呤停药后ptcs的损伤。
[0334]
细胞增殖是肾损伤后恢复的重要过程。肾组织切片进行ki-67染色,观察细胞增殖情况。mydgf-164和黄葵治疗后,肾组织中的ki-67阳性细胞增加(图24c)。此外,mydgf-164治疗后,肾小管和管周毛细血管中的细胞增殖增加,表明mydgf-164可能促进肾小管上皮细
胞以及间质毛细血管上皮细胞的增殖。
[0335]
末端脱氧核苷酸转移酶介导的地高辛脱氧尿苷缺口末端标记(tunnel)常用于组织中凋亡细胞的鉴定。mydgf-164治疗后,通过tunel染色观察到的肾组织中凋亡细胞的频率大大降低(图24d),表明其对凋亡/细胞死亡的保护作用。
[0336]
实施例8:mydgf-164融合蛋白驱动的huvecs增殖与mapk和细胞周期蛋白d1激活相关
[0337]
早期的研究结果表明,天然mydgf激活mapk1/3通路,刺激akt磷酸化,并增加huvecs中cyclin d1的表达。为了评估cd164粘蛋白ii结构域的融合是否改变了mydgf的功能,将人脐静脉内皮细胞(promocell,heidelberg,germany)置于内皮细胞生长培养基中,加入内皮细胞生长补充剂(supplement mix,promocell),在37℃、5%co2的气氛中培养,并以3000个细胞/孔接种在96孔板中并培养24小时,由不同浓度的mydgf-164刺激24或48小时。通过cck-8测定法(yeasen)定量细胞增殖。当调整质量差异时,天然mydgf和mydgf-164融合蛋白之间的增殖活性没有差异(图25a)。在用mydgf(300ng/ml)或mydgf-164(1μg/ml)融合蛋白处理的huvecs的western分析中,两种处理的mapk1/3磷酸化动力学相同(图25b)。此外,mydgf-164也增强了细胞周期蛋白d1的表达(图25c)。简而言之,mydgf-164融合最有可能维持mydgf的细胞信号传导功能。用于蛋白质印迹分析的抗体是p-mapk1/3(y204/t202,cst,cat#4370),总mapk1/3(cst,cat#4695),细胞周期蛋白d1(cst,cat#2922)和β-肌动蛋白(abways,cat#ab0035)。
[0338]
实施例9:与尼可地尔相比,体外mydgf-164融合蛋白可以驱动huvec迁移
[0339]
抗心绞痛剂尼可地尔已临床应用于治疗冠状动脉成形术或溶栓后再灌注引起的损伤。尼可地尔的保护作用归因于三磷酸腺苷敏感性钾(katp)通道的开放,并且可能是水解后产生的一氧化氮的作用。目前尚不清楚尼可地尔是否通过一氧化氮促进内皮细胞对血管生成刺激的迁移活动。我们在划痕修复测定中确定了在mydgf-164和尼可地尔存在下huvec的迁移行为。通过迁移发生单层内皮细胞的闭合通过以剂量依赖性方式添加mydgf-164而增强(图26a,b),而添加尼可地尔对迁移没有影响(图26c,d)。因此,mydgf-164可以增强内皮细胞迁移,这是使用尼可地尔时不存在的另一种组织修复机制。
[0340]
实施例10:与尼可地尔相比,mydgf-164融合蛋白在促进使用huvec的管形成方面优越
[0341]
已显示一氧化氮参与涉及内皮细胞的血管生成过程。内皮细胞形成管是血管生成潜能的一个特征,mydgf-164促进的管形成与一氧化氮相比(图27a,b)。vegfa用作促进管形成的阳性对照。mydgf-164表现出类似于vegfa的管形成的剂量依赖性激活。相反,用最高浓度的尼可地尔处理的内皮细胞仅显示轻微的管形成。
[0342]
实施例11:纯化的fgf21-164融合蛋白
[0343]
fgf21-164融合蛋白在293f细胞中稳定表达,并从条件培养基中纯化分泌的蛋白,通过sds-page和western印迹分析分析纯化的蛋白(图28)。对于fgf21-164,没有糖基化的成熟多肽的预测分子量为24.3kda。sds-page和western分析均证明fgf21-164以约52kda迁移,表明与cd164粘蛋白结构域的融合产生了20至30kda之间的额外质量。
[0344]
实施例12:纯化的fgf21-164融合蛋白的maldi-tof质量
[0345]
为了更准确地确定fgf21-164融合蛋白的分子量,对纯化的蛋白质进行maldi-tof
分析。虽然对于没有糖基化的成熟多肽fgf21-164的预测分子量是24.3kda,但maldi-tof数据(图29)证明单电荷fgf21-164蛋白的质量是42751.5道尔顿,并且双电荷的质量是21601.173道尔顿。同样,在mydgf-164融合中,增加的质量可能是由于融合中cd164粘蛋白结构域部分的糖基化。
[0346]
实施例13:纯化的fgf21-164融合蛋白的sec分析
[0347]
分析sec仍然是一种确定蛋白水动力学行为的方法。fgf21-164融合蛋白在磷酸盐缓冲液中显示出与88kda球状蛋白相当的表观分子量(图30a-c)。该观察结果表明cd164的粘蛋白结构域主要贡献于fgf21-164融合蛋白的水动力学性质。由于粘蛋白结构域的刷状构象,fgf21-164融合蛋白不太可能折叠成球状结构。然而,据信,类似于fc-融合蛋白或peg化蛋白,fgf21-164的增加的水动力学半径应降低肾小球滤过率,从而增加融合蛋白在体内的半衰期。
[0348]
实施例14:纯化的fgf21-164融合蛋白的聚糖分析
[0349]
通过pngase处理和2-ab标记对n-连接的聚糖进行进一步分析,然后进行uplc分析(图31a)。主要的聚糖形式是在6.87,7.39和8.24分钟洗脱的唾液酸化的双触角和三触角聚糖。因此,发现的相对均匀的双触角聚糖结构与考马斯亮蓝染色数据一致(图28),再次表明cd164粘蛋白结构域的n-连接糖基化是高度均一的。还发现了o-连接的聚糖(图31b)。
[0350]
实施例15:纯化的fgf21-164融合蛋白的药代动力学分析
[0351]
先前表述fgf21蛋白的平均血清半衰期为30分钟。为了确定与cd164粘蛋白结构域融合是否延长了fgf21的血清半衰期,在静脉内注射到4只c57/bl6小鼠后,使用lc-ms方法定量fgf21-164的血清浓度(图32)。使用非房室模型分析fgf21-164的药代动力学参数(表2)。测定fgf21-164融合蛋白的终末半衰期为2.60
±
0.335小时,清除率(cl)为21.9
±
1.22ml/h/kg,稳定分布容积(vss)为64.2
±
1.78ml/kg。
[0352]
表2.fgf21-164 pk参数
[0353][0354][0355]
鼠内源性yly肽的浓度约为50pg/ml~2ng/ml,远低于4.00μg/ml的定量下限。
[0356]
实施例15:纯化的fgf21-164融合蛋白刺激的葡萄糖摄取
[0357]
已知fgf21与fgfr1及klotho结合,并且作为激动剂以刺激脂肪细胞摄取葡萄糖。fgf21 fgf21-164融合蛋白刺激3t3-l1脂肪细胞对葡萄糖摄取的剂量依赖性(图33)。
[0358]
实施例15:纯化的fsh-164融合蛋白
[0359]
fsh-164融合蛋白在cho细胞中稳定表达,从条件培养基中纯化分泌蛋白,并通过sds-page和western印迹分析分析纯化的蛋白(图35)。包括糖基化的成熟的异二聚体fsh的预测分子量约为45kda。sds-page和western分析均表明fsh-164迁移至约70kda,表明与cd164粘蛋白结构域的融合产生了20至30kda之间的额外质量。
[0360]
实施例16:纯化的fsh-164融合蛋白在刺激孕酮生物合成中具有活性
[0361]
fsh刺激人颗粒细胞中黄体酮的合成及分泌,且不发生黄体化。kgn细胞系是颗粒样肿瘤细胞系,可用于测试体外fsh功能。在kgn细胞上测试纯化的fsh-164融合蛋白(图36)。fsh-164刺激kgn细胞中的孕酮生物合成,ec50等于6.3nm,与相同测定中的fsh(ec50=5.8)相似。
[0362]
实施例17:纯化的fsh-164融合蛋白在体内表现出延长的pk
[0363]
与重组fsh相比,fsh164融合蛋白清楚地显示了体内半衰期的延长(图37)。与重组fsh的10小时相比,纯化的fsh164的半衰期约为26.7小时(表3)。从理论上讲,fsh半衰期增加2.5倍足以支持每个排卵周期一次剂量治疗方案。
[0364]
表3.fsh164的pk数据总结
[0365]
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:尹鸿萍 杨美家 缪应花 纪庆超
- 技术所有人:江苏艾洛特医药研究院有限公司
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....