一种醇类
α-碳氢键烷基化化合物的制备方法
技术领域
1.本发明属于有机合成技术领域,具体涉及一种醇类α-碳氢键烷基化化合物的制备方法,还涉及由该合成方法制备得到的醇类α-碳氢键烷基化化合物,以及该醇类α-碳氢键烷基化化合物的应用。
背景技术:
2.醇类作为有机化合物的一个大类,是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物。一般所指的醇类,其羟基是与一个饱和的sp3杂化的碳原子相连。在醇类化合物中直接与官能团羟基相连的碳原子称作α碳原子。已有研究表明,具有更高sp3碳原子占比的化合物能改善化合物的类药性,因此,醇类的α-碳氢键官能团化,特别是天然醇类的α-碳氢键烷基化对发展更有效的醇类药物具有重要意义。
3.目前为了实现醇类α-碳氢键的烷基化,主要存在以下几种方案:比如通过使用四正丁基磷酸铵作为共催化剂,可以实现多种醇类化合物的α-碳氢键烷基化;但该方法中涉及到的天然产物的醇类底物只有两例,可采用的底物种类较少。此外,通过大位阻的螺硅烷和硼酸盐作为共催化剂可以加速伯醇的α-碳氢键烷基化。但目前这些方法的底物范围也主要局限于伯醇,普适性较差。
4.本发明致力于阐明一种可以以结构多样的醇(尤其是仲醇、大位阻醇等)作为底物的醇类α-碳氢键烷基化化合物的制备方法。
技术实现要素:
5.有鉴于此,本发明有必要提供一种醇类α-碳氢键烷基化化合物的制备方法,该合成方法具有绿色高效、原子经济性高、选择性高、副产物少、反应底物范围广泛、普适性好、成本低的优势。
6.为了实现上述目的,本发明采用以下技术方案:
7.本发明提供了一种醇类α-碳氢键烷基化化合物的制备方法,包括以下步骤:
[0008][0009]
将式(i)所示的醇类化合物、式(ii)所示的迈克尔受体、共催化剂、光催化剂、氢原子转移试剂混合加入有机溶剂中,在保护气氛(在本发明的实施例中为氮气)下,-20~80℃下可见光(360-830nm)光照2-48小时(优选波长390-470nm蓝光,30℃,24小时),所得反应液经后处理,得到式(iii)所示的醇类α-碳氢键烷基化化合物;
[0010][0011]
式(i)中,r1选自c1-6烷氧基、被c1-c5烷基取代的苯基、c1-c5卤代烷基、c1-c6烷基或环烷基、n-(叔丁氧羰基)胺乙基中的一种;
[0012]
式(ii)所示的迈克尔受体选自2-(双(叔丁氧基羰基)氨基)丙烯酸苄酯、丙烯酸甲酯、丙烯酸苄酯、甲基丙烯酸甲酯、2-丙烯酸-2-甲氧基乙酯、丙烯酸三氟乙酯、1,1,1,3,3,3-六氟异丙基丙烯酸酯、n-甲基-n-苯基丙烯酰胺、n-甲基-n-苄基丙烯酰胺、2-苯基丙烯酸乙酯、小白菊内酯中的一种;
[0013]
所述式(i)所示的醇类化合物、式(ii)所示的迈克尔受体、共催化剂、光催化剂与氢原子转移试剂物质的量比之为1~3:1:0.04~0.4:0.002~0.4:0.05~1(优选为2:1:0.05:0.005:0.2);
[0014]
所述的共催化剂为硼类催化剂;
[0015]
所述光催化剂选自二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐([ir{df(cf3)ppy}2(dtbbpy)]pf6)、[ir(ppy)2(dtbbpy)]pf6、2,4,6-三苯基吡喃四氟化硼盐、10-甲基-9-均三甲苯基吖啶高氯酸盐、2,4,5,6-四(9-咔唑基)-间苯二腈(4czipn)、酸性红、罗丹明中的一种(优选为二[2-(2,4-二氟苯基)-5-三氟甲基吡啶][2-2'-联(4-叔丁基吡啶)]铱二(六氟磷酸)盐);
[0016]
所述氢原子转移试剂选自奎宁环、3-奎宁环酮、3-奎宁环基乙酸酯、苯佐利定、3-奎宁环基苯甲酰胺、4-甲基-n-{1-氮杂二环[2.2.2]辛烷-3-基}苯-1-磺酰胺、(s)-n-((s)-奎宁环-3-基)-1,2,3,4-四氢化萘-1-甲酰胺、4-氰基奎宁环、乙基奎宁环-4-羧酸酯中的一种(优选为奎宁环)。
[0017]
进一步地,r1优选环己基、甲基、n-(叔丁氧羰基)胺乙基、乙基、异丙基、叔丁基、异戊基、3-氟丙基、3,3,3-三氟丙基、2-甲氧基乙基、苯丙基。
[0018]
进一步地,所述硼类催化剂选自克立硼罗、硼替佐米、2-(羟甲基)苯硼酸环状单酯、他伐硼罗、3,3-二甲基苯并[c][1,2]氧杂戊硼烷-1(3h)-醇、苯硼酸、4-氟苯硼酸、4-三氟甲基苯硼酸、二苯基硼酸、10h-二苯并[b,e][1,4]氧杂硼杂环己烷-10-醇中的一种;优选他伐硼罗。
[0019]
进一步,所述的有机溶剂选自乙腈、乙酸乙酯、二氯甲烷、二甲基亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、1,2-二氯乙烷中的一种,优选1,2-二氯乙烷。
[0020]
所述有机溶剂的体积以式(ii)所示的迈克尔受体的物质的量计为2-8ml/mmol;
[0021]
所述后处理为:反应液用乙酸乙酯萃取,取有机相蒸馏脱除溶剂后,剩余物用200-300目硅胶进行柱层析分离,并用体积比为1:1-1:100的乙酸乙酯与石油醚的混合液为洗脱剂进行洗脱,收集含有目标产物的洗脱液,将洗脱液蒸除溶剂并干燥,获得式(iii)所示醇类α-碳氢键烷基化化合物。
[0022]
本发明进一步提供了如前所述的醇类α-碳氢键烷基化产物在有机合成、药物、农药、材料、染料或洗涤剂中的应用。
[0023]
本发明采用上述方法,一步合成得到小白菊内酯衍生物。
[0024][0025]
本发明的小白菊内酯衍生物属于倍半萜烯内酯类天然产物,是一种nf-k
b抑制剂,
可降低组蛋白脱乙酰酶1(hdac-1)和dna甲基转移酶1,具有多种重要的药理活性,如抗肿瘤、抗病毒、抗炎和抗动脉粥样硬化等,可以用于制备抗肿瘤药物、抗病毒药物、抗炎药物和抗动脉粥样硬化药物。
[0026]
本发明采用上述的方法,一步合成得到高丝氨酸衍生物。
[0027][0028]
本发明的化合物均为高丝氨酸衍生物,l-高丝氨酸是一种非蛋白氨基酸,其衍生物不仅可以通过酶促反应转化为其他重要化工中间体,l-高丝氨酸还是合成手性除草剂-草铵膦的一种重要中间体;而且具有丰富的生物活性,例如可以有效的抑制镰状红细胞、抗真菌,可以用于制备抑制镰状红细胞药物、抗真菌药物。
[0029]
本发明的有益效果如下:
[0030]
本发明中的合成方法在硼类催化剂和可见光共催化自由基偶联反应的基础上,发展以未经过修饰的醇类化合物和迈克尔受体作为反应底物,在温和条件下一步反应直接得到醇类α-碳氢键烷基化产物,可用于制备各种复杂的醇类化合物,反应底物便宜范围广,且合成方法操作简单、产率高、选择性好、副产物少、经济高效;并且该合成方法不仅适用于伯醇,同样适用于仲醇、大位阻醇等,具有优异的普适性。
[0031]
该合成方法有利于工业化生产,应用前景广阔,可在有机合成、药物、农药、材料、染料、洗涤剂等领域推广应用。
具体实施方式
[0032]
下面详细描述本发明的实施例,下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。
[0033]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施方式的目的,不是旨在于限制本发明。
[0034]
下面通过具体实施例对本发明进行说明,需要说明的是,下面的具体实施例仅仅是用于说明的目的,而不以任何方式限制本发明的范围,另外,如无特别说明,未具体记载条件或者步骤的方法均为常规方法,所采用的试剂和材料均可从商业途径获得。
[0035]
实施例1
[0036]
将2-(双(叔丁氧基羰基)氨基)丙烯酸苄酯(188mg,0.5mmol)和环己醇(100mg,1mmol)置于2ml 1,2-二氯乙烷中,然后加入光催化剂[ir{df(cf3)ppy}2(dtbbpy)]pf6(2.8mg,0.0025mmol)、共催化剂他伐硼罗(3.8mg,0.025mmol)和氢原子转移试剂奎宁环(11mg,0.1mmol),向反应装置内中充入氮气置换装置内的空气;
[0037]
以波长390-470nm的蓝光为驱动力,在30℃下反应24h;反应结束后,将所得反应液用乙酸乙酯萃取出有机相,蒸馏脱除溶剂后,剩余物用200-300目硅胶进行柱层析分离,并用体积比1:10乙酸乙酯与石油醚的混合液为洗脱剂进行洗脱,收集含有目标产物的洗脱液,将洗脱液蒸除溶剂并干燥,获得产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙
酸苄酯,产量为205mg,其产率为86%。
[0038]
产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的核磁共振结果为:1h nmr(500mhz,cdcl3)δ7.35
–
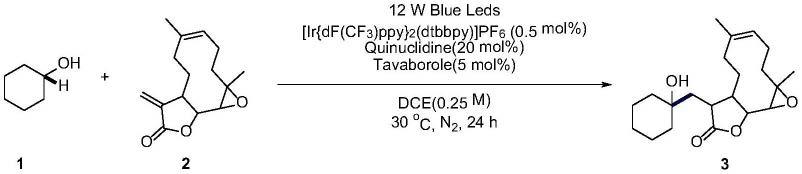
7.27(m,5h),5.19
–
5.09(m,3h),2.51
–
2.47(m,1h),2.46(br,1h),1.86(dd,j=15.2,5.9hz,1h),1.65
–
1.56(m,4h),1.47
–
1.40(m,20h),1.37
–
1.22(m,2h).
13
c nmr(125mhz,cdcl3)δ172.05,152.23,135.47,128.38,128.07,127.88,83.27,70.07,67.08,54.57,38.67,36.95,27.87,25.70,22.15,22.09.hrms(esi)m/z:[m+h]
+
calcd.for c
26h40
no
7 478.2799,found 478.2807。
[0039]
实施例2
[0040]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂为[ir(ppy)2(dtbbpy)]pf6(2.3mg,0.0025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为134mg,产率为56%。
[0041]
实施例3
[0042]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂为2,4,6-三苯基吡喃四氟化硼盐(1mg,0.0025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为102mg,产率为43%。
[0043]
实施例4
[0044]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂为10-甲基-9-均三甲苯基吖啶高氯酸盐(1.2mg,0.0025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为86mg,产率为36%。
[0045]
实施例5
[0046]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂为4czipn(1.9mg,0.0025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为112mg,产率为47%。
[0047]
实施例6
[0048]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂为酸性红(1.2mg,0.0025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为129mg,产率为54%。
[0049]
实施例7
[0050]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂为罗丹明(0.9mg,0.0025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为107mg,产率为45%。
[0051]
实施例8
[0052]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂用量为(1.2mg,0.001mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为112mg,产率为47%。
[0053]
实施例9
[0054]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂用量为(11mg,0.01mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为126mg,产率为53%。
[0055]
实施例10
[0056]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂用量为(16.8mg,0.015mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为133mg,产率为56%。
[0057]
实施例11
[0058]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂用量为(22.4mg,0.02mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为140mg,产率为59%。
[0059]
实施例12
[0060]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的光催化剂用量为(224mg,0.2mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为143mg,产率为60%。
[0061]
实施例13
[0062]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为克立硼罗(6.3mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为145mg,产率为61%。
[0063]
实施例14
[0064]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为硼替佐米(9.6mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为145mg,产率为61%。
[0065]
实施例15
[0066]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为2-(羟甲基)苯硼酸环状单酯(3.3mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为124mg,产率为52%。
[0067]
实施例16
[0068]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为3,3-二甲基苯并[c][1,2]氧杂戊硼烷-1(3h)-醇(4.0mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为169mg,产率为71%。
[0069]
实施例17
[0070]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为苯硼酸(3.0mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为78mg,产率为31%。
[0071]
实施例18
[0072]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为4-氟苯硼酸(3.5mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为88mg,产率为37%。
[0073]
实施例19
[0074]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为4-三氟甲基苯硼酸(4.7mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙
酸苄酯的产量为90mg,产率为38%。
[0075]
实施例20
[0076]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为二苯基硼酸(4.5mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为81mg,产率为34%。
[0077]
实施例21
[0078]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂为10h-二苯并[b,e][1,4]氧杂硼杂环己烷-10-醇(4.9mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为72mg,产率为30%。
[0079]
实施例22
[0080]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂用量为(3.0mg,0.02mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为171mg,产率为72%。
[0081]
实施例23
[0082]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂用量为(7.6mg,0.05mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为164mg,产率为69%。
[0083]
实施例24
[0084]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂用量为(15mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为119mg,产率为50%。
[0085]
实施例25
[0086]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的共催化剂用量为(30.2mg,0.2mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为102mg,产率为43%。
[0087]
实施例26
[0088]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂为3-奎宁环基乙酸酯(16.9mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为174mg,产率为73%。
[0089]
实施例27
[0090]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂为苯佐利定(23.1mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为169mg,产率为71%。
[0091]
实施例28
[0092]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂为3-奎宁环基苯甲酰胺(23mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为168mg,产率为68%。
[0093]
实施例29
[0094]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂
为4-甲基-n-{1-氮杂二环[2.2.2]辛烷-3-基}苯-1-磺酰胺(28mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为74mg,产率为31%。
[0095]
实施例30
[0096]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂为(s)-n-((s)-奎宁环-3-基)-1,2,3,4-四氢化萘-1-甲酰胺(28.4mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为150mg,产率为63%。
[0097]
实施例31
[0098]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂为3-奎宁环酮(12.5mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为24mg,产率为10%。
[0099]
实施例32
[0100]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂为乙基奎宁环-4-羧酸酯(18.3mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为174mg,产率为73%。
[0101]
实施例33
[0102]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂为4-氰奎宁环(13.6mg,0.1mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为88mg,产率为37%。
[0103]
实施例34
[0104]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂用量为(2.8mg,0.025mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为160mg,产率为67%。
[0105]
实施例35
[0106]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂用量为(5.5mg,0.05mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为165mg,产率为69%。
[0107]
实施例36
[0108]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂用量为(8.3mg,0.075mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为167mg,产率为70%。
[0109]
实施例37
[0110]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂用量为(16.7mg,0.15mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为162mg,产率为68%。
[0111]
实施例38
[0112]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂用量为(33.3mg,0.3mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为129mg,产率为54%。
[0113]
实施例39
[0114]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的氢原子转移试剂用量为(55.6mg,0.5mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为114mg,产率为48%。
[0115]
实施例40
[0116]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂为2ml乙腈,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为176mg,产率为74%。
[0117]
实施例41
[0118]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂为2ml二氯甲烷,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为200mg,产率为84%。
[0119]
实施例42
[0120]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂为2ml乙酸乙酯,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为191mg,产率为80%。
[0121]
实施例43
[0122]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂为2ml n,n-二甲基甲酰胺,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为114mg,产率为48%。
[0123]
实施例44
[0124]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂为2ml二甲基亚砜,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为169mg,产率为71%。
[0125]
实施例45
[0126]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂为2ml n,n-二甲基乙酰胺,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为105mg,产率为44%。
[0127]
实施例46
[0128]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂的用量为4ml,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为176mg,产率为74%。
[0129]
实施例47
[0130]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的有机溶剂的用量为1ml,产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为188mg,产率为79%。
[0131]
实施例48
[0132]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物的用量为(50mg,0.5mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为174mg,产率为73%。
[0133]
实施例49
[0134]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物的用量为(75mg,0.75mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为191mg,产率为80%。
[0135]
实施例50
[0136]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物的用量为(125mg,1.25mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为207mg,产率为87%。
[0137]
实施例51
[0138]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物的用量为(150mg,1.5mmol),产物2-(双(叔丁氧基羰基)氨基)-3-(1-羟基环己基)丙酸苄酯的产量为212mg,产率为89%。
[0139]
实施例52
[0140]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为甲醇(32mg,1mmol),获得的产物为苄基双(叔丁氧羰基)高丝氨酸,产量为153mg,其产率为75%。
[0141]
产物苄基双(叔丁氧羰基)高丝氨酸的核磁共振结果为:1h nmr(500mhz,cdcl3)δ7.38-7.27(m,5h),5.20-5.13(m,2h),5.03(dd,j=9.8,4.7hz,1h),3.79-3.69(m,1h),3.64-3.57(m,1h),2.52-2.47(m,1h),2.46-2.39(m,1h),2.09-2.01(m,1h),1.46(s,18h).
13
cnmr(125mhz,cdcl3)δ170.65,152.59,135.54,128.44,128.15,127.97,83.61,66.91,59.00,55.66,32.62,27.89.hrms(esi)m/z:[m+h]
+
calcd.for c
21h32
no
7 410.2173,found 410.2179。
[0142]
实施例53
[0143]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为乙醇(32mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-4-羟基戊酸酯,产量为158mg,其产率为74%。
[0144]
产物苄基2-(双(叔丁氧羰基)氨基)-4-羟基戊酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.37-7.30(m,5h),5.21-4.99(m,3h),4.06-3.98(3.82-3.69)(m,1h),3.04(br,1h),2.47(2.15)(ddd,j=14.6,6.2,4.3hz,1h),2.08-2.01(1.86-1.76)(m,1h),1.45(1.44)(s,18h),1.24(1.23)(s,3h).
13
c nmr(100mhz,cdcl3)δ170.94(170.69),152.72(152.24),135.53,128.42,128.12,127.94,83.66(83.32),66.89,66.11,63.96,56.05(55.85),39.69,38.85,27.88(27.86),23.47(23.00).hrms(esi)m/z:[m+h]
+
calcd.for c
22h34
no
7 424.2330,found424.2333。
[0145]
实施例54
[0146]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为异丙醇(60mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-4-羟基-4-甲基戊酸酯,产量为164mg,其产率为75%。
[0147]
产物苄基2-(双(叔丁氧羰基)氨基)-4-羟基-4-甲基戊酸酯的核磁共振结果为:1h nmr(500mhz,cdcl3)δ7.39-7.28(m,5h),5.21-5.10(m,3h),2.55(dd,j=15.2,5.1hz,1h),
2.53(br,1h),1.86(dd,j=15.1,6.2hz,1h),1.44(s,18h),1.28(s,3h),1.25(s,3h).
13
c nmr(125mhz,cdcl3)δ171.91,152.28,135.48,128.43,128.14,127.93,83.39,69.50,67.17,55.32,43.44,30.53,28.74,27.92.hrms(esi)m/z:[m+h]
+
calcd.for c
23h36
no
7 438.2486,found438.2496。
[0148]
实施例55
[0149]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为正丁醇(74mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-4-羟基庚酸酯,产量为185mg,其产率为82%。
[0150]
产物苄基2-(双(叔丁氧羰基)氨基)-4-羟基庚酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.39-7.28(m,5h),5.23-5.01(m,3h),3.88-3.79(3.59-3.50)(m,1h),2.88(br,1h),2.55-2.48(1.79-1.70)(m,1h),2.13-2.06(m,1h),1.52-1.40(m,22h),0.96-0.87(m,3h).
13
c nmr(100mhz,cdcl3)δ171.00(170.80),152.69(152.21),135.54,128.40,128.09,127.93,83.58(83.26),69.68,67.54,66.86,55.98(55.80),39.57,39.19,38.23,37.01,29.65,27.89(27.85),18.92(18.79),13.96.hrms(esi)m/z:[m+h]
+
calcd.for c
24h38
no
7 452.2643,found452.2645。
[0151]
实施例56
[0152]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为异戊醇(88mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-4-羟基-6-庚酸甲酯,产量为162mg,其产率为70%。
[0153]
产物苄基2-(双(叔丁氧羰基)氨基)-4-羟基-6-庚酸甲酯的核磁共振结果为:1h nmr(500mhz,cdcl3)δ7.37-7.28(m,5h),5.23-4.99(m,3h),3.96-3.86(3.74-3.53)(m,1h),2.55-2.46(2.11-2.04)(m,1h),1.82-1.67(m,2h),1.46-1.43(m,18h),0.96-0.83(m,6h).
13
cnmr(100mhz,cdcl3)δ171.01(170.78),152.74(152.25),135.56,128.42,128.12,127.95,83.60(83.27),68.04,66.89,65.84,55.98(55.78),46.65(46.16),38.72(37.38),29.67,27.92(27.87),24.62(24.59),23.28(22.98),22.29(22.05).hrms(esi)m/z:[m+h]
+
calcd.for c
25h40
no
7 466.2799,found 466.2807。
[0154]
实施例57
[0155]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为3-氟丙醇(78mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-6-氟-4-羟基己酸酯,产量为118mg,其产率为52%。
[0156]
产物苄基2-(双(叔丁氧羰基)氨基)-6-氟-4-羟基己酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.38-7.29(m,5h),5.21-5.00(m,3h),4.76-4.46(m,2h),4.11-4.02(3.81-3.72)(m,1h),3.25(2.38)(d,j=3.1hz,1h),2.59-2.51(2.23-2.14)(m,1h),2.13-2.05(1.70-1.59)(s,1h),1.93-1.76(m,2h),1.46(1.45)(s,18h).
13
c nmr(100mhz,cdcl3)δ170.82(170.58),152.84(152.29),135.51,135.47,128.44,128.16,127.98(127.97),83.86(83.47),82.38(82.00),80.75(80.38),67.00(66.97),64.05(64.00),55.92(55.81),38.30,37.71(37.62),37.52(37.43),37.29,27.91(27.87).hrms(esi)m/z:[m+h]
+
calcd.for c
23h35
fno
7 456.2392,found 456.2398。
[0157]
实施例58
[0158]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为3,3,3-三氟丙醇(114mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-6,6,6-三氟-4-羟基己酸酯,产量为86mg,其产率为35%。
[0159]
产物苄基2-(双(叔丁氧羰基)氨基)-6,6,6-三氟-4-羟基己酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.39-7.28(m,5h),5.22-5.10(m,2h),5.07-4.95(m,1h),3.90-3.82(3.61-3.52)(m,1h),3.32(2.35)(d,j=3.8hz,1h),2.59-2.51(2.34-2.27)(m,1h),2.20-2.12(2.09-2.02)(m,1h),1.84-1.66(m,2h),1.46(1.45)(s,18h).
13
c nmr(100mhz,cdcl3)δ170.72(170.48),152.86(152.36),135.43(135.40),128.47,128.23,128.02(128.01),83.99(83.67),68.72,67.11(67.07),66.38,55.96(55.83),38.22(37.27),30.44(30.15),,29.68(29.50),27.90(27.87).hrms(esi)m/z:[m+h]
+
calcd.for c
23h33
f3no
7 492.2204,found 492.2208。
[0160]
实施例59
[0161]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为n-(叔丁氧羰基)乙醇胺(161mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-5-((叔丁氧羰基)氨基)-4-羟基戊酸酯,产量为172mg,其产率为64%。
[0162]
产物苄基2-(双(叔丁氧羰基)氨基)-5-((叔丁氧羰基)氨基)-4-羟基戊酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.38-7.28(m,5h),5.21-4.93(m,4h),3.92(3.79)(br,1h),3.63(3.56)(br,1h),3.38-3.27(3.71-3.65)(m,1h),3.18-2.99(m,1h),2.57-2.40(2.22-2.12)(m,1h),2.06-1.98(1.80-1.75)(m,1h),1.51-1.38(m,27h).
13
c nmr(100mhz,cdcl3)δ170.96(170.59),170.71,156.94(156.26),152.69,152.18,152.12,152.03,135.45,135.42,135.38,128.43,128.16,127.98,83.87(83.43),67.42,67.09,67.05,67.01,66.93,55.78(55.55),35.41(34.60),28.32(28.30),27.88(27.86).hrms(esi)m/z:[m+h]
+
calcd.for c
27h43
n2o9539.2963,found 539.2969。
[0163]
实施例60
[0164]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为苯丙醇(136mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-4-羟基-6-苯基己酸酯,产量为200mg,其产率为78%。
[0165]
产物苄基2-(双(叔丁氧羰基)氨基)-4-羟基-6-苯基己酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.36-7.30(m,5h),7.29-7.23(m,2h),7.22-7.14(m,3h),5.22-5.01(m,3h),3.93-3.82(3.58-3.39)(m,1h),3.08(br,1h),2.86-2.75(m,1h),2.74-2.63(m,1h),2.60-2.52(2.12-2.04)(m,1h),2.24-2.01(m,2h),1.89-1.74(m,2h),1.44(1.43)(s,18h).
13
cnmr(100mhz,cdcl3)δ170.97(170.73),152.77(152.30),142.04(141.93),135.53(135.51),128.44,128.39,128.37,128.31,128.15,127.98,125.79(125.72),83.71(83.41),69.60,66.94,55.99,55.90,39.09,38.62,38.22,37.21,32.07(32.02),29.68,27.91(27.86).hrms(esi)m/z:[m+h]
+
calcd.for c
29h40
no
7 514.2799,found 514.2801。
[0166]
实施例61
[0167]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的醇类化合物为乙二醇甲醚(76mg,1mmol),获得的产物为苄基2-(双(叔丁氧羰基)氨基)-4-羟基-5-甲氧基戊酸酯,产量为147mg,其产率为65%。
[0168]
产物苄基2-(双(叔丁氧羰基)氨基)-4-羟基-5-甲氧基戊酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.39-7.29(m,5h),5.22-5.06(m,3h),4.05-3.97(3.82-3.73)(m,1h),3.44(3.30)(dd,j=9.5,3.4hz,1h),3.38(3.37)(s,3h),3.03(2.45)(d,j=3.1hz,1h),2.48-2.39(2.24-2.16)(m,1h),2.10-1.96(1.88-1.81)(m,1h),1.65-1.59(m,1h),1.45(1.44)(s,18h).
13
c nmr(100mhz,cdcl3)δ170.81(177.73),152.54(152.12),135.58,128.43,127.98(127.95),83.52(83.21),68.23,67.02,66.92(66.86),59.13(59.02),55.66(55.39),34.28(33.44),27.93(27.89).hrms(esi)m/z:[m+h]
+
calcd.for c
23h36
no
8 454.2435,found 454.2439。
[0169]
实施例62
[0170]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为丙烯酸甲酯(43mg,0.5mmol),获得的产物为3-(1-羟基环己基)丙酸甲酯,产量为66mg,其产率为71%。
[0171]
产物3-(1-羟基环己基)丙酸甲酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ3.64(s,3h),2.41(t,j=7.6hz,2h),1.76(t,j=7.6hz,2h),1.69(br,1h),1.61-1.24(m,10h).
13
cnmr(100mhz,cdcl3)δ175.12,70.57,51.62,37.29,36.62,28.02,25.67,22.07.hrms(esi)m/z:[m+h]
+
calcd.for c
10h19o3 187.1329,found 187.1333。
[0172]
实施例63
[0173]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为丙烯酸苄酯(81mg,0.5mmol),获得的产物为苄基3-(1-羟基环己基)丙酸酯,产量为103mg,其产率为79%。
[0174]
产物苄基3-(1-羟基环己基)丙酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.40-7.28(m,5h),5.12(s,2h),2.49(t,j=7.6hz,2h),1.81(t,j=7.6hz,2h),1.71(br,1h),1.60-1.45(m,6h),1.44-1.33(m,2h),1.28-1.24(m,2h).
13
c nmr(100mhz,cdcl3)δ174.45,135.93,128.51,128.20,128.17,70.65,66.31,37.36,29.67,28.32,25.70,22.11.hrms(esi)m/z:[m+h]
+
calcd.for c
16h23o3 263.1642,found 263.1646。
[0175]
实施例64
[0176]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为甲基丙烯酸甲酯(50mg,0.5mmol),获得的产物为3-(1-羟基环己基)-2-甲基丙酸甲酯,产量为56mg,其产率为56%。
[0177]
产物3-(1-羟基环己基)-2-甲基丙酸甲酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ3.66(s,3h),2.81-2.74(2.38-2.28)(m,1h),2.74-2.64(m,1h),2.00(dd,j=14.2,10.3hz,1h),1.80-1.30(m,10h),1.18(1.16)(s,3h).
13
c nmr(100mhz,cdcl3)δ178.60(178.16),70.97(70.95),51.79,46.17(40.15),38.69,38.39,36.63,34.71,34.49,25.74,25.01,22.65,22.13,19.60.hrms(esi)m/z:[m+h]
+
calcd.for c
11h21o3 201.1485,found 201.1489。
[0178]
实施例65
[0179]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为2-丙烯酸-2-甲氧基乙酯(65mg,0.5mmol),获得的产物为2-甲氧基乙基3-(1-羟基环己基)丙酸酯,产量为76mg,其产率为66%。
[0180]
产物2-甲氧基乙基3-(1-羟基环己基)丙酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ4.26-4.21(m,2h),3.62-3.57(m,2h),3.38(s,3h),2.47(t,j=7.1hz,2h),1.80(t,j=7.0hz,2h),1.61-1.49(m,6h),1.43-1.35(m,2h),1.31-1.26(m,2h).
13
c nmr(100mhz,cdcl3)δ174.61,70.64,70.40,63.44,58.94,37.38,29.68,28.28,25.74,22.13.hrms(esi)m/z:[m+h]
+
calcd.for c
12h23o4 231.1591,found 231.1597。
[0181]
实施例66
[0182]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为丙烯酸三氟乙酯(77mg,0.5mmol),获得的产物为2,2,2-三氟乙基3-(1-羟基环己基)丙酸酯,产量为100mg,其产率为79%。
[0183]
产物2,2,2-三氟乙基3-(1-羟基环己基)丙酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ4.55-4.39(m,2h),2.82-2.44(m,2h),2.36-1.82(m,2h),1.80-1.42(m,10h).
13
cnmr(100mhz,cdcl3)δ177.68,171.22,84.14,60.83,60.47,60.10,59.75,39.51,38.74,38.28,35.92,31.10,29.68,25.79,24.91,22.59.hrms(esi)m/z:[m+h]
+
calcd.for c
11h18
f3o3255.1203,found 255.1210。
[0184]
实施例67
[0185]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为1,1,1,3,3,3-六氟异丙基丙烯酸酯(111mg,0.5mmol),获得的产物为1,1,1,3,3,3-六氟丙烷-2-基3-(1-羟基环己基)丙酸酯,产量为108mg,其产率为67%。
[0186]
产物1,1,1,3,3,3-六氟丙烷-2-基3-(1-羟基环己基)丙酸酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ5.86-5.69(m,1h),2.86-2.47(m,2h),2.39-1.91(m,2h),1.91-1.29(m,10h).
13
c nmr(100mhz,cdcl3)δ177.40,169.68,84.20,66.84,66.50,66.16,65.89,38.64,38.29,35.90,30.82,25.61,24.91,22.59,22.56.hrms(esi)m/z:[m+h]
+
calcd.for c
12h17
f6o
3 323.1076,found 323.1079。
[0187]
实施例68
[0188]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为n-甲基-n-苯基丙烯酰胺(81mg,0.5mmol),获得的产物为3-(1-羟基环己基)-n-甲基-n-苯丙酰胺,产量为69mg,其产率为53%。
[0189]
产物3-(1-羟基环己基)-n-甲基-n-苯丙酰胺的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.41(d,j=6.7hz,2h),7.35(d,j=5.8hz,1h),7.19(d,j=7.1hz,2h),3.25(s,3h),2.67(br,1h),2.25-2.15(m,2h),1.77-1.68(m,2h),1.57-1.32(m,8h),1.29-1.25(m,2h).
13
c nmr(100mhz,cdcl3)δ174.25,143.97,129.77,127.84,127.19,70.17,37.61,29.64,28.18,25.81,22.19.hrms(esi)m/z:[m+h]
+
calcd.for c
16h24
no
2 262.1802,found 262.1809.
[0190]
实施例69
[0191]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为n-甲基-n-苄基丙烯酰胺(98mg,0.5mmol),获得的产物为n-苄基-3-(1-羟基环己基)-n-甲基丙酰胺,产量为62mg,其产率为45%。
[0192]
产物n-苄基-3-(1-羟基环己基)-n-甲基丙酰胺的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.42-7.13(m,5h),4.60(4.57)(s,2h),2.94(2.96)(s,3h),2.72(br,1h),
2.52(t,j=6.9hz,2h),1.93-1.80(m,2h),1.66-1.38(m,10h).
13
c nmr(100mhz,cdcl3)δ174.61(174.20),137.29(136.46),128.93,128.58,128.02,127.61,127.34,126.29,70.34(70.28),51.05(53.45),37.88(37.79),34.87(34.22),29.69(s),27.38(26.97),25.87(25.85),22.68,22.32(22.27).hrms(esi)m/z:[m+h]
+
calcd.for c
17h26
no
2 276.1958,found 276.1967。
[0193]
实施例70
[0194]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为2-苯基丙烯酸乙酯(88mg,0.5mmol),获得的产物为3-(1-羟基环己基)-2-苯丙酸乙酯,产量为70mg,其产率为51%。
[0195]
产物3-(1-羟基环己基)-2-苯丙酸乙酯的核磁共振结果为:1h nmr(400mhz,cdcl3)δ7.37-7.21(m,5h),4.20-4.01(m,2h),3.85(dd,j=10.0,2.7hz,1h),2.49(dd,j=14.2,10.4hz,1h),1.79(dd,j=14.4,2.6hz,1h),1.59-1.39(m,8h),1.30-1.22(m,3h),1.19(t,j=7.1hz,3h).
13
c nmr(100mhz,cdcl3)δ175.10,140.54,128.66,127.74,127.03,104.99,71.10,60.91,46.41,38.71,36.77,25.70,22.13,22.09,14.00.hrms(esi)m/z:[m+h]
+
calcd.for c
17h25o3 277.1798,found 277.1805。
[0196]
实施例71
[0197]
本实施例采用同实施例1相同的实施方式,不同之处在于:采用的迈克尔受体为小白菊内酯(124mg,0.5mmol),获得的产物为(z)-8-((1-羟基环己基)甲基)-1a,5-二甲基-2,3,6,7,7a,8,10a,10b-八氢氧化肾上腺素[2',3':9,10]环十碳[1,2-b]呋喃-9(1ah)-酮,产量为111mg,其产率为64%。
[0198]
产物(z)-8-((1-羟基环己基)甲基)-1a,5-二甲基-2,3,6,7,7a,8,10a,10b-八氢氧化肾上腺素[2',3':9,10]环十碳[1,2-b]呋喃-9(1ah)-酮的核磁共振结果为:1h nmr(400mhz,cdcl3)δ5.34(br,1h),5.16(d,j=11.8hz,1h),3.91(t,j=9.1hz,1h),3.50(s,1h),2.71(d,j=9.0hz,1h),2.59(t,j=11.0hz,1h),2.46-2.25(m,2h),2.25-2.10(m,2h),2.05-1.85(m,3h),1.74-1.56(m,8h),1.54-1.38(m,3h),1.35-1.20(m,8h).
13
c nmr(100mhz,cdcl3)δ179.47,134.35,125.16,83.38,69.76,66.12,61.53,50.64,43.43,41.13,39.65,36.69,36.57,29.67,29.42,25.76,24.05,22.24,17.14,16.87.hrms(esi)m/z:[m+h]
+
calcd.for c
21h33o4 349.2373,found 349.2380。
[0199]
通过以上实施例可以看出,本发明中的合成方法可实现各种醇类化合物的α-碳氢键烷基化,还适用于甾体药物和天然产物的结构修饰。该合成方法操作简单,反应条件温和,使用范围广泛,可用于制备各种复杂的醇类化合物,具有选择性高、副产物少、反应底物范围广泛、普适性好、成本低的优势。
[0200]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0201]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 该技术已申请专利。仅供学习研究,如用于商业用途,请联系技术所有人。
- 技术研发人员:孙天义 刘石惠 姜玉新 张兴贤
- 技术所有人:浙江工业大学
- 我是此专利的发明人
- 该领域下的技术专家
- 如您需求助技术专家,请点此查看客服电话进行咨询。
- 1、薛老师:1.CRISPR-Cas系统 2.基因编辑 3.基因修复 4.天然产物合成 5.单分子技术开发与应用
- 2、张老师:1.探索新型氧化还原酶结构-功能关系,电催化反应机制 2.酶电催化导向的酶分子改造 3.纳米材料、生物功能多肽对酶-电极体系的影响4. 生物电化学传感和生物电合成体系的设计与应用。
- 3、豆老师:1.环境纳米材料及挥发性有机化合物(VOCs) 2.CO污染物的催化氧化 3.低温等离子体 4.吸脱附等控制技术
- 4、赵老师:1.高分子材料改性及加工技术 2.微孔及过滤材料 3.环境友好高分子材料
- 5、邬老师:1.高分子材料的共混与复合 2.涉及材料功能化及结构与性能的研究; 高分子热稳定剂的研发
- 如您是高校老师,可以点此联系我们加入专家库。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
精彩留言,会给你点赞!
专利分类正在加载中....