一种上皮间充质转化的三维肿瘤细胞体外模型及其构建方法
1.本发明涉及生物技术领域,特别是涉及一种上皮间充质转化的三维肿瘤细胞体外模型及其构建方法。
背景技术:
2.上皮间充质转化(epithelial
–
mesenchymaltransition),在生物的胚胎发育和癌症的发生发展中都起着重要的作用,肿瘤细胞的上皮间充质转化是促进肿瘤迁移和干性发生的重要因素。近年来的研究表明,肿瘤细胞微环境中的生物化学因素(如tgf-β刺激)可诱导肿瘤细胞发生上皮-间质转化,而微环境中的物理/力学因素(如空间几何约束、机械拉伸等)也参与调节这一细胞表型转化过程。然而,在生物物理/力学因素微环境对诱导细胞emt表型的具体机制仍有待探索。
3.几十年来,大部分肿瘤研究还停留在依托二维细胞培养和动物实验的基础上。研究表明,三维肿瘤微环境对于肿瘤在体内的生长起着至关重要的作用。在体外的二维培养不仅改变了肿瘤的生长环境对于肿瘤细胞与细胞之间、细胞与基质之间的相互作用也改变了细胞的生长方式。相比2d培养的单层细胞,三维模型的出现在体外给探究细胞结构、粘附、机械传导的信号途径提供了更好的平台,为肿瘤药物研发筛选和检测提供了新的手段。此外,相比于异种移植构建肿瘤模型,3d细胞培养可以更高效的反应体内肿瘤的生长和发育情况。尽管3d细胞培养是一项具有创新性的组织工程技术,但仍有一些问题有待解决,包括维持细胞活性、结构框架等问题。将上皮间充质转化与3d细胞培养结合在一起,可以为肿瘤进一步病理和药理研究提供新的思路和方向。
技术实现要素:
4.本发明的目的是提供一种三维上皮间充质转化的肿瘤模型构建方法,以解决上述现有技术存在的问题,本发明将上皮间充质转化的肿瘤细胞及基质材料共培养得到三维上皮间充质转化的肿瘤细胞体外模型,填补肿瘤上皮间充质转化机制体外研究中三维层面的缺失,可以应用于药物研发、筛选和检测,体外肿瘤治疗的研究等方面。
5.为实现上述目的,本发明方法包括以下步骤:
6.1.细胞准备
7.细胞在5%co2细胞培养箱37℃培养。培养基用dmem完全培养基。
8.细胞复苏时,预热恒温水浴锅至37℃,快速将细胞从液氮取出,放置于水浴锅中,晃动冻存管使细胞悬液完全融化。准备15ml离心管,做好标记后,加入完全培养基5ml,加入解冻的细胞。同时设置离心机转速为1200rpm,放入盛有细胞悬液的离心管后,离心3min,吸去上清,用完全培养基重悬后全部移细胞培养容器中放置于5%co2细胞培养箱37℃培养。
9.细胞传代时,当细胞已达到培养皿底面的80%密度时可执行以下操作。吸去培养皿中的完全培养基后,用在水浴锅中预热到37℃的pbs缓冲液清洗,以避免残留培养基对胰酶作用的影响,吸去pbs缓冲液,加入胰蛋白酶消化细胞。消化时间结束后加入完全培养基
终止消化并将细胞悬液移至15ml离心管中,1200rpm离心3min后吸去上清。用完全培养基重悬后,根据实验需求将部分细胞悬液移至细胞培养容器中放置于5%co2细胞培养箱37℃培养。
10.2.三维模型构建
11.胶原以1:10的比例将胶原与10
×
pbs充分混合,使用0.1m的naoh调整ph至7.0(7.0-7.5效果相同),得到混合物。将混合物铺至细胞培养容器底部后加入2
×
105/ml(1
×
105-5
×
105/ml均可)细胞。将细胞培养容器皿中放置于5%co2细胞培养箱37℃培养。获得细胞体外三维模型。
12.3.上皮间充质转化诱导
13.(1)使用上皮间充质转化诱导剂(如tgf-β),对体外二维模型进行上皮间充质转化诱导。将5~10ng/mltgf-β提前加入2
×
105/ml(1
×
105-5
×
105/ml均可)细胞悬液中并加至细胞培养容器中,放置于5%co2细胞培养箱37℃培养。获得细胞体外上皮间充质转化二维模型。
14.(2)使用上皮间充质转化诱导剂(如tgf-β),对体外三维模型进行上皮间充质转化诱导。将5~10ng/mltgf-β提前加入2
×
105/ml(1
×
105-5
×
105/ml均可)细胞悬液中,将混合液加入已铺有水凝胶的细胞培养容器中。将细胞培养容器中放置于5%co2细胞培养箱37℃培养。获得细胞体外上皮间充质转化三维模型。
15.4.上皮间充质转化标志物检测
16.(1)rna提取
17.取出所需的细胞吸去培养基加入预冷的pbs缓冲液润洗两次后,使用rna提取试剂盒进行rna提取(天根dp419),提取结束后溶解rna,使用酶标仪测定rna浓度后,置于-80℃备用。
18.(2)rna反转录
19.将制备好的rna根据反转录试剂盒说明书流程进行操作。根据试剂盒反应体系,于42℃反应2min去除基因组dna(gdna)。去除gdna后,根据试剂盒要求配制cdna反转录体系,按照反应程序获得cdna。
20.(3)实时定量荧光pcr
21.使用sybrgreensupermix,根据说明书反应体系进行体系配置及反应程序设置,加入pcr联排管中,每个实验组至少有3个重复。移入实时定量荧光pcr仪,设置循环数为40个循环。
22.本发明还提供一种肿瘤细胞体外模型在如下(1)-(3)中至少一种中的应用:
23.(1)制备组织修复或再生的材料;
24.(2)药物开发、药物筛选、药物检测或药物测试;
25.(3)构建药理和病理肿瘤模型。
26.本发明公开了以下技术效果:
27.(1)细胞存活正常
28.由于三维上皮间充质转化的肿瘤细胞体外模型的重要载体是水凝胶,不可避免出现挤压力降低模型中细胞存活率的问题,本发明制备的三维上皮间充质转化的肿瘤细胞体外模型采用胶原为载体,细胞存活率接近常规二维培养,对使用模型进行后续试验有重大
优势。
29.(2)模拟多种基质硬度
30.本发明通过对胶原浓度调节,可在体外模拟多种三维上皮间充质转化肿瘤模型的基质硬度,提供更加贴合体内环境的肿瘤研究平台。
31.(3)操作便捷
32.本发明制备三维上皮间充质转化的肿瘤细胞体外模型,过程简单操作便捷,缩短的实验进程有利于此模型在研究中的进一步应用。
附图说明
33.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
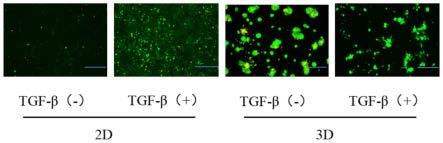
34.图1为使用三维上皮间充质转化的肿瘤细胞体外模型的构建方法获得的二维和三维上皮间充质转化肿瘤细胞模型组织结构体,图中2d、3d中标尺均为250μm;
35.图2为三维上皮间充质转化肿瘤细胞模型的存活率,图中2d、3d中标尺均为250μm;
36.图3为三维模型的上皮间充质转化标志物表达含量变化;其中a、b分别为emt标志物n-cadherin、e-cadherin在2d及3d培养中的mrna表达量变化,c、e、d分别为emt相关基因vimentin、twist1和snail1在3d培养中的mrna表达量变化。柱状图中ns表示p值》0.05;“*”表示p《0.05;“**”表示p《0.01;“***”表示p《0.001;
37.图4为不同tgf-β浓度诱导下的上皮间充质转化三维模型,a、c为5ng/mltgf-β诱导后的细胞及死活染色结果,b、d为10ng/mltgf-β诱导后的细胞及死活染色结果,e为emt标志物n-cadherin的mrna表达量变化,图中a-d中标尺均为250μm;**表示p《0.01;
38.图5为不同力学微环境下的上皮间充质转化三维模型,a、c为1mg/mltgf-β诱导后的细胞及死活染色结果;b、d为2.4mg/mltgf-β诱导后的细胞及死活染色结果;e、f分别为emt标志物n-cadherin和e-cadherin的mrna表达量变化,图中a-d中标尺均为250μm;**表示p《0.01。
具体实施方式
39.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
40.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
41.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所
有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
42.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
43.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
44.下述实施例中所使用的实验方法如无特殊说明,均为常规方法;材料、试剂如无特殊说明,均从商业途径中购得。
45.本实验中水凝胶的制备选用天然胶原。
46.实施例1构建上皮间充质转化的肿瘤细胞三维模型
47.(1)肺肿瘤细胞的二维培养
48.肺癌a549细胞(购自中国国家细胞库)采用dmem完全培养基在5%co2的37℃培养箱进行培养,当细胞密度达到80%后使用胰蛋白酶进行消化传代。
49.(2)含细胞的三维胶原的制备
50.下述所有操作均在冰上进行。
51.以肺癌细胞为例,冰浴重悬于完全培养基的a549细胞。胶原以1:10的比例将胶原与10
×
pbs充分混合,使用0.1m的naoh调整ph至7.0(7.0-7.5效果相同),得到混合物。将混合物铺至细胞培养容器底部后加入2
×
105/ml(1
×
10
5-5
×
105/ml均可)的a549细胞,使用tgf-β诱导,其浓度选择为5ng/ml(5~10ng/ml均可)。将加入细胞悬液的3d培养细胞放入含有5%co2,95%o2的37℃培养箱进行培养。最终所得三维上皮间充质转化肿瘤细胞模型组织结构体如图1所示。在2d培养中tgf-β诱导48h后,与对照组相比,tgf-β处理组中细胞形态变化明显,细胞拉伸,细胞间连接疏松,获得纺锤状的成纤维细胞样的间质表型(如图1中的2d模型),说明tgf-β能诱导肺癌a549细胞从形态学发生上皮间充质转化。
52.实施例2三维上皮间充质转化的肿瘤模型存活率测定
53.采用荧光死活染色方式测定细胞存活率。将三维上皮间充质转化肿瘤细胞模型组织结构体用胰酶溶解为二维细胞混合物后进行荧光死活染色,利用试剂盒步骤如下:
54.配置贮存液:配制荧光素双醋酸酯贮存液(5mg/ml,溶于丙酮,储存于-20℃)和碘化丙啶贮存液(5mg/ml,溶于pbs或水,储存于4℃)。
55.染色时,将样品放置在孔板内,加入1mlpbs,再分别加入1μlfda和1μlpi贮存液(稀释1000倍),染色5min。
56.洗弃染色液,pbs漂洗,荧光显微镜下观察、照相。
57.检测结果如图2所示,三维培养tgf-β诱导肺癌细胞a549细胞的存活率与二维细胞的结果无明显差异。
58.实施例3三维模型的上皮间充质转化标志物检测
59.采用实时荧光定量pcr法检测tgf-β作用后的细胞内上皮间充质转化的相关mrna的表达。检测结果如图3所示,分析结果发现,不同浓度tgf-β诱导后,肺癌细胞a549三维模型的e-钙粘蛋白(e-cadherin)均呈现下降趋势而n-钙粘蛋白(n-cadherin)表达量显著上升,这同样说明肺癌细胞a549三维模型中发生上皮间充质转化。
60.在3d培养中检测emt相关基因vimentin、twist1和snail1在3d培养中的mrna表达量变化,检测结果如图3所示,不同浓度tgf-β诱导后,肺癌细胞a549三维模型的nvimentin、twist1和snail1表达量显著上升,这同样说明肺癌细胞a549三维模型中发生上皮间充质转化。
61.实施例4不同tgf-β浓度诱导下的上皮间充质转化三维模型
62.分析不同tgf-β诱导浓度下上皮间充质转化三维模型的变化,将胶原混合物铺至细胞培养容器底部后加入2
×
105/ml(1
×
10
5-5
×
105/ml均可)的a549细胞,分别使用5ng/mltgf-β及10ng/mltgf-β处理a549细胞,进一步培养。所得三维模型如图4所示,分析结果发现,相比5ng/mltgf-β诱导浓度,10ng/mltgf-β诱导浓度会导致n-cadherin表达量显著下降,这说明在体外三维上皮间充质转化肿瘤细胞模型中,tgf-β的浓度影响模型上皮间充质转化程度。
63.实施例5不同力学微环境下的上皮间充质转化三维模型
64.通过控制整个培养体系中胶原浓度改变上皮间充质转化三维模型的力学微环境。分析不同浓度下上皮间充质转化三维模型的形态变化如图5a所示,发现,正如图5b所示,胶原浓度2.4mg/ml的上皮间充质转化模型相比胶原浓度1mg/ml的上皮间充质转化模型其细胞形态发生了明显变化,且通过实时荧光定量分析发现,胶原浓度2.4mg/ml的上皮间充质转化模型相比胶原浓度1mg/ml的上皮间充质转化模型e-cadherin表达量下降而n-cadherin表达量显著上升,符合emt特征,数据说明体外模型的上皮间充质转化也受到基质硬度的影响。
65.本模型可以通过控制胶原浓度改变三维模型力学微环境对上皮间充质力学微环境的研究提供有利的实验模型。
66.以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1