基于肿瘤组织块3D培养的临床药敏筛选平台及其应用
基于肿瘤组织块3d培养的临床药敏筛选平台及其应用
技术领域
1.本发明涉及临床药敏筛选领域,特别涉及一种基于肿瘤组织块3d培养的临床药敏筛选平台及其应用。
背景技术:
2.早在1953年,black和speer首先进行了肿瘤药敏试验,但由于检测技术的落后,都没有真正的应用于临床。20世纪70年代后期由hamburger和salmon建立的适宜人肿瘤原代细胞生长的双层软琼脂培养系统,即人肿瘤干细胞集落测定法为肿瘤体外药敏试验的发展打下了基础。而后随着肿瘤化疗药物的不断增加即肿瘤治疗的不断发展,肿瘤体外药敏试验亦随之发展起来。
3.肿瘤临床前模型的研究对阐明肿瘤进展、转移相关的复杂机制十分重要,并且能够为肿瘤药物筛选提供验证和预测的平台。构建肿瘤模型主要有2d肿瘤细胞培养,3d肿瘤细胞培养和动物体内肿瘤培养三种方法。2d肿瘤细胞培养系统和动物模型已辅助开展了部分肿瘤学研究,但这两种模型存在一些缺陷,因此不能完全转化为临床试验。
4.2d培养体系能够为肿瘤病理研究提供信息,但是肿瘤细胞在2d模型中以单层形式增殖,缺乏细胞-细胞、细胞-细胞外基质(extracellular matrix,ecm)的相互作用关系,导致基因表达、蛋白质合成与体内环境存在明显差异。此外,2d培养体系的物质交换方式无法模拟体内肿瘤组织的氧气、营养物质和代谢废物的转运梯度。因此,2d培养无法模拟生理肿瘤微环境(tumormicroenvironment,tme),导致临床疗效符合率低,这限制了它在药物筛选中的应用。
5.携带肿瘤的动物模型是监测药物利用度、治疗效果和剂量毒性的重要工具。但其核心问题在于,只有不到30%的患者能够成瘤,且成瘤时间大约在2-3月,而且种间差异导致结果重现性差,使用动物模型测试抗肿瘤药物并转化为临床试验的比例不到8%。出于伦理及成本考虑,利用动物进行疾病研究或药物试验时应符3r原则(reduction,replacement,refinement)。因此,资助机构建议使用细胞培养模型替代动物模型,从而减少用于肿瘤研究和药物评估的动物数量。
6.为弥补2d培养和动物模型的缺陷,研究者们开发了多种3d肿瘤细胞培养技术,主要是利用不同材料、成型技术构建具有3d结构的细胞载体及细胞团。相比2d培养,3d培养能够通过重建细胞-细胞、细胞-ecm相互作用的3d通信网络,重现体内肿瘤微环境和肿瘤细胞生物学行为。通过调控环境因素或添加额外的刺激,可用3d肿瘤模型模拟更真实的肿瘤微环境,从而减小体外细胞模型与体内肿瘤间的差异。
7.1971年,judah folkman首次提出“肿瘤的生长和转移依赖于血管生成”的假说,当肿瘤处于缺氧环境时,就会释放诱导因子刺激血管生成,通过新生血管提供氧气和营养物质,以供肿瘤增殖或转移。如果能够搞清楚肿瘤诱导血管生成的过程并将其切断,也就等于抑制了肿瘤的生长,抗血管生成药物应运而生。2004年,第一个抑制肿瘤血管的药物avastin(安维汀)在美国上市。2005年,我国自主研发的重组人血管内皮抑制素“恩度”在中
国上市。多项临床试验证实抗血管生成药物在抗肿瘤治疗中起着重要地位。
8.恶性肿瘤药敏试验在指导临床用药及帮助制订合理的个体化治疗方案中具有重要意,更重要的是可以筛选出不敏感药物,避免了药物对人体的毒副作用及经济费用。目前药敏试验主要还是集中在实验室研究中,真正进入到临床前瞻性试验的常规应用还很少,主要原因是现有的肿瘤体外药敏试验无一完全满足药敏试验的标准,即所需标本少,快速、敏感、可筛选作用方式不同的药物,缺少与临床疗效有良好的匹配、费用低廉、易用于临床推广等。
技术实现要素:
9.本发明要解决的技术问题是提供一种临床符合率高、样本需求少、检测时间短、观察与操作便捷的临床药敏筛选平台,为临床标准治疗失败的恶性肿瘤患者提供临床疗效符合率高的临床用药方案,帮助临床医生制定肿瘤耐药后解决方案,破解耐药难题。
10.为解决上述技术问题,本发明提供的一种基于肿瘤组织块3d培养的临床药敏筛选平台,至少包括以下步骤:
11.(1)取材:从恶性肿瘤患者病灶部位穿刺获取肿瘤组织块样本;
12.(2)样本处理与培养:在无菌条件下将收集到的肿瘤组织块样本剪碎成微小肿瘤组织块,生理盐水冲洗后放置于每孔含有100-200ul肿瘤微小组织块培养基的多孔板中培养24-48小时,于5%co2、37℃的恒温箱中培养;
13.(3)肿瘤新生血管生成:预冷的肿瘤微小组织块培养基中加有cd31单克隆抗体,在荧光显微镜下能荧光显示肿瘤新生血管;
14.(4)药敏试验:在荧光显微镜下观察到密度均匀的肿瘤新生血管后,将培养好的微小肿瘤组织块均匀分布至每孔含有100-200ul肿瘤微小组织块培养基的多孔板中,加入不同的抗肿瘤药物共孵育成药物处理组,并设置对照组,再培养24-72小时;
15.(5)药敏结果分析:在荧光显微镜下观察微小肿瘤组织块的新生血管变化情况,计算不同的抗肿瘤药物的药敏抑制率(%)=(药物处理组的荧光强度/对照组的荧光强度)*100%;
16.(6)指导治疗:根据步骤(5)中药敏抑制率最高的药物指导患者的治疗方案。
17.具体的,所述肿瘤组织块样本使用tsk 18g/16g穿刺针,获取肿瘤组织块样本2-3条,大小(0.1-0.2)cm*(0.1-0.2)cm*(1-2)cm。
18.具体的,所述微小肿瘤组织块大小不超过0.1cm*0.1cm*0.1cm。
19.具体的,所述预冷的肿瘤微小组织块培养基是由1%琼脂糖(invitrogen),10%fbs(gibco或者hyclone),2%基质胶(invitrogen),0.1% cd31单抗(sigma或者abcam),5% ebm2培养基(含有多种细胞因子,invitrogen)组成,4℃存储备用。
20.具体的,所述对照组的对照剂是dmso、0.9% nacl或5%葡萄糖中的任一种。
21.具体的,所述药物处理组的所述抗肿瘤药物先溶于所述对照剂,再加入所述多孔板共孵育。
22.本发明还提供权利要求1所述的临床药敏筛选平台在抗肿瘤药物筛选中的应用。
23.具体的,所述临床药敏筛选平台可应用于各种微小肿瘤组织块的培养。
24.具体的,所述临床药敏筛选平台在个体化药敏检测方面的应用。
25.具体的,所述临床药敏筛选平台在制定肿瘤耐药后解决方案的应用。
26.具体的,所述临床药敏筛选平台可应用于新药的研究和评估、分析抗肿瘤药物敏感性及筛选和评估抗肿瘤药物、开发肿瘤耐药逆转药物、研究更有效的肿瘤治疗方法。
27.本发明利用微小肿瘤组织块具备的微生态,借鉴3d培养基的组织微环境,能够在一定范围内模拟肿瘤细胞在体生长状态,具有实验条件可控、对多种复合因素可进行对比性研究,且成功率高,培养周期短,可大批量开展药物筛选,破除传统意义上pdx成瘤率低、培养周期长的缺点,解决pdc不能模拟体内微环境、效率低下的弊端,建成一种制作成功率高、培养周期短、可直接肉眼观察的新型抗肿瘤药物筛选平台。
28.本发明的有益效果是:
29.1.微小肿瘤组织块培养,采样需求量低;
30.2.培养条件容易可控;
31.3.实验周期短,3-7天可以出结果,且结果可视化强;
32.4.保留原始肿瘤组织的遗传特性、病理特性、对药物的敏感性;
33.5.制作成功率高、成本低。
附图说明
34.为了更清楚地说明本发明的技术方案,下面对本发明所需要使用的附图作简单的介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
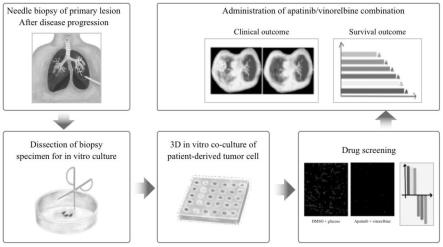
35.图1是本发明的临床药敏筛选平台的技术路线图。
36.图2是肺癌患者的微小组织块3d培养24-48小时后在荧光显微镜下的生长状况。
37.图3是肺癌患者的微小肿瘤组织块经长春瑞滨(抗血管生成药物)作用后的荧光强度。
38.图4是肺癌患者的微小肿瘤组织块经长春瑞滨+阿帕替尼(化疗+抗血管药物)作用后的荧光强度。
39.图5是肺癌患者的微小肿瘤组织块经紫杉醇(化疗药物,既往对此药物耐药)作用后的荧光强度。
40.图6是在本发明的药敏筛选平台指导下的肺癌患者临床案例疗效评价(分别为该患者接受长春瑞滨+阿帕替尼治疗前,治疗3月及治疗45月的ct图像)。
41.图7是在本发明的药明筛选平台指导下的30例肺癌患者临床案例疗效评价(30例患者,23例患者有效,有效率76.7%)。
42.图8是脂肪肉瘤患者的微小组织块3d培养24-48小时后在荧光显微镜下的生长状况。
43.图9是脂肪肉瘤患者的微小组织块经长春瑞滨+帕博利珠单抗(化疗+抗血管药物)作用后的荧光强度。
44.图10是在本发明的药敏筛选平台指导下的脂肪肉瘤患者临床案例疗效评价(分别为该患者接收长春瑞滨+帕博利珠单抗治疗前,治疗3月及治疗30月的ct图像)。
具体实施方式
45.下面将结合附图,对本发明中的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其它实施例,都属于本发明保护的范围。
46.实施例一、肺癌肿瘤组织块3d培养的临床药敏筛选平台的建立及应用
47.基于肿瘤组织块3d培养的临床药敏筛选平台的技术路线如图1所示,具体步骤如下:
48.1.取材
49.从恶性肿瘤患者(患者李某,确诊为晚期肺癌iv期,既往接受含有培美曲塞及紫杉醇的治疗方案,均耐药(肿块增大))病灶部位穿刺获取肺癌肿瘤组织块样本(符合伦理学,以及经过患者同意),一般使用tsk 18g/16g穿刺针,获取肺癌肿瘤组织块2-3条,大小(0.1-0.2)cm*(0.1-0.2)cm*(1-2)cm。
50.2.肺癌微小组织块培养基配置
51.肺癌微小组织块培养基成分:1%琼脂糖(invitrogen),10%fbs(gibco或者hyclone),2%基质胶(invitrogen),0.1% cd31单抗(sigma或者abcam),5% ebm2培养基(含有多种细胞因子,invitrogen),4℃存储备用。
52.注:cd31是肿瘤血管生成的重要分子,一旦血管生成,cd31会被消耗掉,并参与肿瘤血管生成的过程,进而在荧光显微镜下显示荧光。
53.3.样本处理与培养
54.立即在无菌条件下将收集到的肿瘤组织剪碎成微小肿瘤组织块,大约0.1cm*0.1cm*0.1cm大小,生理盐水冲洗后放置于每孔含有100-200ul肺癌微小组织块培养基的多孔板中培养。如图2所示,微小肿瘤组织块培养24-48小时后,微小肿瘤组织块生长良好,可以在荧光显微镜下观察到肿瘤新生血管密度均匀,标志着微小肿瘤组织块能够在一定范围内模拟肿瘤细胞在体生长状态,肿瘤微环境已构建。
55.4.药敏试验
56.在荧光显微镜下观察到密度均匀的肿瘤新生血管后,将培养好的微小肿瘤组织块均匀分布至每孔含有100-200ul肺癌微小组织块培养基的多孔板中,加入不同的抗肿瘤药物(例如培美曲塞、吉西他滨、阿帕替尼、紫杉醇、长春瑞滨、长春瑞滨+阿帕替尼)并设置对照组,对照组的对照剂是dmso,再培养24h-72h,在荧光显微镜下观察观察肿瘤新生血管的变化情况。
57.5.药敏结果分析
58.通过confocal荧光显微镜观察微小肿瘤组织块中新生血管的荧光强度,计算药敏抑制率,药敏抑制率(%)=(药物处理组的荧光强度/dmso组的荧光强度)*100%,得出最佳适应抗肿瘤药物并应用于临床实践,上述肺癌组织块3d培养的临床药敏结果见下表1。
59.表1.肺癌组织块3d培养的临床药敏结果
[0060][0061]
如图3所示,微小肿瘤组织块经长春瑞滨(抗血管生成药物)作用后的荧光强度较未作用前(如图2)明显降低。
[0062]
如图4所示,微小肿瘤组织块经长春瑞滨+阿帕替尼(化疗+抗血管药物)作用后的荧光强度较图3进一步降低。
[0063]
如图5所示,微小肿瘤组织块经紫杉醇(化疗药物,既往对此药物耐药)作用后的荧光强度较图2没有明显降低。
[0064]
6.临床疗效
[0065]
根据上述的试验结果,本发明的临床药敏筛选平台提示该患者对长春瑞滨+阿帕替尼治疗方案敏感,如图6所示,该患者接受长春瑞滨+阿帕替尼治疗前,治疗3月及治疗45月的ct图像,该患者病灶较前明显缩小,且控制时间近4年。
[0066]
7.临床队列
[0067]
如图7所示,在一项多达30例肺癌治疗耐药后的前瞻性队列中,接受本发明的药敏筛选平台提供的治疗方案,11例患者肿块较前明显缩小(肿瘤缩小比例超过30%),12例患者的肿瘤较前控制稳定(30例患者,23例患者有效,有效率76.7%),在此队列研究中,充分验证药敏试验平台与临床疗效的高度异质性。
[0068]
实施例二、脂肪肉瘤组织块3d培养的临床药敏筛选平台的建立及应用
[0069]
基于脂肪肉瘤组织块3d培养的临床药敏筛选平台的具体步骤如下:
[0070]
1.取材
[0071]
从恶性肿瘤患者(患者周某,确诊为左背部脂肪肉瘤iv期,腰大肌转移、肺转移,既往接受含有阿霉素、环磷酰胺及多柔比星的治疗方案,均耐药(肿块增大))病灶部位穿刺获取脂肪肉瘤样本(符合伦理学,以及经过患者同意),一般使用tsk 18g/16g穿刺针,获取肿瘤组织块2-3条,大小(0.1-0.2)cm*(0.1-0.2)cm*(1-2)cm。
[0072]
2.脂肪肉瘤微小组织块培养基配置
[0073]
脂肪肉瘤微小组织块培养基成分:1%琼脂糖(invitrogen),10%fbs(gibco或者hyclone),2%基质胶(invitrogen),0.1% cd31单抗(sigma或者abcam),5% ebm2培养基(含有多种细胞因子,invitrogen),后4℃存储备用。注:cd31是肿瘤血管生成的重要分子,一旦血管生成,cd31会被消耗掉,并参与肿瘤血管生成的过程,进而在荧光显微镜下显示荧光。
[0074]
3.样本处理与培养
[0075]
立即在无菌条件下将收集到的肿瘤组织剪碎成微小肿瘤组织块,大约0.1cm*0.1cm*0.1cm大小,生理盐水冲洗后放置于每孔含有100-200ul脂肪肉瘤组织块微小培养基的多孔板中培养。如图8所示,微小肿瘤组织块培养24-48小时后,微小肿瘤组织块生长良好,可以在荧光显微镜下观察到肿瘤新生血管密度均匀,标志着微小肿瘤组织块能够在一定范围内模拟肿瘤细胞在体生长状态,肿瘤微环境已构建。
[0076]
4.药敏试验
[0077]
在荧光显微镜下观察到密度均匀的肿瘤新生血管后,将培养好的微小肿瘤组织块均匀分布至每孔含有100-200ul脂肪肉瘤微小组织块培养基的多孔板中,加入不同的抗肿瘤药物(例如阿霉素、吉西他滨、环磷酰胺、帕博利珠单抗、长春瑞滨、长春瑞滨+帕博利珠单抗)并设置对照组,对照组的对照剂是dmso,再培养24h-72h,在荧光显微镜下观察观察肿瘤新生血管的变化情况。
[0078]
5.药敏结果分析
[0079]
通过confocal荧光显微镜观察肿瘤组织块中新生血管的荧光强度,计算药敏抑制率,药敏抑制率(%)=(药物处理组的荧光强度/dmso组的荧光强度)*100%
[0080]
得出最佳适应抗肿瘤药物并应用于临床实践,上述脂肪肉瘤组织块3d培养的临床药敏结果见下表2。
[0081]
表2.脂肪肉瘤组织块3d培养的临床药敏结果
[0082][0083]
如图9所示,微小肿瘤组织块经长春瑞滨+帕博利珠单抗作用后的荧光强度较未作用前(如图8)明显降低。
[0084]
6.临床疗效
[0085]
根据上述试验结果,药敏筛选平台提示该患者对长春瑞滨+帕博利珠单抗治疗方案敏感,如下图10所示,分别为该患者接收长春瑞滨+帕博利珠单抗治疗前,治疗3月及治疗30月的ct图像,该患者病灶较前明显缩小,且控制时间近3年。
[0086]
综上所述,本发明与现有技术的区别如下表3:
[0087]
表3.本发明与现有技术的区别
[0088][0089]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明保护的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1