靶向ROR1的抗原结合蛋白的制作方法
靶向ror1的抗原结合蛋白
技术领域
1.本技术涉及生物医药领域,具体的涉及一种靶向ror1的抗原结合蛋白。
背景技术:
2.ror1是一种跨膜受体酪氨酸激酶蛋白,人源ror1由一个胞外的免疫球蛋白样结构域(ig)、两个富含半胱氨酸的结构域(fzd)、近膜kringle结构域、单次跨膜结构以及一个胞内酪氨酸激酶结构域(tkd)、两个丝/苏氨酸富集结构域(s/trd)和一个脯氨酸富集结构域(prd)组成。通过介导多种信号通路的信号传递,调节细胞分裂、增殖、迁移和细胞趋化。在早期胚胎发育过程中高表达。伴随着胎儿发育的过程,ror1的表达量逐渐下降。
3.ror1在人正常组织中低表达或不表达,但是在多种血液瘤及实体瘤中高度表达。高表达ror1的血液瘤包括b细胞慢性淋巴细胞白血病(cll)、急性淋巴细胞白血病(all)、非霍奇金淋巴瘤(nhl)和髓系血液癌症。在实体瘤中,表达ror1的肿瘤包括三阴性乳腺癌、结肠癌、肺癌、胰腺癌、卵巢癌等,并且ror1的表达情况还与疾病的进展以及治疗效果密切相关。因此ror1可作为一种特异性的肿瘤标志物以及肿瘤治疗的一个潜在有吸引力的靶点。
技术实现要素:
4.本技术提供了一种靶向ror1的分离的抗原结合蛋白。在本技术中,所述分离的抗原结合蛋白能够特异性结合ror1抗原,并且具有较好的结合活性。本技术所述的分离的抗原结合蛋白能够与细胞(例如,a549细胞、mda mb231细胞、mec-ror1细胞、jeko-1细胞)表面表达的ror1结合。本技术所述的分离的抗原结合蛋白能够对肿瘤具有杀伤作用。
5.一方面,本技术提供了一种分离的抗原结合蛋白,其能够结合ror1(受体酪氨酸激酶孤儿受体1),所述分离的抗原蛋白包含cdr1,cdr2和cdr3,所述cdr1的氨基酸序列如seq id no:1所示,所述cdr2的氨基酸序列如seq id no:2所示,且所述cdr3的氨基酸序列如seq id no:3所示。
6.在某些实施方式中,所述分离的抗原结合蛋白为单域抗体。
7.在某些实施方式中,所述分离的抗原结合蛋白包含vhh。
8.在某些实施方式中,所述vhh的氨基酸序列如seq id no:8所示。
9.在某些实施方式中,所述分离的抗原结合蛋白包括抗体或其抗原结合片段。
10.在某些实施方式中,所述抗体选自下组:单克隆抗体、多克隆抗体、嵌合抗体、人源化抗体和全人源抗体。
11.在某些实施方式中,所述分离的抗原结合蛋白包含至少一个vhh片段。
12.在某些实施方式中,所述分离的抗原结合蛋白包含两个vhh片段。
13.在某些实施方式中,所述分离的抗原结合蛋白还包含fc区。
14.在某些实施方式中,所述fc区源自igg fc区。
15.在某些实施方式中,所述fc区源自人igg fc区。
16.在某些实施方式中,所述分离的抗原结合蛋白具有下述性质中的一种或多种:
17.(1)能够特异性结合ror1;以及
18.(2)能够与细胞表面表达的ror1结合。
19.另一方面,本技术还提供了药物分子,其包含所述分离的抗原结合蛋白。
20.另一方面,本技术还提供了核酸分子,其编码所述分离的抗原结合蛋白。
21.另一方面,本技术还提供了载体,其包含所述核酸分子。
22.另一方面,本技术还提供了细胞,其包含所述核酸分子,和/或所述载体。
23.另一方面,本技术还提供了药物组合物,其包含所述分离的抗原结合蛋白、所述药物分子、所述核酸分子、所述载体、和/或所述细胞,以及任选地药学上可接受的载体。
24.另一方面,本技术还提供了试剂盒,其包含所述分离的抗原结合蛋白,所述试剂盒能够检测样品中ror1的存在和/或含量。
25.另一方面,本技术还提供了所述分离的抗原结合蛋白、所述药物分子、所述核酸分子、所述载体、所述细胞、和/或所述药物组合物在制备药物中的用途,所述药物用于预防和/或治疗ror1相关的疾病和/或病症。
26.在某些实施方式中,所述疾病和/或病症包括肿瘤。
27.在某些实施方式中,所述肿瘤包括实体瘤和/或血液瘤。
28.在某些实施方式中,所述肿瘤包括ror1阳性肿瘤。
29.本领域技术人员能够从下文的详细描述中容易地洞察到本技术的其它方面和优势。下文的详细描述中仅显示和描述了本技术的示例性实施方式。如本领域技术人员将认识到的,本技术的内容使得本领域技术人员能够对所公开的具体实施方式进行改动而不脱离本技术所涉及发明的精神和范围。相应地,本技术的附图和说明书中的描述仅仅是示例性的,而非为限制性的。
附图说明
30.本技术所涉及的发明的具体特征如所附权利要求书所显示。通过参考下文中详细描述的示例性实施方式和附图能够更好地理解本技术所涉及发明的特点和优势。对附图简要说明如下:
31.图1显示的是本技术所述免疫后第1至第5天收集的免疫前和免疫后羊驼血清中的ror1特异性抗体滴度。
32.图2显示的是本技术所述从cdna库中扩增序列大小,图2a显示第一次pcr产生两组不同的扩增子,分子量约为0.7kb和0.9kb,图2b显示使用0.7kb的扩增子作为模板来扩增,得到片段大小为400bp左右的dna片段。
33.图3显示的是本技术所述在平板中通过系列稀释计算菌落数,进而估计文库大小所用的平板。
34.图4显示的是本技术所述对文库中90个序列的系统发育分析图。
35.图5显示的是本技术所述连续筛选三轮ror1的特异性抗原结合蛋白所用平板。
36.图6显示的是本技术所述elisa结果,图6a显示筛选后的序列od450值,图6b显示vhh1、vhh2、抗ror1 mab的od450值。
37.图7显示的是本技术所述纯化后抗原结合蛋白sds-page结果。
38.图8显示的是本技术所述纯化后抗原结合蛋白特异性结合重组ror1蛋白结果,图
8a显示筛选后抗原结合蛋白,图8b显示阴性对照、阳性对照结合效果。
39.图9显示的是本技术所述抗原结合蛋白的特异性验证结果。
40.图10显示的是本技术所述抗原结合蛋白结合表达ror1的a549细胞流式结果。
41.图11显示的是本技术所述抗原结合蛋白结合表达ror1的mb231细胞流式结果。
42.图12显示的是本技术所述抗原结合蛋白结合表达ror1的jeko-1细胞流式结果。
具体实施方式
43.以下由特定的具体实施例说明本技术发明的实施方式,本领域技术人员可由本说明书所公开的内容容易地了解本技术发明的其他优点及效果。
44.术语定义
45.在本技术中,术语“抗原结合蛋白”通常指包含结合抗原部分的蛋白质,以及任选地允许结合抗原的部分采用促进抗原结合蛋白与抗原结合的构象的支架或骨架部分。抗原结合蛋白的可包括但不限于抗体、抗原结合片段(fab,fab’,f(ab)2,fv片段,f(ab’)2,scfv,di-scfv和/或dab)、免疫缀合物、多特异性抗体(例如双特异性抗体)、抗体片段、抗体衍生物、抗体类似物或融合蛋白等,只要它们显示出所需的抗原结合活性即可。本技术的“分离的抗原结合蛋白”可以包含结合抗原的部分和任选地,允许抗原结合部分采用促进所述抗原结合部分结合抗原的构象的支架或构架部分。
46.在本技术中,术语“单域抗体”通常是指包含了抗体中单个可变域的片段,可以选择性地和特定抗原结合。本技术所述单域抗体可以包括一个重链可变域,本技术所述的单域抗体可以包括抗原结合片段,所述抗原结合片段可以包括vhh。
47.在本技术中,术语“多肽”通常是指氨基酸残基的聚合物。该术语也适用于其中一个或多个氨基酸残基是相应的天然存在的氨基酸的类似物或模拟物的氨基酸聚合物、以及天然存在的氨基酸聚合物。该术语也可包括例如通过添加糖残基以形成糖蛋白或被磷酸化而被修饰的氨基酸聚合物。多肽可由天然存在的和非重组的细胞或由遗传工程改造的或重组的细胞产生,并且可包含具有天然蛋白质的氨基酸序列的分子、或具有天然序列的一个或多个氨基酸的缺失、添加和/或取代的分子。术语“多肽”可以包括抗原结合片段、抗体或具有抗原结合片段的一个或多个氨基酸的缺失、添加和/或取代的序列。
48.在本技术中,术语“核酸”通常指核苷酸(例如核糖核苷酸或脱氧核糖核苷酸)的聚合物,并且可包括天然存在的(腺嘌呤、鸟嘌呤、胞嘧啶、尿嘧啶和胸腺嘧啶)、非天然存在的和经修饰的核酸。术语“核酸”可包括基因,cdna或mrna。例如,核酸分子可以是合成的(例如化学合成的)或重组的。核酸可以包括含有天然核苷酸的类似物或衍生物的核酸,其具有与参考核酸相似的结合特性并且以类似于天然存在的核苷酸的方式进行代谢。核酸序列还可以包括其保守修饰的变体(例如简并密码子取代),等位基因,直向同源物,snp和互补序列以及明确指出的序列。该术语不受聚合物的长度限制。核酸可以是单链或双链的,并且一般含有5
’‑3’
磷酸二酯键,核苷酸类似物可以具有其他连接。
49.在本技术中,术语“恒定区”通常是指除了可变区之外的抗体的结构域的总合。恒定区不直接涉及抗原的结合,但是显示不同的效应子功能。取决于它们重链的恒定区的氨基酸序列,抗体被分为下述类别:iga,igd,ige,igg和igm,并且这些中的一些可以被进一步分为类别如igg1,igg2,igg3,和igg4,iga1和iga2。对应于不同种类的抗体的重链恒定区分
别被称为α、δ、ε、γ和μ。
50.在本技术中,术语“抗原结合片段”通常是指一个与抗原结合或与抗原结合(即特异性结合)的完整抗体(即与它们所衍生的完整抗体)竞争的免疫球蛋白或抗体的多肽片段。所述抗原结合片段可以包括但不限于:fab、fab’、f(ab’)2和fv片段,vhh,线性抗体,单链抗体,双体抗体,以及由抗体片段形成的多特异性抗体。
51.在本技术中,术语“可变区”或“可变结构域”通常是指抗体轻链和/或重链的一部分,一般包括重链中的大约氨基末端的120-130个氨基酸和轻链中的大约100-110个氨基末端氨基酸。可变区一般在氨基酸序列中,甚至在相同物种的抗体中广泛不同。抗体的可变区可以决定其特定抗原的每种特定抗体的结合和特异性。序列的可变性集中在那些称作互补决定区(cdrs)的区域中,而可变区中保守性更高的区域称作构架区(fr)。轻链和重链的cdrs在其中可含有很大程度负责抗体与抗原的直接相互作用的氨基酸。
52.在本技术中,术语“药物分子”通常可以包含任何本领域已知的药物形式。例如,所述药物分子可以是蛋白。例如,所述药物分子可以是多肽。例如,所述药物分子可以是不同形态的药物的结合物。例如,所述药物分子中可以包括小分子药物。
53.在本技术中,术语“细胞”通常是指可以或已经含有包括本技术所述的核酸分子的质粒或载体,或者能够表达本技术所述的融合蛋白或其抗原结合片段的个体细胞,细胞系或细胞培养物。所述细胞可以包括单个细胞的子代。由于天然的,意外的或故意的突变,子代细胞与原始亲本细胞在形态上或在基因组上可能不一定完全相同,但能够表达本技术所述的抗原结合蛋白即可。所述细胞可以通过使用本技术所述的载体体外转染细胞而得到。所述细胞可以是原核细胞(例如大肠杆菌),也可以是真核细胞(例如酵母细胞,例如cos细胞,中国仓鼠卵巢(cho)细胞,hela细胞,hek293细胞,cos-1细胞,ns0细胞或骨髓瘤细胞)。
54.在本技术中,术语“载体”通常是指能够在合适的宿主中自我复制的核酸分子,其将插入的核酸分子转移到细胞(例如,宿主细胞)中和/或细胞之间。所述载体可包括主要用于将dna或rna插入细胞中的载体、主要用于复制dna或rna的载体,以及主要用于dna或rna的转录和/或翻译的表达的载体。所述载体还包括具有多种上述功能的载体。所述载体可以是当引入合适的细胞时能够转录并翻译成多肽的多核苷酸。通常,通过培养包含所述载体的合适的细胞,所述载体可以产生期望的表达产物。在本技术中,所述载体可以为质粒。
55.在本技术中,术语“药学上可接受的”通常是指不干扰活性成分的生物活性的有效性的无毒材料。此类制剂可以常规地含有药学上可接受浓度的盐、缓冲剂、防腐剂、相容的载体、补充的免疫增强剂,如佐剂和细胞因子和任选其他治疗剂,如化学治疗剂。
56.在本技术中,术语“互补决定区”或术语“cdr”通常是指在抗体可变序列内的互补性决定区。在重链和/或轻链的每个可变区中存在3个cdrs,所述cdrs对于每个可变区命名为cdr1、cdr2和cdr3。如本文使用的,cdr组合可指在能够结合抗原的单个可变区中出现的3个cdrs的组。这些cdrs的确切边界已根据不同系统不同地限定。由kabat(kabat等人,sequences of proteins of immunological interest national institutes of health,bethesda,md.(1987)和(1991))描述的系统,不仅提供了可应用于抗体的任何可变区的明确残基编号系统,还提供了限定3个cdrs的精确残基边界。这些cdrs可以被称为kabat cdrs。chothia和同事(chothia和lesk,j.mol.biol.196:901-917(1987)以及chothia等人,nature 342:877-883(1989))发现kabat cdrs内的某些亚部分采取几乎相同
的肽主链构象,尽管在氨基酸序列水平上具有大的多样性。这些亚部分命名为l1、l2和l3或h1、h2和h3,其中“l”和“h”分别指轻链和重链区域。这些区域可以被称为chothia cdrs,所述chothia cdrs具有与kabat cdrs重叠的边界。与kabat cdrs重叠的限定cdrs的其他边界已由padlan(faseb j.9:133-139(1995))和maccallum(j mol biol 262(5):732-45(1996))描述。在其他的cdr边界定义可能不严格地遵循上述系统之一,但仍将与kabat cdrs重叠,尽管按照特定残基或残基组或甚至整个cdrs并不显著影响抗原结合的预测或实验发现,它们可以缩短或加长。本文所述cdrs,可使用imgt划分方式进行定义。
57.在本技术中,术语“药物组合物”通常是指涉及适合施用于患者、可以是人患者的组合物。例如,本技术所述的药物组合物,其可以包含本技术所述的抗原结合蛋白、本技术所述的免疫缀合物、本技术所述的核酸分子、本技术所述的载体和/或本技术所述的细胞,以及任选地药学上可接受的载剂。此外,所述药物组合物还可以包含一种或多种(药学上有效的)载剂、稳定剂、赋形剂、稀释剂、增溶剂、表面活性剂、乳化剂和/或防腐剂的合适的制剂。组合物的可接受成分在所用剂量和浓度下对接受者无毒。本发明的药物组合物可以包括但不限于液体、冷冻和冻干组合物。
58.在本技术中,术语“ror1”通常指受体酪氨酸激酶孤儿受体1。在本技术中,该术语涵盖ror1全长及其功能活性片段或其变体。例如,该术语可以包括ror1的ig样结构域和/或卷曲结构域。例如,该术语可以包括ror1的第30-305位氨基酸。例如,全长的人ror1抗原的序列可以在genebank登录号q01973下记载。
59.本技术中所述的蛋白还可包括其功能性变体、衍生物、类似物、同源物及其片段。
60.术语“功能性变体”指与天然存在序列具有基本上同一的氨基酸序列或由基本上同一的核苷酸序列编码并能够具有天然存在序列的一种或多种活性的多肽。在本技术的上下文中,任何给定序列的变体是指其中残基的特定序列(无论是氨基酸或核苷酸残基)已经经过修饰而使得所述多肽或多核苷酸基本上保留至少一种内源功能的序列。可以通过天然存在的蛋白质和/或多核苷酸中存在的至少一个氨基酸残基和/或核苷酸残基的添加、缺失、取代、修饰、替换和/或变异来获得变体序列,只要保持原来的功能活性即可。
61.在本技术中,术语“衍生物”通常是指本技术的多肽或多核苷酸而言包括自/对序列的一个(或多个)氨基酸残基的任何取代、变异、修饰、替换、缺失和/或添加,只要所得的多肽或多核苷酸基本上保留其至少一种内源功能。
62.在本技术中,术语“类似物”通常对多肽或多核苷酸而言,包括多肽或多核苷酸的任何模拟物,即拥有该模拟物模拟的多肽或多核苷酸的至少一种内源功能的化学化合物。
63.通常,可以进行氨基酸取代,例如至少1个(例如,1、2、3、4、5、6、7、8、9、10或20个以上)氨基酸取代,只要经修饰的序列基本上保持需要的活性或能力。氨基酸取代可包括使用非天然存在的类似物。
64.用于本技术的蛋白质或多肽也可以具有氨基酸残基的缺失、插入或取代,所述氨基酸残基产生沉默的变化并导致功能上等同的蛋白质。可以根据残基的极性、电荷、溶解性、疏水性、亲水性和/或两性性质的相似性进行有意的氨基酸取代,只要保留内源性功能即可。例如,带负电荷的氨基酸包括天冬氨酸和谷氨酸;带正电荷的氨基酸包括赖氨酸和精氨酸;并且含具有相似亲水性值的不带电极性头基的氨基酸包括天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸和酪氨酸。
65.发明详述
66.分离的抗原结合蛋白
67.一方面,本技术提供了一种分离的抗原结合蛋白,其可以包含抗体重链可变区vh中的至少一个cdr,所述cdr可以是hcdr1,hcdr2和/或hcdr3。所述重链可变区vh可包含seq id no:8所示的氨基酸序列。在本技术中,所述分离的抗原结合蛋白的hcdr序列可以包含使用任何方式划分得到的hcdr序列,只要vh序列与seq id no:8所示的氨基酸序列相同,使用任何方式划分得到的hcdr序列都在本技术的保护范围中。在某些具体实施方式中,可以使用imgt划分cdr。
68.在本技术中,所述分离的抗原结合蛋白可以包含hcdr3,所述hcdr3可包含seq idno:3所示的氨基酸序列。
69.在本技术中,所述分离的抗原结合蛋白可以包含hcdr2,所述hcdr2可包含seq idno:2所示的氨基酸序列。
70.在本技术中,所述分离的抗原结合蛋白可以包含hcdr1,所述hcdr1可包含seq idno:1所示的氨基酸序列。
71.在本技术中,所述分离的抗原结合蛋白可以包含hcdr1,hcdr2和hcdr3,所述hcdr1可包含seq id no:1所示的氨基酸序列,所述hcdr2可包含seq id no:2所示的氨基酸序列,且所述hcdr3可包含seq id no:3所示的氨基酸序列。
72.在本技术中,所述分离的抗原结合蛋白的vh可以包含框架区h-fr1,h-fr2,h-fr3和/或h-fr4。
73.在本技术中,所述分离的抗原结合蛋白可以包含h-fr1,所述h-fr1的c末端与所述hcdr1的n末端可以直接或间接相连,且所述h-fr1可以包含seq id no:4所示的氨基酸序列。
74.在本技术中,所述分离的抗原结合蛋白可以包含h-fr2,所述h-fr2可以位于所述hcdr1和所述hcdr2之间,且所述h-fr2可以包含seq id no:5所示的氨基酸序列。
75.在本技术中,所述分离的抗原结合蛋白可以包含h-fr3,所述h-fr3可以位于所述hcdr2和所述hcdr3之间,且所述h-fr3可以包含seq id no:6所示的氨基酸序列。
76.在本技术中,所述分离的抗原结合蛋白可以包含h-fr4,所述h-fr4的n末端与所述hcdr3的c末端可以直接或间接相连,且所述h-fr4可以包含seq id no:7所示的氨基酸序列。
77.在本技术中,所述的分离的抗原结合蛋白可以包含h-fr1,h-fr2,h-fr3和h-fr4,所述h-fr1可以包含seq id no:4所示的氨基酸序列,所述h-fr2可以包含seq id no:5所示的氨基酸序列,所述h-fr3可以包含seq id no:6所示的氨基酸序列,且所述h-fr4可以包含seq id no:7所示的氨基酸序列。
78.在本技术中,所述的分离的抗原结合蛋白可以包含hcdr1,hcdr2,hcdr3,h-fr1,h-fr2,h-fr3和/或h-fr4,且所述h-fr1的c末端与所述hcdr1的n末端直接或间接相连,所述h-fr2位于所述hcdr1和所述hcdr2之间,所述h-fr3位于所述hcdr2和所述hcdr3之间,所述h-fr4的n末端与所述hcdr3的c末端直接或间接相连。在本技术中,直接或间接相连可以通过分子间作用力连接,或者可以通过连接子连接。
79.在本技术中,所述的分离的抗原结合蛋白,其可以包含重链可变区vh,所述vh可以
包含seq id no:8所示的氨基酸序列。
80.在本技术中,所述的分离的抗原结合蛋白,其可以包含重链恒定区,且所述重链恒定区可以包含fc片段。所述fc区可以源自igg fc区,例如,人igg fc区;例如,igg1 fc区;例如igg4 fc区。例如,所述fc片段可以包括其变体,所述变体可以包括所述fc片段的氨基酸序列经过取代、缺失和/或添加一个或多个氨基酸。例如1-30个、1-20个或1-10个,又例如1个、2个、3个、4个、5个、6个、7个、8个或9个氨基酸取代、缺失和/或插入;或者可以涵盖其同源物,所述同源物可以为与所述fc片段的氨基酸序列具有至少约85%(例如,具有至少约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高的)序列同源性的氨基酸序列。
81.在本技术中,所述的分离的抗原结合蛋白,其可以包括抗体或其抗原结合片段。
82.在某些实施方式中,所述的分离的抗原结合蛋白,其中所述抗原结合片段可以选自下组:fab,fab’,f(ab)2,fv片段,f(ab’)2,scfv,di-scfv,vhh和/或dab。
83.在本技术中,所述的分离的抗原结合蛋白,其中所述抗体可以选自下组:单克隆抗体、单链抗体、嵌合抗体、人源化抗体和全人源抗体。
84.单域抗体
85.在本技术中,所述分离的抗原结合蛋白可以为单域抗体。
86.在本技术中,所述单域抗体可以包含抗体重链可变区vhh中的至少一个cdr,所述cdr可以是cdr3,cdr2和/或cdr1。所述重链可变区vhh可以包含seq id no:8所示的氨基酸序列。
87.在本技术中,所述单域抗体可以包含cdr3,所述cdr3可以包含seq id no:3所示的氨基酸序列。
88.在本技术中,所述单域抗体可以包含cdr2,所述cdr2可以包含seq id no:2所示的氨基酸序列。
89.在本技术中,所述单域抗体可以包含cdr1,所述cdr1可以包含seq id no:1所示的氨基酸序列。
90.在本技术中,所述单域抗体可以包含cdr1,cdr2和cdr3,所述cdr1可以包含seq id no:1所示的氨基酸序列,所述cdr2可以包含seq id no:2所示的氨基酸序列,且所述cdr3可以包含seq id no:3所示的氨基酸序列。
91.在本技术中,所述单域抗体可以包含fr1,所述fr1的c末端与所述cdr1的n末端可以直接或间接相连,且所述fr1可以包含seq id no:4所示的氨基酸序列。
92.在本技术中,所述单域抗体可以包含fr2,所述fr2可以位于所述cdr1和所述cdr2之间,且所述fr2可以包含seq id no:5所示的氨基酸序列。
93.在本技术中,所述单域抗体可以包含fr3,所述fr3可以位于所述cdr2和所述cdr3之间,且所述fr3可以包含seq id no:6所示的氨基酸序列。
94.在本技术中,所述单域抗体可以包含fr4,所述fr4的n末端与所述cdr3的c末端可以直接或间接相连,且所述fr4可以包含seq id no:7所示的氨基酸序列。
95.在本技术中,所述单域抗体可以包含fr1,fr2,fr3和fr4,所述fr1可以包含seq id no:4所示的氨基酸序列,所述fr2可以包含seq id no:5所示的氨基酸序列,所述fr3可以包含seq id no:6所示的氨基酸序列,且所述fr4可以包含seq id no:7所示的氨基酸序列。
96.在本技术中,所述单域抗体可以包含cdr1,cdr2,cdr3,fr1,fr2,fr3和/或fr4,且所述fr1的c末端与所述cdr1的n末端直接或间接相连,所述fr2位于所述cdr1和所述cdr2之间,所述fr3位于所述cdr2和所述cdr3之间,所述fr4的n末端与所述cdr3的c末端直接或间接相连。在本技术中,直接或间接相连可以通过分子间作用力连接,或者可以通过连接子连接。
97.在本技术中,所述的单域抗体,其可以包含重链可变区vhh,所述vhh可以包含seq id no:8所示的氨基酸序列。
98.在本技术中,所述的单域抗体,其可以包含重链恒定区,且所述重链恒定区可以包含fc片段。例如,所述fc片段可以包括其变体,所述变体可以包括所述fc片段的氨基酸序列经过取代、缺失和/或添加一个或多个氨基酸。例如1-30个、1-20个或1-10个,又例如1个、2个、3个、4个、5个、6个、7个、8个或9个氨基酸取代、缺失和/或插入;或者可以涵盖其同源物,所述同源物可以为与所述fc片段的氨基酸序列具有至少约85%(例如,具有至少约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%或更高的)序列同源性的氨基酸序列。
99.多肽、药物分子、核酸、载体、细胞、制备方法
100.另一方面,本技术提供了一种多肽,其可以包含所述的分离的抗原结合蛋白。
101.另一方面,本技术提供了一种药物分子,其可以包含所述的分离的抗原结合蛋白
102.另一方面,本技术提供了分离的一种或多种核酸分子,所述一种或多种核酸分子可编码本技术所述的分离的抗原结合蛋白或所述的多肽。例如,所述一种或多种核酸分子中的每一个核酸分子可以编码完整的所述分离的抗原结合蛋白或所述的多肽,也可以编码其中的一部分。本技术所述的核酸分子可以为分离的。在本技术中,可以通过本领域已知的多种方法来制备编码所述分离的抗原结合蛋白或所述的多肽的核酸。
103.另一方面,本技术提供了一种或多种载体,其包含本技术所述的一种或多种核酸分子。每种载体中可包含一种或多种所述核酸分子。此外,所述载体中还可包含其他基因,例如允许在适当的宿主细胞中和在适当的条件下选择该载体的标记基因。此外,所述载体可以含有多种控制表达的元件,包括启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,所述载体还可以含有复制起始位点。此外,所述载体可以包括,例如质粒、粘粒、病毒、噬菌体或者在例如遗传工程中通常使用的其他载体。
104.另一方面,本技术提供了一种细胞,所述细胞可包含本技术所述的一种或多种核酸分子和/或本技术所述的一种或多种载体。在某些实施方式中,每种或每个细胞可包含一个或一种本技术所述的核酸分子或载体。在某些实施方式中,每种或每个细胞可包含多个(例如,2个或以上)或多种(例如,2种或以上)本技术所述的核酸分子或载体。例如,可将本技术所述的载体引入所述细胞中,例如原核细胞(例如,细菌细胞)、cho细胞、ns/0细胞、hek293细胞,或者其他真核细胞,如来自植物的细胞、真菌或酵母细胞等。可通过本领域已知的方法将本技术所述的载体引入所述细胞中,例如电穿孔、lipofectine转染、lipofectamin转染等。
105.另一方面,本技术提供了制备本技术所述的分离的抗原结合蛋白或所述的多肽的方法。所述方法可包括,在使得所述分离的抗原结合蛋白或所述的多肽表达的条件下,培养本技术所述的细胞。例如,可通过使用适当的培养基、适当的温度和培养时间等,这些方法
是本领域普通技术人员所了解的。
106.药物组合物,应用
107.另一方面,本技术提供了一种药物组合物,其包含所述的分离的抗原结合蛋白,所述的多肽,所述的药物分子,所述的核酸分子,所述的载体,所述的细胞,和/或药学上可接受的载体。
108.例如,所述药学上可接受的载体可以包括缓冲剂、抗氧化剂、防腐剂、低分子量多肽、蛋白质、亲水聚合物、氨基酸、糖、螯合剂、反离子、金属复合物和/或非离子表面活性剂等。
109.在本技术中,所述药物组合物可被配制用于口服给药,静脉内给药,肌肉内给药,在肿瘤部位的原位给药,吸入,直肠给药,阴道给药,经皮给药或通过皮下储存库给药。所述药物组合物可以用于抑制肿瘤生长。例如,本技术的药物组合物可以抑制或延缓疾病的发展或进展,和/或可以减轻和/或稳定疾病状态。
110.本技术所述的药物组合物可以包含预防和/或治疗有效量的所述分离的抗原结合蛋白。所述预防和/或治疗有效量是能够预防和/或治疗(至少部分治疗)患有或具有发展风险的受试者中的疾病或病症和/或其任何并发症而所需的剂量。
111.另一方面,本技术提供了一种可以用于检测或测定ror1的方法,所述方法可以包括使用所述的分离的抗原结合蛋白或所述的多肽。
112.另一方面,本技术提供了一种可以用于检测或测定样品中ror1的试剂盒,所述试剂盒可以包括所述的分离的抗原结合蛋白或所述的多肽。
113.另一方面,本技术提供了一种所述的分离的抗原结合蛋白,所述的多肽,所述的药物分子,所述的分离的核酸分子,所述的载体,所述的细胞和/或所述的药物组合物在制备预防和/或治疗疾病和/或病症的药物中的用途。
114.另一方面,本技术提供了所述分离的抗原结合蛋白,所述的多肽,所述的药物分子,所述的分离的核酸分子,所述的载体,所述的细胞和/或所述的药物组合物,其制备预防或治疗疾病或病症。
115.另一方面,本技术提供了预防或治疗疾病的方法,其包括向有需要的受试者施用本技术所述的分离的抗原结合蛋白,所述的多肽,所述的药物分子,所述的分离的核酸分子,所述的载体,所述的细胞和/或所述的药物组合物。
116.在本技术中,所述的用途中所述疾病和/或病症可以由ror1异常表达引起或介导。
117.在本技术中,所述疾病和/或病症可以包含肿瘤。例如,所述肿瘤可以包含实体瘤和/或血液瘤。例如,所述肿瘤可以为ror1阳性肿瘤。
118.本技术还提供了以下实施方案:
119.1.分离的抗原结合蛋白,其包含抗体重链可变区vh中的至少一个cdr,所述抗体重链可变区包含seq id no:8所示的氨基酸序列。
120.2.根据实施方案1所述的分离的抗原结合蛋白,其包含hcdr1,hcdr2和hcdr3,所述hcdr1包含seq id no:1所示的氨基酸序列,所述hcdr2包含seq id no:
121.2所示的氨基酸序列,且所述hcdr3包含seq id no:3所示的氨基酸序列。
122.3.根据实施方案1-2中任一项所述的分离的抗原结合蛋白,其包含h-fr1,所述h-fr1的c末端与所述hcdr1的n末端直接或间接相连,且所述h-fr1包含seq id no:
123.4所示的氨基酸序列。
124.4.根据实施方案1-3中任一项所述的分离的抗原结合蛋白,其包含h-fr2,所述h-fr2位于所述hcdr1和所述hcdr2之间,且所述h-fr2包含seq id no:5所示的氨基酸序列。
125.5.根据实施方案1-4中任一项所述的分离的抗原结合蛋白,其包含h-fr3,所述h-fr3位于所述hcdr2和所述hcdr3之间,且所述h-fr3包含seq id no:6所示的氨基酸序列。
126.6.根据实施方案1-5中任一项所述的分离的抗原结合蛋白,其包含h-fr4,所述h-fr4的n末端与所述hcdr3的c末端直接或间接相连,且所述h-fr4包含seq id no:7所示的氨基酸序列。
127.7.根据实施方案1-6中任一项所述的分离的抗原结合蛋白,其包含重链可变区vh,所述vh包含seq id no:8所示的氨基酸序列。
128.8.根据实施方案1-7中任一项所述的分离的抗原结合蛋白,其还包含抗体重链恒定区。
129.9.根据实施方案8所述的分离的抗原结合蛋白,其中所述抗体重链恒定区包含fc片段。
130.10.根据实施方案9所述的分离的抗原结合蛋白,其包括抗体或其抗原结合片段。
131.11.根据实施方案10所述的分离的抗原结合蛋白,其中所述抗原结合片段选自下组:fab,fab’,f(ab)2,fv片段,f(ab’)2,scfv,di-scfv,vhh和/或dab。
132.12.根据实施方案10-11中任一项所述的分离的抗原结合蛋白,其中所述抗体选自下组:单克隆抗体、单链抗体、嵌合抗体、人源化抗体和全人源抗体。
133.13.根据实施方案1-12中任一项所述的分离的抗原结合蛋白,其为单域抗体。
134.14.根据实施方案13所述的分离的抗原结合蛋白,其中所述单域抗体包含cdr1,cdr2和cdr3,所述cdr1包含seq id no:1所示的氨基酸序列,所述cdr2包含seq id no:2所示的氨基酸序列,且所述cdr3包含seq id no:3所示的氨基酸序列。
135.15.根据实施方案1-14中任一项所述的分离的抗原结合蛋白,其包含vhh,所述vhh包含seq id no:8所示的氨基酸序列。
136.16.根据实施方案1-15中任一项所述的分离的抗原结合蛋白,其具有下述性质中的一种或多种:
137.(1)能够特异性结合ror1;以及
138.(2)能够与细胞表面表达的ror1结合。
139.17.根据实施方案16所述的分离的抗原结合蛋白,其中所述ror1包含ror1的ig样结构域和卷曲结构域。
140.18.根据实施方案16-17中任一项所述的分离的抗原结合蛋白,其中所述ror1包含ror1的q30-d305位氨基酸序列。
141.19.多肽,其包含实施方案1-18中任一项所述的分离的抗原结合蛋白。
142.20.药物分子,其包含实施方案1-18中任一项所述的分离的抗原结合蛋白。
143.21.核酸分子,其编码实施方案1-18中任一项所述的分离的抗原结合蛋白,或实施方案19所述的多肽。
144.22.载体,其包含实施方案21所述的核酸分子。
145.23.细胞,其包含实施方案1-18中任一项所述的分离的抗原结合蛋白,实施方案19
所述的多肽,实施方案20所述的药物分子,实施方案21所述的核酸分子和/或实施方案22所述的载体。
146.24.制备实施方案1-18中任一项所述的分离的抗原结合蛋白或实施方案19所述的多肽的方法,所述方法包括在使得实施方案1-18中任一项所述的分离的抗原结合蛋白或实施方案19所述的多肽表达的条件下,培养实施方案23所述的细胞。
147.25.药物组合物,其包含实施方案1-18中任一项所述的分离的抗原结合蛋白,实施方案19所述的多肽,实施方案20所述的药物分子,实施方案21所述的核酸分子,实施方案22所述的载体,实施方案23所述的细胞,和/或药学上可接受的载体。
148.26.一种用于检测ror1的存在和/或含量的方法,所述方法包括使用实施方案1-18中任一项所述的分离的抗原结合蛋白或实施方案19所述的多肽。
149.27.试剂盒,其包含实施方案1-18中任一项所述的分离的抗原结合蛋白或实施方案19所述的多肽,所述试剂盒用于检测或测定样品中ror1的存在和/或含量。
150.28.实施方案1-18中任一项所述的分离的抗原结合蛋白、实施方案19所述的多肽、实施方案20所述的药物分子、实施方案21所述的核酸分子、实施方案22所述的载体、实施方案23所述的细胞、实施方案25所述的药物组合物在制备药物中的用途,所述药物用于预防和/或治疗ror1表达相关的疾病和/或病症。
151.29.根据实施方案28所述的用途,其中所述疾病和/或病症包括肿瘤。
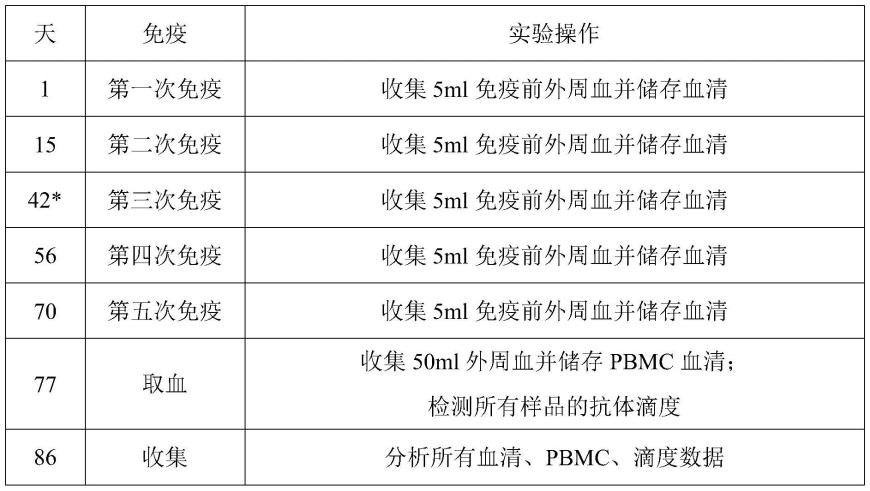
152.30.根据实施方案29所述的用途,其中所述肿瘤包括实体瘤和/或血液瘤。
153.31.根据实施方案29-30中任一项所述的用途,其中所述肿瘤包括ror1阳性肿瘤。
154.32.一种预防和/或治疗ror1表达相关的疾病和/或病症的方法,其包括向有需要的受试者施用实施方案1-18中任一项所述的分离的抗原结合蛋白、实施方案19所述的多肽、实施方案20所述的药物分子、实施方案21所述的核酸分子、实施方案22所述的载体、实施方案23所述的细胞和/或实施方案25所述的药物组合物。
155.33.根据实施方案32所述的方法,其中所述疾病和/或病症包括肿瘤。
156.34.根据实施方案33所述的方法,其中所述肿瘤包括实体瘤和/或血液瘤。
157.35.根据实施方案33-34中任一项所述的方法,其中所述肿瘤为ror1阳性肿瘤。
158.36.实施方案1-18中任一项所述的分离的抗原结合蛋白、实施方案19所述的多肽、实施方案20所述的药物分子、实施方案21所述的核酸分子、实施方案22所述的载体、实施方案23所述的细胞和/或实施方案25所述的药物组合物,其用于预防和/或治疗ror1表达相关的疾病和/或病症。
159.37.根据实施方案36所述的分离的抗原结合蛋白、所述的多肽、所述的药物分子、所述的核酸分子、所述的载体、所述的细胞和/或所述的药物组合物,其中所述疾病和/或病症包括肿瘤。
160.38.根据实施方案37所述的分离的抗原结合蛋白,其中所述肿瘤为实体瘤和/或血液瘤
161.39.根据实施方案37-38中任一项所述的分离的抗原结合蛋白,其中所述肿瘤为ror1阳性肿瘤。
162.不欲被任何理论所限,下文中的实施例仅仅是为了阐释本技术发明的各个技术方案,而不用于限制本技术发明的范围。
163.实施例
164.实施例1动物免疫
165.实验过程按照以下步骤进行:
166.(1)用新鲜制备的免疫原每隔两周对一只2.5岁的未免疫雌性羊驼进行五次免疫(参见表1.免疫时间表),将免疫原分装若干份(每份用于一次免疫),并在-80℃下储存;
167.(2)第一次免疫时,将300μg免疫原与等体积的弗氏完全佐剂(cfa)混合制成乳剂,随后的免疫(第2次至第5次)将300μg免疫原与等体积的弗氏不完全佐剂(cfa)混合佐剂(ifa)制成乳液(所有疫苗接种实验均经当地伦理委员会批准);
168.(3)每次免疫原给药前(第1~5次),取颈静脉血样5ml,回收血清作为免疫后含igg样品,用于抗原特异性抗体滴度;
169.(4)最后一次免疫接种后7天,收集50ml血液并用ficoll-paque
tm
plus media(gehealthcare,美国)从全血中分离外周血单核细胞(pbmc),在trizol中裂解pbmc,用于以后的总rna提取;
170.(5)elisa比较免疫前和免疫后血清的滴度,以测量抗原诱导的血清转化,在每个出血时间点对每个稀释的血清样品进行一次实验。
171.实验结果如图1所示,免疫血清对重组ror1蛋白显示出明显的反应,免疫后第3~5次血清中ror1特异性抗体滴度均达到1/100,000以上。
172.表1.免疫时间表
[0173][0174]
(*由于在羊驼农场进行covid-19检疫隔离,第3次免疫推迟了两周)
[0175]
实施例2免疫噬箘体库建立
[0176]
实验过程按以下步骤进行:
[0177]
(1)从50ml外周血中分离pbmc并提取总rna后,使用rna作为模板通过市售试剂制备cdna,制备体系见表2;
[0178]
(2)从cdna库中扩增vhh序列,转化到tgi细胞后,根据90mm平板上电转大肠杆菌细胞悬浮液的一系列稀释液中的菌落数,计算文库大小;
[0179]
(3)进行菌落测序和生物信息学分析。
[0180]
实验结果显示,第一次pcr产生两组不同的扩增子,分子量约为0.7kb和0.9kb(图2a),使用0.7kb的扩增子作为模板来扩增vhh,得到片段大小为400bp左右的dna片段(图2b),扩增后文库大小为1.4
×
108(图3),对文库中的90个序列进行系统发育分析,随机挑取96个单菌落进行菌落测序,vhh正确插入噬菌体的比例为93.8%(90/96),特异性vhh序列的比例为96.7%(87/90)(图4)。
[0181]
表2.总rna、cdna和pcr产物的产量
[0182][0183][0184]
实施例3抗原特异性抗原结合蛋白筛选
[0185]
通过监测平板上生长的菌落数量,连续筛选三轮,得到ror1的特异性抗原结合蛋白(图5)。每轮筛选后,ror1包被组的菌落数增加,表明ror1特异性的抗原结合蛋白得到富集。r1、r2和r3分别代表第1轮、第2轮和第3轮筛选结果,nc代表阴性对照。
[0186]
实施例4抗原结合蛋白识别和验证
[0187]
(1)将进行3轮筛选后的特异性抗原结合蛋白进行验证,使用周质提取物进行elisa鉴定,得到抗原阳性克隆;
[0188]
(2)然后通过菌落测序获得阳性克隆的dna序列,鉴定特异性序列;
[0189]
(3)对特异性序列进行重组生产和纯化,检测纯度以确定是否满足后续检测需求;
[0190]
(4)进一步检测抗原结合蛋白对ror1蛋白的亲和性和特异性。
[0191]
实验结果显示,5-26(vhh序列如seq id no:8所示)的od450值高于5-09(vhh序列如seq id no:11所示)和5-95(vhh序列如seq id no:12所示)(图6a)。其中,5-26包含如seq id no:1所示的cdr1,如seq id no:2所示的cdr2,以及如seq id no:3所示的cdr3。两种非特异性vhh(vhh1:序列如seq id no:9;vhh2:序列如seq idno:10所示)与重组ror1蛋白不结合,抗ror1 mab与重组ror1蛋白结合良好(图6b)。该实验结果进一步说明,5-26,5-09和5-95特异性结合重组ror1蛋白,但是5-26结合能力明显优于其他两组。
[0192]
纯化后的sds-page结果显示,抗原结合蛋白(每种约0.5mg)的纯度超过90%,满足后续功能测试的要求(图7),纯化后的抗原结合蛋白5-26,5-9,5-95特异性结合重组ror1蛋白(图8a),阴性对照vhh1和vhh2不结合ror1蛋白,阳性对照结合ror1蛋白(图8b)。该实验结果表明,与5-9和5-95相比,5-26在多个稀释倍数下都可以以较高浓度与ror1蛋白结合,且特异性良好。
[0193]
同时,特异性评价显示,纯化后的抗原结合蛋白5-26,5-9,5-95只与重组ror1蛋白
结合,不与其它两种带his标签的蛋白(pd-l1和rbd)结合,表明所选的抗原结合蛋白不识别其他标签。抗ror1 mab(阳性对照)仅与重组ror1蛋白结合。anti-his mab(sinobiological,#105327-mm02t-h)可以与所有三种his标签的蛋白(pd-l1、rbd、ror1)结合(图9)。实验中使用的纯化后抗原结合蛋白浓度均为3μg/ml,其蛋白的c端都包含一个his标签和一个ha标签,用于识别的二抗是hrp抗ha标签抗体(abcam,#ab1190)。该实验结果说明,5-26对ror1蛋白特异性良好,基本不与pd-l1和rbd结合。
[0194]
anti-ror 1mab:ror1 mouse monoclonal antibody,from proteintech(catalog no.:66923-1-ig),分子量130kda,可用于fc,if,ihc,wb,elisa等应用。
[0195]
实施例5抗原结合蛋白结合表达ror1的细胞系
[0196]
在a549、mb231、jeko-1细胞中表达ror1,每孔1.5-2.0
×
105细胞,将抗原结合蛋白以1μg/ml的浓度在4℃条件下与细胞共孵育30分钟,使用anti-ha apc进行染色,流式分析结果显示,在a549细胞中,5-26结合细胞的比率达到97.0%,5-9为18.5%,5-95为11.8%(图10),在mb231细胞中,5-26结合细胞的比率达到96.8%,5-9为61.7%,5-95为53.3%(图11),在jeko-1细胞中,5-26结合细胞的比率达到99.7%,5-9为1.90%,5-95为1.18%(图12)。该实验结果说明,与5-9和5-95相比,5-26结合表达ror1的细胞系的能力更强。
[0197]
前述详细说明是以解释和举例的方式提供的,并非要限制所附权利要求的范围。目前本技术所列举的实施方式的多种变化对本领域普通技术人员来说是显而易见的,且保留在所附的权利要求和其等同方式的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1