一种用于在线光透明和在线观察的器官芯片
1.本实用新型属于器官芯片、生物医学工程、组织光学领域,更具体地,涉及一种用于在线光透明和在线观察的器官芯片。
背景技术:
2.器官芯片是通过细胞在体外芯片中进行培养,实现模拟生物体器官功能的一项新兴科学技术。通过巧妙的仿生设计,器官芯片可以在一定程度上模拟真实器官的形态和功能,可以为医学、药学和生命科学研究提供与真实生物体相仿的模型,为药物研发和筛选、疾病模型构建等研究提供替代动物和临床实验的数据。当前已有多种器官芯片被发展出来,并已被应用到具体临床研究中。
3.对器官芯片的研究和发展离不开对芯片中人工微器官的精准三维测量。传统医学影像技术如ct、mri等可以实现对真实器官的三维成像测量,但是这些方法的分辨率太低,无法应用到微型化芯片上的成像测量中。光学显微成像技术为高分辨地获取组织器官的结构信息提供了重要手段。要获取生物组织三维结构信息,传统的方法多采用组织切片的方式,先将样本切成几微米至几十微米的薄片,再通过荧光显微镜获得细胞乃至亚细胞分辨率的图像,但是这种方法容易导致部分结构信息的丢失,且费时费力,通量极低,不能满足器官芯片高通量培养观察的需求。并且部分器官芯片中存在大量非生物组织的结构,这种切片方法显然不太适用。另一种方法则是利用光学切片显微镜,如激光共聚焦扫描显微镜、双光子显微镜和光片照明荧光显微镜等,或是其他断层成像技术如oct等获取目标的精细结构信息。
4.然而,器官芯片具有多层复杂结构,其中培养的人工微器官往往也具有一定厚度,由于各组分之间折射率不匹配,使得光在样本中的传播路线朝各个方向偏移,表现出强烈的散射倾向,从而限制了上述光学成像系统的成像深度,进而导致组织的成像质量随深度的增加而逐渐降低,增加了对器官芯片高质量成像的难度。另外,现有的器官芯片往往在一个方向上对微流控通道中的微器官进行冲刷,流体的剪切力会影响人工微器官的生理活性。
5.现有器官芯片进行高分辨率高通量观测时,均存在诸多问题,亟待解决。
技术实现要素:
6.针对现有技术的缺陷,本实用新型的目的在于提供一种用于在线光透明和在线观察的器官芯片,以解决现有技术器官芯片在线光透明和观察人工微器官时存在的成像质量欠佳、微器官生理活性不能保证等的技术问题。
7.为实现上述目的,本实用新型提供了一种用于在线光透明和在线观察的器官芯片,自下而上层叠设置有透明基底层、第一图案层、第二图案层以及透明盖板层;其中:
8.所述第一图案层含有所述器官芯片的芯片图案,所述芯片图案包括微流控主通道和分散布置在所述微流控主通道上且与所述微流控主通道相连通的若干个第一通孔;
9.所述第二图案层含有的图案包括若干个第二通孔,且所述第二图案层中的若干个第二通孔与所述第一图案层中的若干个第一通孔一一对应且相连通;
10.所述第二图案层的底部和所述透明基底层的顶部分别与所述微流控主通道的顶部和底部相连接,用于使得所述微流控主通道成为封闭的通道;
11.所述第二图案层两端相对于所述透明盖板层为突出设置,其两端分别设置有与所述微流控主通道相连通的主通道进液孔和主通道出液孔。
12.优选地,所述第一图案层上第一通孔两两之间还设置中间通道;所述第二图案层两端的突出部分上还设置有中间通道进液孔和中间通道出液孔。
13.优选地,所述第一图案层和第二图案层的材料为pdms。
14.优选地,所述第一通孔和第二通孔的横截面形状相同,其为圆形或多边形通孔,所述第一通孔的底部具有u形底。
15.优选地,所述透明基底层和所述第一图案层之间还设置有连接层,所述连接层的材料为pdms,且所述连接层采用的pdms材料的硬度小于所述第一图案层采用的pdms材料的硬度;所述第二图案层的底部和所述连接层的顶部分别与所述微流控主通道的顶部和底部相连接,用于使得所述微流控主通道成为封闭的通道。
16.优选地,所述连接层的厚度为5-20μm范围。
17.优选地,所述第一图案层的厚度为1.5
±
0.1mm,所述第二图案层的厚度为 100
±
10μm。
18.优选地,所述透明基底层为载玻片或盖玻片;所述透明盖板层为载玻片或盖玻片。
19.优选地,所述主通道进液孔、主通道出液孔、中间通道进液孔和中间通道出液孔均为凸台设置。
20.总体而言,通过本实用新型所构思的以上技术方案与现有技术相比,具有以下有益效果:
21.(1)本实用新型提供的一种器官芯片,自下而上层叠设置有透明基底层、第一图案层、第二图案层以及透明盖板层,其中第二图案层中的第二通孔作为观察孔使用,第一图案层中的第一通孔作为人工微器官的培养孔使用,第一通孔和第二通孔位置一一对应且相连通,相互配合实现了培养孔和观察孔的分离,有利于减少镜头与样本间的介质复杂程度以提高观测质量。该器官芯片能够高精度大通量地获取器官芯片和人工微器官的精细结构信息,能够适用于器官芯片的在线透明和在线观测,不影响人工微器官的生存状态。
22.(2)本实用新型提供的一种器官芯片,通过正置开口、超薄pdms和玻片封口的设置,实现了高分辨率的光学成像。优选实施例中通过表面张力形成u型底面,帮助细胞聚集成球。因此能够高精度大通量地获取器官芯片和人工微器官的精细结构信息,适用于器官芯片的在线透明和在线观测,且不影响人工微器官的生存状态。同时在芯片结构中设置透明专用中间通道,通过向该中间通道中循环通入透明试剂,利用扩散效应使得中间通道中的透明试剂缓慢进入芯片中的培养室,可以降低流体剪切力对培养室中人工微器官的影响。
23.(3)本实用新型一些实施例中提出的器官芯片采用pdms为芯片主体材料,利用软光刻方式形成微流控通道、培养孔和观察孔,利用表面张力形成u 型培养孔,同时采用培养孔和观察孔分离的设计,有效地提高了观测质量。
24.(4)本实用新型利用软光刻技术获取芯片模具并使用pdms制作和组装芯片;然后,利用芯片流体系统引入透明化试剂;利用荧光显微镜或其他层析成像技术进行成像检测,获取人工微器官的三维结构信息。本实用新型提供的适配在线活体光透明方法的器官芯片设计极大地提高了样本处理及成像观测的通量。因此,本实用新型与多种成像技术有效结合,为获取人工微器官的三维结构信息提供了高分辨、高通量的解决方案。
附图说明
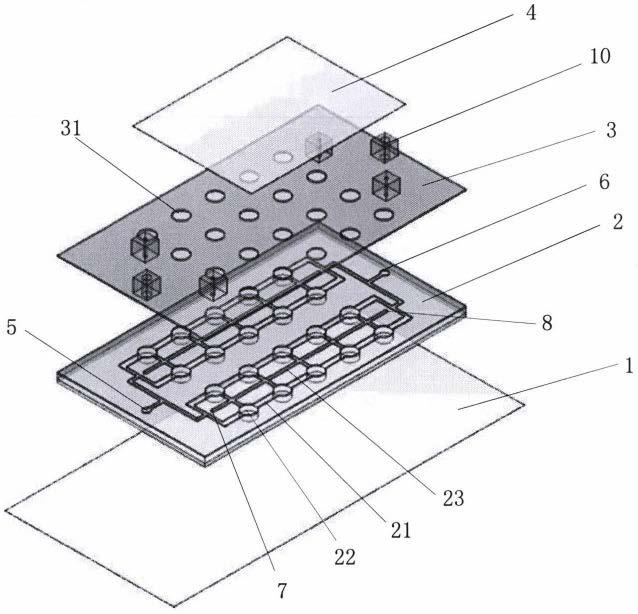
25.图1为本实用新型一些实施例中器官芯片的层状结构示意图。
26.图2为本实用新型一些实施例中第一图案层即培养层的芯片图案。
27.图3为本实用新型一些实施例中第二图案层即观察层的图案。
28.图4为本实用新型一些实施例中器官芯片的整体结构示意图。
29.图5为本实用新型一些实施例中设置有连接层的器官芯片的层状结构示意图。
30.图6为本实用新型一些实施例中器官芯片在线透明前后,适配芯片上肿瘤微器官的对比图。
31.在所有附图中,相同的附图标记用来表示相同的元件或结构,其中:
32.1-透明基底;2-第一图案层;21-微流控主通道;22-第一通孔;23-中间通道;3-第二图案层;31-第二通孔;4-透明盖板层;5-主通道进液孔;6-主通道出液孔;7-中间通道进液孔;8-中间通道出液孔;9-连接层;10-凸台。
具体实施方式
33.为了使本实用新型的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本实用新型进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本实用新型,并不用于限定本实用新型。
34.本实用新型提出的适用于在线光透明和在线观察的器官芯片,通过器官芯片结构设计,该器官芯片中通入透明试剂即可以对人工微器官进行在线透明,且透明后可直接采用共聚焦成像、双光子成像或光片荧光显微成像来在线观察器官芯片,观察结束后将该人工微器官采用培养液进行恢复,恢复完毕后可再次投入使用,始终能够保持人工微器官活体状态。
35.如图1和图4所示,本实用新型一些实施例中提供的一种适用于在线透明和在线观察的器官芯片,自下而上层叠设置有透明基底层1、第一图案层2、第二图案层3以及透明盖板层4;其中:
36.所述第一图案层2含有所述器官芯片的芯片图案。一些实施例中,第一图案层2的芯片图案如图2所示,所述芯片图案包括微流控主通道21和分散布置在所述微流控主通道21上且与所述微流控主通道21相连通的若干个第一通孔 22。
37.所述第二图案层3含有的图案包括若干个第二通孔31,且所述第二图案层 3中的若干个第二通孔31与所述第一图案层2中的若干个第一通孔22一一对应且相连通;第二图案层3的图案如图3所示。器官芯片的整体结构示意图如图4所示。工作时,第二图案层3中的第二通孔31作为观察孔使用,第一图案层2中的第一通孔22作为人工微器官的培养孔使用,第一通孔22和第二通孔 31位置一一对应且相连通,相互配合实现了培养孔和观察孔的分
离,有利于减少镜头与样本间的介质复杂程度以提高观测质量。
38.所述第二图案层3的底部和所述透明基底层1的顶部分别与所述微流控主通道21的顶部和底部相连接,用于使得所述微流控主通道21成为封闭的通道。
39.所述第二图案层3两端相对于所述透明盖板层4为突出设置,且两端的突出部分分别设置有与所述微流控主通道21相连通的主通道进液孔5和主通道出液孔6,如图3所示。
40.一些实施例中,所述第一图案层2和所述第二图案层3均为通过软光刻方法制备得到的不同图案的pdms块体。
41.一些实施例中,第一图案层2的制作方法如下:首先绘制第一图案层的光刻图纸,并制造相应的掩模,然后通过软光刻在硅片上形成对应的阳模,并向硅片上倒入pdms预聚物,并在80℃烘箱内固化10-30min,固化完成后,取下已经形成图案的pdms块,裁剪为合适的大小,即得到第一图案层。软光刻具体为:首先在硅片上旋涂预设厚度的光刻胶,然后进行前烘,完成后将掩模覆盖在硅片上,在光刻机中进行对准曝光,曝光完成后进行后烘。随后进行显影和定影即可。
42.一些实施例中,第二图案层的制作方法如下:首先绘制第二图案层的光刻图纸,并制造相应的掩模,然后通过软光刻在硅片上形成对应的阳模,并向硅片上倒入pdms预聚物,并在80℃烘箱内固化10-30min,固化完成后,取下已经形成图案的pdms块,裁剪为合适的大小,即得到第二图案层。
43.一些实施例中,所述第一图案层2上的第一通孔22两两之间还设置中间通道23;所述第二图案层两端的突出部分上还设置有中间通道进液孔7和中间通道出液孔8。设置中间通道,使得每一个第一通孔22不仅具有来自于微流控主通道的流体经过,而且还有从另一个方向的中间通道的流体经过,而且从中间通道23中循环通入透明试剂,利用扩散效应使得中间通道中的透明试剂缓慢进入芯片中的培养室,可以降低流体剪切力对培养室中人工微器官的影响。较佳实施例中,对于心脏微器官,从中间通道中循环通入透明试剂可持续0.5-1h;对于肿瘤微器官,可持续通入0.5-2h;对于类脑器官,可持续通入6-12h。较佳实施例中,所述微流控主通道与所述中间通道相互垂直。
44.一些实施例中,所述主通道进液孔5、主通道出液孔6、中间通道进液孔7 和中间通道出液孔8均为凸台10设置,通过该凸台10将主通道进液孔5、主通道出液孔6、中间通道进液孔7和中间通道出液孔8引出,便于进液和出液。图中共设置有6个凸台,分别对应一个主通道进液孔5、一个主通道出液孔6、两个中间通道进液孔7和两个中间通道出液孔8。
45.一些实施例中,所述第一通孔22和第二通孔31的横截面形状相同,其为圆形或多边形,多边形比如六边形或八边形;所述第一通孔22的底部为u形底,u形底有利于细胞的三维培养。可通过以下方法制备得到u形底:在第一图案层2制备好以后,用移液器取0.005-0.015g未固化的pdms预聚物,滴入第一图案层2的第一通孔22中,静置3-8分钟后,pdms预聚物可以在表面张力的作用下自发形成u型底面,然后加温固化,得到具有u型底通孔的第一图案层。
46.一些实施例中,如图5所示,所述玻片基底层1和所述第一图案层2之间还设置有连接层9,所述连接层9的材料为pdms,且所述连接层9采用的pdms 材料的硬度小于所述第一图案层2采用的pdms材料的硬度,有利于使所述第一图案层2与透明基底层1连接稳固,且pdms-pdms界面相较于pdms-玻璃界面,更有利于pdms铺开,有助于u型底的形成。且此时所
述第二图案层的底部和所述连接层的顶部分别与所述微流控主通道的顶部和底部相连接,用于使得所述微流控主通道成为封闭的通道。
47.一些实施例中,所述连接层9的厚度为5-20μm范围。
48.一些实施例中,所述第一图案层2的厚度为1.5
±
0.1mm,所述第二图案层 3的厚度为100
±
10μm。
49.一些实施例中,所述透明基底层1为载玻片或盖玻片;所述透明盖板层4 为载玻片或盖玻片。
50.一些实施例中,第一通孔22和第二通孔31的横截面形状为圆形,按照载玻片-连接层-第一图案层2-第二图案层3-盖玻片-物料进出口凸台的顺序,将各层部件使用plasma处理依次键合,并确保第一图案层2和第二图案层3的圆形通孔位置一一对应,最后连接相应的微流控设施即可,得到的微流控器官芯片的整体结构示意图如图5所示。本实用新型提供的上述适配本实用新型透明试剂和透明方法的器官芯片设计,解决了现有技术器官芯片原位透明方法所需时间较长、产生形变较大以及在线器官芯片透明方法的缺失问题。
51.本实用新型一些实施例中利用上述器官芯片对人工微器官进行在线活体透明观察的方法,包括以下步骤:
52.s1、取60%医用碘克沙醇注射液(sigma),和培养液以一定比例混合,然后用移液枪混匀,并加入氯化钙、氯化钾、氯化锌、氯化钠等中的一种或多种调整离子浓度,得到透明试剂。
53.s2、透明:将前述得到的光透明试剂装填在泵中,排尽芯片中的气泡后,以2-200μl/min的速度向芯片中持续灌注光透明试剂,持续半小时。
54.s3、观察:灌注结束后,即可将芯片移至显微镜下观察。
55.s4、恢复:将培养液以2-200μl/min的速度向芯片中持续灌注60分钟,然后放回培养箱即可。
56.本实用新型提出的器官芯片适用于各种人工微器官,微器官可以从市面上采购获得,或按照现有技术的方法自行培养和制作。对于培养三维人工微器官,比如心肌球、肿瘤球、类脑等人工微器官,只需要将细胞悬液(50-100万每毫升)通入芯片中,然后离心,浸泡在培养液中培养即可;其中对于心脏或类脑,在培养时需要加入相应的细胞因子,可参考现有技术的三维人工微器官的培养方法,将三维人工微器官培养在器官芯片的培养孔中。
57.一个实施例中,对肿瘤微器官样本采用本实用新型器官芯片进行在线透明和检测,具体包括如下步骤:
58.(1)制作适配的芯片:根据图2和图3分别绘制第一图案层2和第二图案层3对应的芯片中间层的光刻图纸,并制造相应的掩模,然后通过软光刻在硅片上形成对应的阳模,并向硅片上倒入pdms预聚物,并在80℃烘箱内固化 20min,固化完成后,取下已经形成图案的pdms块,裁剪为合适的大小,得到第一图案层2和第二图案层3;按照载玻片-连接层-第一图案层2-第二图案层 3-盖玻片-主通道进液孔的凸台、主通道出液孔的凸台、中间通道进液孔的凸台和中间通道出液孔的凸台的顺序,将各层部件依次键合,并在第一图案层2中孔洞内填入0.01gpdms预聚物,离心形成u型底面,并再次固化;固化完成后,连接相应的微流控设施,得到如图4和图5所示的微流控芯片。
59.(2)人工微器官培育:在前述所得芯片中通入1百万个/ml的肿瘤细胞悬液,肿瘤细
胞为转染了gfp蛋白的hct116,培养基为rpmi1640,并以400g离心5分钟,随后静置培养。
60.(3)配制相应的透明试剂:取前述1ml60%碘克沙醇注射液,和标准的 dmem培养液以1:1混合,然后用移液枪混匀,最终所得的透明试剂中金属离子浓度为:钾离子的浓度为1.8mm;钙离子的浓度0.2mm;镁离子的浓度0.2mm,钠离子的浓度为80mm。
61.(4)透明:将前述得到的光透明试剂装填在微流泵中,排尽芯片中的气泡后,以40μl/min的速度向芯片中持续灌注光透明试剂,持续半小时。
62.(5)观察:灌注结束后,将芯片移至显微镜下观察,如图6所示,其中图 6内容(a)为光透明前不同深度成像图,图6内容(b)为光透明后不同深度成像图。可以看到,光透明后芯片中的肿瘤微器官逐渐变得透明,同时其结构仍可以保持完整,且成像深度得到明显提升。
63.(6)恢复:将培养液以40μl/min的速度向芯片中持续灌注60分钟,然后放回培养箱即可,该肿瘤微器官仍保持活体状态。
64.本领域的技术人员容易理解,以上所述仅为本实用新型的较佳实施例而已,并不用以限制本实用新型,凡在本实用新型的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本实用新型的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1