一种细胞培养芯片的制作方法
一种细胞培养芯片
1.本技术要求于2022年07月29日提交中国专利局,申请号为2022109110181、发明名称为“一种细胞培养芯片”的中国专利申请的优先权,其全部内容通过引用结合在本技术中。
技术领域
2.本技术涉及细胞培养技术领域,尤其涉及一种细胞培养芯片。
背景技术:
3.细胞培养是指从生物体内取出组织,于模拟体内生理环境等待定的体外条件下,进行孵育培养,使之生存并繁殖。器官芯片技术是一种在芯片中进行体外细胞三维培养的技术,通过对微通道、微反应室和其他功能部件的构建,对芯片中的细胞/流体/气体/细胞外微环境等组分进行精准操控,从而生成具有生物功能性的人体微组织和微器官。器官芯片技术具有集成化、消耗低、通量高、仿真度高、分析快等优点,在新药研发、疾病模型、个性化医疗和航天医学等领域具有广阔的应用前景。2016年,器官芯片技术被达沃斯世界经济论坛列为“十大新兴技术”之一。
4.人体内通过血管运输养分和气体到身体各个部位,并通过器官-血管界面进行营养、气体、代谢物交换。为了对人体内这种结构进行模拟,很多器官芯片技术研究中采用了多孔膜来构建这样的界面,在膜的两侧分别培养血管内皮细胞以及与器官对应的细胞,用以模拟器官-血管界面的细胞排列和界面功能。然而,添加多孔膜的方式一方面对膜本身的性质和生物相容性提出了较高的要求,膜的存在也会影响细胞在各通道之间的自由交互和迁移,另一方面多孔膜在芯片中的结合方式相对而言也较为复杂。
技术实现要素:
5.本技术实施例提供了一种细胞培养芯片,用于解决相关技术中采用多孔膜模拟器官-血管界面的细胞排列和界面功能,多孔膜的存在会影响细胞在各通道之间的自由交互和迁移,及多孔膜在芯片中的结合方式复杂的问题。
6.本技术实施例提供了一种细胞培养芯片,包括:
7.主体;
8.隔断件,位于所述主体内且连接所述主体,所述隔断件具有相背的第一侧壁及第二侧壁,所述隔断件与所述主体之间形成位于所述隔断件的所述第一侧壁所在一侧的第一通道、及位于所述隔断件的所述第二侧壁所在一侧的第二通道,所述第一通道用于流体沿第一方向流通,所述第二通道用于流体沿所述第一方向流通;所述隔断件包括沿所述第一方向间隔分布的至少两个第一隔断部,相邻两个所述第一隔断部之间形成连通所述第一通道及所述第二通道的连通口,所述第一通道包括对应所述连通口的第一连通段,所述第二通道包括对应所述连通口的第二连通段,所述第一连通段的内壁面包括沿所述第一方向延伸且沿第二方向相对分布的第一子侧壁及第二子侧壁,所述第二连通段的内壁面包括沿所
述第一方向延伸且沿所述第二方向相对分布的第三子侧壁及第四子侧壁,所述第一子侧壁位于所述第三子侧壁与所述第四子侧壁之间,所述第二子侧壁位于所述第三子侧壁与所述第四子侧壁之间,所述第二方向与所述第一方向呈夹角设置。
9.在其中一些实施例中,所述第一通道还包括:
10.第一隔断段,对应所述第一隔断部设置,所述第一隔断段的内壁面包括沿所述第一方向延伸且沿所述第二方向相对分布的第五子侧壁及第六子侧壁,所述第五子侧壁靠近所述第一子侧壁设置,所述第六子侧壁靠近所述第二子侧壁设置;
11.其中,所述第五子侧壁位于所述第一子侧壁远离所述第二子侧壁的一侧;或,所述第五子侧壁连接所述第一子侧壁且与所述第一子侧壁位于同一平面内;或,所述第五子侧壁的一端连接所述第一子侧壁,另一端朝与所述第二子侧壁的间距逐渐增大的方向延伸。
12.在其中一些实施例中,所述第六子侧壁位于所述第二子侧壁远离所述第一子侧壁的一侧。
13.在其中一些实施例中,所述隔断件还包括:
14.第二隔断部,沿所述第一方向连接于相邻两个所述第一隔断部之间;
15.第三隔断部,沿所述第一方向连接于相邻两个所述第一隔断部之间,所述第三隔断部与所述第二隔断部沿所述第二方向间隔分布,所述第三隔断部与所述第二隔断部沿所述第二方向相对的两个侧壁分别与所述第一子侧壁及所述第二子侧壁平齐,所述第三隔断部与所述第二隔断部沿所述第二方向相对的两个侧壁之间形成所述连通口。
16.在其中一些实施例中,所述第三隔断部具有沿所述第一方向延伸且朝向所述第二通道的第七子侧壁,所述第二隔断部具有沿所述第一方向延伸且朝向所述第二通道的第八子侧壁,
17.所述第七子侧壁与所述第八子侧壁平齐,或,所述第七子侧壁位于所述第八子侧壁背离所述第一侧壁的一侧。
18.在其中一些实施例中,所述第三隔断部与所述第二隔断部沿所述第二方向相背的两个侧壁均连接所述主体,或,所述第二隔断部与所述第二隔断部沿所述第二方向相背的两个侧壁均与所述主体间隔设置。
19.在其中一些实施例中,所述第一通道还包括对应所述第一隔断部的第一隔断段,所述第二通道还包括对应所述第一隔断部的第二隔断段,
20.对于沿所述第一方向上位于所述第一连通段同侧的第一隔断段及所述第二隔断段,由所述第一隔断段连接所述第一连通段的一端至另一端的方向上,所述第一隔断段与所述第二隔断段之间的间距逐渐增大。
21.在其中一些实施例中,所述主体包括:
22.第一板体;
23.第二板体,与所述第一板体层叠设置,所述隔断件位于第一板体与所述第二板体之间且与所述第一板体及所述第二板体共同形成所述第一通道及所述第二通道,所述第二板体上还形成有与所述第一通道连通的第一通孔、与所述第一通道连通的第二通孔、与所述第二通道连通的第三通孔及与所述第二通道连通的第四通孔。
24.在其中一些实施例中,所述主体还包括:
25.第三板体,层叠设于所述第二板体远离所述第一板体的一侧,所述第三板体上形
成有与所述第一通孔连通的第一入口、与所述第二通孔连通的第一出口、与所述第三通孔连通的第二入口及与所述第四通孔连通的第二出口。
26.在其中一些实施例中,所述细胞培养芯片包括两个所述隔断件,两个所述隔断件的所述第一侧壁相对设置且两个所述第一侧壁之间形成所述第一通道,两个所述隔断件的所述第二侧壁相背设置,且各所述隔断件的所述第二侧壁所在的一侧均形成一所述第二通道。
27.本技术的细胞培养芯片,第一通道的第一子侧壁位于第二通道的第三子侧壁与第四子侧壁之间,第一通道的第二子侧壁位于第二通道的第三子侧壁与第四子侧壁之间,使得第一通道和第二通道之间形成边缘结构,而边缘结构的存在会改变第一通道内流体的铺展方向,对流体在固体表面的铺展起到限制作用,阻止第一通道内的流体通过连通口向第二通道内扩散和溢出。而第一通道内的流体限制在第一通道内,可以在连通口处形成的气液界面来构成第一通道与第二通道之间的器官-血管界面,进行营养、气体、代谢物交换,实现第一通道和第二通道内可分别培养血管内皮细胞以及器官对应的细胞等情况,而无需另外设置多孔膜,结构简单且操作方便。
附图说明
28.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本技术的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
29.图1是本技术第一种实施例提供的细胞培养芯片的立体结构示意图;
30.图2是图1示出的细胞培养芯片的立体爆炸示意图;
31.图3是图1示出的细胞培养芯片中第一板体的立体结构示意图;
32.图4是图1示出的细胞培养芯片的在垂直于第一方向的平面处剖视的立体剖面示意图;
33.图5是图1示出的细胞培养芯片在第一通道内添加流体时的效果示意图;
34.图6是图1示出的细胞培养芯片中第一板体在垂直于第三方向的平面处剖视的立体剖面示意图;
35.图7是本技术第二种实施例提供的细胞培养芯片中第一板体在垂直于第三方向的平面处剖视的立体剖面示意图;
36.图8是本技术第三种实施例提供的细胞培养芯片中第一板体在垂直于第三方向的平面处剖视的立体剖面示意图;
37.图9是本技术第四种实施例提供的细胞培养芯片中第一板体在垂直于第一方向的平面处剖视的立体剖面示意图;
38.图10是本技术第五种实施例提供的细胞培养芯片中第一板体在垂直于第一方向的平面处剖视的立体剖面示意图;
39.图11是本技术第六种实施例提供的细胞培养芯片中第一板体在垂直于第一方向的平面处剖视的立体剖面示意图;
40.图12是图11示出的细胞培养芯片在第一通道内添加流体时的效果示意图;
41.图13是本技术第七种实施例提供的细胞培养芯片的第一连通段131及连通口150内共同设置横截面大致呈矩形的凸台且设置双侧台阶时的剖面示意图;
42.图14是图13示出的细胞培养芯片的仿真效果示意图;
43.图15是图13的一对照组,此时细胞培养芯片的第一连通段131及连通口150内共同设置横截面大致呈矩形的凸台且为单侧台阶;
44.图16是图15示出的细胞培养芯片的仿真效果示意图;
45.图17是图13的另一对照组,此时细胞培养芯片的第一连通段131及连通口150内共同设置横截面大致呈t形的凸台且设置双侧台阶;
46.图18是图17示出的细胞培养芯片的仿真效果示意图;
47.图19是本技术第八种实施例提供的细胞培养芯片中第一板体在垂直于第一方向的平面处剖视的立体剖面示意图;
48.图20是图19示出的细胞培养芯片在第一通道内添加流体时的效果示意图;
49.图21是图13的又一对照组,此时细胞培养芯片的第一连通段131及连通口150内共同设置横截面大致呈矩形的凸台且为上大下小的双侧台阶;
50.图22是图21示出的细胞培养芯片的仿真效果示意图。
51.附图标记说明:100、细胞培养芯片;110、主体;111、第一板体;112、第二板体;1121、第一通孔;1122、第二通孔;1123、第三通孔;1124、第四通孔;113、第三板体;1131、第一入口;1132、第一出口;1133、第二入口;1134、第二出口;120、隔断件;121、第一侧壁;122、第二侧壁;123、第一隔断部;124、第二隔断部;1241、第八子侧壁;1242、第十子侧壁;125、第三隔断部;1251、第七子侧壁;1252、第九子侧壁;130、第一通道;131、第一连通段;1311、第一子侧壁;1312、第二子侧壁;132、第一隔断段;1321、第五子侧壁;140、第二通道;141、第二连通段;1411、第三子侧壁;1412、第四子侧壁;142、第二隔断段;150、连通口;x、第一方向;y、第二方向。
具体实施方式
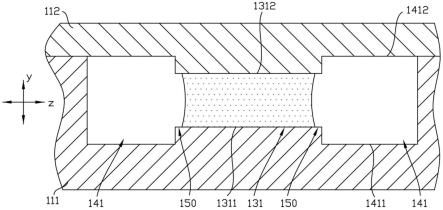
52.为使本技术的目的、技术方案和优点更加清楚,下面将结合附图对本技术实施例方式作进一步地详细描述。
53.下面的描述涉及附图时,除非另有表示,不同附图中的相同数字表示相同或相似的要素。以下示例性实施例中所描述的实施方式并不代表与本技术相一致的所有实施方式。相反,它们仅是如所附权利要求书中所详述的、本技术的一些方面相一致的装置和方法的例子。
54.实施例一
55.请参阅图1至图12,本技术实施例提供了一种细胞培养芯片100,细胞培养芯片100包括主体110和隔断件120。
56.结合图1和图2,隔断件120位于主体110内且连接主体110,隔断件120具有相背的第一侧壁121及第二侧壁122,隔断件120与主体110之间形成位于隔断件120的第一侧壁121所在一侧的第一通道130、及位于隔断件120的第二侧壁122所在一侧的第二通道140。其中,第一通道130用于流体沿第一方向x流通,第二通道140用于流体沿第一方向x流通。具体地,第一通道130和第二通道140可以用于输送细胞/流体/气体/细胞外微环境等组分中的至少
一种。
57.需要说明的是,第一通道130用于流体沿第一方向x流通的实现方式可以为:第一通道130沿第一方向x延伸,进而实现第一通道130内的流体可以沿第一方向x流通。第一通道130用于流体沿第一方向x流通的实现方式也可以为:第一通道130上用于添加流体的部位与用于流出流体的部位大致沿第一方向x分布,进而实现进入第一通道130内的流体大致可以看作是沿第一方向x流通。
58.同样地,第二通道140用于流体沿第一方向x流通的实现方式可以为:第二通道140沿第一方向x延伸,进而实现第二通道140内的流体可以沿第一方向x流通。第二通道140用于流体沿第一方向x流通的实现方式也可以为:第二通道140上用于添加流体的部位与用于流出流体的部位大致沿第一方向x分布,进而实现进入第二通道140内的流体大致可以看作是沿第一方向x流通。
59.本技术实施例中,第一通道130沿第一方向x延伸,第二通道140上用于添加流体的部位与用于流出流体的部位沿第一方向x分布。
60.结合图2和图3,隔断件120包括沿第一方向x间隔分布的至少两个第一隔断部123,相邻两个第一隔断部123之间形成连通第一通道130及第二通道140的连通口150,第一通道130包括对应连通口150的第一连通段131,第二通道140包括对应连通口150的第二连通段141。
61.结合图4和图5,第一连通段131的内壁面包括沿第一方向x延伸且沿第二方向y相对分布的第一子侧壁1311及第二子侧壁1312,第二连通段141的内壁面包括沿第一方向x延伸且沿第二方向y相对分布的第三子侧壁1411及第四子侧壁1412,第一子侧壁1311位于第三子侧壁1411与第四子侧壁1412之间,第二子侧壁1312位于第三子侧壁1411与第四子侧壁1412之间,第二方向y与第一方向x呈夹角设置。
62.结合图5,第一通道130的第一子侧壁1311位于第二通道140的第三子侧壁1411与第四子侧壁1412之间,第一通道130的第二子侧壁1312位于第二通道140的第三子侧壁1411与第四子侧壁1412之间,使得第一通道130和第二通道140之间形成高度差,即,形成边缘结构,而边缘结构的存在会改变第一通道130内流体的铺展方向,对流体在固体表面的铺展起到限制作用,阻止第一通道130内的流体通过连通口150向第二通道140内扩散和溢出。而第一通道130内的流体限制在第一通道130内,可以在连通口150处形成的气液界面来构成第一通道130与第二通道140之间的器官-血管界面,进行营养、气体、代谢物交换,实现第一通道130和第二通道140内可分别培养血管内皮细胞以及器官对应的细胞等情况,而无需另外设置多孔膜,结构简单且操作方便。
63.需要说明的是,本技术实施例的将第一通道130的第一子侧壁1311位于第二通道140的第三子侧壁1411与第四子侧壁1412之间,第一通道130的第二子侧壁1312位于第二通道140的第三子侧壁1411与第四子侧壁1412之间,以使第一通道130和第二通道140之间形成边缘结构,并利用边缘结构处形成的气液界面来实现两个通道内的流体的营养、气体、代谢物交换的方案,可以直接应用于现有的器官芯片中,实现仅在现有的器官芯片的两个通道之间设置本技术实施例提出的第一凸起1231和第二凸起1232即可,而现有的器官芯片的其它结构可以不做调整,适应性较强,且有利于降低研发成本。
64.可选地,第二方向y与第一方向x呈夹角设置,第二方向y与第一方向x之间的夹角
可以为任意的角度,例如,二者之间的夹角可以为0
°
、45
°
、90
°
、135
°
等,优选地,第二方向y与第一方向x之间的夹角可以为90
°
。优选地,第二方向y与隔断件120的第一侧壁121平行。
65.可选地,第一子侧壁1311可以靠近第三子侧壁1411设置,第二子侧壁1312可以靠近第四子侧壁1412设置,第一子侧壁1311、第二子侧壁1312、第三子侧壁1411及第四子侧壁1412可以相互平行,且均平行于第一方向x、垂直于第二方向y。第一子侧壁1311与第三子侧壁1411之间的间距可以大于或等于20um且小于或等于200um,第二子侧壁1312与第四子侧壁1412之间的间距可以大于或等于20um且小于或等于200um。第一子侧壁1311与第三子侧壁1411之间的间距可以与第二子侧壁1312与第四子侧壁1412之间的间距大致相等,本技术实施例对此不作限定。
66.可选地,第一通道130的横截面可以大致呈第一矩形,第一侧壁121可以对应第一矩形的一条边。可选地,第二通道140的横截面可以大致呈第二矩形,第二侧壁122可以对应第二矩形的一条边线。
67.可选地,结合图6,第一通道130除包括第一连通段131外,还包括与第一隔断部123对应的第一隔断段132,第一通道130内的流体和第二通道140内的流体在第一隔断段132处流动时二者断开,而在第一连通段131和第二连通段141处流动时可以通过连通口150进行营养、气体、代谢物交换等。第一隔断段132的内壁面包括沿第一方向x延伸且沿第二方向y相对分布的第五子侧壁1321及第六子侧壁(图中未示出),第五子侧壁1321靠近第一子侧壁1311设置,第六子侧壁靠近第二子侧壁1312设置。
68.在一种示例性的方案中,结合图6,第五子侧壁1321可以连接第一子侧壁1311且与第一子侧壁1311位于同一平面内。此时,第五子侧壁1321与第一子侧壁1311平滑连接,第一通道130内的流体在沿第一方向x流动时,阻碍较小,流动更加顺畅。可选地,第五子侧壁1321和第一子侧壁1311可以均平行于第一方向x且垂直于第二方向y。
69.在又一种示例性的方案中,结合图7,第五子侧壁1321可以一端连接第一子侧壁1311,另一端朝与第二子侧壁1312的间距逐渐增大的方向延伸。此时,第五子侧壁1321至连接第一子侧壁1311的一端至另一端的方向上呈下坡状的斜面,对第一通道130内流体流动的阻碍相对较小。
70.在另一种示例性的方案中,结合图8,第五子侧壁1321可以位于第一子侧壁1311远离第二子侧壁1312的一侧。此时,第五子侧壁1321与第一子侧壁1311之间形成有台阶,设计要求较低,利于生产制造。
71.可选地,第六子侧壁的设计也可以与第五子侧壁1321的设计相似,例如,第六子侧壁可以位于第二子侧壁1312远离第一子侧壁1311的一侧,第六子侧壁也可以连接第二子侧壁1312且与第二子侧壁1312位于同一平面内,第六子侧壁还可以一端连接第二子侧壁1312,另一端朝远离第一子侧壁1311的方向延伸,本技术实施例对此不再赘述。
72.可选地,结合图9,隔断件120的相邻两个第一隔断部123之间可以直接断开。可选地,结合图10,隔断件120还包括第二隔断部124及第三隔断部125,第二隔断部124沿第一方向x连接于相邻两个第一隔断部123之间,第三隔断部125沿第一方向x连接于相邻两个第一隔断部123之间,第三隔断部125与第二隔断部124沿第二方向y间隔分布,第三隔断部125与第二隔断部124沿第二方向y相对的两个侧壁分别与第一子侧壁1311及第二子侧壁1312平齐,第三隔断部125与第二隔断部124沿第二方向y相对的两个侧壁之间形成连通口150。例
如,第三隔断部125与第二隔断部124沿第二方向y相对的两个侧壁分别为第九子侧壁1252和第十子侧壁1242,第九子侧壁1252可以与第二子侧壁1312平齐,第十子侧壁1242可以与第二子侧壁1312平齐。
73.将隔断件120设置成还包括第二隔断部124和第三隔断部125,可以使得第一通道130与第二通道140之间形成的气液界面靠近第二通道140,便于第二通道140内的流体与第一通道130内的流体于连通口150处进行营养、气体、代谢物交换等。
74.可选地,第三隔断部125具有沿第一方向x延伸且朝向第二通道140的第七子侧壁1251,第二隔断部124具有沿第一方向x延伸且朝向第二通道140的第八子侧壁1241。第八子侧壁1241可以与第七子侧壁1251平齐,以能够在第二侧壁122的表面平滑的前提下实现连通口150处气液界面的形成,利于第二通道140内流体流动。可选地,第八子侧壁1241及第七子侧壁1251均垂直于第二通道140的第五侧壁143。
75.在一种示例性的方案中,结合图10,第三隔断部125与第二隔断部124沿第二方向y相背的两个侧壁均连接主体110,此时,可以看作第一连通段131及连通口150内共同设置了横截面大致呈矩形的凸台,可以简化细胞培养芯片100的结构设计,生产制造方便。
76.在另一种示例性的方案中,结合图11和图12,第三隔断部125与第二隔断部124沿第二方向y相背的两个侧壁均与主体110间隔设置,此时,可以看作第一连通段131及连通口150内共同设置了横截面大致呈t形的凸台,通过实验表明,微结构表面达到限制液体效果的微结构的临界角θc>180
°
。而θc=θeage+θ1+θ2,其中,θeage为微结构的边缘角,θ1、θ2为流体在通道内上下固体表面的接触角,t形凸台设计相较于矩形凸台设计而言,边缘角可以从90
°
增加到180
°
,对流体在通道内上下固体表面的接触角要求更低,对流体有更好的阻拦效果。
77.优选地,此方案中,第八子侧壁1241与第一通道130的第一连通段131沿第一方向x延伸且朝向第二通道140的侧壁(例如,子侧壁1313)之间的间距可以大于或等于50um且小于或等于150um,第七子侧壁1251与第一连通段131沿第一方向x延伸且朝向第二通道140的侧壁之间的间距可以大于或等于50um且小于或等于150um,本技术实施例对此不作限定。
78.可选地,第一通道130还包括对应第一隔断部123的第一隔断段132,第二通道140还包括对应第一隔断部123的第二隔断段142,对于沿第一方向x上位于第一连通段131同侧的第一隔断段132及第二隔断段142,由第一隔断段132连接第一连通段131的一端至另一端的方向上,第一隔断段132与第二隔断段142之间的间距逐渐增大。如此,可使得两个通道的端部的间距相对较大,可降低两个通道之间的干扰,有利于两个通道的加工设计。
79.具体地,对于其中一个第一隔断部123而言,由其靠近另一个隔断部123的一端至另一端的方向上,其中一个第一隔断部123沿第一方向x延伸且沿第二方向y相背的两个侧壁之间的间距逐渐增大。
80.可选地,第一隔断部123沿第一方向x延伸且沿第二方向y相背的两个侧壁之间的夹角可以大于或等于5
°
且小于或等于67.5
°
。例如,第一隔断部123沿第一方向x延伸且沿第二方向y相背的两个侧壁之间的夹角可以为5
°
、7
°
、45
°
、67.5
°
等,本技术实施例对此不作限定。
81.可选地,第三隔断部125的第七子侧壁1251可以与第一隔断部123沿第二方向y延伸且朝向第二通道140的侧壁平滑连接,第二隔断部124的第八子侧壁1241可以与第一隔断
部123沿第二方向y延伸且朝向第二通道140的侧壁平滑连接,以提升第一通道130内的流体及第二通道140内的流体在第一隔断部123与第二隔断部124的交界处及第一隔断部123与第三隔断部125的交界处的流动顺畅性。
82.可选地,结合图11,细胞培养芯片100包括两个隔断件120,两个隔断件120的第一侧壁121相对设置且两个第一侧壁121之间形成第一通道130,两个隔断件120的第二侧壁122相背设置,且各隔断件120的第二侧壁122所在的一侧均形成一第二通道140。即,在第一通道130的两侧分别设置一第二通道140,如此,可以通过两个第二通道140在第一通道130内物质的两侧分别进行营养、气体、代谢物交换。
83.可选地,结合图10,在第一连通段131及连通口150内共同设置的横截面大致呈矩形的凸台时,两个隔断件120的第七子侧壁1251可以相互平行,两个隔断件120的第七子侧壁1251之间的间距可以大于或等于350um且小于或等于600um。可选地,第一通道130沿第三方向z上的宽度大于或等于200um且小于或等于500um,第二通道140沿第三方向z上的宽度大于或等于300um且小于或等于700um,第一通道130及第二通道140沿第二方向y上的高度大于或等于200um且小于或等于600um,第三方向z与第一方向x、第二方向y可以两两平行。
84.可选地,结合图11,在第一连通段131及连通口150内共同设置的横截面大致呈t形的凸台时,两个隔断件120的第七子侧壁1251可以相互平行,两个隔断件120的第七子侧壁1251之间的间距可以大于或等于300um且小于或等于600um。可选地,第一通道130沿第三方向z上的宽度大于或等于200um且小于或等于400um,第二通道140沿第三方向z上的宽度大于或等于300um且小于或等于600um,第一通道130及第二通道140沿第二方向y上的高度大于或等于200um且小于或等于600um,第三方向z与第一方向x、第二方向y可以两两平行。
85.可选地,请结合图2,主体110包括第一板体111及第二板体112,第二板体112与第一板体111层叠设置,隔断件120位于第一板体111与第二板体112之间且与第一板体111及第二板体112共同形成第一通道130及第二通道140,第二板体112上还形成有与第一通道130连通的第一通孔1121、与第一通道130连通的第二通孔1122、与第二通道140连通的第三通孔1123及与第二通道140连通的第四通孔1124。其中,第一通孔1121和第二通孔1122可以分别位于第一通道130的相对的两端,第三通孔1123和第四通孔1124可以分别位于第二通道140的相对的两端。
86.可选地,第一通道130对应第一通孔1121和/或第二通孔1122处可以设有膨大部,以便于与第一通孔1121和/或第二通孔1122的连通。可选地,第二通道140对应第三通孔1123和/或第四通孔1124处可以设有膨大部,以便于与第三通孔1123和/或第四通孔1124的连通。
87.可选地,第一板体111和/或第二板体112可以进行亲水表面处理,以提高第一通道130和第二通道140内流体的流动性。
88.可选地,主体110还可以包括第三板体113,层叠设于第二板体112远离第一板体111的一侧,第三板体113上形成有与第一通孔1121连通的第一入口1131、与第二通孔1122连通的第一出口1132、与第三通孔1123连通的第二入口1133及与第四通孔1124连通的第二出口1134。
89.可选地,第三板体113上设有与第一入口1131对应的第一储液池、与第二入口1133对应的第二储液池、与第一出口1132对应的第三储液池、与第二出口1134对应的第四储液
池中的至少一种。可选地,各储液池的横截面大致呈扇形。
90.可选地,细胞培养芯片100的材质可以为pmma、pc、coc、cop和ps等材料。可选地,隔断件120的第二隔断部124可以与第一板体111一体成型,隔断件120的第三隔断部125可以与第二板体112一体成型,以降低细胞培养芯片100的制造复杂性和制造成本,增强芯片中流体的限制效果,提升无膜式细胞培养芯片100构建的成功率。其中,一体成型可以为仅注塑工艺一体成型,本技术实施例对此不作限定。可选地,第一板体111与第二板体112之间、第二板体112与第三板体113之间可以通过热压、超声、激光、胶粘等方式键合组装。
91.可选地,本技术实施例中,第一通道130内流体的流动和/或第二通道140内流体的流动可以通过无泵式重力驱动、外置蠕动泵驱动、注射泵驱动等,使流体能够提供细胞生长所需的流体剪切力环境。
92.通过仿真软件模拟验证,在细胞培养芯片100的第一子侧壁1311位于第三子侧壁1411与第四子侧壁1412之间,第二子侧壁1312位于第三子侧壁1411与第四子侧壁1412之间时,相较于第一子侧壁1311位于第三子侧壁1411与第四子侧壁1412之间,或者,第二子侧壁1312位于第三子侧壁1411与第四子侧壁1412之间而言,可以大大提升第一通道130与第二通道140之间形成的气液界面的最大承受压力,可以对第一通道130内的流体起到更好的限制效果。
93.具体地,在细胞培养芯片100包括一个第一通道130和两个第二通道140,第一连通段131及连通口150内共同设置横截面大致呈矩形的凸台的情况下,若第一通道130及第二通道140沿第三方向z上的宽度均为600um,第一通道130及第二通道140沿第二方向y上的高度均为300um,第一板体111的接触角为100
°
,第二板体112的接触角为60
°
,第一子侧壁1311与第三子侧壁1411之间沿第二方向y上的高度差为100um,第二子侧壁1312与第四子侧壁1412之间沿第二方向y上的高度差为100um时,结合图13至图16,通过仿真软件模拟验证,在第一子侧壁1311位于第三子侧壁1411与第四子侧壁1412之间,或者,第二子侧壁1312位于第三子侧壁1411与第四子侧壁1412之间时,第一通道130和第二通道140之间形成的气液界面的最大承受压力为160pa,而本技术实施例在第一子侧壁1311位于第三子侧壁1411与第四子侧壁1412之间,且,第二子侧壁1312位于第三子侧壁1411与第四子侧壁1412之间时,第一通道130和第二通道140之间形成的气液界面的最大承受压力为900pa,即,本技术实施例的双侧台阶设置的阻挡效果更佳。
94.具体地,在细胞培养芯片100包括一个第一通道130和两个第二通道140,第一连通段131及连通口150内共同设置横截面大致呈t形的凸台的情况下,若第一通道130及第二通道140沿第三方向z上的宽度均为600um,第一通道130及第二通道140沿第二方向y上的高度均为300um,第一板体111的接触角为100
°
,第二板体112的接触角为60
°
,第一子侧壁1311与第三子侧壁1411之间沿第二方向y上的高度差为100um,第二子侧壁1312与第四子侧壁1412之间沿第二方向y上的高度差为100um,第二隔断部124及第三隔断部125沿第二方向y上的高度均为50um时,结合图17至图18,通过仿真软件模拟验证,第一通道130和第二通道140之间形成的气液界面的最大承受压力为1140pa,即,本技术实施例的双侧t型台阶设置的阻挡效果更佳。
95.其中,仿真软件可以通过comsol multiphysics(5.6)进行建模,模拟验证时,可以假定水和空气都是不可压缩的牛顿流体,并假定密度是常数。
96.具体地,气液界面的最大承受压力可以满足navier-stokes方程,可以表示为:
[0097][0098][0099]
式中:u为流速,ρ为密度,μ为动力粘度,p为压力,f
st
为表面张力,i为单位矩阵。建模时,初始条件流速u和压力p都设置为0。左侧为压力边界为0,右侧为压力入口边界,改变其数值,可以得出不同结构的最大承受压力,从而判断其性能的优异。
[0100]
数值模拟方法为:利用相场法追踪气液界面。整个计算区域通过高阶函数φ区分为空气区域ω1(-1≤φ《0)和水区域ω2(0《φ≤1),φ=0的区域就是气液界面。其中,变量φ可以满足cahn-hilliard方程,可以表示为:
[0101][0102]
式中:γ为移动性,它决定了cahn-hilliard扩散的时间尺度,λ为混合能密度,ε为界面厚度。上述方程、边界条件和初值均在comsol multiphysics(5.6)有限元框架中实现。此外,相对容差(a
rt
=0.005)和绝对容差(a
at,k
=0.05)控制计算步中的误差,当其满足一下条件时,才会进行下一步运算:
[0103][0104]
式中:m为物理场的个数,nj为物理场中的自由度数量,vk为特定时间步长的解向量,ek为计算器中的误差。
[0105]
本实施例的细胞培养芯片100在用于肠道芯片的使用方法包括:
[0106]
s11、将主体110的第二板体112进行亲水处理,并与第一板体111和第三板体113组装形成细胞培养芯片100。
[0107]
s12、对细胞培养芯片100进行灭菌处理。
[0108]
s13、向第一通道130内加入matrigel/胶原混合水凝胶,由于第一子侧壁1311和第二子侧壁1312的阻拦作用,matrigel/胶原混合水凝胶被限制在第二通道140,而不会流入到第一通道130中。其中,matrigel/胶原混合水凝胶可以通过第一入口1131加入第一通道130,多余的matrigel/胶原混合水凝胶可以通过第一出口1132流出。
[0109]
s14、matrigel/胶原混合水凝胶固化,形成水凝胶条带。
[0110]
s15、向其中一个第二通道140加入肠上皮细胞,使肠上皮细胞在第一通道130和第二通道140的matrigel/胶原混合水凝胶气液交界面上贴壁。向该其中一个第二通道140加入肠上皮细胞培养基,给肠上皮细胞提供生长所需的营养。其中,肠上皮细胞及肠上皮细胞培养基可以从与该其中一个第二通道140对应的第二入口1133加入,多余的肠上皮细胞及肠上皮细胞培养基可以通过与该其中一个第二通道140对应的第二出口1134流出。
[0111]
s16、向另一个第二通道140加入血管内皮细胞,使血管内皮细胞在第一通道130和第二通道140的matrigel/胶原混合水凝胶气液交界面上贴壁。向该另一个第二通道140加入血管内皮细胞培养基,给血管内皮细胞提供生长所需的营养。其中,血管内皮细胞及血管
内皮细胞培养基可以从与该另一个第二通道140对应的第二入口1133加入,多余的血管内皮细胞及血管内皮细胞培养基可以通过与该另一个第二通道140对应的第二出口1134流出。
[0112]
s17、细胞培养成功后构建完成肠-内皮器官模型,用于后续测试。
[0113]
本实施例的细胞培养芯片100在用于细胞3d培养的使用方法包括:
[0114]
s21、将主体110的第二板体112进行亲水处理,并与第一板体111和第三板体113组装形成细胞培养芯片100。
[0115]
s22、对细胞培养芯片100进行灭菌处理。
[0116]
s23、向第一通道130内加入混有细胞的水凝胶,由于第一子侧壁1311和第二子侧壁1312的阻拦作用,混有细胞的水凝胶被限制在第二通道140,而不会流入到第一通道130中。其中,混有细胞的水凝胶可以通过第一入口1131加入第一通道130,多余的混有细胞的水凝胶可以通过第一出口1132流出。
[0117]
s24、混有细胞的水凝胶固化,形成水凝胶条带。
[0118]
s25、向两个第二通道140加入细胞培养基,给细胞提供生长所需的营养。其中,细胞培养基可以从第二通道140对应的第二入口1133加入,多余的细胞培养基可以通过第二通道140对应的第二出口1134流出。
[0119]
s26、细胞培养成功,用于后续测试。
[0120]
实施例二
[0121]
请参阅图19至图20,本实施例提供了另一种细胞培养芯片100,该细胞培养芯片100与实施例一中的细胞培养芯片100大致相同,区别在于,实施例一中,第七子侧壁1251与第八子侧壁1241平齐,而本实施例中,结合图19和图20,第七子侧壁1251位于第八子侧壁1241背离第一侧壁121的一侧。
[0122]
通过实验显示,将第七子侧壁1251位于第八子侧壁1241背离第一侧壁121的一侧,可以控制第一通道130内流体在连通口150处形成的气液界面的形貌和产生的表面能。且当第七子侧壁1251与第八子侧壁1241之间沿第三方向z上的间距增大时,气液界面变大,流体表面吉布斯自由能增加,可以进一步对抗第一通道130内流体内部产生的压力,达到更好的流体限制效果。
[0123]
可选地,第七子侧壁1251可以与第八子侧壁1241平行。可选地,第七子侧壁1251位于第二侧壁122远离第一侧壁121的一侧。
[0124]
可选地,在细胞培养芯片100包括两个隔断件120,细胞培养芯片100形成有一第一通道130及位于第一通道130两侧的第二通道140时,在第一连通段131及连通口150内共同设置的横截面大致呈矩形的凸台时,两个隔断件120的第七子侧壁1251可以相互平行,两个隔断件120的第七子侧壁1251之间的间距可以大于或等于350um且小于或等于600um,两个第七子侧壁1251之间的间距与两个隔断件120的第八子侧壁1241之间的间距差大于或等于50um且小于或等于300um。
[0125]
可选地,第一通道130的第一子侧壁1311与第二通道140的第三子侧壁1411之间的间距可以大于或等于20um且小于或等于200um,第一通道130的第二子侧壁1312与第二通道140的第四子侧壁1412之间的间距可以大于或等于20um且小于或等于200um。第一子侧壁1311与第三子侧壁1411之间的间距可以与第二子侧壁1312与第四子侧壁1412之间的间距
大致相等,本技术实施例对此不作限定。
[0126]
可选地,第一通道130沿第三方向z上的宽度大于或等于200um且小于或等于500um,第二通道140沿第三方向z上的宽度大于或等于300um且小于或等于700um,第一通道130及第二通道140沿第二方向y上的高度大于或等于200um且小于或等于600um,第三方向z与第一方向x、第二方向y可以两两平行。
[0127]
具体地,在细胞培养芯片100包括一个第一通道130和两个第二通道140,第一连通段131及连通口150内共同设置横截面大致呈矩形的凸台的情况下,若第一通道130及第二通道140沿第三方向z上的宽度均为600um,第一通道130及第二通道140沿第二方向y上的高度均为300um,第一板体111的接触角为100
°
,第二板体112的接触角为60
°
,第一子侧壁1311与第三子侧壁1411之间沿第二方向y上的高度差为100um,第二子侧壁1312与第四子侧壁1412之间沿第二方向y上的高度差为100um,两个第七子侧壁1251之间的间距与两个第八子侧壁1241之间的间距差等于200um时,结图21和图22,通过仿真软件模拟验证,第一通道130和第二通道140之间形成的气液界面的最大承受压力为410pa,阻挡效果更佳。
[0128]
本实施例的细胞培养芯片100在用于肠道芯片的使用方法包括:
[0129]
s31、将主体110的第二板体112进行亲水处理,并与第一板体111和第三板体113组装形成细胞培养芯片100。
[0130]
s32、对细胞培养芯片100进行灭菌处理。
[0131]
s33、向第一通道130内加入matrigel/胶原混合水凝胶,由于第一子侧壁1311和第二子侧壁1312的阻拦作用,matrigel/胶原混合水凝胶被限制在第二通道140,而不会流入到第一通道130中。其中,matrigel/胶原混合水凝胶可以通过第一入口1131加入第一通道130,多余的matrigel/胶原混合水凝胶可以通过第一出口1132流出。
[0132]
s34、matrigel/胶原混合水凝胶固化,形成水凝胶条带。
[0133]
s35、向其中一个第二通道140加入肠上皮细胞,使肠上皮细胞在第一通道130和第二通道140的matrigel/胶原混合水凝胶气液交界面上贴壁。向该其中一个第二通道140加入肠上皮细胞培养基,给肠上皮细胞提供生长所需的营养。其中,肠上皮细胞及肠上皮细胞培养基可以从与该其中一个第二通道140对应的第二入口1133加入,多余的肠上皮细胞及肠上皮细胞培养基可以通过与该其中一个第二通道140对应的第二出口1134流出。
[0134]
s36、向另一个第二通道140加入血管内皮细胞,使血管内皮细胞在第一通道130和第二通道140的matrigel/胶原混合水凝胶气液交界面上贴壁。向该另一个第二通道140加入血管内皮细胞培养基,给血管内皮细胞提供生长所需的营养。其中,血管内皮细胞及血管内皮细胞培养基可以从与该另一个第二通道140对应的第二入口1133加入,多余的血管内皮细胞及血管内皮细胞培养基可以通过与该另一个第二通道140对应的第二出口1134流出。
[0135]
s37、细胞培养成功后构建完成肠-内皮器官模型,用于后续测试。
[0136]
本实施例的细胞培养芯片100在用于细胞3d培养的使用方法包括:
[0137]
s41、将主体110的第二板体112进行亲水处理,并与第一板体111和第三板体113组装形成细胞培养芯片100。
[0138]
s42、对细胞培养芯片100进行灭菌处理。
[0139]
s43、向第一通道130内加入混有细胞的水凝胶,由于第一子侧壁1311和第二子侧
壁1312的阻拦作用,混有细胞的水凝胶被限制在第二通道140,而不会流入到第一通道130中。其中,混有细胞的水凝胶可以通过第一入口1131加入第一通道130,多余的混有细胞的水凝胶可以通过第一出口1132流出。
[0140]
s44、混有细胞的水凝胶固化,形成水凝胶条带。
[0141]
s45、向两个第二通道140加入细胞培养基,给细胞提供生长所需的营养。其中,细胞培养基可以从第二通道140对应的第二入口1133加入,多余的细胞培养基可以通过第二通道140对应的第二出口1134流出。
[0142]
s46、细胞培养成功,用于后续测试。
[0143]
在本技术的描述中,需要理解的是,术语“第一”、“第二”等仅用于描述目的,而不能理解为指示或暗示相对重要性。对于本领域的普通技术人员而言,可以具体情况理解上述术语在本技术中的具体含义。此外,在本技术的描述中,除非另有说明,“多个”是指两个或两个以上。“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b这三种情况。字符“/”一般表示前后关联对象是一种“或”的关系。
[0144]
以上所揭露的仅为本技术较佳实施例而已,当然不能以此来限定本技术之权利范围,因此依本技术权利要求所作的等同变化,仍属本技术所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1