扩增胆管细胞的方法与流程
扩增胆管细胞的方法
1.资助
2.本工作得到了欧洲肝脏研究协会
(easl)
的支持
。
引起本技术的项目根据欧盟地平线
2020
研究与创新计划
(
拨款协议号
741707)
,接受了来自欧洲研究理事会
(erc)
的资助
。
3.领域
4.本发明涉及人类胆管细胞类器官的分离和增殖,例如以用于疾病建模
、
药物筛选和再生医学
。
5.背景
6.类器官具有独特的组织修复潜力,因为它们保留了其来源组织的关键功能和特征
。
然而,它们修复天然上皮并恢复其复杂性的能力尚未在人类中得到确认,而类器官的移植和体内存活仅在数量有限的动物研究中得到证实
(1)。
胆管上皮为解决这一挑战和在人类中开发概念验证研究展现了一种典型的和临床上重要的系统
。
实际上,将胆汁从肝脏转移到十二指肠的胆源性系统病症占儿科的
70
%,并且占成人肝移植的多达三分之一
(2)。
这导致了对治疗替代物,如基于细胞的治疗的迫切需求
。
此外,适合再生医学应用的类器官可易于从称为胆管细胞的胆源性上皮细胞得到
(3)。
最后,胆管也概括了在其他空腔器官中发现的上皮多样性
(4)。
实际上,沿着胆管树
(biliary tree)
的不同区域表现出不同的转录谱和功能特性,如胆汁的化学修饰
(5,6)
,以及肝内导管
、
肝外导管和胆囊之间疾病敏感性的变化
。
7.然而,这种区域变化对来源于胆管树的不同区域的类器官的特征和再生潜力的影响仍有待表征
。
8.概述
9.本技术的发明人已经认识到,在法尼醇
x
受体
(fxr)
激动剂存在下产生的胆管细胞类器官表现出更接近体内胆管细胞的转录谱,并且相对于先前的胆管细胞类器官具有改进的功能和再生潜力
。
以这种方式产生的胆管细胞类器官可用于治疗和其他应用,例如可用于再生医学
、
药物筛选和疾病建模中
。
10.本发明的一方面提供了体外扩增胆管细胞的方法,其包括:
11.(i)
提供胆管细胞群体;以及
12.(ii)
在法尼醇
x
受体
(fxr)
激动剂存在下培养所述群体,以产生经
fxr
处理的胆管细胞
(ftc)
的扩增群体
。
13.扩增群体中的经
fxr
处理的胆管细胞可以为类器官的形式
。
14.在一些优选的实施方案中,在包含法尼醇
x
受体
(fxr)
激动剂
、
表皮生长因子
(egf)、
经典
wnt
信号传导抑制剂和非经典
wnt
信号传导增强剂的扩增培养基中培养所述群体,以产生经
fxr
处理的胆管细胞的扩增群体
。
15.法尼醇
x
受体
(fxr)
激动剂可以是胆汁酸,如鹅去氧酸
(chenodeoxylic acid)(cda)、
奥贝胆酸
(oca/int-747)、
胆酸
(ca)、
脱氧胆酸
(dca)、
石胆酸
(litocholic acid)(lca)、gw4064、px-102/104、cilofexor、tropifexor、nidufexor
和
fexaramine。
16.非经典
wnt
信号传导增强剂可以是经典和非经典
wnt
信号传导的增强剂,优选
r-脊
椎蛋白
1。
17.经典
wnt
信号传导抑制剂可以是
dickkopf
相关蛋白
1(dkk-1)。
18.优选地,在扩增培养基中的三维培养物中培养胆管细胞
。
19.在一些实施方案中,方法还可以包括破坏类器官以产生分离的经
fxr
处理的胆管细胞群体
。
可以在扩增培养基中进一步培养分离的经
fxr
处理的胆管细胞,以扩增或增殖所述群体
。
20.本发明的另一方面提供了通过本文所述的方法产生的分离的经
fxr
处理的胆管细胞群体
。
经
fxr
处理的胆管细胞可以为类器官
、
亚类器官组装体或单个细胞的形式
。
21.本发明的另一方面提供了支架,其包括通过本文所述的方法产生的经
fxr
处理的胆管细胞
。
22.本发明的另一方面提供了治疗胆源性病症的方法,其包括向有需要的个体施用如本文所述产生的分离的经
fxr
处理的胆管细胞群体或经
fxr
处理的胆管细胞类器官
。
23.本发明的另一方面提供了治疗胆源性病症的方法,其包括
24.向有需要的个体施用分离的胆管细胞群体或胆管细胞类器官;以及
25.向所述个体施用
fxr
激动剂
。
26.优选地,分离的胆管细胞或类器官是经
fxr
处理的胆管细胞或类器官
。
27.本发明的另一方面提供了治疗胆源性病症的方法,其包括
28.将分离的获自个体的肝组织离体暴露于
fxr
激动剂;以及
29.将所述肝组织移植到所述个体
。
30.方法还可以包括向个体施用
fxr
激动剂
。
31.本发明的另一方面提供了准备用于移植的肝组织的方法,其包括将分离的肝组织离体暴露于
fxr
激动剂
。
32.本发明的另一方面提供了筛选化合物的方法,其包括
33.使如本文所述产生的经
fxr
处理的胆管细胞群体与测试化合物接触;以及
34.确定测试化合物对经
fxr
处理的胆管细胞的影响和
/
或经
fxr
处理的胆管细胞对测试化合物的影响
。
35.优选地,与测试化合物接触的
fxr
激动剂处理的胆管细胞为类器官
(co)
的形式
。
36.本发明的另一方面提供了用于产生经
fxr
处理的胆管细胞的试剂盒,其包含扩增培养基,所述扩增培养基包含
fxr
激动剂
、
表皮生长因子
(egf)、
经典
wnt
信号传导抑制剂和非经典
wnt/pcp
信号传导增强剂
。
37.本发明的另一方面提供了对胆源性病症进行体外建模的方法,其包括:
38.(i)
提供来自患有胆源性病症的个体的胆管细胞群体;以及
39.(ii)
在包含表皮生长因子
(egf)、
经典
wnt
信号传导抑制剂和非经典
wnt
信号传导增强剂的扩增培养基中培养所述群体,以产生表现出胆源性病症基因型或表型的经
fxr
处理的胆管细胞的扩增群体
。
40.本发明的另一方面提供了测试胆源性病症的个体的方法,其包括
41.提供来自个体的分离的原代胆管细胞群体,使用上文所示的本发明的一方面的方法扩增所述胆管细胞群体,以产生经
fxr
处理的胆管细胞的扩增群体;以及
42.确定经
fxr
处理的胆管细胞的表型
。
43.下面将更详细地描述了本发明的方面和实施方案
。
44.附图的简要说明
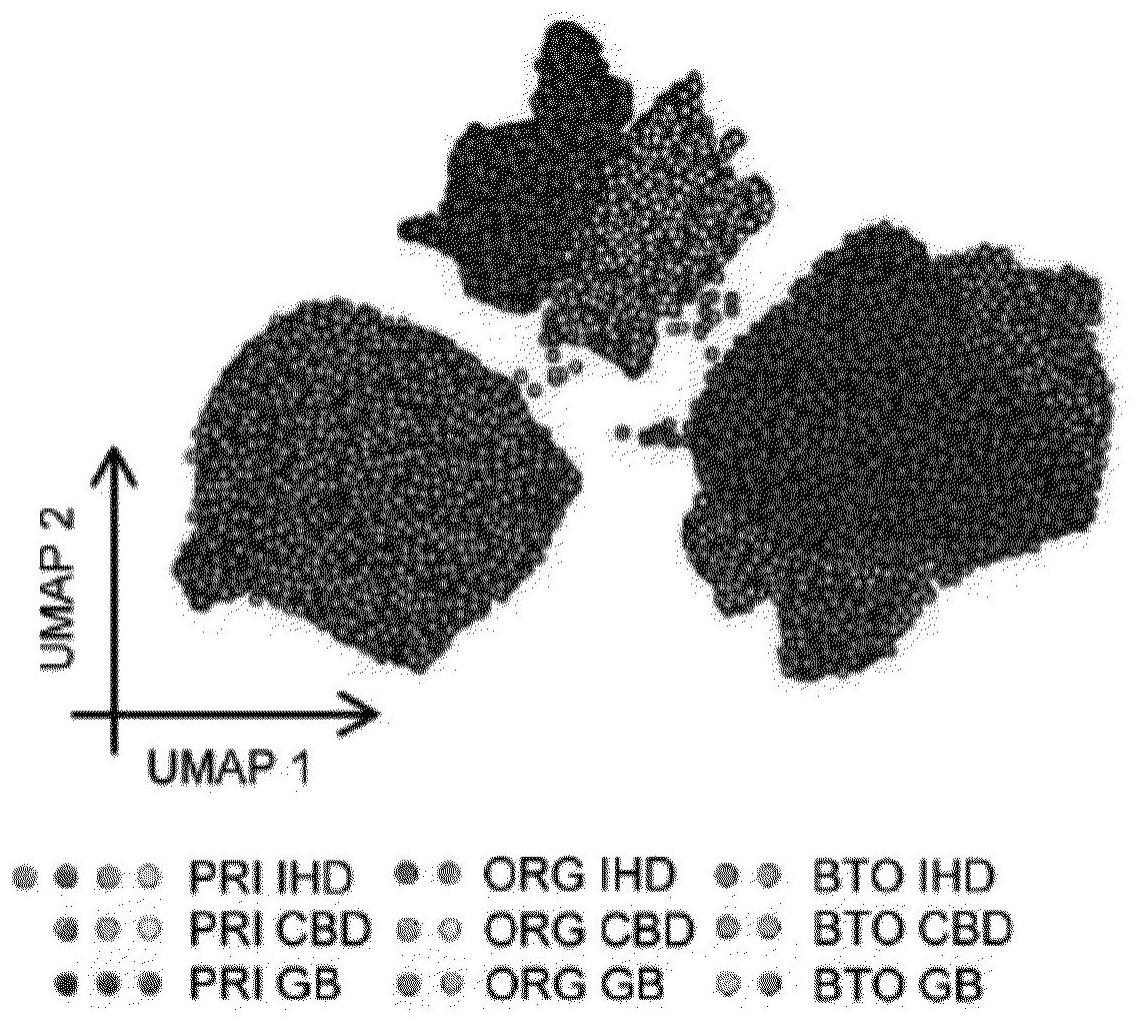
45.图1显示了胆管细胞类器官
(co)
的特性由小生境刺激控制,并且小生境中
(
体内;例如胆汁
)
或体外
(cda)
的
fxr
激动剂诱导胆囊特性,并使类器官的转录谱转变为更接近其体内对应物
。(a)
胆囊胆汁处理之前和之后原代胆管细胞及其相应的类器官的
umap(35,603
个细胞
)
,说明了不同区域类器官之间的相似性,以及其响应于胆汁的标记的变化
。pri
,原代;
ihd
,肝内导管;
cbd
,胆总管;
gb
,胆囊;
org
,类器官;
bto
,胆汁处理的类器官
。(b)
主要区域
、
类器官和
bto(
数据
s1-s2)
之间的前
100
个差异表达基因
(deg)
的热图,说明了类器官失去了区域差异并上调了培养相关的基因,但在胆汁处理后重新获得了胆囊标志物
。(c-d)qpcr(c)(
每组n=4个样品;中心线,中值;盒,四分位距
(iqr)
;
11
个晶须
(whisker)
,范围;管家基因,
hmbs
;
#p》0.05
,
**
p《0.01
,
***
p《0.001
,
****
p《0.0001)
;以及免疫荧光
(d)
,其证明了在没有
fxr 2
抑制剂
z-gs
的情况下,用鹅去氧胆酸
(cda)
处理后胆囊标志物和胆汁酸靶基因上调
。z-gs
,
z-固甾酮
。
比例尺,
50
μ
m。
46.图2显示了在没有
fxr
激动剂的情况下产生的胆管细胞类器官
(co)
在移植后挽救了胆管病,并呈现与植入部位对应的特性
。(a)
实验概略示意图
。(b)kaplan-meier
曲线
(
处于风险中的动物数量
)
,其证明了胆囊类器官注射后的动物挽救;
p
=
0.0018(
**
)
,对数秩检验
。(c)
磁共振胰胆管造影术
(mrcp)
,其证明了类器官注射后胆管病的挽救
。(d)
免疫荧光,其证明了门脉三合体
(portal triads)
中表达红色荧光蛋白
(rfp)
的胆囊类器官的植入,其中肝内
(sox4)
标志物上调
。
比例尺;黄色,
50
μm;白色,
5 100
μ
m。pv
,门静脉
。
47.图3显示了在没有
fxr
激动剂的情况下产生的胆管细胞类器官
(co)
植入到接受常温灌注
(nmp)
的人类肝脏中,并改善了胆汁特性
。(a)
用于类器官注射的技术的示意图和
(b)
使用的
nmp
回路的照片
。bd
,胆管;
gb
,胆囊;
ha
,肝动脉;
pv
,门静脉;
ivc
,下腔静脉;
l
,肝
rfp
,红色荧光蛋白;
p
,泵;o,氧合器;
prc
,浓集红细胞
。(c)
揭示灌流液中不存在
rfp
细胞的流式细胞术
。(d)
揭示肝内
(sox4)
标志物上调和胆囊
(sox17)
标志物丧失的
rfp
胆囊类器官植入的免疫荧光
。
比例尺,
50
μ
m。(e)
类器官注射提高了胆汁
ph
和胆汁分泌
。
***
p《0.001。n
=3个
nmp
肝
。
每次测量通过
10
个不同的数据点表示,每个器官通过不同的符号表示
。
48.详述
49.本发明涉及使用包含
fxr
激动剂的细胞培养基
(
称为“扩增培养基”)
对胆管细胞进行体外扩增,以产生具有更接近体内胆管细胞
(“经
fxr
处理的胆管细胞”)
表型的胆管细胞
。
50.这些经
fxr
处理的胆管细胞可以表现出增加的体外胆汁抗性;增加的植入效率;以及增加的再生胆管的能力
。
此外,经
fxr
处理的胆管细胞可以表现出改善的功能和更接近体内胆管细胞的表型,因此可用于药物筛选和疾病建模
。
51.胆管细胞是来自胆源性组织上皮的细胞,它是覆盖胆管树管腔表面的单层细胞
。
胆管细胞在体内胆汁分泌和电解质转运中起着重要作用
。
52.如本文所述的在
fxr
激动剂存在下扩增胆管细胞产生扩增的胆管细胞群体,其表现出与体内原代胆管细胞,如原代胆囊胆管细胞的转录谱类似的转录谱
。
例如,胆管细胞可以表达更多的原代胆管细胞标志物,如
fgf19
和
sox17
,并且表达的水平可以与原代胆管细胞相似
。
该扩增群体中的胆管细胞在本文中可被称为“经
fxr
处理的胆管细胞”或“ftc”。
53.胆管细胞的转录谱可以例如通过
bulk
或
scrnaseq
或
qpcr
,然后进行数据分析,如
本文所述的基因集富集分析
(gsea)
或基于分区的图抽象
(paga)
分析来确定
。
标志物表达也可以通过免疫荧光或蛋白质印迹分析来确定
。
54.经
fxr
处理的胆管细胞和类器官也可表现出相对于其他扩增的胆管细胞群体和类器官的功能的增加
。
例如,经
fxr
处理的胆管细胞和类器官可以表现出更高的胆汁抗性
、
更高的
ctfr
活性
、
增加的再生活性
、
更有效的胆汁碱化和改善的屏障功能
。
55.胆管细胞功能可通过标准功能测定,如
cftr
测定
、scr/sst
测定
、
罗丹明测定和
clf
测定来确定
(
参见例如,
f.sampaziotis
等人
,nat.protoc.12,814
–
827(2017)
和
wo2018/234323)。
56.合适的胆管细胞包括原代胆管细胞,使用本领域可得到的方法
(
参见例如
wo2018/234323)
从原代胆管细胞产生或扩增的胆管细胞,或者使用本领域可得到的方法
(
参见例如,
sampaziotis
等人
,nat biotech 33(8)845-853(2015)、wo2016/207621)
,通过体外分化从多能细胞产生的胆管细胞
。
57.直接从肝内或肝外胆源性组织,如胆管或胆囊的上皮分离原代胆管细胞,并且其与连续的
(
人工永生化的
)
胆源性细胞系不同
。
原代胆管细胞可以是肝内或肝外胆管细胞
。
58.如本文所述使用的原代胆管细胞是哺乳动物,优选人类
。
原代胆管细胞可以从成人或儿童供体获得
。
59.原代胆管细胞群体不包含干细胞或其他多能或专门细胞
。
群体中原代胆管细胞的分化能力局限于其起源谱系,并且它们不能分化为其他谱系的细胞,如肝细胞或胰腺细胞
(
即群体由胆管细胞和胆管细胞前体组成
)。
60.在一些实施方案中,原代胆管细胞可以是癌细胞,其可用于例如药物筛选
。
61.原代胆管细胞可以获自或分离自本文所述方法中的原代胆汁组织,或者可以先前已从原代胆汁组织中获得
。
合适的胆汁组织可以包括胆囊和来自肝胰胆管
(hpb)、
胰胆管
(pancreatobiliary
,
pb)
或胆道系统的任何部分的胆管,包括胆总管
(cbd)、
胆囊管
、
肝总管
、
右肝管
、
左肝管
、
肝内管和胰管
。
原代胆汁组织可以例如获自肝外植体
、
肝组织
、
肝活检
、
胆管切除
、
胆囊切除术
、
胰腺切除术
、
内窥镜检查
(ercp
,例如活检
、
刷取
、spyglass
内窥镜
、eus
活检
)
或胆汁
(
例如通过
ercp
或
ptc)。
62.在一些优选的实施方案中,胆管细胞是肝外胆管细胞
。
肝外胆管细胞源自肝外胆管树的胆源性上皮,并且可以获自肝外胆汁组织,如胆囊
、
胆囊胆管
、
胆总管或肝总管
。
63.在其他实施方案中,胆管细胞是肝内胆管细胞
。
肝内胆管细胞源自肝内胆管树的胆源性上皮
。
64.从中获得胆管细胞的原代胆汁组织可以是供体个体中原位的,或者可以是先前从供体个体获得的组织样品,例如在手术或解剖,如胆管切除
、
肝切除或移植
、
胰腺切除
、
胆道镜检查或胆囊切除术之后
。
在使用之前,可以将合适的组织储存在保存溶液中
。
65.可以通过任何方便的技术从原代胆汁组织中获得胆管细胞群体
。
在一些实施方案中,可以采用围手术期技术,如例如通过刷取或刮取来机械解离原代胆汁组织,以移出原代胆管细胞群体
。
在其他实施方案中,可以使用微创技术,如内镜逆行胰胆管造影术
(ercp)
刷取
。
66.在一些实施方案中,可以通过肝活检或外植体组织的机械解离来获得胆管细胞群体,例如通过在本文所述的培养条件下,在添加或不添加诸如
hgf
和毛喉素的因子的情况
下,接种小
(
例如亚毫米
)
部分的组织
。
可选地,可以使用机械解离
(
刮取
/
切割
)
和使用基质消化酶如释放酶
、
胶原酶或透明质酸酶的酶消化的组合,将肝组织
、
胆囊和胆管外植体解离成单个原代细胞或小团块
。
随后可以用针对胆源性标志物如
epcam
的抗体标记单个原代细胞,并用免疫分离方法,如磁性或荧光相关的细胞分选
(macs
或
facs)
进行分离
。
67.分离的单细胞可以使用本文所述的
3d
培养条件进行接种或处理以进行单细胞
rna
测序
。
本文的数据显示本文所述的
3d
培养条件选择性地扩增胆管细胞类器官
。
其他肝细胞类型,如肝细胞,在这些条件下不增殖
。
这可以例如通过肝脏标志物的下调来显示
(
图
28)。
68.原代胆汁组织可以来源于健康个体或具有已知病理学以实现疾病建模的患者
。
69.来源于患有胆源性病症的个体的胆管细胞可用于产生扩增群体,其表现出与胆源性病症相关的基因型或表型
。
产生具有胆源性病症相关的基因型或表型的胆管细胞的方法可包括;
70.由患有胆源性病症的个体提供原代胆管细胞群体,
71.扩增如本文所述的原代胆管细胞,
72.从而产生具有胆源性病症相关的基因型或表型的胆管细胞群体
。
73.扩增的具有胆源性病症相关表型的群体可以表现出胆源性病症的一种或多种特征
。
在一些实施方案中,胆源性病症的一种或多种特征可以响应于特定条件或处理而表现
。
例如,可将胆管细胞与一种或多种其他的细胞类型共培养,以引发胆源性病症相关的表型
。
例如,可将胆管细胞与免疫细胞如
t
细胞共培养,以引发与自身免疫性胆源性病症,如原发性胆汁性肝硬化
(pbc)
相关的表型
。
74.一旦产生具有胆管病症相关表型的胆管细胞,可以对其进行培养
、
扩增和维持,例如以用于筛选
。
75.具有胆源性病症相关表型的胆管细胞可以表现出胆源性病症的一种或多种特性
、
特征或病理学特点
。
76.扩增培养基是支持类器官
(
胆管细胞类器官
)
形式的胆管细胞增殖的细胞培养基
。
77.扩增培养基是包含法尼醇
x
受体
(fxr)
激动剂的营养培养基
。
78.法尼醇
x
受体
(fxr
;
nr1h4
;基因
id 9971)
是一种配体激活的转录因子,其被胆汁酸激活并调节参与胆汁酸合成和转运的基因表达
。fxr
可以具有数据库登录号
np_001193906.1
的氨基酸序列或其同种型,并且可以由
nm_001206977.2
的核苷酸序列或其同种型编码
。
79.合适的
fxr
激动剂是本领域已知的,并且包括胆汁酸,如鹅去氧胆酸
(cda)、
胆酸和奥贝胆酸
(oca)
;咖啡醇;
fexaramine
;
int-767
;
ab23a
;姜黄素;水飞蓟素;常春藤次酸
(hedragonic acid)
;二氢青蒿素;细格菌素
(altenusin)
;
px-102
;
bar704
;
gw 4064
;以及
tropoflexor。
其他
fxr
激动剂可以使用本领域中可得到的测定法来鉴定
(
参见例如,
van der wiel
等人
,scientific reports 9,2193(2019)
;
han int j mol sci.2018
年7月;
19(7):2069),hiebl
等人
,biotech adv 2018,36,1657。
80.fxr
激动剂可以以足以激活或激动
fxr
的浓度存在于扩增培养基中
。
例如,扩增培养基可含有
1-100
μm,优选约
10
μm的
fxr
激动剂,如
cda。
81.用于培养胆管细胞的合适扩增培养基是本领域熟知的
。
82.在一些优选的实施方案中,扩增培养基还可以包含
egf、
经典
wnt
抑制剂和非经典
wnt
增强剂
。
83.非经典
wnt
信号传导增强剂是刺激
、
促进或增加非经典
wnt
信号传导通路的活性的化合物
。
84.非经典
wnt
信号传导通路是一种
β-连环蛋白非依赖性通路,其参与脊椎动物中的组织极性和形态发生过程
(komiya,y.&habas,r.organogenesis 4,68
–
75(2008)
;
patel,v.
等人
,hum.mol.genet.17,1578
–
1590(2008)
;
strazzabosco,m.&somlo,s.gastroenterology 140,(2011))。
85.非经典
wnt
信号传导通路的组分包括
wnt4、wnt5a、wnt11、lrp5/6、dsh、fz、daam1、rho、rac、prickle
和
strabismus。
用于测定非经典
wnt/pcp
信号传导通路的活性的合适方法是本领域熟知的,并且包括基于
atf-2
的报告子测定
(ohkawara
等人
,(2011)dev dyn 240(1)188-194)
和基于
rho
相关的蛋白激酶
(rock)
的测定
。
86.非经典
wnt
信号传导增强剂可以选择性地增强非经典
wnt
信号传导,或者更优选地,可以增强非经典
wnt
信号传导和经典
wnt
信号传导通路
(
即
wnt
信号传导激动剂
)。
87.优选的非经典
wnt
信号传导增强剂包括
wnt
信号传导激动剂
r-脊椎蛋白
。
88.r-脊椎蛋白是一种分泌型激活蛋白,具有两个富含半胱氨酸的弗林蛋白酶样结构域和一个正向调节
wnt
信号传导通路的血小板反应蛋白1型结构域
。
优选地,
r-脊椎蛋白是人类
r-脊椎蛋白
。
89.r-脊椎蛋白可包括
rspo1(
基因
id 284654
核酸序列参考
nm_001038633.3
,氨基酸序列参考
np_001033722.1)、rspo2(
基因
id 340419
核酸序列参考
nm_001282863.1
,氨基酸序列参考
np_001269792.1)、rspo3(
基因
id 84870
,核酸序列参考
nm_032784.4
,氨基酸序列参考
np_116173.2)
或
rspo4(
基因
id 343637
,核酸序列参考
nm_001029871.3
,氨基酸序列参考
np_001025042.2)。
90.r-脊椎蛋白很容易从商业来源
(
例如
r&d systems,minneapolis,mn)
获得
。
可以使用标准技术容易地确定如本文所述的用于扩增胆管细胞的
r-脊椎蛋白的合适浓度
。
例如,扩增培养基可包含
50ng/ml
至5μ
g/ml r-脊椎蛋白,优选约
500ng/ml。
91.经典
wnt
信号传导抑制剂是抑制
、
阻断或降低经典
wnt
信号传导通路的活性的化合物
。
92.经典
wnt
信号传导通路是参与基因表达调节的
β-连环蛋白依赖性通路
(klaus
等人
,nat.rev.cancer(2008)8 387-398
;
moon
等人
,(2004)nat.rev.genet.5 691-701
;
niehrs
等人
,nat rev mol.cell biol.(2012)13 763-779)。
用于测定经典
wnt
信号传导通路的活性的合适方法是本领域熟知的,并且包括
top-flash
测定法
(molenaar
等人
,cell.1996
年8月9日;
86(3):391-9)
和
β-连环蛋白测定法
。
93.合适的经典
wnt
信号传导抑制剂包括
dickkopf
相关蛋白
1-4(dkks1-4)、soggy-1/dkkl1、
分泌型卷曲相关蛋白
1-5(sfrp1-5)、wnt
抑制因子
1(wif-1)、draxin、sost/
硬骨素
、igfbp-4、usag1
和
notum。
94.优选地,经典
wnt
信号传导抑制剂是
dkk-1。dkk-1(
基因
id 22943
,核酸序列参考
nm_012242.2、
氨基酸序列参考
np_036374.1)
是一种在胚胎发生中起作用的具有两个富含半胱氨酸的区域的分泌性蛋白质
。dkk-1
易于从商业来源
(
例如
r&d systems,minneapolis,mn)
获得
。
可以使用标准技术容易地确定本文所述的用于扩增胆管细胞类器官的
dkk-1
的合
适浓度
。
例如,扩增培养基可包含
10ng/ml
至1μ
g/ml dkk-1
,例如约
100ng/ml。
95.表皮生长因子
(egf
;
ncbi
基因
id:1950
,核酸序列
nm_001178130.1gi:296011012
;氨基酸序列
np_001171601.1gi:296011013)
是一种通过结合表皮生长因子受体
(egfr)
来刺激细胞生长
、
增殖和细胞分化的蛋白质因子
。
可以使用常规重组技术生产或从商业供应商
(
例如
r&d systems,minneapolis,mn
;
stemgent inc,usa)
获得
egf。
可以使用标准技术容易地确定如本文所述的用于扩增胆管细胞类器官的
egf
的合适浓度
。
例如,扩增培养基可包含
2-500ng/ml egf
,优选约
20ng/ml。
96.可以在二维或三维培养物的扩增培养基中培养胆管细胞
。
优选地,在三维培养物中的扩增培养基中培养胆管细胞
。
对于三维培养,扩增培养基还包含支架基质,其支持细胞在三维中的生长和增殖,并允许胆管细胞组装成类器官
。
97.合适的支架基质是本领域熟知的,并且包括水凝胶,如胶原
、
胶原
/
层粘连蛋白
、
压缩胶原
(
例如
raft
tm
,lonza biosystems)、
海藻酸盐
、
琼脂糖
、
复合蛋白水凝胶,如基底膜提取物,以及合成的聚合物水凝胶
(gjorevsk
等人
,nature(2016)539 560-564)
,如聚乙醇酸
(pga)
水凝胶和交联的葡聚糖和
pva
水凝胶
(
例如
cellendes gmbh,reutlingen de)、
惰性基质如多孔聚苯乙烯,以及分离的天然
ecm
支架
(engitix ltd,london uk)。
98.其他合适的支架基质可包括脱细胞的胆源性组织,例如脱细胞的胆囊
、
胆总管或肝内胆管
。
99.支架基质可以是化学上明确的,例如胶原或致密的胶原水凝胶,或者非化学上明确的,例如复合蛋白水凝胶
。
优选地,扩增培养基中的支架基质是复合蛋白水凝胶
。
合适的复合蛋白水凝胶可以包括细胞外基质组分,如层粘连蛋白
、
胶原
iv、
巢蛋白
(enactin)
和硫酸肝素蛋白多糖
。
复合蛋白水凝胶还可以包括来自
engelbreth-holm-swarm(ehs)
小鼠肉瘤细胞的细胞外基质蛋白的水凝胶
。
合适的复合蛋白水凝胶可从商业来源获得,并且包括
matrigel
tm
(corning life sciences)
或
cultrex
tm bme 2rgf(amsbio
tm inc)。
例如,扩增培养基可包括
66
% matrigel
tm
。
100.扩增培养基可包括支架基质和补充有以下物质的营养培养基或者由支架基质和补充有以下物质的营养培养基组成:
(i)egf
,
(ii)
经典
wnt
抑制剂如
dkk-1
,
(iii)
非经典
wnt
增强剂如
r-脊椎蛋白,以及
(iv)fxr
激动剂如
cda。
101.营养培养基可包括基础培养基
。
合适的基础培养基包括
iscove
改良
dulbecco
培养基
(iscove’s modified dulbecco’s medium,imdm)、ham’s f12、
高级
dulbecco
改良
eagle
培养基
(advanced dulbecco’s modified eagle medium,dmem)
或
dmem/f12(price
等人
,focus(2003),25 3-6)、williams e(williams,g.m.
等人
,exp.cell research,89,139-142(1974))
,以及
rpmi-1640(moore,g.e.
和
woods l.k.,(1976)tissue culture association manual.3,503-508。
在一些实施方案中,
williams e
培养基可例如优选是
33
%
williams e
培养基
。
102.基础培养基可补充有培养基补充物和
/
或一种或多种另外的组分,例如转铁蛋白
、1-硫代甘油
、
脂质
、l-谷氨酰胺或替代物,如
l-丙氨酰-l-谷氨酰胺
(
例如
glutamax
tm
)、
烟酰胺
、
亚油酸和亚硒酸
(
例如
its+
预混物
)、
地塞米松
、
硒
、
丙酮酸
、
缓冲剂如
hepes、
碳酸氢钠
、
磷酸-l-抗坏血酸三钠盐
、
葡萄糖和抗生素如青霉素和链霉素,以及任选的聚乙烯醇;聚乙烯醇和胰岛素;血清白蛋白;或者血清白蛋白和胰岛素
。
103.例如,基础培养基可以补充有
10mm
烟酰胺
、17mm
碳酸氢钠
、0.2mm2-磷酸-l-抗坏血酸三钠盐
、6.3mm
丙酮酸钠
、14mm
葡萄糖
、20mm hepes、6
μ
g/ml
胰岛素
、
人类6μ
g/ml
转铁蛋白
、6ng/ml
亚硒酸
、5
μ
g/ml
亚油酸
、0.1um
地塞米松
、2mm l-丙氨酰-l-谷氨酰胺
、100u/ml
青霉素
、100
μ
g/ml
链霉素
。
104.营养培养基可以是化学上明确的基础营养培养基
。
化学上明确的培养基是用于培养细胞的营养溶液,其仅包含明确的组分,优选已知化学结构的组分
。
化学上明确的培养基不含未明确的组分或包括未明确组分的成分,如饲养细胞
、
基质细胞
、
血清
、
血清白蛋白和复杂的细胞外基质,如
matrigel
tm
。
化学上明确的培养基可以被人源化
。
人源化的化学上明确的培养基不含来源于或分离自非人类动物的组分或补充物,如胎牛血清
(fbs)
和牛血清白蛋白
(bsa)
,以及小鼠饲养细胞
。
条件培养基包括来自培养细胞的未明确的组分,并且不是化学上明确的
。
105.合适的化学上明确的营养培养基是本领域熟知的,并且包括补充有以下组分的
william’s e
培养基:烟酰胺
、
碳酸氢钠
、2-磷酸-l-抗坏血酸三钠盐
、
丙酮酸钠
、
葡萄糖
、hepes、its+
预混物
(
胰岛素
、
转铁蛋白
、
硒酸和亚油酸
)、
地塞米松
、glutamax、
青霉素和链霉素
。
106.可将胆管细胞在扩增培养基中培养多代
。
例如,可将胆管细胞培养
10
代或更多代
、20
代或更多代
、30
代或更多代
、40
代或更多代或者
50
代或更多代
。
一次传代可能花费
2-8
天,优选约5天
。
107.可以通过消化支架基质,通过离心收获胆管细胞类器官,以及将类器官分解成单个胆管细胞来传代胆管细胞
。
可以按如上所述在扩增培养基中重新悬浮和培养胆管细胞,在扩增培养基中它们转化为类器官
。
108.用于细胞培养的合适技术是本领域熟知的
(
参见例如,
basic cell culture protocols,c.helgason,humana press inc.u.s.(2004
年
10
月
15
日
)isbn:1588295451
;
human cell culture protocols(methods in molecular medicine s.)humana press inc.,u.s.(2004
年
12
月9日
)isbn:1588292223
;
culture of animal cells:a manual of basic technique,r.freshney,john wiley&sons inc(2005
年8月2日
)isbn:0471453293,ho wy et al jimmunol methods.(2006)310:40-52,handbook of stem cells(
编辑
r.lanza)isbn:0124366430)basic cell culture protocols’,j.pollard
和
j.m.walker(1997),
‘
mammalian cell culture:essential techniques’,a.doyle
和
j.b.griffiths(1997),
‘
human embryonic stem cells’,a.chiu
和
m.rao(2003),stem cells:from bench to bedside’,a.bongso(2005),peterson&loring(2012)human stem cell manual:a laboratory guide academic press and
‘
human embryonic stem cell protocols’,k.turksen(2006)。
培养基及其成分可从商业来源
(
例如
gibco,roche,sigma,europa bioproducts,r&dsystems)
获得
。
可将标准哺乳动物细胞培养条件用于上述培养步骤,例如
37℃
,
21
%氧气,5%二氧化碳
。
优选每两天更换培养基,并允许细胞通过重力沉降
。
109.胆管细胞群体可在如本文所述的扩增培养基中作为类器官被扩增
105倍或更多倍
、10
10
倍或更多倍
、10
15
倍或更多倍
、10
20
倍或
10
30
倍或更多倍
。
110.将原代胆管细胞群体在扩增培养基中增殖,并组装成胆囊样胆管细胞
(co)
的类器官
。
胆管细胞类器官是三维多细胞组装体或包囊,其包括一层通过紧密连接而连接的胆囊
样胆管细胞,所述紧密连接包围内腔并将其与外部环境分离
。
经
fxr
处理的胆管细胞可以表现出标志物如
cftr
的极化表达
。
111.由经
fxr
处理的胆管细胞在扩增培养基中形成的类器官可以表现出体内胆管细胞,如来自胆囊的胆管细胞的形态或物理特征
。
例如,相对于在没有
fxr
的情况下扩增的胆管细胞,经
fxr
处理的胆管细胞可以表现出具有增加的高基比的柱状和具有较厚的壁的类器官
。
112.类器官可以例如包括纤毛
、
紧密连接
、
微绒毛
、
外泌体和
/
或管状结构
。
可以通过标准显微镜程序确定类器官的形态和物理特征
。
113.扩增的胆囊样胆管细胞群体,无论是类器官还是单个细胞的形式,都可以不含或实质上不含其他细胞类型,即胆管细胞群体可以是同质的或实质上同质的
。
例如,在培养基中培养后,群体可含有
80
%或更多
、90
%或更多
、95
%或更多
、98
%或更多或者
99
%或更多的胆管细胞
。
优选地,胆管细胞群体实质上不含其他不需要纯化的细胞类型
。
114.经
fxr
处理的胆管细胞可以表达一种或多种胆源性标志物
。
例如,胆管细胞可以表达细胞角蛋白
7(krt7
或
ck7)、
细胞角蛋白
19(krt19
或
ck19)、
γ
谷氨酰转移酶
(ggt)、
肝细胞核因子1β
(hnf1b)、
分泌素受体
(sctr)、
钠依赖性胆汁酸转运蛋白
1(asbt/slc10a2)、sry
盒
9(sox9)jagged 1(jag1)、notch2、scr、sstr2、
顶端盐和胆汁转运体
(asbt)、
水通道蛋白1和阴离子交换剂,以及囊性纤维化跨膜传导调节因子
(cftr)。
典型地,群体中至少
98
%的胆管细胞在如本文所述的扩增培养基中传代
20
代后,可以共表达
ck7
和
ck19。
经
fxr
处理的胆管细胞还可以表达
sox17、fgf19
和图
1b
中所示的其他标志物
。
115.优选地,经
fxr
处理的胆管细胞以与原代胆管细胞对应的水平表达成熟胆源性标志物
。
胆管细胞可以是成熟的胆管细胞,并且可以缺乏胎体特征
。
116.与原代胆管细胞相反,扩增群体中经
fxr
处理的胆管细胞可缺乏
mhc 1
类或2类蛋白,例如
hla
蛋白如
hla-e
或
hla-drb1
的表达
。
另外,胆管细胞可以表现出具有胆管树的一个区域的原代胆管细胞特征的基因,例如由胆汁酸梯度诱导的基因如
sox17
和
fgf19
的表达,并且可缺乏具有来自胆管树的不同区域的原代胆管细胞特征的基因的表达
。
117.在一些实施方案中,经
fxr
处理的胆管细胞群体可能没有干细胞或其他多能或专能细胞
。
例如,相对于对照细胞,胆管细胞可以表现出不表达或低表达干细胞标志物,如
pou5f1、oct4、nanog、prominin 1(prom1)、
富含亮氨酸4重复序列的g蛋白偶联受体
(lgr)
如
lgr-4、lgr-5
或
lgr-6、sox2、ssea-3、ssea-4、tra-1-60、klf-4
和
c-myc。
在一些优选的实施方案中,胆管细胞表达高水平的胆源性标志物,低水平的干细胞标志物如
lgr5
和
prom1
,并且不表达多能性标志物如
oct4、nanog
和
sox2。
118.经
fxr
处理的胆管细胞群体可没有非胆管细胞,如肝细胞或胰腺细胞
。
胆管细胞不表达非胆管谱系的标志物,如肝细胞或胰腺标志物
。
例如,胆管细胞可缺少白蛋白
(alb)、
α
1-抗胰蛋白酶
(serpina1
或
6a1at)、
胰腺和十二指肠同源盒
1(pdx1)、
胰岛素
(ins)、
胰高血糖素
(gcg)
和成肝细胞胎体标志物如
afp
的表达
。
119.在一些实施方案中,经
fxr
处理的胆管细胞群体可缺乏上皮间充质转化
(emt)
标志物的表达
。
例如,胆管细胞可缺乏波形蛋白
(vim)、snail
家族转录抑制因子
1(snai1)
和
/
或
s100
钙结合蛋白
9a4(s100a4)
的表达
。
120.可以监测和
/
或检测经
fxr
处理的胆管细胞的扩增群体中一种或多种胆源性标志
物的表达和缺乏一种或多种非胆源性标志物的表达
。
例如,可以确定经
fxr
处理的胆管细胞的扩增群体中如上文陈述的一种或多种成熟胆源性标志物的表达或产生
。
这允许确定和
/
或监测经
fxr
处理的胆管细胞的扩增群体的同质性
。
121.如本文所述的产生的经
fxr
处理的胆管细胞的扩增群体可以在体外表现出原代胆管细胞,如原代胆囊
(gb)
胆管细胞的一种或多种功能特性
。
例如,胆管细胞可以组装成表现出一种或多种,优选全部的如下所述特性的类器官
。
122.经
fxr
处理的胆管细胞类器官可以表现出胆汁酸转移
、
碱性磷酸酶
(alp)
活性和
/
或
γ-谷氨酰-转肽酶
(ggt)
活性
。alp
和
ggt
活性的量可以对应于原代胆管细胞表现的
alp
和
ggt
活性的量
。
可以例如按本文所述确定
alp
和
ggt
活性
。
123.经
fxr
处理的胆管细胞类器官可以表现出主动分泌,例如,多药抗性蛋白-1(mdr1)
介导的分泌
。
这可以通过在
mdr1
抑制剂维拉帕米存在和不存在的情况下,测量荧光
mdr1
底物如罗丹明
123
在经
fxr
处理的胆管细胞类器官的管腔中的积聚来确定,如本文所述的
。
124.经
fxr
处理的胆管细胞类器官可以表现出对分泌素和生长抑素的应答
。
例如,胆管细胞类器官可以表现出响应于分泌素增加的分泌活性和响应于生长抑素降低的活性
。
这可以通过测量类器官大小的变化来确定
。
例如,分泌素可以增加胆管细胞类器官的大小并且生长抑素可以减小胆管细胞类器官的大小
。
125.经
fxr
处理的胆管细胞类器官可以表现出胆汁酸的主动转移,例如顶端盐和胆汁转运体
(asbt)
介导的转移
。
胆汁酸转移活性可以例如通过测量荧光性胆汁盐如
clf
相对于另一荧光化合物如
fitc
的主动转移来确定,如本文所述的
。
126.经
fxr
处理的胆管细胞类器官可以表现出囊性纤维化跨膜传导调节因子
(cftr)
活性
。ctfr
活性可通过测量响应于具有不同氯化物浓度的培养基的细胞内和管腔内氯化物浓度,例如,荧光氯化物指示剂
n-(6-甲氧基喹啉基
)
乙酰乙酯
(mqae)
来确定,如本文所述的
。
127.经
fxr
处理的胆管细胞类器官可以表现出对
atp
和乙酰胆碱的应答
。
例如,胆管细胞类器官中的细胞内
ca
2+
水平可以响应于
atp
或乙酰胆碱而增加
。
可以使用标准技术确定细胞内
ca
2+
水平
。
128.经
fxr
处理的胆管细胞类器官可以表现出对血管内皮生长因子
(vegf)、
有丝分裂原如
il6
和雌激素的应答
。
例如,胆管细胞类器官可以表现出响应于
vegf
而增加的增殖
。
129.胆管细胞类器官可以表现出对药物如鲁玛卡托
(vx809)
的应答
。
例如,在从患有囊性纤维化的供体个体获得的原代胆管细胞扩增的胆管细胞类器官中,大小
、cftr
活性和
/
或管腔内流体分泌可响应于鲁玛卡托而增加
。
下文描述了用于确定对鲁玛卡托的应答的合适方法
。
130.通过要求保护的方法产生的经
fxr
处理的胆管细胞类器官的应答和
/
或活性的量可对应于原代胆管细胞,优选原代肝内胆管细胞或原代肝外胆管细胞如胆总管
(cbd)
胆管细胞表现出的应答和
/
或活性的量
。
另外,通过要求保护的方法产生的经
fxr
处理的胆管细胞类器官的应答和
/
或活性的量可以大于在没有
fxr
激动剂存在下产生的胆管细胞类器官的应答和
/
或活性的量
。
131.如上文所述的,在扩增培养基中扩增后,可以解离或破坏经
fxr
处理的胆管细胞类器官,以产生单个经
fxr
处理的胆管细胞
。
132.将类器官解离成单个组成细胞的合适方法是本领域熟知的
(
参见例如,
f.sampaziotis,
等人
,nat.protoc.12,814
–
827(2017))。
例如,可以使用分散酶或非酶回收溶液如
cell recovery solution
tm
(corning)
,从扩增培养基中收获胆管细胞类器官,并使用蛋白酶如胰蛋白酶解离
。
合适的试剂是可商购获得的,并且包括
tryple
tm express(thermofisher scientific)。
133.可以监测和
/
或测定如本文所述扩增的经
fxr
处理的胆管细胞执行一种或多种胆管细胞功能的能力
。
例如,可以监测和
/
或测定细胞组装成类器官和
/
或执行
mdr1
功能;胆汁酸转移;
vegf、
乙酰胆碱或
atp
应答;
cftr
介导的氯化物运输;或者分泌素或生长抑素应答中的一种或多种的能力
。
134.如本文所述产生的经
fxr
处理的胆管细胞可按本文所述进行扩增,或者使用标准哺乳动物细胞培养技术进行培养或维持
(
参见例如,
f.sampaziotis,
等人
,nat.protoc.12,814
–
827(2017))
,或者进行进一步的操作或处理
。
在一些实施方案中,如本文所述产生的胆管细胞群体可以例如通过冷冻干燥和
/
或冷冻保存而被储存
。
经
fxr
处理的胆管细胞可以作为类器官
、
亚类器官组装体或单个细胞储存
。
合适的储存方法是本领域熟知的
。
例如,可将胆管细胞悬浮在冷冻保存培养基
(
例如,
cellbanker
tm
(ams biotechnology ltd,uk)
中,并例如在-70℃
或更低温度下冷冻
。
135.可将经
fxr
处理的胆管细胞群体与其他试剂如缓冲剂
、
载体
、
稀释剂
、
防腐剂和
/
或药学上可接受的赋形剂混合
。
合适的试剂在下面更详细地描述
。
本文所述的方法可包括将胆管细胞群体与治疗上可接受的赋形剂混合,以产生治疗组合物
。
混合的经
fxr
处理的胆管细胞可以为类器官
、
亚类器官组装体或单个细胞的形式
。
136.在一些实施方案中,相比在没有
fxr
激动剂的情况下产生的胆管细胞,如本文所述产生的经
fxr
处理的胆管细胞表现出增加的再生能力,并且可用于治疗
。
对于治疗应用,经
fxr
处理的胆管细胞优选为临床级细胞
。
优选使用化学上明确的扩增培养基,从本文所述的原代胆管细胞产生用于治疗的经
fxr
处理的胆管细胞群体
。
取决于具体应用,经
fxr
处理的胆管细胞可以为类器官
、
亚类器官组装体或单个细胞的形式
。
137.经
fxr
处理的胆管细胞的扩增群体可被移植
、
输注或以其他方式施用到个体中
。
合适的技术是本领域熟知的
。
138.经
fxr
处理的胆管细胞的扩增群体可以是自体的,即经
fxr
处理的胆管细胞是从最初从随后施用的同一个体
(
即供体和受体个体相同
)
获得的原代胆管细胞扩增的
。
用于施用至受体个体的合适的经
fxr
处理的胆管细胞的扩增群体可通过以下方法产生,该方法包括提供从个体获得的原代胆管细胞的初始群体,并按如上所述扩增胆管细胞群体,以产生用于施用的经
fxr
处理的胆管细胞的扩增群体
。
139.经
fxr
处理的胆管细胞的扩增群体可以是同种异体的,即原代胆管细胞最初是从与随后施用经
fxr
处理的胆管细胞的个体不同的个体
(
即供体和受体个体不同
)
获得的
。
供体和受体个体可以是
hla
匹配的和
/
或血型匹配的,以避免排斥和其他不期望的免疫作用
。
供体和受体个体还可以匹配先前的病毒感染史和
/
或病毒免疫状态,例如先前的
cmv
感染
。
在一些实施方案中,受体个体可以接受免疫抑制治疗,以减少或防止同种异体的经
fxr
处理的胆管细胞的排斥
。
用于施用至受体个体的合适的经
fxr
处理的胆管细胞的扩增群体可以通过以下方法产生,该方法包括提供获自供体个体的初始原代胆管细胞群体,并按如上所述扩增胆管细胞群体,以产生用于施用的经
fxr
处理的胆管细胞的扩增群体
。
在一些实施方
案中,扩增的群体可被工程化以减少或灭活免疫原性抗原如
hla
的表达,和
/
或可以用一种或多种免疫抑制剂治疗受体个体
。
140.在一些优选的实施方案中,可将经
fxr
处理的胆管细胞的扩增群体与生物相容性支架,如脱细胞的人类细胞外基质或脱细胞的非人类
(
例如猪
)
细胞外基质混合
。
141.可以利用如上所述扩增的胆管细胞接种生物相容性支架
。
例如,可在生产过程中将经
fxr
处理的胆管细胞的单个胆管细胞或亚类器官组装体注射到支架上或其内,或者混合到支架中
。
然后可以在扩增培养基中培养包含胆管细胞的支架,使得胆管细胞填充支架
。
胆管细胞可以在支架内增殖并组装成类器官,然后组装成多层上皮
。
142.合适的生物相容性支架可以包括水凝胶,如纤维蛋白
、
壳聚糖
、
糖胺聚糖
、
丝
、
纤维蛋白
、
纤连蛋白
、
弹性蛋白
、
胶原
、
糖蛋白如纤连蛋白或多糖如几丁质或纤维素胶原
、
胶原
/
层粘连蛋白
、
致密胶原
、
海藻酸盐
、
琼脂糖
、
复合蛋白水凝胶如基膜提取物
、
生物有机凝胶,以及合成的聚合物水凝胶如聚乳酸
(pla)、
聚乙醇酸
(pga)、
聚己内酯
(polycapryolactone)(pcl)
水凝胶
、
交联葡聚糖和
pva
水凝胶
(
例如
cellendes gmbh,reutlingen de)、
惰性基质如多孔聚苯乙烯
、
聚酯
、
可溶性玻璃纤维多孔聚苯乙烯和分离的天然
ecm
支架,例如脱细胞的胆囊和胆管支架
(engitix ltd,london uk)。
支架可以是可生物降解的
。
143.支架的大小或形状取决于预期的应用
。
合适的支架形状可以例如包括贴片
、
薄片和管,包括直管和支管,其直径长达例如
10-12mm。
144.如本文所述产生的在生物相容性支架内培养的经
fxr
处理的胆管细胞组织成功能性胆源性上皮
。
填充的支架可以表现出胆源性上皮的一种或多种特性
。
例如,填充的支架可以是抗胆汁的,并且可以表现出一种或多种上述功能特性
。
经
fxr
处理的胆管细胞所填充的支架可用作人工胆源性上皮组织,例如用于治疗或筛选
。
145.本发明的另一方面提供了通过本文所述的方法产生的分离的经
fxr
处理的胆管细胞群体
。
群体可以为类器官
、
亚类器官组装体或簇或者单个细胞的形式
。
146.如本文所述产生的经
fxr
处理的胆管细胞群体可以实质上不含其他细胞类型
。
例如,群体在扩增培养基中培养后可包含
70
%或更多
、80
%或更多
、85
%或更多
、90
%或更多,或者
95
%或更多的经
fxr
处理的胆管细胞
。
可以通过如上所述的胆源性标志物的表达确定群体中经
fxr
处理的胆管细胞的存在或比例
。
147.优选地,经
fxr
处理的胆管细胞群体实质上不含不需纯化的其他细胞类型
。
如果需要,可通过任何方便的技术
(
包括
facs)
来纯化胆管细胞群体或胆管细胞类器官
。
148.在一些实施方案中,可以工程化经
fxr
处理的胆管细胞,以表达异源蛋白,例如标志物蛋白如
gfp
或者酶,和
/
或减少或防止一种或多种内源蛋白,例如与免疫原性相关的蛋白的表达
。
例如,可以用载体转染胆管细胞,所述载体包含编码异源蛋白的核酸;抑制内源蛋白表达的抑制剂
rna
;或者使内源蛋白灭活的位点特异性核酸酶
。
在一些实施方案中,胆管细胞可被工程化以纠正遗传缺陷
。
例如,可以纠正来源于患有囊性纤维化的个体的胆管细胞中的
cftr
基因的缺陷
。
在其他实施方案中,胆管细胞可被工程化,以去除免疫原性抗原,如人类白细胞抗原
(hla)。
这可以用于产生用于同种异体用途的低免疫原性或非免疫原性细胞
。
149.本发明的另一方面提供了通过本文所述的方法产生的包括胆管细胞的支架
。
合适的支架如下文所述
。
150.本发明的另一方面提供了包括通过本文所述的方法产生的经
fxr
处理的胆管细胞填充的支架的人工胆源性上皮组织,例如用于治疗
。
除了经
fxr
处理的胆管细胞,人工组织还可以掺入其他细胞,如基质和
/
或内皮细胞
。
151.本发明的方面还延伸到包含如本文所述在溶液中或在生物相容性支架中产生的胆管细胞的药物组合物
、
药剂
、
药物或其他组合物,以及制备药物组合物的方法,所述方法包括将此类胆管细胞与药学上可接受的赋形剂
、
媒介物
、
载体或可生物降解的支架以及任选地一种或多种其它成分混合
。
152.含有根据本发明扩增的经
fxr
处理的胆管细胞的药物组合物可以包含一种或多种另外的组分
。
例如,除了胆管细胞外,药物组合物还可包含药学上可接受的赋形剂
、
载体
、
缓冲剂
、
防腐剂
、
稳定剂
、
抗氧化剂或本领域技术人员熟知的其他材料
。
这些材料应该是无毒的且不应干扰胆管细胞的活性
。
载体或其他材料的确切性质将取决于施用途径
。
153.液体药物组合物通常包括液体载体,如水
、
石油
、
动物油或植物油
、
矿物油或合成油
。
可以包括生理盐水溶液
、
组织或细胞培养基
、
葡萄糖或其他糖溶液或二醇,如乙二醇
、
丙二醇或聚乙二醇
。
154.组合物可以为肠道外可接受的水溶液的形式,其是无热原的并且具有合适的
ph、
等渗性和稳定性
。
本领域相关技术人员能够使用例如等渗媒介物如氯化钠
、
林格注射液或乳酸林格注射液来制备合适的溶液
。
可以使用人工脑脊液来制备组合物
。
155.本发明的另一方面提供了治疗胆源性病症或肝脏疾病的方法,其包括向有需要的个体施用如本文所述产生的经
fxr
处理的胆管细胞群体
。
156.本发明的另一方面提供了如本文所述产生的经
fxr
处理的胆管细胞群体,其用于治疗有需要个体中的胆源性病症或肝脏疾病的方法的用途中,其包括向个体施用所述群体
。
157.本发明的另一方面提供了如本文所述产生的经
fxr
处理的胆管细胞群体在制备用于治疗胆源性病症或肝脏疾病的药物中的用途
。
158.经
fxr
处理的胆管细胞可以为类器官
、
亚类器官组装体或簇或者单个细胞的形式
。
159.胆源性病症是个体中的胆源性组织受损
、
有缺陷或在其他方面功能失调的病况,例如,以胆管损伤或破坏
、
异常胆管或胆管缺失为特征的病症
。
胆源性病症可以包括胆管组织损伤
、
缺血性狭窄
、
创伤性胆管损伤和胆管病,例如遗传性
、
发育性
、
自身免疫性和环境诱导的胆管病,如囊性纤维化相关的胆管病
、
药物诱导的胆管病
、alagille
综合征
、
多囊肝脏疾病
、
原发性胆汁性肝硬化
(pbc)、
原发性硬化性胆管炎
(psc)、aids
相关胆道病
、
胆管消失综合征
、
胆源性癌症
、
胆管缺失
(ductopenia)
如成人特发性胆管缺失
、
术后胆源性并发症
、
胆道闭锁
、
黄色肉芽肿性胆囊炎
(xgc)、
胆囊腺肌瘤病
、
胆囊感染例如沙门氏菌
、
胆囊癌,以及肝外胆管或肝内胆管的其他病症
。
160.在一些实施方案中,可在悬浮液中将经
fxr
处理的胆管细胞的扩增群体施用至个体
。
在悬浮液中施用经
fxr
处理的胆管细胞群体可用于例如治疗肝脏疾病和胆源性病症
。
161.肝脏疾病可以包括胆管病,例如胆管缺失,如缺血性胆管缺失
、
先天性胆管缺失如
alagille
综合征
、
代谢性胆管缺失和药物诱导的胆管缺失;复杂疾病,如肝内原发性硬化性胆管炎
(psc)
和原发性胆汁性胆管炎
(pbc)、
胆管消失综合征;移植后胆管病和影响肝内胆管树的病况
。
162.在其他实施方案中,可在生物相容性支架内将经
fxr
处理的胆管细胞群体施用至个体
。
合适的支架可以包括已经用经
fxr
处理的胆管细胞接种或重新填充的脱细胞的器官,如胆管
。
例如,可以向个体施用填充有胆管细胞的支架
。
在支架中施用胆管细胞群体可用于例如治疗胆道闭锁
、
胆道狭窄
、
创伤或医源性胆源性损伤和影响肝外胆管树的病况
。
163.可以通过本领域已知的任何技术
(
例如
lindvall,o.(1998)mov.disord.13,suppl.1:83-7
;
freed,c.r.
等人
,(1997)cell transplant,6,201-202
;
kordower
等人
,(1995)new england journal of medicine,332,1118-1124
;
freed,c.r.,(1992)new england journal of medicine,327,1549-1555,le blanc
等人
,lancet 2004may 1
;
363(9419):1439-41)
,将溶液或支架中的胆管细胞移植到患者中
。
特别地,可以将细胞悬液注射或输注到患者的胆管
、
胆囊
、
门静脉
、
肝实质
、
腹膜腔或脾脏中
。
可经静脉内
、
脾内
、
腹膜内或经由内镜逆行胰胆管造影术
(ercp)
或经皮胆管造影术
(ptc)
施用胆管细胞悬液
。
可以通过外科植入将胆管细胞填充的支架施用至个体
。
164.根据本发明的组合物的施用优选为“预防上有效的量”或“治疗上有效的量”(
视情况而定,尽管预防可被视为治疗
)
,这足以显示对个体的益处
。
实际施用量
、
施用率和施用时间进程将取决于所治疗情况的性质和严重程度
。
治疗处方,例如剂量决定等,由一般从业人员和其他医疗医生负责
。
165.包含经
fxr
处理的胆管细胞的组合物可以单独施用,或者可以与其他治疗同时或依序联合施用,具体取决于待治疗的病况
。
166.本发明的方法可用于治疗接受胆管细胞移植的患者,例如用于治疗肝脏疾病或胆源性病症
。
例如,治疗胆源性病症的方法可包括;
167.向有需要的个体施用分离的胆管细胞群体或胆管细胞类器官;以及
168.向个体施用
fxr
激动剂
。
169.施用
fxr
激动剂可以改善胆管细胞或胆管细胞类器官的功能或再生能力
。
170.在一些实施方案中,胆管细胞或胆管细胞类器官可以是经
fxr
处理的胆管细胞或胆管细胞类器官
。
例如,如上所述产生经
fxr
处理的胆管细胞或胆管细胞类器官
。
在其他实施方案中,胆管细胞或胆管细胞类器官可以在没有
fxr
处理的情况下产生,并且可以在施用至个体后暴露
fxr
激动剂
。
171.本发明的方法可用于离体肝组织处理
。
准备用于移植的肝组织的方法可以包括;
172.将分离的肝组织离体暴露于
fxr
激动剂
。
173.将肝组织暴露于
fxr
激动剂可以改善其中胆管细胞的功能特性和再生能力
。
174.这可用于例如治疗肝脏疾病或胆源性病症
。
治疗胆源性病症的方法可以包括:
175.将分离的获自个体的肝组织离体暴露于
fxr
激动剂;以及
176.在所述暴露后将肝组织移植到个体
。
177.方法还可以包括在将肝组织移植到个体后将
fxr
激动剂施用至个体
。
这可以用于例如在植入后维持细胞改善的功能或再生能力
。
178.本发明的其他方面涉及使用如本文所述扩增的经
fxr
处理的胆管细胞来确定患者对药物的敏感性
。
方法可以包括:
179.(i)
由患有疾病状况如胆源性病症或肝脏疾病的个体提供分离的原代胆管细胞群体;以及
180.(ii)
在包含
fxr
激动剂
、
表皮生长因子
(egf)、
经典
wnt
信号传导抑制剂和非经典
wnt/pcp
信号传导增强剂的扩增培养基中培养所述群体,以产生表现出疾病表型的经
fxr
处理的胆管细胞的扩增群体,
181.(iii)
使通过本文所述的方法产生的经
fxr
处理的胆管细胞的扩增群体与治疗化合物接触;以及
182.(iv)
确定治疗化合物对所述经
fxr
处理的胆管细胞的影响,
183.其中经
fxr
处理的胆管细胞的疾病表型的改善指示个体对治疗化合物敏感
。
184.可以确定相对于不存在治疗化合物情况下,在存在治疗化合物情况下经
fxr
处理的胆管细胞的增殖
、
生长
、
活力或胆汁酸抗性,它们执行如下所述的一种或多种细胞或类器官功能的能力,或者它们执行以下一种或多种功能的能力:(i)移植后植入到非人类动物模型,
(ii)
在非人类动物模型中体内形成胆管,
(iii)
在非人类动物模型中体内挽救疾病表型,
(iv)
在移植后延长非人类动物模型的存活,
(v)
在非人类动物模型中体内维持细胞功能,
(vi)
体内逆转胆管缺失,
(vii)
在非人类动物模型中移植后改善血清肝功能标志物,和
/
或
(viii)
植入
、
修复导管和改善离体维持的人类器官的功能
。
185.相对于不存在于治疗化合物情况下,在存在治疗化合物情况下扩增的经
fxr
处理的具有疾病表型的胆管细胞执行这些功能中的一种或多种的能力的增加指示该化合物对个体中的疾病具有改善作用
。
186.如上文所述产生的分离的经
fxr
处理的胆管细胞群体可用于例如在毒性筛选中对测试化合物与胆管细胞的相互作用建模,对胆源性病症建模,或者筛选具有潜在治疗作用的化合物
。
187.在一些实施方案中,胆管细胞可获自健康原代组织
。
在其他实施方案中,胆管细胞可获自来自患有胆源性疾病的供体的原代组织,并且可以表现出疾病表型
。
188.本发明的另一方面提供了来源于正常患者或患有胆源性病症患者的经
fxr
处理的胆管细胞群体用于胆源性病症的疾病建模和发病机制研究的用途
。
189.用于建模和筛选的经
fxr
处理的胆管细胞可以为类器官
(
胆管细胞类器官
)、
亚类器官簇或例如通过破坏胆管细胞类器官产生的单个细胞
(
胆管细胞
)
的形式
。
190.筛选化合物的方法可以包括:
191.使通过本文所述的方法产生的经
fxr
处理的胆管细胞群体与测试化合物接触;以及
192.确定测试化合物对所述胆管细胞的影响和
/
或所述胆管细胞对测试化合物的影响
。
193.可以确定相对于不存在测试化合物的情况下,在存在测试化合物的情况下胆管细胞的增殖
、
生长
、
活力或胆汁酸抗性,或者它们执行一种或多种细胞或类器官功能的能力
。
194.增殖
、
生长
、
活力或执行一种或多种细胞或类器官功能的能力的降低指示化合物具有毒性作用,以及生长
、
活力或执行一种或多种细胞或类器官功能的能力的增加指示化合物对胆管细胞具有改善作用
。
195.在一些实施方案中,经
fxr
处理的胆管细胞可以来源于胆源性肿瘤,并且可以确定测试化合物对肿瘤来源细胞的增殖
、
生长
、
活力或执行一种或多种细胞或类器官功能的能力的影响
。
196.可以确定相对于不存在测试化合物的情况下,存在测试化合物的情况下的基因表达
。
例如,可以确定一种或多种胆源性标志物基因的表达
。
表达的组合降低指示化合物具有毒性作用或可以改变胆管细胞的功能状态
。
可以在核酸水平上,例如通过
rt-pcr
,或者在蛋白质水平上,例如通过免疫学技术如
elisa
,或者通过活性测定来测定基因表达
。
细胞色素
p450
测定,例如发光
、
荧光或显色测定是本领域熟知的,并且可从商业供应商处获得
。
197.在一些实施方案中,可以确定胆源性疾病的风险基因座或与胆源性疾病,例如上述疾病相关的基因的表达
。
198.可以测定经
fxr
处理的胆管细胞对测试化合物的代谢
、
降解或分解
。
在一些实施方案中,可以连续地或在一个或多个时间点确定或测量测试化合物和
/
或所述测试化合物的代谢物的量或浓度随时间的变化
。
例如,可以确定或测量测试化合物的量或浓度的降低和
/
或所述测试化合物的代谢物的量或浓度的增加
。
在一些实施方案中,可以确定测试化合物和
/
或代谢物的量或浓度的变化率
。
用于测量测试化合物或代谢物的量的合适技术包括质谱法
。
199.这可用于确定测试化合物的体内半衰期
、
毒性
、
功效或其他体内特性
。
200.可以确定和
/
或测量相对于不存在测试化合物的情况下,在存在测试化合物的情况下经
fxr
处理的胆管细胞的一种或多种功能
。
例如,可以确定和
/
或测量胆管细胞执行一种或多种
mdr1
功能的能力:胆汁酸转移;
vegf、
乙酰胆碱或
atp
应答;
cftr
介导的氯化物运输;
ggt
活性
、alp
活性或分泌素或生长抑素应答
、
毛喉素诱导的肿胀
(dekkers
等人
,nat med 2013
;
19:939
–
45)
胆汁抵抗
、
碳酸氢盐分泌
、
管腔完整性
(
即化合物是否破坏紧密连接并使类器官的管腔塌陷
)、
化合物进出类器官管腔的转移以及管腔中细菌的存在或活力
。
还可以确定胆管细胞组装成胆管细胞类器官的能力
。
201.相对于不存在测试化合物情况下,在存在测试化合物情况下经
fxr
处理的胆管细胞执行这些功能中的一种或多种的能力的降低指示化合物对胆管上皮具有毒性作用
。
相对于不存在测试化合物的情况下,在存在测试化合物的情况下胆管细胞执行这些功能中的一种或多种的能力的增加指示化合物具有促胆管效应
(
例如,它促进胆管上皮的活性
)。
202.本发明的另一方面提供了用于产生经
fxr
处理的胆管细胞类器官的试剂盒,其包含扩增培养基,所述扩增培养基包含
fxr
激动剂
。
203.试剂盒还可以包含表皮生长因子
(egf)、
非经典
wnt/pcp
信号传导增强剂和经典
wnt
信号传导抑制剂
。
204.上文更详细地描述了合适的扩增培养基
。
205.试剂盒还可以包含支架基质,如
matrigel
tm
。
支架基质可以作为扩增培养基的一部分提供,或者可以单独提供
。
206.可以在去离子蒸馏水中配制扩增培养基
。
通常在使用前对扩增培养基进行灭菌以防止污染,例如,通过紫外光
、
加热
、
辐射或过滤
。
可以对一种或多种培养基进行冷冻
(
例如,在-20℃
或-80℃
下
)
以进行储存或运输
。
一种或多种培养基可以含有一种或几种抗生素以防止污染
。
207.试剂盒还可以包含取样器,如刷子或刮除器,以用于从原代胆汁组织中分离原代胆管细胞
。
试剂盒还可以包含用于从组织样品中机械分离胆管细胞的板或容器,以及用于从组织碎屑中分离细胞的离心管
。
208.试剂盒还可以包含保存介质以在提取细胞之前保存组织
。
合适的介质包括
uw
溶液
(
例如
vivaspin
tm
)
和补充有促存活细胞因子和
/
或
rock
抑制剂的
william’s e
培养基
。
209.试剂盒还可以包含洗涤介质
。
合适的洗涤介质可以包括补充有
egf
和
rock
抑制剂的
william’s e
培养基
。
210.试剂盒还可以包含促存活细胞因子,如
rock-抑制剂
。
211.试剂盒还可以包含板加热器
。
212.试剂盒还可以包含冷冻保存溶液
。
合适的冷冻保存介质如上文所述
。
213.一种或多种培养基可以是
1x
制剂或更浓缩的制剂,例如
2x-250x
浓缩培养基制剂
。
在
1x
制剂中,培养基中的每种成分都是预期用于细胞培养的浓度,例如上文陈述的浓度
。
在浓缩制剂中,一种或多种成分以比预期用于细胞培养的浓度更高的浓度存在
。
浓缩培养基是本领域熟知的
。
可以使用已知的方法浓缩培养基,例如盐沉淀或选择性过滤
。
可以利用水
(
优选去离子和蒸馏的
)
或任何合适的溶液,例如盐水溶液
、
水性缓冲液或培养基稀释浓缩培养基以供使用
。
214.试剂盒中的一种或多种培养基可被包含在密封容器中
。
对于培养基的运输或储存,可以优选密封容器,以防止污染
。
容器可以是任何合适的容器,如烧瓶
、
板
、
瓶
、
罐
、
小瓶或袋
。
215.本发明的另一方面提供了扩增培养基用于体外扩增经
fxr
处理的胆管细胞的用途,其中所述扩增培养基包含
fxr
激动剂
。
216.扩增培养基还可以包含表皮生长因子
(egf)、
非经典
wnt
信号传导增强剂和经典
wnt
信号传导抑制剂
。
217.扩增培养基的合适的另外组分是本领域已知的
(
参见例如,
f.sampaziotis,
等人
,nat.protoc.12,814
–
827(2017))。
218.本发明的其他方面和实施方案提供了用术语“由
…
组成
(consisting of)”代替术语“包括
(comprising)”的上述方面和实施方案,以及用术语”基本上由
…
组成
(consisting essentially of)”代替术语“包括
(comprising)”的上述方面或实施方案
。
219.应当理解,除非上下文另有要求,否则本技术公开了任何上述方面和上述实施方案与彼此的所有组合
。
类似地,除非上下文另有要求,否则本技术单独地或与任何其他方面一起公开了优选和
/
或任选特征的所有组合
。
220.在阅读本公开内容时,以上实施方案的修改
、
其他实施方案及其修改对于技术人员将是显而易见的,因此,这些都在本发明的范围内
。
221.本说明书中提及的所有文件和序列数据库条目均出于所有目的通过引用整体并入本文中
。
[0222]“和
/
或”当在本文中使用时应视为在具有或没有另一个的情况下,两个具体特征或组分中的每一个的具体公开内容
。
例如,“a
和
/
或
b”应被视为
(i)a
,
(ii)b
,以及
(iii)a
和b中的每一个的具体公开内容,就像每一个在本文中单独陈述一样
。
[0223]
现在将通过实施例的方式并参考上述附图来说明本发明的某些方面和实施方案
。
[0224]
实验
[0225]
1.
方法
[0226]
组织收集
[0227]
在停止循环后,在无菌条件下尽可能快地从已故移植器官供体获得胆囊
、
胆管
、
肝活检和胆汁
。
将组织样品和取出用于移植但随后衰退的肝转移到威斯康星大学器官保存溶液的
4℃
实验室中
。
[0228]
组织解离
[0229]
按如上所述,将切除的组织
(
胆囊
、
肝外导管和肝
)
转移到实验室,并在切除后立即进行处理
。
将胆囊和肝外胆管样品排出胆汁,并通过纵向切口暴露器官管腔
。
在处理前将肝脏样品分成
1cm2的立方体
。
将所有样品用具有
ca2+mg2++edta(0.5mm)
的温热
pbs
洗涤两次,然后在
37℃
和
200rpm
的孵育振动器中,使用释放酶
(0.2w
ü
nsch/ml)
进行酶消化
30
分钟
。
将
dna
酶
i(2000u/ml)
加入到溶液中,以防止细胞聚集并增加活力
。
使用
miltenyi biotec gentlemacs
组织解离器和
gentlemacs tissue dissociation c tubes
进一步解离肝脏样品
。
对于胆囊和肝外导管样品,轻轻机械刮擦管腔足以在酶消化后释放上皮细胞
。
将所有细胞悬液通过
70um
过滤器过滤以去除碎屑和残留组织,用含有1% bsa(w/v)
的
pbs
洗涤,并在保持
4℃
温度的冷冻离心机中以
400g
离心5分钟
。
将细胞重悬于
miltenyi biotec
红细胞
(rbc)
裂解液中,并在室温
(rt)
下孵育
10
分钟
。
根据制造商的说明,使用
miltenyi biotec
碎屑去除溶液试剂盒来去除残留的碎屑和死细胞
。
对于肝脏样品,将得到的细胞悬液以
50g
离心5分钟
(4℃)
,以沉淀肝细胞部分,收集上清液并如下所述分离胆管细胞
。
[0230]
细胞分离
[0231]
在组织解离为单细胞后,根据制造商的说明,使用
miltenyi biotech automacs pro
分离器和
cd326(epcam)
微珠,利用磁相关细胞分选
(macs)
分离胆管细胞
。
对所得细胞进行计数,以
444g
离心5分钟,重悬至
1000
个细胞
/
μ
l
的浓度并储存在冰上
。
[0232]
10x
单细胞文库制备过程
[0233]
将
gem-rts(
乳液包裹的凝胶珠,其对聚腺苷酸化的
mrna
进行条形码标记,然后进行逆转录
)
破碎,并使用硅烷磁珠从
gem-rt
混合物中纯化第一链
cdna
,然后经由
pcr
扩增
cdna。
在酶片段化
、
末端修复和a加尾后进行尺寸选择
(
使用
spriselect
试剂
)。
将适配子连接到片段上,并在清洗步骤之后进行索引
pcr。
在用
sriselect
进行另一轮尺寸选择后,对完成的文库进行定量
(agilent bioanalyser
和
qpcr)
,并稀释以在
illumina
测序仪
(hs4000)
上运行
。
[0234]
10x
数据的处理和标准化
[0235]
手动检查来自测序运行的结果,以确认总产量和质量符合预期
。
将来自仪器的数据转换为
fastq
格式,即
10x
软件
cellranger
所需的输入格式,并使用可从
10x
获得的人类参考
grch36-1.2.0
进行比对
。
通过整合来自已发表数据集的胆管细胞簇
(macparland sa
等人
,10 2018
中的簇
17)(17)
的计数来增强数据集
。
细胞被注释为不同来源的一部分,这些是原代组织
(pri)、
未处理的类器官
(org)
和处理的类器官
(orgt)。
每个起源包括三个区域:肝内胆管
(ihd)、
胆总管
(cbd)、
胆囊
(gb)。
保留来自至少一种来源中的每批的至少3个细胞中的读取计数
》0
的基因,以用于下游分析
。
基于
umi
映射到线粒体基因组的百分比和通过利用软件包
scater(18)
中的常规
isoutlier
确定异常值
(3
个中值绝对偏差
)
检测到的基因数目,来去除低质量细胞
。
通过保留表达至少一种胆源性标志物
epcam、krt7、krt19(
计数
》3)
的细胞,来分离胆管细胞
。
[0236]
利用
seurat
包
(19)
进行标准化
、
高度可变基因的鉴定和细胞周期回归
(
回归出
g2m
和s期评分之间的差异
)。
我们在
scran
中采用了常规
fastmnn
进行批次校正
(20)。
批次校正的样品显示在图
2a
中
。
通过应用
louvain
方法进行群落检测而得到的,并且特征在于在
umi
映射到线粒体基因组的百分比中为异常值的细胞和检测到的基因数目的小簇被过滤掉
。
[0237]
标准化
10x
数据的分析
[0238]
通过选择产生3个聚类和
10
个随机初始化的分辨率,使用
scanpy
包
(21)
中的
louvain
方法对标准化数据进行聚类
。
使用调整兰德系数
(adjusted rand index,ari)
和调整互信息
(ami)
,评估
louvain
聚类和来源注释之间的相似性
。
两种度量都位于区间
[0,1]
中,其中接近0的值表示随机标记,并且恰好为1意味着两个分区相同
。
对于两种测量,在通过随机初始化获得的不同分区上计算的平均值都
》0.95
,表明来源和聚类之间的高度对应性
。
对区域进行的相同分析显示区域和聚类之间的较差匹配,表明位于不同区域中的细胞的转录谱相似
。
通过估计基于分区的图抽象
(paga)
框架内的数据流形分区的连接性,在来源和区域分辨率上量化转录相似性
。
在来源分辨率上,该分析显著强调了处理过的类器官和原代组织之间的转录相似性高于未处理的类器官和原代组织之间的转录相似性
。
有趣的是,在区域分辨率上,我们确认了原代组织中相邻位置之间的较高转录相似性,其中肝内导管和胆囊具有最低的连接值
。
连接性和解剖位置之间的这种关联,以及位于不同区域中的细胞的相似性,表明原代组织中细胞的转录谱存在逐渐变化,其可以作为伪空间维度来表示
。
根据这种观点,我们通过应用以下两种伪时间
(
或伪空间
)
排序方法来分析原代组织:扩散伪时间
(22)
和
monocle 2(23)。
在
monocle 2
中,使用差异
genetest
例程计算伪时间中的差异表达
。
两种方法都证实了转录相似性和解剖位置之间的关联,并允许沿着伪空间维度表示区域标志物
。
由于大多数细胞具有
》0.65
的扩散伪时间值,因此密度图显示在
[0.65,0.9]
范围内,以提高可视化并避免过度拥挤
。
然后,我们单独分析了类器官
(
处理和未处理的
)
和原代组织中的每个区域,以确定潜在的细胞亚群
。
由于样本量相对较小,我们应用了聚类方法
sc3
,其高精度和鲁棒性是通过一致性方法
(consensus approach)(24)
,结合多种聚类解决方案得出的
。sc3
允许用户预先定义聚类的数目
。
由于这种选择的随意性,我们在
1-10
之间改变聚类的数目,计算了聚类在不同分辨率下的稳定性
(sc3
稳定性指数
)
,并构建了聚类树,其显示随着聚类分辨率的增加,细胞是如何移动的
(
软件包
clustree)(25)。
在每个区域内都没有形成稳定的子树,这表明缺乏定义细胞亚群的稳定聚类
。
在
scanpy
中,通过应用
wilcoxon
秩和检验
(p
值
《0.01
,
|log2
倍变化
|》1)
来鉴定区域标志物和差异表达的基因
。
使用软件包
gsea(26)
和
enrichr(27)
进行基因集
、
基因本体论和通路富集
。
[0239]
数据可用性
[0240]
10x
原始数据
(fastq
文件
)
已经存放在存储库
arrayexpress
中,登录号为
e-mtab-8495 22。
[0241]
类器官衍生和培养
[0242]
使用我们确立的方法
(11,12)
,将一部分分离的用于
scrnaseq
的细胞作为类器官进行培养和增殖
。
在相同的条件下培养细胞,而不考虑它们的来源区域
。
[0243]
免疫荧光
、rna
提取和定量实时
pcr
[0244]
按先前所述进行
if、rna
提取和
qpcr(11,12,28,29)。
[0245]
除非另有说明,否则所有
qpcr
数据均表示为四个独立谱系
(line)
的中值
、
四分位距
(iqr)
和范围
(
最小值到最大值
)。
数值是相对于管家基因羟甲基胆素合酶
(hmbs)。
使用
zeiss axiovert 200m
倒置显微镜或
zeiss lsm 700
共聚焦显微镜获取所有
if
图像
。
使用
imagej 1.48k
软件
(wayne rasband,nihr,usa,http://imagej.nih.gov/ij)
进行图像处理
。if
图像代表3个不同的实验
。
[0246]
ggt
活性
[0247]
基于制造商的说明,使用
maxdiscovery
tm
γ-谷氨酰转移酶
(ggt)
酶测定试剂盒
(bioo scientific)
,以一式三份测量
ggt
活性
。
误差条表示
sd。
[0248]
碱性磷酸酶染色
[0249]
根据制造商的说明,使用
bcip/nbt
显色底物
(5-溴-4-氯-3-吲哚基-磷酸酯
/
硝基蓝四唑鎓
)(promega)
进行碱性磷酸酶
。
[0250]
流式细胞术分析
[0251]
按先前所述进行流式细胞术分析
(11,12,28,29)。
[0252]
胆汁酸处理
[0253]
在
10
μ
m z-gs(santa cruz,sc-204414)
存在或不存在情况下,用
10
μ
mcda(sigma,c9377-5g)
将类器官孵育
72
小时
。
[0254]
动物实验
[0255]
所有动物实验均根据英国内政部法规
(
英国内政部项目许可证编号
ppl 70/8702)
进行
。
在室内饲养缺乏
b、t
和
nk
淋巴细胞的免疫缺陷
nsg
小鼠
(nod.cg-prkdcscid il2rgtm1wjl/szj)
,并在程序之前和之后随意获取食物和水
。
使用4–8周龄的雄性动物
。
将动物随机分为处理组和对照组
。
实验是盲化进行的,并且在不可能做到这一点的情况下
(
例如,由于外科程序的进行
)
,对实验组的特征进行盲化来进行数据分析
。
将同窝出生的动物用作对照
。
[0256]
细胞递送
[0257]
将胆管细胞通过肝外胆管树逆行递送至肝脏中
(14)。
简言之,在胆囊中放置并固定了一根细孔套管
。
为了将注入物转移到肝脏,用夹子阻塞远端胆总管
。
通过胆囊中的套管以1μ
l/g
总体重的总体积,以1μ
l/
秒的最大速度输注细胞
。
[0258]
mda
施用
[0259]
在细胞递送前7天
、5
天和3天,通过腹膜内
(ip)
施用
4,4
′‑
亚甲基二苯胺
(mda)
,以
50
μ
g/g
总体重的浓度3次诱导胆管病
。
如上所述,在细胞递送之前,将另外剂量的
mda
直接施用到肝外胆管树内
。
[0260]
血液样品采集
[0261]
在选择性地宰杀动物时,在末端麻醉下,使用
23g
针头直接从下腔静脉采血并将血液转移到
1.5ml eppendorf
管中进行进一步处理
。
[0262]
血液样品处理
[0263]
血液样品由剑桥大学核心生化测定实验室
(cbal)
进行常规处理
。
所有样品分析均在
siemens dimension exl
分析仪上,使用
siemens
提供的试剂和测定方案进行
。
[0264]
组织收集
[0265]
除非另有说明,否则在所有动物实验结束时,当宰杀动物时,收集组织以用于切片和染色
。
由于动物福利原因
(
体重减轻
、
黄疸和临床恶化
)
或在移植后3个月选择性地宰杀动物
。
时间点显示在相关的
kaplan-meier
曲线上
(
图
3b)。
[0266]
冰冻切片
[0267]
将切除的组织固定在4% pfa
中,在蔗糖溶液中浸泡过夜,在最佳切割温度
(oct)
化合物中封固,并在-80℃
下储存,直到切片
。
使用冷冻切片机
(cryostat microtome)
将切片切割至
6-10
μm的厚度,并封固在显微镜载玻片上,以用于进一步分析
。
[0268]
苏木精和伊红
(h&e)
染色
[0269]
h&e
染色由
addenbrooke
医院的组织学服务部门进行,或者根据制造商的说明使用
sigma-aldrich
试剂进行
。
简言之,将组织切片水合,用
meyer
苏木精溶液
(sigma-aldrich)
处理5分钟,用温热自来水洗涤
15
分钟,置于蒸馏水中
30-60
秒,并用曙红溶液
(sigma-aldrich)
处理
30-60
秒
。
随后对切片进行脱水,并使用快速硬化封固介质
(sigma-aldrich)
进行封固
。
[0270]
组织学
[0271]
组织学切片由一位对肝胆组织学
(sd)
特别感兴趣的独立组织病理学家进行审查
。
[0272]
小鼠肝脏中移植细胞的定量
[0273]
对每只动物的3个随机切片进行分析,评估不同的叶
(lobe)。
总共分析了
49,846
个细胞,每只动物约
10,000
个细胞
。
[0274]
mr
成像
[0275]
处死动物后进行磁共振胰胆管造影术
。
使用
bruker biospec 94/20
系统
(bruker,ettlingen,germany)
在
9.4t
下进行
mrcp。
为了更高的信噪比以给出改善的胆管可视化,使用了参数略有变化的二维序列
(
以
11ms
间隔隔开回波,以给出
110ms
的有效回波时间;重复时间为
5741ms
;矩阵大小为
256
×
256
;视野为
4.33
×
5.35cm2,产生
170
×
200
μ
m2的平面分辨率
)。
通过肝脏和胆囊以
0.6mm
厚度冠向获取切片
。
对于这种获取,使用了容积线圈来减少射频不均匀性的影响
。
[0276]
为了检查胆管树,通过最大强度投影准备图像
。
使用
t1
加权
3dflash(
快速小角度激发
)
序列进行结构成像以排除肿瘤生长,翻转角为
25
°
,重复时间为
14ms
,且回波时间为
7ms。
矩阵为
512
×
256
×
256
,视野为
5.12
×
2.56
×
2.56cm3,最终各向同性分辨率为
100
μ
m。
[0277]
使用
osirix
软件从源数据生成胆管树的体积渲染图像
。
目的区域是手动从剩余数据中分割出来的
。mrcp
图像由两名对肝胆放射学
(emg,su)
特别感兴趣的独立放射科医生进行审查
。
[0278]
供体肝脏的离体常温灌注
[0279]
将
metra(organox,oxford,uk)
常温肝脏灌注装置用于人类肝脏的离体灌注,如先前所述的
(15,30)。
在临床上用于保存用于移植肝脏的机器
(15)
,通过向其灌注
abo
血型兼容的常温含氧血液,实现了延长的自动器官保存
。
灌注装置集成了在线血气测量,以及软件控制的算法,以将
ph、po2
和
pco2(
在生理限度内
)、
温度和平均动脉压保持在生理正常限度内
。
简言之,将肝动脉
、
门静脉
、
下腔静脉和胆管进行插管,连接到装置,并开始灌注
。
[0280]
胆管插管
[0281]
通过在荧光镜引导下将两个
fr
鞘插入胆总管中,然后使用两个
2.7fr
微导管经由鞘,分别插管左肝导管和右肝导管,然后插管第3段和第5段导管,来实现胆管插管
。
通过用少量离子造影剂进行的胆管造影片证实了微导管的外周放置
。
将细胞注射到第3段中,并将载体注射到第5段中
。
[0282]
细胞递送
[0283]
将表达
rfp
的类器官机械解离成小团块和单细胞的混合物,并利用~
2cm3的分布面积在第3段的外周导管中施用约
10x106个表达
rfp
的细胞,在荧光镜引导下对其进行插管,以将细胞递送最大化
(
参见胆管插管部分
))。
使用相同的技术在第5段的外周分支中递送载体介质,并将器官在
nmp
上维持长达
100
小时
。
[0284]
人类肝脏中移植细胞的定量
[0285]
分析了3个注射有
rfp
标记的胆囊类器官的人类肝脏
。
从细胞分布面积
(
~
2cm3)
中获得切片
。
每个肝脏分析5个切片,且总共分析
4,463
个细胞
。
[0286]
胆汁抽吸
[0287]
按照相关章节中所述进行胆管插管
。
插管后,使用导丝交换技术将2根微流体导管
(cma microdialysis catheter,harvard bioscience inc,usa)
置于各自的节段导管中
。
导管的内轴和外轴以及入口和出口管道由聚氨酯制成,并且膜由聚芳基醚砜组成,膜孔径为
100kda
,且外径为
0.4mm。
将每根导管的入口管道连接到便携式电池驱动的
cma 107
微透析泵
(harvard bioscience inc,usa)
,并且将泵设置为以1μ
l/min
的速率抽吸
。
[0288]
胆汁体积和
ph
测量
[0289]
对n=3个不同的肝脏进行了测量
。
如先前所述,对每个肝脏进行至少2次重复测量,在可能的情况下增加到3次
(27)。
将胆汁体积相对于产生其的胆管体积进行标准化,胆管体积对应于对照臂中细胞或载体的分布体积
。
这是使用在胆管造影片上描绘这些导管所需的造影剂体积来计算的
。
请注意,所有导管在体积测量之前都已准备好
。
[0290]
超声成像
[0291]
使用
hitachi aloka arrieta v70
和
10mhz
手持式探头在常温灌注装置中对肝脏进行离体成像
。
在轴向和矢状面上获得图像,并对门静脉
、
肝静脉及其主要分支进行评估
。
还对肝内胆管进行了评估,特别注意已灌输类器官的第3段和接受载体的第5段中的对照区域
。
[0292]
统计分析
[0293]
所有统计分析均使用
graphpad prism 6
进行
。
对于不适合描述性统计的小样本量,绘制了单个数据点
。
为了比较平均值,使用双侧
student t
检验来计算统计显著性
。
在适当的情况下,使用
d'agostino&pearson omnibus
正态性检验确认了我们的值的正态分布
。
使用
brown-forsythe
检验来检验样本之间的方差
。
为了将多个组与参考组进行比较,在方差相等的组之间使用了单因素
anova
和随后的
dunnett
检验,而对方差不相等的组应用
kruskal-wallis
检验和随后的
dunn
检验
。
使用对数秩
(mantel-cox)
检验比较生存率
。
如果给出重复数
(n)
,则这指类器官谱系或不同动物的数目,除非另有说明
。
[0294]
对于动物实验,基于先前的研究方差来估计组大小
。
选择最终的动物组大小,以允许在不同的时间点选择性宰杀,同时保持
n》4
只动物活过
30
天,以确保再现性
。
没有使用统计学方法来计算样本量
。
没有使用正式的随机化方法来将动物分配到研究组
。
然而,由一名未参与研究的技术人员将来自一个笼子的同窝出生动物随机分配到实验组或对照组
。
没有动物被排除在分析之外
。
将盲法用于放射学成像
。
[0295]
2.
结果
[0296]
我们生成了人类胆管树的单细胞图,以用作表征胆管细胞类器官的框架
。
为此目
的,使用我们确立的条件
(3,16)
,将从每个区域
(ihd、cdb、gb)
分离的用于
scrnaseq
的一部分原代胆管细胞作为类器官增殖
。
所得到的类器官表达胆管细胞标志物
(krt7、krt19、sox9、hnf1b、cftr)
,表现出相当的功能性
(alp、ggt
活性
)
和相似的扩增潜力,而与它们的来源区域无关
。
为了进一步探索这些相似性,我们对这些类器官
(
每个区域2个谱系;
gb
:
5859
个细胞;
cbd 5321
个细胞;
ihd 6641
个细胞
)
进行了
scrnaseq。umap
和
pca
分析表明,类器官表现出重叠的转录组特征
(
图
1a)
,表明体外生长的胆管细胞呈现出类似的转录特征,而与其来源区域无关
。
值得注意的是,细胞周期相关基因的回归并没有改变这些观察结果,排除了一个共同的“增殖”特征可以掩盖不同空间来源的类器官之间的差异
。
此外,我们没有检测到任何共表达已知体干细胞标志物
(lgr5、prom1、tacstd2、ncam)
的细胞,排除了类器官相似性反映共同祖细胞
/
干细胞特征的可能性
。
[0297]
然后,我们将来自不同区域的类器官与原代胆管细胞进行了比较,以探索这些相似性是否对应于它们体外原始区域特征的丧失
(
图
1a)。
细胞周期回归后的类器官和原代细胞共有一种核心转录谱,反映了它们共同的胆管细胞性质,这通过当与不同的肝细胞类型如星状细胞和
lsecs
相比时,它们在
umap
空间中的接近性和高
paga
连接性来说明
。
然而,
deg
分析强调了区域特异性标志物如
slc13a1
和
slc26a3
的下调
(
图
2b)
;而基因本体论
(go)
和基因集富集分析
(gsea)
将这些
deg
鉴定为促进胆管细胞适应其各自微环境的因素,例如胆汁酸相对于培养基处理基因
。
此外,根据先前的报道
(14)
,我们证实了类器官中
yap
靶基因的上调
。
因此,作为类器官增殖的原代胆管细胞通过维持其核心转录特征来适应其新的微环境,同时失去其来源区域特异性标志物的表达
。
[0298]
为了探索控制胆管细胞特征的机制,我们决定在我们的培养条件中添加胆汁作为胆管细胞微环境的主要决定因素
。
[0299]
用人类胆囊胆汁将不同的类器官
(ihd、cbd、gb)
处理
72
小时,然后使用
scrnaseq
进行表征
(
图
1a)(gb
:
3815
个细胞;
cbd 3224
个细胞;
ihd 3653
个细胞
)。umap
和
pca
揭示出,经处理的类器官呈现出新的重叠基因表达特征
(
图
2a
证实了适应胆汁暴露的共同能力
。
重要的是,
paga
和
deg
分析表明,这种转录谱向胆囊特征转移
(
图
1b)。
为了表征控制这种转变的因素,我们查询了胆汁处理的类器官中差异表达的基因
。go、gsea
和
umap
分析证实了区域特异性标志物
(sox17、muc13、fgf19
;图
2b)
的诱导,并揭示了胆汁酸受体通路和下游靶标
(nr1h4/fxr、nr1i2、nr0b2、slc51a、fgf19、abca1、pparg
;图
1b)
的上调
。
值得注意的是,这些结果是通过分别使用鹅去氧胆酸和
z-22
固甾酮激活和抑制法尼醇
x
受体
(fxr)
来验证的
(
图
1c-1d)
,从而证实了无论其来源如何,体外生长的胆管细胞都可以对环境刺激做出响应并适应环境刺激
。
总之,这些结果表明,当受到适当的小生境因素的指示时,胆管细胞类器官可以呈现不同的区域特征
。
[0300]
为了验证胆管细胞的可塑性并探索其功能意义,我们决定评估移植后来自胆管树一个区域的类器官是否可以修复不同的区域
。
为此,我们使用
4,4
’‑
亚甲基二苯胺
(mda)
在免疫缺陷小鼠中诱导胆管病
(17)(
图
2a-2b)
,并试图利用在没有
fxr
激动剂的情况下产生的表达红色荧光蛋白表达
(rfp)
的人类胆囊类器官的导管内递送
(18)
来挽救表型
。
接受无细胞的载体介质的对照动物在3周内体重减轻并死亡
(
图
2b)
,发展出了通过
if、
组织学和磁共振胰胆管造影术
(mrcp)
证明的胆汁淤积和胆管病
(
图
2c)。
相反,接受类器官的动物在实验结束时被选择性地宰杀,并存活长达3个月,胆管病消退和血清生物化学正常
(
图
2b-2c)。
移
植的胆囊胆管细胞植入不同大小的肝内导管中
(
图
2d)
,相当于~
25
%-55
%的再生胆管上皮
。
[0301]
核心胆源性标志物
(krt7、krt19、cftr)
也得到表达,同时根据先前的报道
(13)
,我们在植入细胞和天然细胞中都观察到
yap
激活
。
值得注意的是,我们从未观察到其他肝谱系标志物如白蛋白的表达,表明胆管细胞类器官的可塑性可能仅限于其胆源性谱系
。
此外,植入的细胞以与天然小鼠胆管细胞相似的水平表达增殖标志物;而在所有进行的分析中从未注意到异常生长或肿瘤形成
(
图
2c、2d)
,包括实验结束时的
t1
加权的身体
mr
成像
。
因此,类器官移植提供了修复受损上皮和挽救急性损伤所需的健康细胞
。
[0302]
最后,为了确保我们的结果不是肝内隔室或胆囊类器官特异性的,我们使用我们确立的方法
(3)
,在免疫受损小鼠的胆囊中移植在没有
fxr
激动剂情况下得到的胆总管来源的胆管细胞类器官
。
植入的细胞表现出胆总管标志物的丧失和胆囊标志物的上调,证实了我们先前的发现适用于胆管树的不同隔室和不同来源的类器官
。
总之,这些结果确定,来自胆管树不同区域的胆管细胞是可互换的,并表明肝外细胞可用于修复急性肝内导管损伤
。
[0303]
小鼠模型中的细胞移植实验非常有用,但并不总是能预测治疗结果
(19)。
此外,小鼠肝脏微环境与人类不同,这增加了我们的结果可能无法在物种之间转化的可能性
。
为了解决这些挑战,我们开发了一种利用离体器官灌注在人类中进行基于细胞的治疗的新模型
(20)。
开发了离体常温灌注
(nmp)
以通过在移植前通过肝移植物循环温热的含氧血液来改善器官保存并减少缺血再灌注损伤
。
重要的是,胆管树对导致导管损伤的缺血特别敏感
(21,22)。nmp
期间的低胆汁
ph(《12 7.5)
被用作此类胆管病的预测因素
(23)。
[0304]
为了评估我们的细胞修复人类胆管的治疗潜力,在实验开始时,在意味着缺血性导管损伤的胆汁
ph《7.5
的已故移植供体肝脏
(n
=
3)
的肝内导管中注射在没有
fxr
激动剂情况下得到的
rfp
胆囊类器官
。
在正常体温下用含氧血液和营养物灌注器官
(20)
;图
3a-43b)
长达
100
小时,以便维持接近生理的微环境
。
重要的是,在荧光镜引导下,将类器官递送到肝内导管的末端分支中,以最小化细胞的分布面积并最大化细胞密度
。
在实验结束时,超声成像揭示出没有导管扩张或阻塞的证据,而通过流式细胞术在灌流液中未检测到表达
rfp
的细胞,证实了注射的细胞保留在胆管隔室中
(
图
3c)。
更重要的是,移植的类器官植入在肝内胆管树中
(
图
3d)
,
rfp
细胞再生了~
40
%-85
%的注射导管;并表达关键的胆源性标志物
(krt7、krt19、cftr、ggt)。
因此,在实验结束时,注射的导管由天然和移植的胆管细胞的混合物组成,供体和受体细胞之间有多个过渡点,并且没有胆管病的证据
(
图
3d)。
[0305]
相反,未接受细胞的对照导管显示出缺血性损伤的证据,上皮连续性丧失,并且导管腔内细胞脱落
(
图
3d)。
我们随后表征了移植对器官功能的影响
。
从生理上讲,胆管细胞通过水转移和碳酸氢盐分泌来改变胆汁的组成和
ph(6)。
因此,我们比较了来自类器官注射的相对于载体注射的导管的胆汁
。
因此,从注射了细胞的导管抽吸的胆汁表现出更高的
ph
和体积
(
图
3e)
,证实了移植的胆管细胞保留了其改变胆汁组成的功能
。
总之,这些结果提供了以下首次原理论证:灌注器官可用于确定人类细胞的功能性移植,并通过表明胆管细胞可互换用于人类器官移植验证了我们的小鼠数据
。
[0306]
我们的结果表明,胆管上皮由具有由其局部环境决定的不同转录谱的胆管细胞组成
。
由于缺乏小生境刺激,这种多样性在类器官培养中丧失
。
然而,类器官可以在体外和移植后适当地适应局部环境信号,恢复区域特异性标志物的表达,并呈现不同的区域特征
。
因
此,来自单个区域的类器官可能潜在地修复整个胆管树
。
这种可塑性可能对再生医学具有重大影响
。
实际上,尽管基于自体细胞的治疗潜在地避免了免疫抑制的需要,但其用于原代类器官的应用受到疾病对上皮影响的限制
。
然而,胆管病属于局限性疾病家族,主要影响器官的特定区域
(24)。
[0307]
因此,我们的结果提供了以下概念验证:来自备用区域如胆囊的胆管细胞可用于基于自体细胞的治疗以修复构成了胆管病中最常见的损伤部位的人类肝内胆管
。
此外,我们用于在人类灌注器官中植入细胞的新模型为在移植前使用基于离体细胞的治疗来改善移植物功能铺平了道路,这最终可以增加可用器官的数目,并减少对移植等待名单的压力
。
在这种情况下,将来可以常规使用来自细胞库的质量受控且易于获得的同种异体胆管细胞类器官,以预防处于胆道损伤风险
(
例如胆汁
ph
值低
)
器官中的缺血性胆管病,因为器官接受者将接受免疫抑制作为其标准护理的一部分
。
重要的是,我们的结果为在人类器官中移植类器官提供了原理论证,这可以加快监管审批,并加速首次人体试验进程
。
最终,同样的方法也可以应用于各种离体灌注器官和细胞类型,以验证功能性细胞移植,证明安全性,改善细胞移植技术和疗效,并加速新的基于细胞的治疗的临床转化
。
[0308]
参考文献
[0309]
1.j.drost,h.clevers,dev.144,968
–
975(2017).
[0310]
2.r.h.squires,et al hepatology.60,362
–
98(2014).
[0311]
3.f.sampaziotis,et al.nat.med.23,954
–
963(2017).
[0312]
4.k.parikh,et al nature.567,49
–
55(2019).
[0313]
5.c.a.rimland et al.hepatology(2020),3 doi:10.1002/hep.31252.
[0314]
6.j.h.tabibian et al.compr.physiol.3,541
–
565(2013).
[0315]
7.a.i.masyuk,et al hepatology.43,7 s75
–
s81(2006).
[0316]
8.k.-s.yoo,et al gut liver.10,851
–
8(2016).
[0317]
9.s.j.l.b.zweers et al hepatology.55,575
–
583(2012).
[0318]
10.y.zong et al int.j.biochem.cell biol.43,257
–
64(2011).
[0319]
11.k.si-tayeb,et al dev.cell.18,175
–
189(2010).
[0320]
12.n.aizarani et al nature.572,199
–
204(2019).
[0321]
13.b.j.pepe-mooney,et al cell stem cell.25,23-38.e8(2019).
[0322]
14.l.planas-paz,et al cell stem cell.25,39-53.e10(2019).
[0323]
15.a.lanzini,bile.encycl.food sci.nutr.,471
–
478(2003).
[0324]
16.o.c.tysoe,et al nat.protoc.14,1884
–
1925(2019)
[0325]
17.m.-o.lee et al toxicol.pathol.36,660
–
673(2008).
[0326]
18.n.l.berntsen et al am.j.physiol.-gastrointest.liver physiol.314,g349
–
g359(2018).
[0327]
19.c.arber et al semin.hematol.50,131
–
144(2013)
[0328]
20.d.nasralla et al nature.557,6 50
–
56(2018).
[0329]
21.a.i.skaro et al surgery.146,543
–
553(2009).
[0330]
22.c.k.enestvedt et al liver transpl.19,965
–
72(2013).
[0331]
23.c.j.e.watson et al am.j.transplant.18,2005
–
2020(2018).
[0332]
24.r.g.farmer et al gastroenterology.68,627
–
35(1975).
[0333]
25.s.a.macparland et al nat.commun.9,4383(2018).
[0334]
26.d.j.mccarthy et al bioinformatics.33,1179
–
1186(2017).
[0335]
27.a.butler,et al nat.biotechnol.36,411
–
420(2018).
[0336]
28.l.haghverdi et al nat.biotechnol.36,421
–
427(2018).
[0337]
29.f.a.wolf,et al genome biol.19(2018),doi:10.1186/s13059-017-1382-0.
[0338]
30.l.haghverdi,et al nat.methods.13,845
–
848(2016).
[0339]
31.x.qiu,q.et al nat.methods.14,979
–
19 982(2017).
[0340]
32.v.y.kiselev,et al nat.methods.14,483
–
486(2017).
[0341]
33.l.zappia,a.et al gigascience.7(2018),doi:10.1093/gigascience/giy083.
[0342]
34.a.subramanian,et al.proc.natl.acad.sci.u.s.a.102,15545
–
15550(2005).
[0343]
35.m.v.kuleshov et al.nucleic acids res.44,w90
–
w97(2016).
[0344]
36.f.sampaziotis et al.nat.biotechnol.33,845
–
852 17(2015).
[0345]
37.f.sampaziotis,et al.nat.protoc.12,814
–
827(2017).
[0346]
38.r.ravikumar,et al.am.j.transplant.16,1779
–
1787(2016)
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1