克服抑制因素的基于T细胞的免疫疗法的基因靶标
背景技术:
1、嵌合抗原受体(car)t细胞疗法作为免疫疗法对于部分侵袭性血液恶性肿瘤来说是变革性的。此外,t细胞受体(tcr)转基因t细胞已在早期临床研究中显示出积极结果。然而,许多癌症(尤其是实体瘤)在对当前基于car或tcr的t细胞疗法产生初步反应后,无法做出反应或迅速进展。在肿瘤块内,免疫抑制微环境对抗肿瘤免疫的功效构成了关键障碍(参见,例如anderson,等,cancer cell31,311–325,2017;binnewies,等,nat.med.24,541–550,2018)。此外,持续暴露于抗原可能导致t细胞功能失调,突出了需要平衡工程改造的t细胞的效应功能和长期持久性(例如,vardhana,等,nat.immunol.21,1022–1033,2020;wei,等.,nature 576,471–476,2019)。正在测试对选定基因的靶向操作,作为增强过继性t细胞疗法疗效的策略。大规模crispr筛选可以加速发现基因扰动,从而增强工程改造的t细胞的功效。我们之前在原代人t细胞中开发了发现平台并将其应用于鉴定t细胞增殖的新型遗传调节因子(shifrut,等,cell 175,1958–1971.e15,2018;
2、wo2020/014235)。采用腺苷拮抗剂来模拟腺苷a2a抑制信号传导的升高,以响应缺氧肿瘤微环境中高水平的腺苷。
技术实现思路
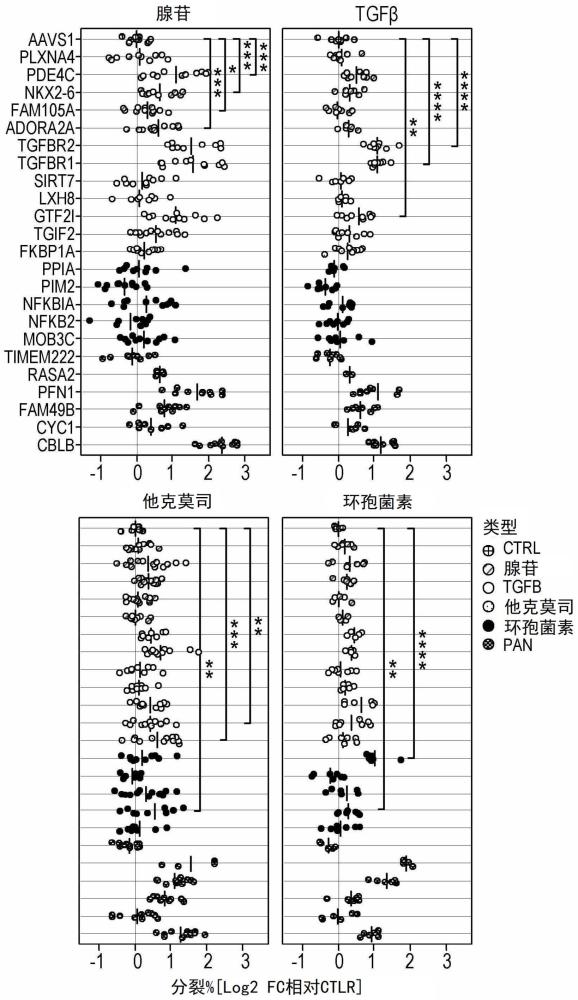
1、本公开部分基于使用肿瘤微环境(tme)中常见的各种免疫抑制条件来鉴定可赋予对肿瘤微环境中发现的各种形式的抑制抗性的基因靶标的无偏基因筛选的开发。为了模拟内在检查点信号,我们关注钙/钙调磷酸酶信号传导的抑制剂(他克莫司(tacrolimus)和环孢菌素(cyclosporine)),该信号传导是t细胞激活的关键途径,通常在肿瘤浸润t细胞中受到抑制(park,等,front.immunol.11,195,2020;martinez,等,immunity 42,265–278,2015)。为了模拟tme中的显著外在抑制信号,我们使用了tgfβ,这是一种限制肿瘤内t细胞功能的典型抑制性细胞因子(kloss,等,mol.ther.26,1855–1866,2018)。最后,由于调节性t细胞(treg)是多种肿瘤类型中t细胞功能失调的重要介质(plitas等,immunity 45,1122–1134,2016),我们调整了我们的筛选平台来分析细胞间相互作用并揭示赋予treg的效应t细胞抑制抗性的基因。
2、因此,在一个方面中,本文提供了遗传修饰的造血细胞,其包含对编码t细胞刺激负调节因子的基因(在本文也称为t细胞负调节基因)的遗传修饰,例如,所述遗传修饰抑制由该基因编码的多肽产物的表达或活性,其中该多肽产物的表达或活性相较于对照野生型造血细胞被抑制至少60%。在一些实施方式中,对编码t细胞刺激负调节因子的基因进行遗传修饰使该基因失活。在一些实施方式中,遗传修饰的造血细胞是t细胞。在一些实施方式中,t细胞是cd8+t细胞或cd4+t细胞。在一些实施方式中,使用基因编辑技术抑制t细胞负调节基因,例如规律间隔成簇短回文重复序列(crispr)系统,包括crispr干扰(crispri)、crisproff和碱基编辑,以引入功能突变的缺失。或者,可以使用转录激活因子样效应子核酸酶(talen)系统、锌指核酸酶系统或大范围核酸酶系统抑制t细胞负调节基因。在一些实施方式中,使用反义rna、sirna、微小rna或短发夹rna抑制t细胞负调节基因。在一些实施方式中,经修饰的t细胞负调节基因是选自下组的基因:alas1、ambra1、ankrd32、arhgap15、c15orf40、c3orf33、c8orf44、carkd、cd300lb、cenpb、chl1、chst3、clec4m、col15a1、col25a1、coro1a、cul3、cwc27、cyc1、dok2、dusp4、eng、fam49b、fkbp1a、fubp1、gab3、glrx、greb1l、gtf2h2、gtf2i、haus1、hist1h2ad、hist1h2bc、hoxa10、igfbp4、irf2bp2、iyd、kcnk4、kdm6b、l1cam、lama3、lhx8、mob3c、mbtd1、mrpl17、mrpl33、mtif2、myo1h、nefl、nfkb1a、nfkb2、nmt1、orc6、pcbp2、pcgf1、pdcd6ip、pdcl、pfn1、pim2、piwil4、plglb2、plxna4、pde4c、nxx2-6、potej、ppia、ppp2r5d、ptprg、rfpl1、rnf13、rnf185、rnf7、rprd1b、rps6kl1、sel1l3、sepw1、sh3bgrl、sirt7、sit1、slc47a1、slc9a3、sp1、st5、stat6、tbl1y、tgfbr1、tgfbr2、tgif2、ticrr、tmem62、tnk1、tns2、tp53bp1、ttn、tufm、upk1b、uqcrc1、wwox、xcl1、zbtb7a、zfyve28、znf101、znf436、znf506、znf716和znf805。在一些实施方式中,t细胞负调节基因是chst3、ttn、nmt1、rps6kl1、stat6、c8orf44、pdcl、tp53bp1、wwox、glrx、znf506、tns2或tbl1y。在一些实施方式中,t细胞负调节基因是uqcrc1、irf2bp2、rprd1b、ambra1、dusp4或pcbp2。在一些实施方式中,t细胞负调节基因是cul3、coro1a、rfpl1、hist1h2ad、plglb2、sh3bgrl、glrx、arhgap15、chl1、sit1、cyc1、ambra1、gab3、dok2、fubp1或pdcd6ip。在一些实施方式中,t细胞负调节基因是kdm6b、col15a1、zfyve28、carkd、znf101、hoxa10、c3orf33、alas1、cyc1、zbtb7a、fam49b、mrpl17、greb1l、ppp2r5d、slc9a3、cwc27或gtf2h2。在一些实施方式中,t细胞负调节基因是znf716、xcl1、nfkb2、potej、sp1、nefl、kcnk4、tnk1、clec4m、pcgf1、rnf13、slc47a1、znf436、wwox、ankrd32、sel1l3、sepw1或col25a1。在一些实施方式中,t细胞负调节基因是cenpb、cd300lb、iyd、st5、rnf7、mbtd1、mrpl33、myo1h、piwil4、znf805、hist1h2bc、upk1b、lama3、eng、orc6、ticrr、c15orf40、tufm、rnf185、ptprg、haus1、tmem62、igfbp4、l1cam或mtif2。
3、在另一方面中,本文提供了这样的细胞群,其包含如本文所述(例如在本段中所述)的遗传修饰的造血细胞,例如t细胞。在一些实施方式中,造血细胞(例如,t细胞)可以包含如本文所述的两种或更多种遗传修饰。
4、在另一方面中,本文提供了治疗癌症的方法,其包括给予这样的细胞群,所述细胞群包含如本文所述(例如在前段中所述)的遗传修饰的造血细胞。
5、在另一方面,本文提供了遗传修饰的t细胞,所述遗传修饰的t细胞的免疫功能相较于野生型t细胞已经调节(例如,降低)并包含抑制t细胞基因编码的多肽的表达的遗传修饰,其中所述多肽的表达相较于对照野生型t细胞被抑制至少60%;并且该基因选自下组:alas1、ambra1、ankrd32、arhgap15、c15orf40、c3orf33、c8orf44、carkd、cd300lb、cenpb、chl1、chst3、clec4m、col15a1、col25a1、coro1a、cul3、cwc27、cyc1、dok2、dusp4、eng、fam49b、fkbp1a、fubp1、gab3、glrx、greb1l、gtf2h2、gtf2i、haus1、hist1h2ad、hist1h2bc、hoxa10、igfbp4、irf2bp2、iyd、kcnk4、kdm6b、l1cam、lama3、lhx8、mob3c、mbtd1、mrpl17、mrpl33、mtif2、myo1h、nefl、nfkb1a、nfkb2、nmt1、orc6、pcbp2、pcgf1、pdcd6ip、pdcl、pfn1、pim2、piwil4、plglb2、plxna4、pde4c、nxx2-6、potej、ppia、ppp2r5d、ptprg、rfpl1、rnf13、rnf185、rnf7、rprd1b、rps6kl1、sel1l3、sepw1、sh3bgrl、sirt7、sit1、slc47a1、slc9a3、sp1、st5、stat6、tbl1y、tgfbr1、tgfbr2、tgif2、ticrr、tmem62、tnk1、tns2、tp53bp1、ttn、tufm、upk1b、uqcrc1、wwox、xcl1、zbtb7a、zfyve28、znf101、znf436、znf506、znf716和znf805。在一些实施方式中,t细胞负调节基因是chst3、ttn、nmt1、rps6kl1、stat6、c8orf44、pdcl、tp53bp1、wwox、glrx、znf506、tns2或tbl1y。在一些实施方式中,t细胞负调节基因是uqcrc1、irf2bp2、rprd1b、ambra1、dusp4或pcbp2。在一些实施方式中,t细胞负调节基因是cul3、coro1a、rfpl1、hist1h2ad、plglb2、sh3bgrl、glrx、arhgap15、chl1、sit1、cyc1、ambra1、gab3、dok2、fubp1或pdcd6ip。在一些实施方式中,t细胞负调节基因是kdm6b、col15a1、zfyve28、carkd、znf101、hoxa10、c3orf33、alas1、cyc1、zbtb7a、fam49b、mrpl17、greb1l、ppp2r5d、slc9a3、cwc27或gtf2h2。在一些实施方式中,t细胞负调节基因是znf716、xcl1、nfkb2、potej、sp1、nefl、kcnk4、tnk1、clec4m、pcgf1、rnf13、slc47a1、znf436、wwox、ankrd32、sel1l3、sepw1或col25a1。在一些实施方式中,t细胞负调节基因是cenpb、cd300lb、iyd、st5、rnf7、mbtd1、mrpl33、myo1h、piwil4、znf805、hist1h2bc、upk1b、lama3、eng、orc6、ticrr、c15orf40、tufm、rnf185、ptprg、haus1、tmem62、igfbp4、l1cam或mtif2。在一些实施方式中,基因是失活的。在一些实施方式中,t细胞是cd8+或cd4t细胞。在一些实施方式中,使用crispr系统、talen系统、锌指核酸酶系统、大范围核酸酶系统、sirna、反义rna、微小rna或短发夹rna抑制基因。在另一方面中,本发明提供了细胞培养物,其包含遗传修饰的t细胞,例如,如本文本段中所描述的。
6、在其他方面中,本文提供了生成用于治疗患有癌症的对象的遗传修饰的细胞群的方法,所述方法包括:从患者获得造血细胞;抑制选自下组的t细胞负调节基因的表达:alas1、ambra1、ankrd32、arhgap15、c15orf40、c3orf33、c8orf44、carkd、cd300lb、cenpb、chl1、chst3、clec4m、col15a1、col25a1、coro1a、cul3、cwc27、cyc1、dok2、dusp4、eng、fam49b、fkbp1a、fubp1、gab3、glrx、greb1l、gtf2h2、gtf2i、haus1、hist1h2ad、hist1h2bc、hoxa10、igfbp4、irf2bp2、iyd、kcnk4、kdm6b、l1cam、lama3、lhx8、mob3c、mbtd1、mrpl17、mrpl33、mtif2、myo1h、nefl、nfkb1a、nfkb2、nmt1、orc6、pcbp2、pcgf1、pdcd6ip、pdcl、pfn1、pim2、piwil4、plglb2、plxna4、pde4c、nxx2-6、potej、ppia、ppp2r5d、ptprg、rfpl1、rnf13、rnf185、rnf7、rprd1b、rps6kl1、sel1l3、sepw1、sh3bgrl、sirt7、sit1、slc47a1、slc9a3、sp1、st5、stat6、tbl1y、tgfbr1、tgfbr2、tgif2、ticrr、tmem62、tnk1、tns2、tp53bp1、ttn、tufm、upk1b、uqcrc1、wwox、xcl1、zbtb7a、zfyve28、znf101、znf436、znf506、znf716和znf805;选择t细胞负调节基因被抑制的造血细胞;和离体扩增选定的造血细胞群。在一些实施方式中,t细胞负调节基因是chst3、ttn、nmt1、rps6kl1、stat6、c8orf44、pdcl、tp53bp1、wwox、glrx、znf506、tns2或tbl1y。在一些实施方式中,t细胞负调节基因是uqcrc1、irf2bp2、rprd1b、ambra1、dusp4或pcbp2。在一些实施方式中,t细胞负调节基因是cul3、coro1a、rfpl1、hist1h2ad、plglb2、sh3bgrl、glrx、arhgap15、chl1、sit1、cyc1、ambra1、gab3、dok2、fubp1或pdcd6ip。在一些实施方式中,t细胞负调节基因是kdm6b、col15a1、zfyve28、carkd、znf101、hoxa10、c3orf33、alas1、cyc1、zbtb7a、fam49b、mrpl17、greb1l、ppp2r5d、slc9a3、cwc27或gtf2h2。在一些实施方式中,t细胞负调节基因是znf716、xcl1、nfkb2、potej、sp1、nefl、kcnk4、tnk1、clec4m、pcgf1、rnf13、slc47a1、znf436、wwox、ankrd32、sel1l3、sepw1或col25a1。在一些实施方式中,t细胞负调节基因是cenpb、cd300lb、iyd、st5、rnf7、mbtd1、mrpl33、myo1h、piwil4、znf805、hist1h2bc、upk1b、lama3、eng、orc6、ticrr、c15orf40、tufm、rnf185、ptprg、haus1、tmem62、igfbp4、l1cam或mtif2。在一些实施方式中,造血细胞是造血干细胞。在一些实施方式中,造血细胞是t细胞,例如cd8+或cd4+ t细胞。在一些实施方式中,使用crispr系统、talen系统、锌指核酸酶系统、大范围核酸酶系统、sirna、反义rna、微小rna或短发夹rna抑制t细胞负调节基因。
7、定义
8、如本文所用,除非文中另有明确说明,单数形式的“一个”、“一种”和“该/所述”也旨在指代复数形式。
9、术语“多核苷酸”和“核酸”可互换使用,并且是指任何长度的核苷酸的聚合形式,即脱氧核糖核苷酸或核糖核苷酸。这些术语包括rna、dna以及上述物质的合成形式和混合聚合物。在特定实施方式中,核苷酸指核糖核苷酸、脱氧核苷酸或任一类型核苷酸的修饰形式或类似物及其组合。此外,多核苷酸可以包括通过天然存在和/或非天然存在的核苷酸键连接在一起的天然存在和修饰的核苷酸之一或两者。核酸分子可以经过化学或生物化学修饰,或者可以含有非天然或衍生化的核苷酸碱基。这类修饰包括,例如,标记物、甲基化、用类似物取代一个或多个天然产生的核苷酸、核苷酸间修饰,诸如不带电荷连接(例如,甲基膦酸酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等),带电荷连接(例如,硫代磷酸酯,二硫代磷酸酯等),侧基部分(例如,多肽),嵌入剂(例如,吖啶、补骨脂素等),螯合剂,烷基化剂和修饰的连接(例如,α-异头核酸等)。“多核苷酸”和“核酸”还旨在包括任何拓扑构象,包括单链、双链、部分双链、三链、发夹、环状和挂锁构象。除非另有明确说明,述及核酸序列包括其互补物。因此,当指具有特定序列的核酸分子时,应理解为包含其互补链及其互补序列。述及编码多肽序列的“多核苷酸”或“核酸”还包括包含编码相同多肽序列的替代密码子的核酸和经密码子优化的核酸。
10、如本文所用,术语“互补”或“互补性”指核苷酸之间或核酸之间特定的碱基配对。碱基配对可以是完全互补或部分互补。
11、术语“基因”可以表示参与产生或编码多肽链的dna区段。它可以包括编码区之前和之后的区域(前导区和尾区)以及个体编码区段(外显子)之间的间插序列(内含子)。基因通过hugo基因命名委员会(hugo gene nomenclature committee)指定的人类基因符号和命名法来定义。
12、“启动子”定义为指导核酸转录的一种或多种核酸控制序列。如本文所用,启动子包括靠近转录起始位点的必需的核酸序列。启动子还任选地包括远端增强子或阻抑物元件,其可位于距转录起始位点多达几千个碱基对处。
13、术语“抑制表达”指抑制或减少基因或蛋白质的表达。为了抑制或减少基因(即编码转录因子的基因或转录因子调控的基因)的表达,可以修饰基因的序列和/或结构,以使基因不会被转录(对于dna)或翻译(对于rna),或者不会被转录或翻译以产生功能性蛋白(例如,转录因子)。本文进一步详细描述了用于抑制或减少基因表达的各种方法。一些方法可以将核酸取代、添加和/或缺失引入野生型基因中。一些方法还可以在基因中引入单链或双链断裂。为了抑制或减少蛋白质(例如,t细胞抑制蛋白)的表达,可以抑制或减少编码蛋白质的基因或多核苷酸的表达,如上所述。在其它实施方式中,可以使用例如抗体或蛋白酶直接靶向蛋白质以抑制或减少蛋白质的表达。“抑制”表达指相较于参比对照水平而言减少至少10%,例如减少至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%,或至少约90%或更高并包括减少100%(即相较于参比样品而言不存在的水平)。本文所用术语“失活(的)”是指阻止由该基因编码的多肽产物的表达。失活可以在基因表达的任何阶段或过程发生,包括但不限于:转录、翻译和蛋白质表达,并且失活可以影响任何基因或基因产物,包括但不限于:dna、rna、诸如mrna和多肽。在一些实施方式中,“抑制(的)表达”反映了修饰的细胞中一定百分比的失活,例如,还包含其中靶基因未失活的细胞的群体中至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%或更多的细胞。
14、本文使用的术语“遗传修饰”是指对细胞进行的任何修饰以改变基因的表达。此类修饰包括对基因组的修饰以及将抑制性序列(例如抑制性rna)引入细胞的修饰。
15、本文所用短语“修饰”在修饰细胞的基因组的上下文中指在靶基因组区域处诱导基因组序列的结构改变。例如,修饰可以采取将核苷酸序列插入细胞基因组的形式。例如,可以将编码多肽的核苷酸序列插入到编码t细胞中内源细胞表面蛋白的基因组序列中。核苷酸序列可以编码功能结构域或其功能片段。这类修饰可以例如通过诱导靶基因组区域内的双链断裂,或位于相对链且侧接靶基因组区域的单链切口对进行。用于在靶基因组区域处或靶基因组区域内诱导单链或双链断裂的方法包括使用针对靶基因组区域的核酸酶结构域(例如cas9或其衍生物)和向导物(例如向导rna)。
16、术语“患者”、“对象”、“个体”等本文中可互换使用,并且指任何动物,例如,哺乳动物,诸如灵长类动物。在某些非限制性实施方式中,患者、对象或个体为人。
17、本文所用术语“治疗”、“处理”等通常指获得所需的药理学和/或生理学作用。就完全或部分防止疾病、病症或其症状的方面而言,这种作用可以是预防性的,和/或就部分或完全治愈疾病或病症和/或由该疾病或病症所致不良影响如症状而言,这种作用可以是治疗性的。本文所用的“治疗/处理”涵盖对对象疾病或病症的任何治疗,并且包括:(a)预防疾病或病症在可能易患该疾病或病症但尚未被诊断为患有该疾病或病症的对象中发生;(b)抑制疾病或病症(例如阻止其发展);或(c)缓解疾病或病症(例如,导致疾病或病症消退,提供一种或多种症状的改善)。
- 还没有人留言评论。精彩留言会获得点赞!