一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮的方法
1.本发明属于化学合成工艺领域,具体涉及一种使用碘代吡啶鎓盐催化剂催化芳基取代胺、芳基取代甲醛和丹尼谢夫斯基双烯的三组分一锅法串联反应,用于合成2,3-二氢吡啶酮的方法。
背景技术:
2.卤键指存在于作为路易斯酸的卤素原子和作为路易斯碱的具有孤对电子的原子或π电子体系之间的非共价弱相互作用。卤键与同属于非共价相互作用的氢键相比,具有其特殊性:(1)卤键的键角接近180
°
;(2)卤键结合能范围非常大,通常在5
–
180 kj/mol之间;(3)卤键对位阻效应十分敏感。
3.为了加强卤键供体形成卤键的能力,使其能够类似其它弱相互作用,作为反应驱动力催化有机化合物的官能团转化,现采用的策略主要有:(1)通过引入正电荷、增加基团电负性等方法,增强卤键供体骨架对卤素原子的吸电子能力,降低卤素原子表面电荷密度;(2)减小卤键供体与受体之间空间位阻,有利于卤键强度的增加;(3)使用倾向于形成更强卤键作用的碘化物。
4.虽然基于上述策略所开发的一系列卤键供体已经可以作为催化剂,应用于亲核取代、转移氢化、diels-alder反应、共轭加成等多种反应中,但是也逐步面临越来越多问题难以解决。碳碘键在被高度极化时十分脆弱,仅仅由于反应体系中存在弱亲核试剂、碱、极性溶剂,或者反应温度较高、光照等,就可能发生断裂从而导致卤键供体的分解失活。这将使得卤键催化的适用性十分狭窄,无法顺利应用于复杂的反应体系中。
5.为了解决上述问题,本发明通过合成碘代吡啶鎓型卤键催化剂,选择性构建卤键供体与反应中间体的强相互作用,成功实现了催化剂的动态掩蔽以防止其受到其他亲核试剂进攻失活,同时动态活化反应中间体以促进其后续反应的发生。基于此策略,本发明成功实现了以多种芳基取代胺、芳基取代甲醛和丹尼谢夫斯基双烯的三组分一锅法串联反应,用于高收率合成一系列具有不同取代基的2,3-二氢吡啶酮类生物碱。
技术实现要素:
6.现在将通过以下条款来描述本发明的内容和技术实施方式。
7.本发明旨在提供一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮的方法。该方法可在无金属、配体和其它助剂存在下,催化芳基取代胺、芳基取代甲醛和丹尼谢夫斯基双烯的aza-diels-alder反应,用于制备2,3-二氢吡啶酮类化合物。该催化反应反应条件简单、绿色环保、成本低廉、产物收率高。
8.本反应所使用的芳基取代胺和芳基取代甲醛,具有图2的结构:其中,r1选自芳环或杂芳环体系,其中所述芳环或杂芳环体系未被取代或被选自c1至c4烷基、c1烷氧基、酯基、乙烯基的一个或多个基团取代。r2选自芳环或杂芳环体系,其中所述芳环或杂芳环体系未被取代或被选自c1至c4烷基、芳基、卤素、c1烷氧基、硝基的一
个或多个基团取代。
9.本发明采用的技术方案是:一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法,是在四氢呋喃(下述为thf)溶液中,加入芳基取代胺、芳基取代甲醛、丹尼谢夫斯基双烯和如下文所述制备的碘代吡啶鎓盐催化剂,在一定温度条件下充分搅拌进行反应,得到2,3-二氢吡啶酮类化合物。
10.优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述丹尼谢夫斯基双烯与所述芳基取代胺和芳基取代甲醛的摩尔比为1.5:1:1。
11.优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述碘代吡啶鎓盐催化剂为芳基取代胺和芳基取代甲醛的物质的量的5-10%。
12.优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述芳基取代胺的芳基取代基r1不相同,选自芳环或杂芳环体系,其中所述芳环或杂芳环体系未被取代或被选自c1至c4烷基、c1烷氧基、酯基、乙烯基的一个或多个基团取代。所述芳基取代甲醛的芳基取代基r2不相同,选自芳环或杂芳环体系,其中所述芳环或杂芳环体系未被取代或被选自c1至c4烷基、芳基、卤素、c1烷氧基、硝基的一个或多个基团取代。
13.优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述芳基取代胺选自以下化合物,包括对甲氧基苯胺、对甲苯胺、间甲苯胺、4-正丁基苯胺、4-叔丁基苯胺、4-胺基苯甲酸甲酯、4-胺基苯乙烯、苯胺中的一种或多种。所述芳基取代甲醛选自以下化合物,包括对硝基苯甲醛、对甲苯甲醛、间甲苯甲醛、邻甲苯甲醛、枯茗醛、4-叔丁基苯甲醛、对甲氧基苯甲醛、间甲氧基苯甲醛、邻甲氧基苯甲醛、对氯苯甲醛、间氯苯甲醛、邻氯苯甲醛、对氟苯甲醛、1-甲基吲哚-2-甲醛、糠醛、噻吩-2-甲醛、2-萘甲醛中的一种或多种。
14.优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述催化剂为无毒、无害、无金属的吡啶鎓盐催化剂。
15.优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述吡啶鎓盐催化剂的碳源、氮源和碘源都来自碘代吡啶优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述吡啶鎓盐催化剂的制备方法包括如下步骤:将200~500 mg碘代吡啶加入烧瓶中,再加入4 ml无水甲苯进行搅拌,再将150~400 mg三氟甲磺酸甲酯滴加进烧瓶中,直至滴加完毕后在23℃条件下搅拌0.5~1 h。反应结束后将混合物进行抽滤,用无水乙醚洗涤滤饼,收集滤饼并重结晶纯化,使用真空油泵抽干残留溶剂得到碘代吡啶鎓盐催化剂。
16.优选的,所述一种碘代吡啶鎓盐催化一锅法合成2,3-二氢吡啶酮类化合物的方法中,所述反应温度为23℃,反应时间为4
–
20 h。
17.本发明将反应后获得的粗产品混合物进行分离纯化,可以得到满足实际应用需要的高纯度2,3-二氢吡啶酮类化合物产品。其具体方法为:先向反应混合物中加入饱和食盐水,淬灭反应,然后用有机溶剂多次萃取反应液,收集并合并有机相。使用无水硫酸钠干燥有机相,过滤,将滤液减压蒸馏除去其中绝大部分有机溶剂,最后所得浓缩液用硅胶柱色谱纯化,得到目标产物2,3-二氢吡啶酮类化合物。
18.本发明的有益效果和应用价值是:本发明所述的碘代吡啶鎓盐催化剂制备方法简单。该方法利用甲基化试剂三氟甲磺酸甲酯和碘代吡啶反应,得到吡啶鎓盐催化剂,然后重结晶纯化催化剂。所涉及的制备工艺与操作简单,制备工艺成本低廉,有利于规模化生产。
19.本发明所述的碘代吡啶鎓盐催化芳基取代胺、芳基取代甲醛和丹尼谢夫斯基双烯的aza-diels-alder反应,无需额外添加金属、配体或其他助剂,仅以吡啶鎓盐作为催化剂。该催化反应条件温和、操作简单、成本低廉、产物收率高。
附图说明
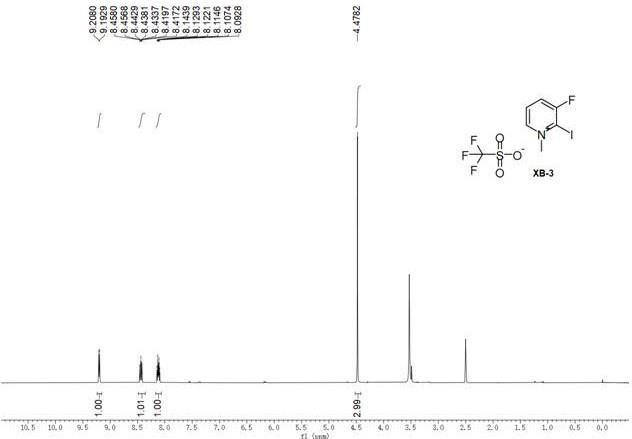
20.图1为芳基取代胺、芳基取代甲醛和丹尼谢夫斯基双烯的aza-diels-alder反应合成2,3-二氢吡啶酮类化合物结构图;图2为本反应所使用的的芳基取代胺和芳基取代甲醛结构图;图3为本发明制备的其中一种碘代吡啶鎓盐催化剂的核磁共振氢谱(1h nmr)测试结果图。
具体实施方式
21.下面将结合本发明的具体实施例和附图对本发明的技术方案进行清楚、详细地描述。
22.以下实施例中,碘代吡啶鎓盐催化剂的制备方法如下:将223 mg2-碘-3-氟吡啶加入烧瓶中,再加入4 ml无水甲苯进行搅拌,再将113.2 μl三氟甲磺酸甲酯滴加进烧瓶中,直至滴加完毕后在23℃条件下搅拌30分钟。反应结束后将混合物进行抽滤,用无水乙醚洗涤滤饼,收集滤饼并重结晶纯化,使用真空油泵抽干残留溶剂得到吡啶鎓催化剂,表示为xb-3。
23.将制备得到的碘代吡啶鎓盐催化剂进行核磁共振氢谱(1h nmr)分析。其中nmr结果如图1所示。从图中可明显的看到,化学位移9.20 ppm、8.48-8.36 ppm和8.12 ppm的三个峰分别是吡啶环上的三个氢,化学位移4.48 ppm的峰为甲基上的三个氢。
24.以下实施例中,催化芳基取代胺、芳基取代甲醛和丹尼谢夫斯基双烯的aza-diels-alder反应合成2,3-二氢吡啶酮类化合物的催化剂选用xb-3。
25.实施例1本例为使用对硝基苯甲醛、4-正丁基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-正丁基苯基)-2-(4-硝基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对硝基苯甲醛、0.2 mmol 4-正丁基苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到69.4 mg棕黄色目标产物,收率99%。
[0026]
实施例2
本例为使用对硝基苯甲醛、4-叔丁基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-叔丁基苯基)-2-(4-硝基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对硝基苯甲醛、0.2 mmol 4-叔丁基苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到69.4 mg淡红色目标产物,收率99%。
[0027]
实施例3本例为使用对硝基苯甲醛、间甲苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(3-甲基苯基)-2-(4-硝基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对硝基苯甲醛、0.2 mmol间甲苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到59.2 mg棕黄色目标产物,收率96%。
[0028]
实施例4本例为使用间苯甲醛、间甲苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(3-甲基苯基)-2-(3-甲基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol间苯甲醛、0.2 mmol间甲苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到51.5 mg黄色目标产物,收率93%。
[0029]
实施例5本例为使用对硝基苯甲醛、对甲苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲基苯基)-2-(4-硝基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对硝基苯甲醛、0.2 mmol对甲苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到53.7 mg棕黄色目标产物,收率87%。
[0030]
实施例6本例为使用枯茗醛、对甲氧基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲氧基苯基)-2-(4-异丙基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol枯茗醛、0.2 mmol对甲氧基苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到53.7 mg棕黄色目标产物,收率87%。
[0031]
实施例7本例为使用对甲氧基苯甲醛、对甲苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲基苯基)-2-(4-甲氧基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对甲氧基苯甲醛、0.2 mmol对甲苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到51.0 mg黄色目标产物,收率87%。
[0032]
实施例8本例为使用对硝基苯甲醛、对甲氧基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲氧基苯基)-2-(4-硝基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对硝基苯甲醛、0.2 mmol对甲氧基苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到55.8 mg黄色目标产物,收率86%。
[0033]
实施例9本例为使用1-甲基吲哚-2-甲醛、对甲氧基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲氧基苯基)-2-(1-甲基吲哚-2-基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol 1-甲基吲哚-2-甲醛、0.2 mmol对甲氧基苯胺、0.3mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩
后得到29.3 mg棕黄色目标产物,收率44%。
[0034]
实施例10本例为使用糠醛、对甲氧基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲氧基苯基)-2-(呋喃-2-基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol糠醛、0.2 mmol对甲氧基苯胺、0.3 mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10 ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到36.1 mg棕黄色目标产物,收率67%。
[0035]
实施例11本例为使用噻吩-2-甲醛、对甲氧基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲氧基苯基)-2-(噻吩-2-基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol噻吩-2-甲醛、0.2 mmol对甲氧基苯胺、0.3 mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10 ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到37.1 mg棕黄色目标产物,收率65%。
[0036]
实施例12本例为使用2-萘甲醛、对甲氧基苯胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-(4-甲氧基苯基)-2-(萘-1-基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol 2-萘甲醛、0.2 mmol对甲氧基苯胺、0.3 mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10 ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到39.5 mg黄色目标产物,收率60%。
[0037]
实施例13本例为使用对硝基苯甲醛、正戊胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-戊基-2-(4-硝基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对硝基苯甲醛、0.2 mmol正戊胺、0.3 mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10 ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓
缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到30.6 mg棕红色目标产物,收率53%。
[0038]
实施例14本例为使用对硝基苯甲醛、环戊胺和丹尼谢夫斯基双烯为原料,催化[4+2]环化反应制备1-环戊基-2-(4-硝基苯基)-2,3-二氢吡啶-4-酮:将3.9 mg催化剂、0.2 mmol对硝基苯甲醛、0.2 mmol环戊胺、0.3 mmol丹尼谢夫斯基双烯和1 ml thf,加入放置有搅拌子的10 ml schlenk管中,用橡胶塞密封,并将反应容器中的空气置换为n2。将反应混合物于23℃均匀搅拌,反应4 h。时间结束后,加入1 ml饱和食盐水淬灭反应,然后加入二氯甲烷(3
×
1 ml)萃取反应液,收集并合并有机相,使用无水硫酸钠干燥,过滤,并将滤液减压蒸馏以除去其中绝大部分有机溶剂。最后将所得粗产品浓缩液用硅胶柱色谱纯化(洗脱剂:正己烷/乙酸乙酯=100:20~100),浓缩后得到25.2 mg棕黄色目标产物,收率44%。
[0039]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限定。其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1