一种多取代的1,2,3,4-四氢喹啉的制备方法
本发明涉及医药和天然化合物化工中间体合成,尤其是涉及一种多取代的1,2,3,4-四氢喹啉的制备方法。
背景技术:
1、四氢喹啉及其衍生物是一类重要的生物碱,广泛存在于天然产物和药物分子中,是很多天然产物和药物分子的活性骨架(chem.rev.,2019,119,5057-5191)。四氢喹啉化合物通常具有良好的生物活性,如抗菌、抗炎、抗肿瘤、抗病毒等(chem.sci.,2022,13,3674-3687)。由于四氢喹啉化合物的重要性,其高效合成仍是有机合成的热点之一(angew.chem.,int.ed.,2022,doi:10.1002/anie.202207829)。因此发展更加高效的方法来合成结构多样的这类化合物具有十分重要的研究意义和应用价值。
2、通过文献调研发现,合成四氢喹啉的方法包括如下几种:
3、方法(1):分子内环化反应合成四氢喹啉。以芳胺衍生物为起始原料,通过分子内环化反应形成新的化学键,涉及二氢吡啶环上所有可能的化学键,如n-c2,c2-c3,c3-c4,c4-c4a,n-c8a等。如路线(1),以氰胺为原料,通过lewis酸促进分子内烯烃的氨基氰化反应,首先是c-c双键分子内亲核进攻lewis酸活化的n-磺酰氰胺,使n-cn键断裂,再双键加成,制备得到2,2-二取代四氢喹啉(angew.chem.,int.ed.2014,53,5170-5174)。
4、
5、方法(2):分子间加成反应合成四氢喹啉。例如,路线(2),以2-氨基苯乙酮和4-氯苯甲醛为原料,在l-脯氨酸存在下,发生分子间氮杂michae1/分子内迈克尔加成串联反应,得到四氢喹啉酮衍生物后,经还原反应得到四氢喹啉衍生物(tetrahedron lett.2012,53,2269-2272)。
6、
7、方法(3):povarov反应合成四氢喹啉。在酸催化下,由芳胺和醛形成n-芳亚胺,与富电子的烯烃之间发生[4+2]环加成反应,称为povarov反应,例如路线(3),其由俄罗斯化学家l.s.povarov于20世纪60年代发现(curr.org.synth.2016,13,157-175),该方法成为合成四氢喹啉最常用的方法。
8、
9、方法(4):重排反应合成四氢喹啉。例如路线(4),sc(otf)3作为催化剂,α-烷基-α-重氮酯进攻靛红底物,通过1,2-芳基迁移路径形成中间态,进而发生对映选择性扩环,得到2-喹诺酮类化合物,收率达到94%,ee值达到99%(angew.chem.,int.ed.2012,51,8644-8647)。
10、
11、方法(5):喹啉加氢合成四氢喹啉。利用ru、co、rh、ir、ni、pd、pt和au等多种过渡金属催化剂,可实现喹啉类化合物的选择性加氢,制备四氢喹啉衍生物,此外,有机催化剂和硼试剂也被用于喹啉和其他相关n-杂环的区域选择性加氢反应。例如路线(5),在温和条件下,以hantzsch酯为氢源,fe(otf)2为催化剂,对喹啉衍生物进行选择性加氢,得到四氢喹啉衍生物,该条件对其它官能团的容忍性较好,如氯和硝基取代基,收率较高。
12、
13、综上所述,尽管合成四氢喹啉的方法众多,取得了很大的进步,但是由于四氢喹啉化合物具有重要的生理活性,在药物研发中具有广泛的用途,因此,开发新方法简洁高效合成取代的四氢喹啉具有很重要的意义。特别是,需要一种成本低、绿色高效、收率高、选择性高的方法合成取代的四氢喹啉化合物。
技术实现思路
1、本发明的目的在于提供多取代的1,2,3,4-四氢喹啉的制备方法,本发明以邻-n-酰基苯基mbh碳酸酯和不饱和烯烃为原料,在路易斯碱催化剂的作用下,在有机溶剂中发生[4+2]环加成反应,生成多取代的1,2,3,4-四氢喹啉化合物。
2、为了实现本发明的上述目的,特采用以下技术方案:
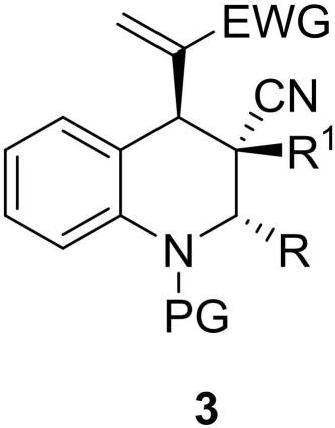
3、一种式3所示的多取代的1,2,3,4-四氢喹啉的制备方法,包括以下步骤:
4、
5、式1所示的mbh(森田-贝里斯-希尔曼)碳酸酯化合物、式2所示的烯烃化合物和路易斯碱催化剂在有机溶剂中发生加成反应,分离纯化后得到式3所示的多取代的1,2,3,4-四氢喹啉化合物;
6、其中,式1中,pg选自boc保护基、ac保护基、ts保护基、cbz保护基、烷基保护基(如甲基、乙基)、苄基保护基;
7、ewg选自酯基(如甲酯、乙酯、叔丁酯)、氰基、酮羰基、硝基、砜基;
8、式2中,r选自取代或未取代的c1-c6直链或支链烷基、取代或未取代的c2-c6直链或支链烯基、取代或未取代的c6-c12芳基、含1至4个选自氮、氧、硫杂原子的5-10元杂芳基、取代或未取代的c3-c6环状烷基;所述取代的取代基选自氰基、硝基、氨基、羟基、巯基、卤素、c1-c6烷基、卤代c1-c6烷基、c2-c6烯基、c1-c6烷氧基、卤代c1-c6烷氧基、苯基、c1-c6烷基取代苯基;
9、r1选自酯基、ts基、bz基、取代或未取代的砜基;所述取代的取代基选自氰基、硝基、氨基、羟基、巯基、卤素、苯基、卤代苯基、c1-c6直链或支链烷基、c3-c6环状烷基、c2-c6直链或支链烯基。
10、在一些实施方式中,式2中,r选自取代或未取代的c1-c6直链或支链烷基、取代或未取代的c6-c12芳基、含1至4个选自氮、氧、硫杂原子的5-10元杂芳基;所述取代的取代基选自卤素、氰基、硝基、c1-c6烷基、卤代c1-c6烷基、c1-c6烷氧基、卤代c1-c6烷氧基;r进一步优选为甲基、乙基、苯基、萘基、呋喃基、噻吩基、吲哚基、取代的苯基(即r3、r4、r5、r6和r7各自独立地选自h、f、cl、br、氰基、硝基、甲基、叔丁基、三氟甲基、甲氧基、三氟甲氧基);r特别优选为甲基、苯基、苄基、萘基、噻吩基、呋喃基(如1-萘基、2-萘基、2-呋喃基、3-噻吩基)、间二氯苯基、三氟甲苯基、(邻、对、间)氯苯基、(邻、对、间)溴苯基、对氟苯基、对叔丁基苯基、对甲基苯基、硝基苯基、氰基苯基、对三氟甲氧基苯基、对甲氧基苯基等。
11、在一些实施方式中,式2中,r1选自酯基、ts基、bz基、苯基砜基、卤代苯基砜基。
12、在一些实施方式中,所述路易斯碱催化剂选自1,4-二氮杂二环[2.2.2]辛烷(dabco)、4-二甲氨基吡啶(dmap)、三乙胺(tea)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(dbu)、三苯基膦、三环己基膦中的一种。
13、在一些实施方式中,所述式1所示的mbh碳酸酯化合物、式2所示的烯烃化合物和路易斯碱催化剂的摩尔比为1-2∶1-1.2∶0.1-0.5,优选为1.2∶1∶0.2。
14、在一些实施方式中,所述有机溶剂选自乙腈、甲苯、二氯甲烷、三氯甲烷、四氢呋喃、乙酸乙酯、丙酮、乙醚、二氧六环、二甲苯、苯、二甲亚砜和甲酰胺中的至少一种,优选为二氯甲烷、甲苯、乙酸乙酯、四氢呋喃中的一种。
15、在一些实施方式中,所述加成反应条件包括:温度为25-100℃,优选25℃(例如20、30、40、50、60、65、70、75、80、85、90、95、100℃),和/或,时间为1-24h(例如1、2、3、4、5、6、7、8、9、10、12、16、18、20、24h)。
16、在一些实施方式中,反应产物通过柱层析的方法进行分离纯化。
17、在一些实施方式中,分离纯化过程所使用的溶剂为石油醚和乙酸乙酯的混合溶剂,石油醚和乙酸乙酯的体积比可以为10∶1~5∶1。
18、有益效果:
19、1、本发明路易斯碱催化mbh碳酸酯与烯烃发生[4+2]环加成反应,反应机理如下:
20、
21、首先在mbh碳酸酯1在路易斯碱(lewis base,lb)催化剂作用下离去co2和叔丁基氧负离子(t-buo-),随后,叔丁基氧负离子拔掉n上的氢后产生两性离子中间体ii;随后,中间体ii与烯烃底物2发生亲核加成形成中间体iii,最后中间体iii亲核加成完成分子内环化,随着路易斯碱催化剂的离去,得到多取代的1,2,3,4-四氢喹啉产物3。
22、2、本发明的有益效果是该产物的非对映选择性和区域选择高,无需金属催化剂,一步即可得到反应产物,避免了多步反应的过程,反应过程简单,反应条件非常温和且只需在有机溶剂中室温搅拌即可,原料易得,成本低,工艺稳定且收率高,操作和后处理简单,反应结束后只需采用柱层析分离即可得到产物,有利于该发明方法应用于工业的绿色生产(经核磁初步确定纯度至少98%以上,dr>99∶1)。产物能克级制备和进一步衍生转化,为药物研发提供参考。
- 还没有人留言评论。精彩留言会获得点赞!